阿魏酸钠生物学活性
——对高糖诱导SH-SY5Y细胞凋亡的保护作用
2017-01-03许元鸿
赵 航, 许元鸿
(中国医科大学 附属第一医院,辽宁 沈阳 110001)
阿魏酸钠生物学活性
——对高糖诱导SH-SY5Y细胞凋亡的保护作用
赵 航, 许元鸿*
(中国医科大学 附属第一医院,辽宁 沈阳 110001)
探讨阿魏酸钠对高糖诱导的人神经母细胞瘤(SH-SY5Y)细胞凋亡的保护作用及其机制。分别通过葡萄糖培养液,以及具有阶梯阿魏酸钠含量的葡萄糖混合培养液进行SH-SY5Y细胞培养,持续时间为48 h。对其中细胞的存活率使用MTT比色法检测;通过Hoechst33258染色观察细胞核形态改变;细胞凋亡率引入流式细胞仪进行测验;离心获得细胞上清液后,使用对其中含有的8-羟基脱氧鸟苷酸(8-OHdG)组分使用酶联免疫吸附法检测。结果显示阿魏酸钠保护组细胞存活率明显升高,细胞核形态明显改善,组细胞早期凋亡率、上清液中8-OHdG的分泌量均明显降低。结果可见,阿魏酸钠对高糖诱导的SH-SY5Y细胞凋亡具有保护作用,其机制可能与阿魏酸钠的抗氧化作用有关。
8-羟基脱氧鸟苷酸; 细胞凋亡;高糖;阿魏酸钠;SH-SY5Y细胞
作为一种代谢紊乱综合征,糖尿病(diabetes mellitus,DM)最为主要的特征表现就是血糖异常,我国近年来糖尿病有愈演愈烈之势[1]。糖尿病已被认定为认知功能减退的独立危险因素[2]。糖尿病引起的认知功能损害是多因素、多环节的致病过程,其中长期高血糖引起的神经细胞凋亡在该过程中发挥了重要作用[3]。阿魏酸钠为3-甲氧基-4-羟基丙烯酸钠盐的二水化合物,表现的作用包括抗炎作用、抗自由基作用以及抗氧化作用,在包括当归、川芎等在内的多种中药中属于其有效单体成分[4]。本研究为探讨SH-SY5Y细胞受到高糖诱导而凋亡的过程中阿魏酸钠具有的保护机制,建立了相关的神经元凋亡模型。
1 材料与方法
1.1 材料
1.1.1 细胞 人神经母细胞,从北京协和医学院基础医学院购买实验中需要的SH-SY5Y细胞样品。
1.1.2 培养基 DMEM 培养基,主要成分含有各种氨基酸和葡萄糖,从美国Hyclone公司购买胎牛血清及低糖DMEM培养基。
1.1.3 试剂及仪器 阿魏酸钠购自苏州畅通有限公司,纯度大于99.0%;Hoechst33258购自sigma公司;Annexin V-FITC流式检测试剂盒购自北京四正柏生物科技有限公司;人8-OHdG ELISA试剂盒购自上海邦奕商贸有限公司;流式细胞仪购自美国贝克曼库尔特公司。
1.2 方法
1.2.1 细胞培养及分组 SH-SY5Y细胞采用含有10%胎牛血清的低糖DMEM培养液,添加青霉素100 kU/L、链霉素100 mg/L,置于恒温37 ℃、5%的CO2培养箱中培养,隔天换液。选取对数生长期细胞,换用无血清低糖DMEM培养基饥饿培养24 h后进行实验。细胞分为对照组,用低糖DMEM培养基培养48 h;高糖凋亡组,用葡萄糖终浓度为50 mmol/L的DMEM培养基培养48 h;阿魏酸钠保护组,用含终浓度50 mmol/L葡萄糖+50、100、200 μmol/L阿魏酸钠的DMEM培养基培养细胞48 h;甘露醇对照组,用含45 mmol/L甘露醇的低糖DMEM培养基培养48 h[5]。
1.2.2 MTT法检测不同分组的细胞存活率 在完成培养处理前4 h,在各个级别中添加20 μL浓度5 mg/mL 的MTT,后吸除培养液。分别将150 μL二甲亚砜(DMSO)加入各孔中,避光摇床持续振荡10 min。通过酶标分析仪测定各组细胞于490 nm光的吸光度(A)。细胞存活率(%)=(A实验组-A空白组)/(A正常组-A空白组)×100%[6]。
1.2.3 Hoechst33258核染色检测神经元凋亡 依据上述方法进行处理后, Hoechst33258染色[7]荧光显微镜下观察其形态变化。如果观察到致密浓染的固缩态染色细胞核,可以判断是凋亡细胞;如果发现其呈现较低的荧光强,同时伴随着均一的弥漫,可判断为正常细胞。
1.2.4 Annexin V-FITC 流式细胞仪测定细胞凋亡率 各组细胞处理结束后,用胰酶消化将细胞制成单细胞悬液,4 ℃预冷的PBS洗细胞2次后,重悬细胞于250 μL结合缓冲液中,调节浓度至1×106/mL,吸取100 μL的细胞悬液于5 mL流式管中,加入5 μL Annexin V/FITC和10 μL 20μg/mL的碘化丙锭溶液,混匀后于室温避光孵育15 min,在反应管中加入400 μL PBS,上流式细胞仪(FACS)分析[8]。
1.2.5 酶联免疫吸附法检测细胞上清液中8-OHdG的分泌量 依据上述方法处理后,取各孔的上清液,1 000 r/min离心10 min,取上清,再按作业指导书操作,完成检测步骤,获得不同组别中8-OHdG的含量(ng/mL)[9]。
2 结果与分析
2.1 阿魏酸钠对高糖诱导SH-SY5Y细胞损伤存活率的影响
由表1可知,细胞在高糖凋亡组中存活率显著减小(P<0.01)。阿魏酸钠对高糖引起的细胞损伤有保护作用,细胞存活率显著提高。50、100、200 μmol/L阿魏酸钠处理后存活率由高糖凋亡组的(65.8±5.9)%,分别上升至 (67.9±5.6)%、(83.2±6.8)% 、(89.2±6.3)%。对照组与甘露醇组则无明显的现象。
表1 阿魏酸钠对高糖诱导SH-SY5Y细胞 损伤存活率的影响Table 1 The effect of high glucose on the survival rate of cells SH-SY5Y damage induced by sodium ferulic acid ±s,n=6)
注:与对照组比较,**P<0.01;与高糖损伤组比较,##P<0.01
2.2 阿魏酸钠对高糖诱导SH-SY5Y细胞凋亡细胞核形态的影响
荧光显微镜下观察SH-SY5Y细胞形态,结果显示,与对照组相比,高糖处理可以使SH-SY5Y细胞凋亡数目明显增加,凋亡特征性有所不同,可以看到细胞核致密浓染等具有指示性的现象,部分样品中还可以看到裂解的细胞核(图1B)。阿魏酸钠保护组下细胞核形态有显著改善,细胞核固缩裂解降低(图1C、D、E)。对照组与甘露醇组则无明显现象。

图1 高糖诱导凋亡SH-SY5Y细胞核受到阿魏酸钠作用后的形态表现
2.3 阿魏酸钠对高糖诱导SH-SY5Y细胞凋亡率的影响
由图2、表2可知,高糖可以诱导SH-SY5Y细胞凋亡,凋亡率由对照组的4.93%升高至高糖凋亡组的23.53%(P<0.01)。经阿魏酸钠处理后凋亡率明显降低,其中以200 μmol/L阿魏酸钠组凋亡率降低最为明显,随着阿魏酸钠浓度的降低,凋亡率慢慢提高。对照组与甘露醇组则无明显现象。

图2 阿魏酸钠对高糖诱导SH-SY5Y细胞凋亡率的影响Fig.2 Effect of sodium ferulic acid on the apoptosis rate of SH-SY5Y cells induced by high glucose
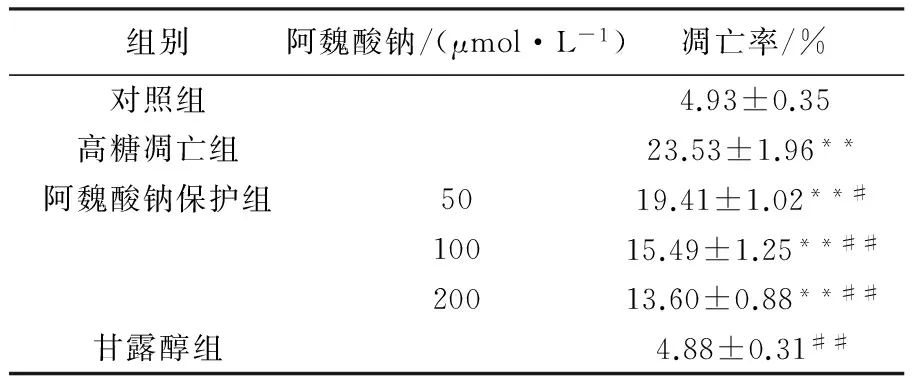
组别阿魏酸钠/(μmol·L-1)凋亡率/%对照组4.93±0.35高糖凋亡组23.53±1.96**阿魏酸钠保护组5019.41±1.02**#10015.49±1.25**##20013.60±0.88**##甘露醇组4.88±0.31##
注:与对照组比较,**P<0.01; 与高糖凋亡组比较,#P<0.05,
##P<0.01,表3同
2.4 酶联免疫吸附法检测细胞上清液中8-OHdG的分泌量
高糖凋亡组细胞上清液中的8-OHdG含量明显升高,由对照组的(0.42±0.03) ng/mL升高至高糖凋亡组的(3.30±0.19) ng/mL(P<0.01);阿魏酸钠可以明显抑制细胞上清液中的8-OHdG含量的升高,50 μmol/L阿魏酸钠即可明显降低上清液中8-OHdG的含量,随着阿魏酸钠含量升高效果更加明显。甘露醇组和对照组上清液中的8-OHdG含量无差异。
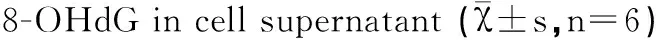

组别阿魏酸钠/(μmol·L-1)质量浓度/(ng·mL-1)对照组0.42±0.03##高糖凋亡组3.30±0.19**阿魏酸钠保护组502.82±0.19**##1002.24±0.11**##2001.77±0.14**##甘露醇组0.41±0.02##
3 讨 论
SH-SY5Y细胞系繁殖速度较快,但分化水平不高,并且该肿瘤细胞的生理生化特性以及形态均类似于普通神经细胞,其在研究探索神经系统疾病发病机制以及各类药剂的作用原理中发挥了重要的作用[10]。本研究中对SH-SY5Y细胞通过50 mmol/L葡萄糖孵育,制备凋亡模型,结果发现48 h后细胞存活率明显降低(P<0.01);Hoechst33258荧光染色可以观察明显的凋亡特征性改变;AnnexinV-FITC流式细胞分析可见高糖凋亡组凋亡率明显升高。综上所述,50 mmol/L葡萄糖孵育SH-SY5Y细胞48 h可以引起细胞凋亡,而由于甘露醇组和对照组并无差异,推断50 mmol/L葡萄糖引起的细胞凋亡和渗透压的变化并无直接关系。研究结果显示,糖尿病高血糖媒介转导引起的DNA氧化损伤是导致细胞凋亡的一个关键的路径[11]。在医学界,8-OHdG是获得广泛认同的DNA氧化损伤标志物,它是活性氧簇(ROS)导致DNA氧化损伤的主要的以及特异性产物。本研究结果显示,高糖凋亡组上清液中8-OHdG的分泌量为(3.30±0.19) ng/mL,与正常对照组(0.42±0.03) ng/mL相比,升高了8.25倍,可见高糖孵育引起了细胞DNA的氧化损伤,推测高糖引起的凋亡与其氧化损伤有关。
阿魏酸钠保护组细胞上清液中8-OHdG的分泌量均明显下降,而高浓度下降更加明显,与高糖凋亡组相比均有显著性差异(P<0.01);甘露醇对照组细胞上清液中8-OHdG的分泌量与正常对照组相比差异无统计学意义,可见阿魏酸钠可以抑制高糖引起的8-OHdG含量升高,推测阿魏酸钠可能是通过降低氧化应激来发挥保护作用。
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China [J]. N Engl J Med, 2010, 362(12):1090-1101.
[2] Knopman DS, Mosley TH, Catellier DJ, et al. Atherosclerosis riskin communities study brain MRI study. Fourteen-year longitudinal studyof vascular risk factors, APOE genotype, and cognition: the ARIC MRIStudy[J]. Alzheimers Dement,2009,(5):207-214.
[3] Tomlinson DR, Gardiner NJ. Glucose neurotoxicity[J].Nat Rev Neurosci, 2008, 9(1):36-45.
[4] 闫恩志,范莹,隋海娟,等.阿魏酸钠对脂多糖引起的大鼠海马炎症反应的抑制作用及其机制探讨[J].中成药,2013,35(2):211-215.
[5] 李宗泽,杨清俊,朱艳凌,等. 肌肽对高糖诱导SH-SY5Y细胞凋亡的保护作用[J].中国药理学与毒理学杂志,2013,27(5):795-800.
[6] 刘云,包琼琼,庄晓赛,等.梓醇对乳胞素诱导SH-SY5Y细胞损伤的保护作用[J].中国药理学与毒理学杂志,2012,26(1):58-63.
[7] Li Z G, Zhang W X, Sima Anders A F.C-peptide enhances insulin-mediated cell growth and protection against high glucose-induced apoptosis in SH-SY5Y cells[J]. Diabetes Metab. Res. Rev, 2003, 19(5):375-85.
[8] Lee M, Kwon BM, Suk K, et al. Effects of obovatol on GSH depleted glia-mediated neurotoxicity and oxidative damage [J].J Neuroimmune Pharmacol, 2012, 7(1):173-86.
[9] David R,Tomlinson,Natalie J. Gardiner. Glucose neurotoxicity[J]. Nature reviews,2008,9:36-45.
[10] Cao M F, Jiang J J, Du Y F, et al. Mitochondria-targeted antioxidant attenuates high glucose-induced P38 MAPK pathway activation in human neuroblastoma cells[J]. Mol Med Report, 2012, 5(4):929-934.
[11] Kasai H, Nishimura S.Hydroxylation of deoxyguanosine at the C-8 position by ascorbic acid and other reducing agents[J].Nuclcic Acids Res,1984,12(4):213-2145.
Sodium Ferulate Bioactivity-Protective Effects on High Glucose Induced SH-SY5Y Cell Apoptosis
ZHAO Hang, XU Yuan-hong
( 1stAffil.Hosp.,ChinaMed.Uni.,Shenyang110001)
Protective effect and its mechanism of sodium ferulate (SF) on high glucose induced human neuroblastoma (SH-SY5Y) cell apoptosis was investigated. Cultural liquid of glucose as well as mixed cultural liquid of ladder content of sodium ferulate were respectively carried out SH-SY5Y cell cultivation at 48 h of duration. The cell viability was detected using colorimetry, observed the cell nucleus morph variation by Hoechst 3258 staining; the cell apoptosis rate was detected by inducing flow cytometry; after obtained cell supernatant centrifugally, detect the component containing 8-hydroxy deoxyguanosine (8-OHdG) using an enzyme-linked immunity sorbent assay. The results found that SF protection group significantly increased the cell survival rate; and the nucleus morph was significantly improved; the rate of early apoptotic cells, and the supernatant of 8-OHdG secretion were significantly reduced. Thereby SF on high glucose induced SH-SY5Y apoptosis has protective effect, and the mechanism may relate to antioxidation of SF.
high glucose; SH-SY5Y cell; apoptosis; sodium ferulate; 8-OHdG
赵航 男,硕士研究生。研究方向为普通外科肝胆疾病的治疗与防治。E-mail:zhaohang5abc@163.com
* 通讯作者。男,主任医师,硕士生导师。研究方向为胰腺疾病的治疗与预防。E-mail:12223596@qq.com
2015-11-03;
2015-12-01
Q81;R282.71;R329.2
A
1005-7021(2016)03-0065-04
10.3969/j.issn.1005-7021.2016.03.012
