耐力运动通过抑制HIF-1α/iNOS预防高脂饮食小鼠脂肪组织炎症
2017-01-03邹华刚陈香仙
邹华刚,陈香仙
耐力运动通过抑制HIF-1α/iNOS预防高脂饮食小鼠脂肪组织炎症
邹华刚,陈香仙
目的:研究耐力运动对高脂饮食小鼠脂肪组织HIF-1α/iNOS信号的影响,探讨运动预防脂肪组织炎症的分子机制。方法:8周龄C57BL/6小鼠40只随机分为正常饮食对照组(NC)、正常饮食运动组(NE)、高脂饮食对照组(HC)、高脂饮食运动组(HE),运动组进行8周跑台运动(13 m/min)。ELISA法测定血清TNF-α、IL-6,RT-PCR法测定基因表达,Western Blot法测定蛋白表达。结果:与NC组相比,HC组小鼠血清TNF-α、IL-6浓度显著升高(P<0.05),脂肪组织SVCs TNF-α、IL-6、IL-1β、HIF-1α、PDK1、LDH-A、GLUT1、iNOS mRNA表达均显著升高(P<0.05),HIF-1α和iNOS蛋白表达显著升高(P<0.05);与NC组相比,NE组小鼠SVCs HIF-1α mRNA和蛋白表达显著下降(P<0.05),其余参数无显著差异;与HC组相比,HE组血清TNF-α、IL-6显著下降 (P<0.05),脂肪组织SVCs TNF-α、IL-6、IL-1β、HIF-1α、PDK1、LDH-A、GLUT1、iNOS mRNA表达显著下降,HIF-1α、iNOS蛋白表达显著下降(P<0.05)。结论:8周耐力跑台运动可有效预防高脂饮食小鼠脂肪组织慢性炎症,其机制可能与运动抑制脂肪组织巨噬细胞HIF-1α/iNOS信号轴有关。
耐力运动;脂肪组织;低氧;慢性炎症;胰岛素抵抗;鼠;动物实验
Hotamisligil等人1993年发现,肥胖动物脂肪中炎症因子肿瘤坏死因子(tumor necrosis factor α,TNF-α)表达增多为引发胰岛素抵抗的关键因素[5]。Weisberg等人2003年指出,肥胖动物脂肪中巨噬细胞为慢性炎症反应的主要效应细胞,脂肪大部分炎症因子如TNF-α、 白细胞介素6(interleukin,IL-6)、IL-1β等源自巨噬细胞[18]。脂肪组织巨噬细胞(adipose tissue macrophage,ATMs)与慢性炎症、肥胖性胰岛素抵抗之间的关系经过10年左右的研究取得丰富成果,加深了人们对ATMs功能的理解和认识,健康脂肪中ATMs以抗炎的M2表型存在,肥胖时ATMs激活转化为促炎的M1表型,脂肪组织微环境的变化为ATMs表型转化重要机制[12]。缺氧可能为ATMs表型转化的一个重要原因[3]。肥胖时脂肪细胞体积增加使脂肪组织膨胀,局部血流供应不足,引起细胞氧气供应不足[15]。缺氧激活转录因子低氧诱导因子(hypoxia-inducible factor,HIF-1α),HIF-1α调控诱导型一氧化氮合成酶(inducible nitric synthase,iNOS)表达,iNOS通过催化底物L-精氨酸,释放一氧化氮(nitric oxide,NO)[9],过量NO促进脂肪组织炎症和胰岛素抵抗[12]。
有动物、人体实验证明,运动是预防和改善慢性炎症的有效途径之一[20]。Kawanishi等发现,16周耐力训练(12~20 m/min,60 min/天)不但显著降低高脂饮食小鼠脂肪组织巨噬细胞标志物,更诱导M1-M2表型转化,有效改善脂肪组织慢性炎症[7]。一次急性运动虽不足以降低大鼠脂肪组织巨噬细胞数量,却可诱导M1-M2表型转化,改善慢性炎症和胰岛素敏感性[11]。然而,运动抗炎的相关分子机制鲜有报道,鉴于缺氧对脂肪组织炎症的重要作用,缓解脂肪组织缺氧可能为运动改善炎症的途径之一。Disanzo等发现,8周跑台耐力训练显著降低肥胖大鼠附睾脂肪乳酸水平,提示脂肪组织缺氧得到改善[1]。运动对肥胖动物脂肪组织中巨噬细胞缺氧情况的影响鲜有报道,本研究观察8周中等强度耐力跑台运动对高脂饮食(high fat diet,HFD)小鼠脂肪组织巨噬细胞HIF-1α/iNOS信号的影响。
1 实验材料与方法
1.1 实验对象与分组
8周龄C57BL/6小鼠40只购自上海斯莱克动物有限公司,适应饲养1周后随机分为正常饮食对照组(NC)、正常饮食运动组(NE)、高脂饮食对照组(HC)、高脂饮食运动组(HE),每组10只。清洁级动物房饲养温度22~25℃,相对湿度50%~65%,每天光照12 h。
1.2 运动干预和取材

1.3 实验试剂和仪器设备
实验试剂:蛋白裂解液,蛋白酶抑制剂,BCA蛋白浓度测定试剂盒、预染蛋白分子量标准,ECL发光液(江苏碧云天生物);TNF-α、IL-6 ELISA试剂盒(南京建成),Trizol(Invitrogen),一抗HIF-1α(美国Santa Cruz),iNOS(美国Santa Cruz),内参GAPDH(美国Santa Cruz),羊抗兔二抗(江苏碧云天生物)。
仪器设备:低温离心机(北京时代北利),超低温冰箱(Thermol Scientic),电动匀浆器(北京优尼康),酶标仪(瑞士Tecan),PCR仪(美国应用生物),荧光定量PCR仪(美国应用生物),电泳仪(北京六一)。
1.4 指标测试与方法
1.4.1 RT-PCR法检测脂肪组织基因表达
Trizol法提取脂肪组织总RNA:100 mg附睾脂肪于1 mL Trizol剪碎,匀浆2~3次,14 000 rpm、4℃离心10 min,取上清,加入200 μl氯仿,室温静置5 min,14 000 rpm、4℃离心15 min,取上层水相(约400 μl)加等体积(约400 μl)异丙醇,室温静置10 min,14 000 rpm、4℃离心10 min,去上清,1 mL预冷75%乙醇重悬沉淀,7 500 rpm、4℃离心5 min,去乙醇,20 μl DEPC水溶解RNA,酶标仪检测RNA浓度和纯度。
RNA逆转录反应。根据逆转录试剂(TOYOBO)盒说明书进行RNA逆转录反应:20 μl反应体系包括5×buffer 4 μl,RT酶Mix 1 μl,Primer Mix1 1 μl,RNA模板2 μl,DEPC水12 μl,cDNA产物可保存于-20℃。SYBR Green掺入法进行PCR扩增反应:20 μl反应体系包括SYBR Green Mix 10 μl,cDNA 2 μl,上、下游引物各0.04 μl(共0.2 μM),DEPC水7.92 μl。反应条件为95℃ 1 min预变性→95℃ 15 s变性→60℃ 30 s退火→72℃ 45 s延伸,进行50个循环,统计Ct值(表1)。
1.4.2 分离脂肪组织SVCs
附睾脂肪基质血管组分细胞(stromal vascular fraction cells,SVCs)分离:200 mg附睾脂肪于2 ml PBS (0.5%BSA)中剪碎,转移到50 ml离心管, 1 mL PBS(0.5%BSA)涮洗残留组织转移到50 ml离心管,加入3 mL II型胶原酶消化液 (PBS +0.5%BSA+4 mg/mL II型胶原酶),37℃水浴孵育消化20 min,加入10 ml PBS (0.5%BSA),移液枪反复吹打细胞团,100 μm细胞滤网过滤细胞悬液,转移至新50 ml离心管,500 g、4℃离心10 min,弃上清,收集底层SVCs细胞团[13]。5 ml PBS(0.5%BSA)重悬和冲洗SVCs细胞,500 g、4℃离心5 min,western blot备用。
1.4.3 Western blot法检测蛋白表达
细胞蛋白裂解液裂解细胞,BCA法测定蛋白浓度(BSA为标准品)。10%浓度的SDS-PAGE 分离HIF-1α和iNOS,每孔蛋白上样量20 μg,湿法转膜1 h,5%脱脂牛奶封闭1 h,1×TBST洗膜,3×5 min,一抗(HIF-1α 1∶1 000;iNOS 1∶500 ;GAPDH 1∶1 000)4℃孵育过夜,1×TBST洗膜,3×5 min,二抗(羊抗兔IgG 1∶3 000~5 000)室温孵育2 h,1×TBST 洗膜3×5 min,加入ECL发光液,暗室曝光,Image J软件读取条带灰度值,以目的蛋白与内参蛋白灰度值比值为蛋白相对表达含量。

表 1 靶基因引物序列一览表Table 1 Primer Sequence of Target Gene
1.5 数据统计分析
所有实验数据均以平均数±标准差形式呈现,采用SPSS 11.0软件进行双因素方差分析,以P<0.05为显著性差异。
2 实验结果
2.1 8周跑台运动对高脂饮食小鼠生理和代谢指标影响
表2所示,与NC组相比,HC组小鼠体质量、附睾脂肪含量、血清TNF-α、IL-6显著增加或升高(P<0.05);与NC组相比,NE组小鼠各参数无显著变化;与HC组相比,HE组小鼠体质量、附睾脂肪含量、血清TNF-α、IL-6显著下降(P<0.05)。
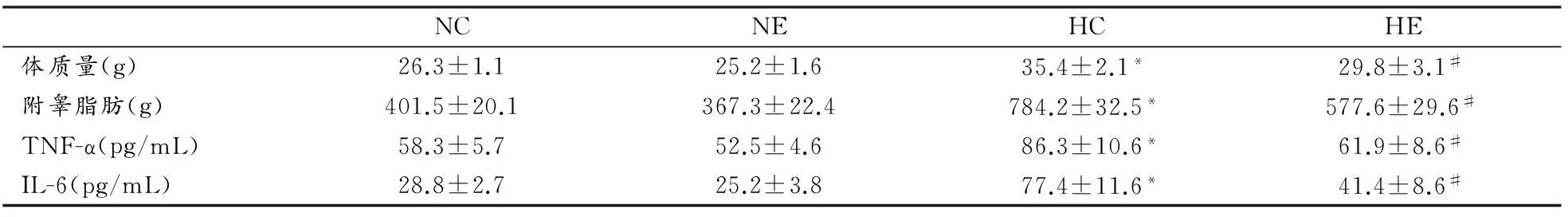
表 2 运动对小鼠生理和代谢指标的影响一览表Table 2 The Effect of Exercise on Physiology and Metabolic Parameters of Mice
注:* 表示与NC组相比P<0.05 ;#表示与HC组相比P<0.05,下同。
2.2 8周跑台运动对高脂饮食小鼠附睾脂肪SVCs炎症因子基因表达的影响
图1所示,与NC组相比,HC组小鼠附睾脂肪SVCs TNF-α、IL-6、IL-1β mRNA表达显著升高(P<0.05);与NC组相比,NE组小鼠附睾脂肪SVCs TNF-α、IL-6、IL-1β mRNA表达具下降趋势但无显著差异;与HC组小鼠相比,HE组小鼠附睾脂肪SVCs TNF-α、IL-6、IL-1β mRNA表达均显著下降(P<0.05)。
2.3 8周跑台运动对高脂饮食小鼠附睾脂肪SVCs 缺氧相关基因表达的影响
图2所示,与NC组相比,HC组小鼠附睾脂肪SVCs HIF-1α、丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase 1,PDK1)、葡萄糖转运体1(glucose transporter 1,GLUT1)、乳酸脱氢酶(lactic dehydrogense A,LDH-A) 、iNOS mRNA表达显著升高(P<0.05);与NC组相比,NE组小鼠附睾脂肪SVCs缺氧相关基因表达无显著差异;与HC组小鼠相比,HE组小鼠附睾脂肪SVCs HIF-1α、PDK1、GLUT1、LDH-A 、iNOS mRNA表达显著下降(P<0.05)。

图 1 运动对小鼠附睾脂肪SVCs 炎症基因表达变化的影响柱状图Figure 1. The Effect of Exercise on Inflammatory Gene Expression in Epididymis Fat Pad SVCs

图 2 运动对小鼠附睾脂肪SVCs缺氧相关基因表达的影响柱状图Figure 2. The Effect of Exercise on Hypoxia-induced Gene Expression in Epididymis Fat Pad SVCs
2.4 8周跑台运动对高脂饮食小鼠附睾脂肪SVCs HIF-1α表达的影响
图3所示,与NC组相比,HC组小鼠附睾脂肪SVCs HIF-1α蛋白表达显著升高 (P<0.05);与NC组相比,NE组小鼠附睾脂肪SVCs HIF-1α蛋白表达显著下降;与HC组小鼠相比,HE组小鼠附睾脂肪SVCs HIF-1α蛋白表达显著下降 (P<0.05)。

图 3 运动对小鼠附睾脂肪 SVCs HIF-1α蛋白表达的影响示意图Figure 3. The Effect of Exercise on HIF-1α Protein Expression in Epididymis Fat Pad SVCs
2.5 8周跑台运动对高脂饮食小鼠附睾脂肪SVCs iNOS蛋白表达的影响
图4 所示,与NC组相比,HC组小鼠附睾脂肪SVCs iNOS蛋白表达显著升高 (P<0.05);与NC组相比,NE组小鼠附睾脂肪SVCs iNOS蛋白表达无显著变化;与HC组小鼠相比,HE组小鼠附睾脂肪SVCs iNOS蛋白表达显著下降 (P<0.05)。
3 分析与讨论
肥胖小鼠脂肪组织巨噬细胞增多,炎症水平提高,糖尿病治疗药物罗格列酮显著降低肥胖小鼠脂肪组织巨噬细

图 4 运动对小鼠附睾脂肪 SVCs iNOS蛋白表达的影响图Figure 4. The Effect of Exercise on iNOS Protein Expression in Epididymis Fat Pad SVCs
胞和炎症标志物,提示,脂肪组织巨噬细胞介导的慢性炎症实为肥胖诱导胰岛素抵抗发生的关键机制,同时慢性炎症靶向药物可能是糖尿病治疗的重要方向[19]。本研究发现,8周高脂饮食小鼠体质量、附睾脂肪含量显著提高,外周血中炎症因子TNF-α、IL-6浓度显著升高,附睾脂肪组织炎症因子TNF-α、IL-6、IL-1β mRNA表达显著提高,提示,8周高脂饮食小鼠脂肪组织局部和整个机体炎症水平明显升高。脂肪组织炎症分子机制为当下糖尿病医学研究的热点话题,肥胖时脂肪组织缺氧的观点逐渐被人接受。细胞对缺氧的主要应答调控因子为HIF-1α,氧气充足时,加双氧酶利用氧气和α-酮戊二酸羟基化修饰HIF-1α蛋白的关键脯氨酸和天冬氨酸位点,脯氨酸-402位点和/或-564位点的羟基化对希佩尔林道蛋白(VHL)的蛋白结合活性不可或缺,VHL帮助E3泛素连接酶识别,经蛋白酶体途径降解HIF-1α,此外,HIF-1α天冬氨酸-803位点的羟基化阻断转录辅助激活因子p300和CBP结合HIF-1α的转录激活结构域,进一步抑制HIF-1α转录功能。然而,缺氧情况下,羟化酶活性被抑制,HIF-1α激活[6],细胞代谢由葡萄糖氧化磷酸化供能转向糖酵解供能,葡萄糖转化成丙酮酸,丙酮酸经乳酸脱氢酶(lactate dehydrogenase,LDH)直接转化为乳酸。HIF-1α对细胞代谢转化过程至关重要,糖酵解代谢中LDH-A、磷酸果糖激酶L(phosphofructokinase L,PFKL)[16]、丙酮酸脱氢酶激酶1(pyruvate dehydrogenase kinase 1,PDK1)[8]等多个基因由HIF-1α编码。HIF-1通过转录激活PDK1抑制三羧酸循环代谢,PDK1是糖酵解代谢关键限速酶,可磷酸化抑制丙酮酸脱氢酶,细胞氧气充足时,丙酮酸脱氢酶催化丙酮酸转化为乙酰辅酶A进入三羧酸循环,产生还原NADH携带电子经线粒体内膜复合物I (NADH脱氢酶)进入呼吸链,复合物I、III和IV 3个质子泵不断将质子输送到线粒体膜间隙,产生跨膜的电化学梯度(质子动力),质子通过复合物V(ATP合成酶)回流进入线粒体基质,质子动力驱动ATP合成酶合成ATP。HIF-1α还转录调控葡萄糖转运子1(glucose transporter 1,GLUT1),Freemerman等发现,GLUT1过表达可通过诱导巨噬细胞糖代谢转向糖酵解激活巨噬细胞,提高炎症因子分泌[2]。
高脂饮食肥胖小鼠和ob/ob肥胖小鼠炎症水平升高的同时,脂肪组织缺氧标志物HIF-1α和GLUT1 mRNA和蛋白表达显著升高,脂肪组织氧分压下降。免疫组化和特异性低氧探针发现,肥胖小鼠脂肪组织间质区域缺氧尤为显著,缺氧区域与F4/80+巨噬细胞重叠,提示脂肪组织巨噬细胞对缺氧尤为敏感[14]。缺氧处理原代培养的正常小鼠腹膜巨噬细胞8 h,HIF-1α、GLUT1、VEGF、PDK1 mRNA表达显著升高,而TNF-α、IL-1、IL-6 mRNA低氧处理2 h表达就显著增加,缺氧提高了转录因子NF-κB结合活性和TNF-α启动子转录活性[21]。本研究发现,8周高脂饮食小鼠附睾脂肪组织SVCs炎症因子TNF-α、IL-6、IL-1β mRNA表达显著升高,缺氧标志性基因HIF-1α、GLUT1、PDK1和LDHA mRNA表达显著提高,同时,HIF-1α蛋白表达显著增加。脂肪组织基质血管组分(stromal vascular fraction,SVF)富含巨噬细胞、T细胞、脂肪前体细胞、间充质干细胞,其中巨噬细胞数量最多[10],因此,研究时常采用SVCs作为脂肪组织巨噬细胞研究对象。本研究显示,8周高脂饮食小鼠SVCs HIF-α靶基因iNOS mRNA和蛋白表达均显著增加。
有证据表明,耐力运动、抗阻练习能降低肥胖人群的炎症水平[7]。本研究发现,8周耐力跑台训练显著抑制高脂饮食小鼠附睾脂肪组织SVCs炎症因子TNF-α、IL-6、IL-1β mRNA表达,血清炎症因子TNF-α、IL-6浓度显著低于HC组,提示8周耐力跑台训练可有效抑制高脂饮食诱导的慢性炎症。运动预防和治疗慢性炎症部分可能与脂肪组织缺氧得到改善有关。研究还显示,8周耐力跑台运动显著抑制附睾脂肪组织SVCs 缺氧标志物HIF-1α、GLUT1、PDK1和LDHA mRNA表达, HIF-1α蛋白表达显著降低,HIF-1α另一个靶基因iNOS mRNA和蛋白表达均显著下降。然而,8周耐力跑台训练对正常小鼠炎症基因和缺氧相关基因表达并无影响,却显著降低HIF-1α mRNA和蛋白表达,相关机制尚不清楚,本研究未对此进一步深入研究。但是,有文献从运动促进脂肪组织血管生成角度阐述运动改善脂肪组织缺氧的机制。Hatano等发现,9周耐力训练显著提高Wistar大鼠脂肪组织SVCs 血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)及其受体表达,脂肪内皮细胞密度增加[4]。Disanzo等发现,8周耐力跑台训练提高Zuker肥胖大鼠脂肪组织VEGF-A表达,同时降低乳酸水平[1]。
4 结论
8周耐力跑台运动有效预防高脂饮食小鼠慢性炎症,其机制可能与运动抑制脂肪组织巨噬细胞HIF-1α/iNOS信号轴有关。
[1]DISANZO B L,YOU T.Effects of exercise training on indicators of adipose tissue angiogenesis and hypoxia in obese rats[J].Metabolism,2014,63(4):452-455.
[2]FREEMERMAN A J,JOHNSON A R,SACKS G N,etal.Metabolic reprogramming of macrophages:Glucose transporter 1 (GLUT1)-mediated glucose metabolism drives a proinflammatory phenotype[J].J Biol Chem,2014,289(11):7884-7896.
[3]FUJISAKA S,USUI I,IKUTANI M,etal.Adipose tissue hypoxia induces inflammatory M1 polarity of macrophages in an HIF-1alpha-dependent and HIF-1alpha-independent manner in obese mice[J].Diabetologia,2013,56(6):1403-1412.
[4]HATANO D,OGASAWARA J,ENDOH S,etal.Effect of exercise training on the density of endothelial cells in the white adipose tissue of rats[J].Scand J Med Sci Sports,2011,21(6):e115-e121.
[5]HOTAMISLIGIL G S,SHARGILL N S,SPIEGELMAN B M.Adipose expression of tumor necrosis factor-alpha:direct role in obesity-linked insulin resistance[J].Sci,1993,259(5091):87-91.
[6]KAELIN W J.The von Hippel-Lindau protein,HIF hydroxylation,and oxygen sensing[J].Biochem Biophys Res Commun,2005,338(1):627-638.
[7]KAWANISHI N,YANO H,YOKOGAWA Y,etal.Exercise training inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switching from M1 to M2 macrophages in high-fat-diet-induced obese mice[J].Exerc Immunol Rev,2010,16:105-118.
[8]KIM J W,TCHERNYSHYOV I,SEMENZA G L,etal.HIF-1-mediated expression of pyruvate dehydrogenase kinase:A metabolic switch required for cellular adaptation to hypoxia[J].Cell Metab,2006,3(3):177-185.
[9]MELILLO G,MUSSO T,SICA A,etal.A hypoxia-responsive element mediates a novel pathway of activation of the inducible nitric oxide synthase promoter[J].J Exp Med,1995,182(6):1683-1693.
[10]NISHIMURA S,MANABLE I,NAGASAKI M,etal.CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity[J].Nat Med,2009,15(8):914-920.
[11]OLIVEIRA A G,ARAUJO T G,CARVALHO B M,etal.Acute exercise induces a phenotypic switch in adipose tissue macrophage polarization in diet-induced obese rats[J].Obesity(Silver Spring),2013,21(12):2545-2556.
[12]OLEFSKY J M,GLASS C K.Macrophages,inflammation,and insulin resistance[J].Annu Rev Physiol,2010,72:219-246.
[13]ORR J S,KENNEDY A J,HASTY A H.Isolation of adipose tissue immune cells[J].J Vis Exp,2013,(75):e50707.
[14]RAUSCH M E,WEISBERG S,VARDHANA P,etal.Obesity in C57BL/6J mice is characterized by adipose tissue hypoxia and cytotoxic T-cell infiltration[J].Int J Obes(Lond),2008,32(3):451-463.
[15]SUN K,KUSMINSKI C M,SCHERER P E.Adipose tissue remodeling and obesity[J].J Clin Invest,2011,121(6):2094-2101.
[16]SEMENZA G L,ROTH P H,FANG H M,etal.Transcriptional regulation of genes encoding glycolytic enzymes by hypoxia-inducible factor 1[J].J Biol Chem,1994,269(38):23757-23763.
[17]VIEIRA V J,VALENTINE R J,WILUND K R,etal.Effects of exercise and low-fat diet on adipose tissue inflammation and metabolic complications in obese mice[J].Am J Physiol Endocrinol Metab,2009,296(5):E1164-E1171.
[18]WEISBERG S P,MCCANN D,DESAI M,etal.Obesity is associated with macrophage accumulation in adipose tissue[J].J Clin Invest,2003,112(12):1796-1808.
[19]XU H,BARNES G T,YANG Q,etal.Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance[J].J Clin Invest,2003,112(12):1821-1830.
[20]YOU T,ARSENIS N C,DISANZO B L,etal.Effects of exercise training on chronic inflammation in obesity:Current evidence and potential mechanisms[J].Sports Med,2013,43(4):243-256.
[21]YE J,GAO Z,YIN J,etal.Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue of ob/ob and dietary obese mice[J].Am J Physiol Endocrinol Metab,2007,293(4):E1118-E1128.
Endurance Exercise Preventing Adipose TissueInflammation by Inhibiting HIF-1α/iNOS
ZOU Hua-gang,CHEN Xiang-xian
Objective:The effects of endurance exercise on HIF-1α/iNOS signaling in adipose tissue of high fat diet feeding mice were investigated to explore the molecular mechanisms of exercise-induced prevention from adipose tissue inflammation induced by high fat diet.Methods:40 8-week old C57BL/6 mice were randomly divided into 4 groups,namely normal diet control (NC),normal diet exercise (NE),high fat diet control (HC) and high fat diet exercise (HE) with each group 10 mice.Exercise group were subjected to 8 week treadmill running program at a speed of 13 m/min.ELISA assay was used to measure serum TNF-α and IL-6.RT-PCR was used to determine gene expression while Western Blot was used to determine protein expression.Results:Compared to NC group,serum TNF-α,IL-6 and TNF-α,IL-6,IL-1β,HIF-α,PDK1,GLUT1,LDHA,iNOS mRNA expression as well as HIF-1α and iNOS protein expression in adipose tissue SVCs of HC group were significantly elevated (P<0.05).Campared with NC group,HIF-1α mRNA and protein expression in adipose tissue SVCs of NE group were reduced markedly(P<0.05) while other indicators changed without significance.Compared with HC group,serum TNF-α,IL-6 and TNF-α,IL-6,IL-1β,HIF-α,PDK1,GLUT1,LDH-A,iNOS mRNA expression as well as HIF-1α and iNOS protein expression in adipose tissue SVCs of HE group were significantly reduced(P<0.05).Conclusion:8 week endurance treadmill running efficiently prevent chronic inflammation of high fat diet feeding mice possibly by inhibiting HIF-1α/iNOS signaling pathway.
enduranceexercise;adiposetissue;hypoxia;HIF-1α;chronicinflammation;insulinresistance;rat;animalexperiment
1002-9826(2016)02-0085-05
10.16470/j.csst.201602013
2015-02-27;
2015-12-30
邹华刚(1976-),男,安徽安庆人,讲师,硕士,主要研究方向为运动康复与社会体育,Tel:(0553)5910709,E-mail:365522253@qq.com;陈香仙(1964-),女,浙江金华人,教授,博士,主要研究方向为运动损伤与康复,Tel:(0553)5910709,E-mail:jhchxxlu@mail.ahnu.edu.cn。
安徽师范大学 体育学院,安徽 芜湖 241000 Anhui Normal University,Wuhu 241000,China.
G804.5
A
