安徽省小麦赤霉病菌群体遗传多样性AFLP分析
2016-12-30卢丽斌丁克坚
卢丽斌,陈 莉,宛 琼,丁克坚
(安徽农业大学植物保护学院,安徽合肥 230036)
安徽省小麦赤霉病菌群体遗传多样性AFLP分析
卢丽斌,陈 莉,宛 琼,丁克坚
(安徽农业大学植物保护学院,安徽合肥 230036)
为了解安徽省小麦赤霉病菌的群体分化和遗传变异规律,利用AFLP技术对安徽省4个地理群体的68个供试菌株进行了群体遗传多样性分析。结果表明,8对引物共扩增出245条带,供试菌株间的遗传距离为0.014~0.021。4个小麦赤霉病菌群体之间的遗传距离与地理分布没有明显的相关性。4个赤霉病菌群体的Shannon信息指数I为0.321,基因多样性指数H为0.193,表明具有一定的遗传多样性。方差分析表明,被测小麦赤霉病菌群体的遗传变异主要存在于群体内(99.80%),群体间的遗传变异仅占0.20%。4个赤霉病菌群体间存在较低的遗传分化(Gst=0.049)和频繁的基因交流(Nm=9.648)。相比较而言,北部群体和中部群体亲缘关系较近,而南部群体和中、北部群体亲缘关系较远。
安徽;小麦赤霉病菌;遗传多样性;扩增片段长度多态性
小麦赤霉病主要分布在湿润及半湿润地区。近年来,随着全球气候变暖和农作物耕作制度的改变,小麦产区赤霉病的发生面积越来越大,重发生年份出现的频率也逐渐增加。该病害不仅造成小麦严重减产[1],病菌在侵染过程中还产生多种真菌毒素(如DON和NIV)及次生代谢产物污染粮食,引起人畜呕吐、腹痛等中毒症状,严重威胁人和动物的健康[2]。
DNA分子标记技术是用特征性DNA片段来反映生物个体或者群体间基因组的某种差异。目前,已经建立起来的分子标记技术达十多种[3]。AFLP(扩增片段长度多态性)仅需少量引物即可获得较多标记,受环境影响小,分辨率高,经两步选择扩增,带型稳定,灵敏度高,重复性好,被称为最有力的分子标记技术[3],在遗传多样性研究中得到了广泛的应用。Quellet和Seifert[4]利用随机扩增多态性的分子标记对禾谷镰刀菌的遗传特性进行研究,开创了分子水平对镰刀菌进行种型鉴定的先河。Qu等[5]对我国不同地区的437个菌株进行了SCAR(特定序列扩增)和AFLP分析。Yang等[6]利用SNP(单核苷酸多态性)对从大麦种中分离出的1 894个菌株进行分析。刘 恒等[7]利用AFLP技术对陕西省小麦赤霉病菌的遗传多样性进行了分析,结果表明不同区域的禾谷镰刀菌之间的遗传背景存在多样性,群体间有明确的地理分布特征,可以分为A、B两大生态适应性类型。
安徽省地处我国南北过渡地带,是小麦赤霉病主发区。为了解安徽省小麦赤霉病菌群体遗传变异特点及系统演化机制,本研究利用AFLP技术对安徽省4个地理群体的68个镰刀菌进行群体遗传多样性研究,分析其群体分化和遗传变异规律,以期为进一步明确小麦赤霉病菌的遗传变异规律、指导病害科学防治提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
本试验用小麦赤霉病菌,均来自安徽省主要农作物品种抗病性鉴定与研究中心菌种库,菌株采集时间为2009-2015年。各菌株来源及编号见表1。
1.1.2 供试引物
参考Justesen等[ 8]的引物,筛选出8对多态性好、谱带清晰、重复性好的选择性扩增引物,并在每对选择性引物的MseI链的5′端加上相应的荧光(上海生物工程技术有限公司合成),引物信息见表2。
表1 供试菌株信息
Table 1 Information of the tested stains

群体Population采集地Location菌株Strain菌株编号及数量Nameandnumbersofthestrain皖北淮北Huaibei砀山Dangshan(ds)、宿州Suzhou(sz)ds1,sz1,sz2,sz315NorthofAnhui(HB)亳州Bozhou涡阳Guoyang(gy)、亳州Bozhou(bz)gy1,gy2,gy3,gy4,bz1蒙城Mengcheng(mc)、利辛Lixin(lx)mc1,mc2,mc3,mc4,mc4-,lx1沿淮蚌埠Bengbu凤阳Fengyang(fy)、怀远Huanyuan(hy)fy1,fy2,fy3,hy1,hy223AlongtheHuairiver(BF)淮南Huainan固镇Guzhen(gz)、淮南Huainan(hn)gz1,gz2,gz3,hn1,hn2阜阳Fuyang凤台Fengtai(ft)、寿县Shouxian(sx)ft1,ft2,ft3,ft4,sx1阜阳Fuyang(fuy)fuy1,fuy2,fuy3,fuy3-颍上Yingshang(ys)ys1,ys2,ys3,ys3-江淮之间合肥Hefei巢湖Chaohu(ch)、庐江Lujiang(lj)ch1,ch2,ch3,ch4-,lj119Jianghuaicenter(HC)六安Luan长丰Changfeng(cf)、定远Dingyuan(dy)cf1,cf2,dy1,dy2滁州Chuzhou六安Luan(la)、霍邱Huoqiu(hq)la1,la2,la3,la4,la5,hq1金寨Jinzhai(jz)、滁州Chuzhou(cz)jz1,jz2,jz3,cz1沿江安庆Anqing芜湖Wuhu(wh)、含山Hanshan(hs)wh1,wh2,hs111Alongtheriver(WX)铜陵Tongling安庆Anqing(aq)aq1,aq2,aq3,aq4宣城Xuancheng潜山Qianshan(qs)、绩溪Jixi(jx)qs1,jx1铜陵Tongling(tl)、宣城Xuancheng(xc)tl1,xc1Anhui安徽Anhui68
菌株编号后面带“-”为Fusariumgraminearum(Fg)菌株,没有标注的为Fusariumasiaticum(Fa)菌株。
- following the strain number represents theFusariumgraminearum(Fg),others wereFusariumasiaticum(Fa).
表2 AFLP技术所用引物及序列
Table 2 Primers and corresponding sequences used for AFLP analysis

引物名称Primer引物序列(5′⁃3′)Sequence(5′⁃3′)修饰荧光Labeledfluorescence扩增条带数目No.ofpolymorphicbandsPstI⁃adapterTGTACGCAGTCTACCTCGTAGACTGCGTACATGCAMseI⁃adapterTACTCAGGACTCATGACGATGAGTCCTGAGPstI0GTAGACTGCGTACATGCAGMseI0GACGATGAGTCCTGAGTAAM11/P19MseI0+AA/PstI0+GAROX24M11/P20MseI0+AA/PstI0+GCROX39M12/P23MseI0+AC/PstI0+TAFAM20M12/P24MseI0+AC/PstI0+TCFAM57M14/P11MseI0+AT/PstI0+AAHEX33M14/P25MseI0+AT/PstI0+TGHEX22M20/P23MseI0+GC/PstI0+TATAMRA25M20/P25MseI0+GC/PstI0+TGTAMRA25
MseI0+AA:MseI0引物(5′-GACGATGAGTCCTGAGTAA-3′)加上2个选择性碱基(AA);PstI0+GA:PstI0引物(5′-GTAGACTGCGTACATGCAG-3′) 加上2个选择性碱基(GA)。
MseI0+AA:MseI0 primer(5′-GACGATGAGTCCTGAGTAA-3′) plus two selective nucleotides(AA);PstI0+GA:PstI0 primer(5′-GTAGACTGCGTACATGCAG-3′) plus two selective nucleotides(GA).
1.2 试验方法
1.2.1 DNA提取
收集PDA培养基上培养的菌丝,采用CTAB法[9]提取基因组DNA,利用Nanodrop 2000(上海在途生物科技有限公司)测定DNA的纯度和浓度,-20 ℃保存备用。
1.2.2 AFLP检测
AFLP检测参考Justesen等[ 8]方法,首先利用MseI和PstI两种限制性内切酶对基因组DNA进行双酶切,并在T4-DNA Liagase作用下进行连接。37 ℃水浴中酶切连接10.5 h后,PCR仪中65 ℃灭活20 min。酶切连接产物用1%琼脂糖凝胶电泳检测,再利用引物MseI0和PstI0(具体序列见表2)对酶切连接产物进行预扩增,将预扩增产物进行选择性扩增,最后将选择性扩增产物利用遗传分析仪进行谱带分析。
1.2.3 数据分析
利用Gene marker 2.2.0软件对AFLP扩增谱带进行读数,相同迁移位置上有电泳条带的个体记为“1”,无条带的记为“0”,不确定条带的记为“2”,建立0、1二元数据矩阵,作为分析的原始数据。
将供试菌株按照地理分布划分为4个群体,采用软件Popgene Version 1.32计算各个群体的遗传距离。用软件NTSYSpc version 2.1以及类平均聚类法(UPGMA)构建系统聚类树。
采用软件Popgene Version 1.32计算安徽省小麦赤霉病菌总群体和各个群体的多态位点比率(P)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei′s基因多样性指数(H)、Shannon′s信息指数(I)、群体分化系数(Gst)和基因流(Nm)。
利用Multilocus 1.32软件计算安徽省小麦赤霉病菌的AFLP基因型频率,并计算总群体及各亚群体的基因型多样性。
利用Genalex 6.5软件中的分子方差分析(AMOVA)计算安徽省小麦赤霉病菌的φpt参数。为了进一步分析各亚群体间的遗传差异,将安徽省小麦赤霉病菌各菌株之间的遗传距离转换成构建特征向量和特征值后,寻找群体的分散幅度,利用软件中的PCoA方法作图。
运用Structure 2.2软件对安徽省68个小麦赤霉病菌株进行遗传类群的划分。
2 结果与分析
2.1 AFLP结果分析
利用8对多态性高且条带丰富的引物组合M11/P19、M11/P20、M12/P23、M12/P24、M14/P11、M14/P25、M20/P23、M20/P25对供试病菌群体进行多样性分析,对条带进行统计,共得到245个位点,平均每组引物为30.625个位点;8对引物扩增的条带数在20~57之间,其中 M12/P24扩增的条带数最多,为57条(表2)。
2.2 聚类分析
按照小麦赤霉病菌在安徽省的地理分布,由北往南将68个菌株分别划分为皖北(HB)、沿淮(BF)、江淮之间(HC)、沿江(WX)4个群体进行遗传多样性分析(表1)。由表3可知,4个群体的遗传距离为0.014~0.021,遗传相似系数在0.980~0.988之间,表明4个群体间的遗传差异不明显,亲缘关系较近。
表3 4个群体之间的遗传相似系数(右上方)和遗传距离(左下方)
Table 3 Genetic similarity coefficients(upper right) and genetic distance(lower left) between four populations
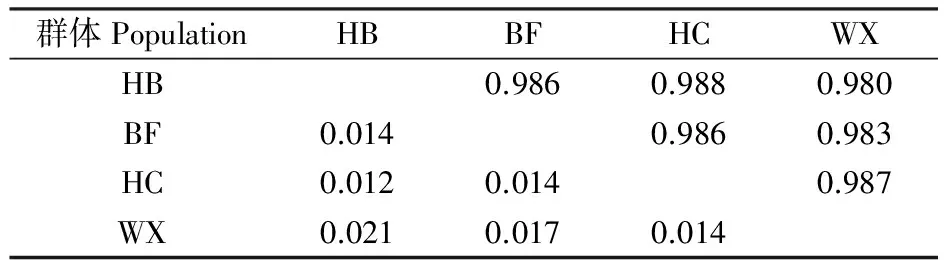
群体PopulationHBBFHCWXHB0.9860.9880.980BF0.0140.9860.983HC0.0120.0140.987WX0.0210.0170.014
根据遗传距离,构建4个群体间的系统聚类图(图1)。由图1可以看出,安徽北部两个群体(HB、HC)和中部群体(BF)亲缘关系较近,而安徽南部群体(WX)和其他三个群体亲缘关系较远。

图1 4个群体的聚类图
2.3 遗传多样性分析
由表4可知,安徽省小麦赤霉病菌群体总的多态性位点比例P为100%;基因多样性指数H为0.193;信息指数I为0.321,表明安徽省小麦赤霉病菌群体具有一定的遗传多样性水平。群体间的遗传分化系数为0.022~0.033,基因流为14.905~22.412;表明安徽省4个群体间存在较低的遗传分化、频繁的基因交流。
表4 安徽省小麦赤霉病菌群体的遗传多样性
Table 4 Genetic diversity ofF.graminearumin Anhui province
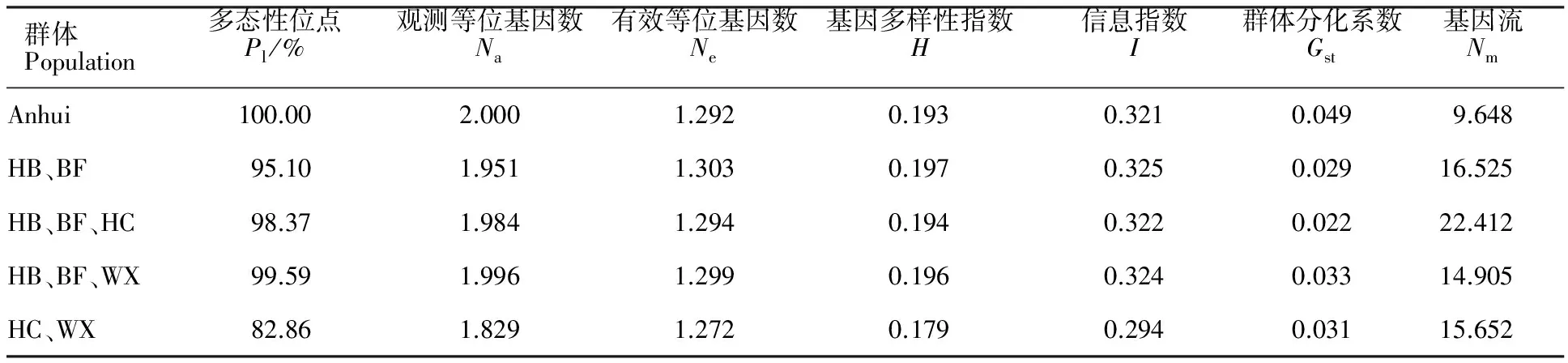
群体Population多态性位点Pl/%观测等位基因数Na有效等位基因数Ne基因多样性指数H信息指数I群体分化系数Gst基因流NmAnhui100.002.0001.2920.1930.3210.0499.648HB、BF95.101.9511.3030.1970.3250.02916.525HB、BF、HC98.371.9841.2940.1940.3220.02222.412HB、BF、WX99.591.9961.2990.1960.3240.03314.905HC、WX82.861.8291.2720.1790.2940.03115.652
Pl:Polymorphic loci;Na:Observed number of alleles;Ne:Effective number of alleles;H:Nei′s gene diversity;I:Shannon′s information index;Gst:Genetic differentiation coefficient;Nm:Estimation of gene flow fromGst.
2.4 基因型分析
将得到的每个AFLP基因型进行人为命名,按顺序编号,如ah6代表安徽第6个基因型。结果显示,68个菌株可分为27个基因型,基因型多样性为0.40,表明被测小麦赤霉病菌群体的AFLP基因型有一定的多样性;HB、BF、HC和WX群体基因型多样性分别为0.53、0.57、0.74、0.82(表5),其中HC、WX群体较高,均超过 0.70。 4个群体中,群体间的共有基因型最少有3个(HB与BF),最多有7个(HC与WX),共有基因型占各群体基因型的比例介于23.10%~77.80%之间,表明各群体间存在着不同程度基因型交流;其中,ah4基因型菌株占比最高。
2.5 遗传结构和遗传分化
由表6可知,4个小麦赤霉病菌群体间的遗传分化水平差异不显著(P=0.387);来自群体内部的遗传变异高达99.80%,群体间的变异仅占0.20%,表明其遗传变异主要来源于群体内部。
为了进一步分析各亚群体间的遗传差异,将安徽省小麦赤霉病菌各菌株之间的遗传距离转换成特征向量和特征值后,寻找小麦赤霉病菌群体的分散幅度,利用Genalex 6.5软件中的PCoA方法作图。由图2可以看出,4个类群主要分为2大类,大部分菌株分布于第一、三象限,小部分菌株分布于第二、四象限,但4个群体均有较多部分的重叠,没有出现自成一类的群体,与之前的聚类分析结果一致。
2.6 群体结构
设置K值为2~12,即将安徽省68个供试菌株划分为2~12个亚群,每个K值分别运行6次,以每个K值为横坐标,以相应的△K值为纵坐标做折线图(图3)。从图3可以看出,当K值为4时,获得了最大的ΔK值,所以最终确定K值为4,将所有供试菌株划分为4个亚群。
表5 安徽省小麦赤霉病菌群体的基因型多样性及各AFLP基因型在群体中的分布
Table 5 Genotypic diversity and the distribution of the corresponding AFLP genotypes obtained in Anhui province

采集地Collectionplace分离物数目Numbersofisolate基因型数目Numbersofgenotype基因型多样性GenotypicdiversityAFLP基因型(相应的分离物数目)AFLPgenotype(Numbersofthecorrespondingisolates)皖北 HB1580.53ah1(1),ah2(1),ah3(2),ah4(6),ah5(1),ah6(2),ah7(1),ah8(1)沿淮 BF23130.57ah2(2),ah4(4),ah7(1),ah9(1),ah10(4),ah11(1),ah12(1),ah13(1),ah14(1),ah15(1),ah16(3),ah17(1),ah18(1)江淮之间 HC19140.74ah4(2),ah6(1),ah7(2),ah10(2),ah13(2),ah15(2),ah19(1),ah20(1),ah21(1),ah22(1),ah23(1),ah24(1),ah25(1),ah26(1)沿江 WX1190.82ah4(2),ah6(1),ah7(2),ah12(1),ah13(1),ah15(1),ah22(1),ah26(1),ah27(1)
表6 安徽省小麦赤霉病菌4个类群AFLP数据的方差分析(AMOVA)结果
Table 6 AMOVA among and with inF.graminearumpopulations in Anhui Province
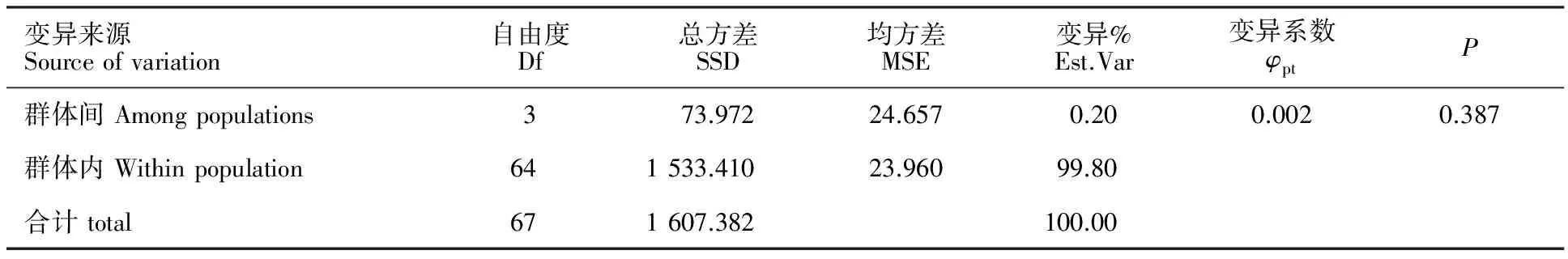
变异来源Sourceofvariation自由度Df总方差SSD均方差MSE变异%Est.Var变异系数φptP群体间Amongpopulations373.97224.6570.200.0020.387群体内Withinpopulation641533.41023.96099.80合计total671607.382100.00

图2 安徽省小麦赤霉病菌4个类群AFLP数据的PCoA载荷图
利用Structure 2.2软件中的混合线性模型聚类法来推断群体结构,作安徽省小麦赤霉病菌的群体结构分析图(图4),由图4可以看出,将供试菌株分为4个亚群,从左往右依次为亚群1,亚群2,亚群3和亚群4。
图4表明,68个小麦赤霉病菌菌株可分为4个亚群,除了WX类群在第二亚群中没有分布外,
其余每个类群在4个亚群中均有分布,且同一地区的不同菌株并不完全分布在同一亚群中,群体结构趋向多样化,没有出现自成一类的群体。该结果与主成分分析和UPGMA聚类的结果较为一致。

图3 K与△K的关系
3 讨 论
本研究利用8对多态性高的AFLP引物,扩增得到245个位点,能够准确反映安徽省小麦赤霉病菌群体的遗传多样性。所用AFLP引物的扩增谱带清晰稳定,且扩增出的谱带多态性比例较高。
聚类分析结果表明,安徽省小麦赤霉病菌遗传距离差异不明显,且亲缘关系与地理位置之间没有明显的相关性。这一结果与许 娟和丁克坚[10]通过RAPD -PCR、ISSR-PCR聚类分析的结果一致。

横轴数值代表菌株编号,竖轴为属于某个群体的概率;红色:亚群1;绿色:亚群2;蓝色:亚群3;黄色:亚群4。
The horizontal axis represents strain number, and vertical axis is the probability of membership of a group. Red:Subgroup 1; Green Subgroup 2; Blue:Subgroup 3; Yelow:Subgroup 4.
图4 安徽省68个小麦赤霉病菌的聚类结果
Fig.4 Clustering results of 68F.graminearumstrains in Anhui
从Nei′s遗传多样性指数来看,安徽省小麦赤霉病菌群体的相关遗传参数(H=0.193)低于AFLP、ISSR 等3种显性标记统计的25种广布植物的平均水平(H=0.220)[11],表明安徽省小麦赤霉病菌群体的遗传多样性不够丰富。这一结果与胡光荣等[12]对我国禾谷镰刀菌群体的遗传多样性鉴定结果不一致,这可能与安徽省的独特地理位置及种植品种有关。安徽省地处南北气候过渡带,耕作制度复杂,属于赤霉病流行区。高产创建以来,小麦品种的布局变化比较大,皖北、皖西北和中部麦区以冬性和半冬性品种为主,淮河以南及沿江麦区则以春性品种为主。
安徽省小麦赤霉病菌的遗传分化系数(Gst)为0.049,低于基于AFLP标记的12个物种的平均水平(Gst=0.210)[11],也低于9个广布物种的平均水平(Gst=0.330)[11],这表明安徽省小麦赤霉病菌不同群体间遗传分化不显著。这与Gale等[13]采用RFLP方法对浙江省3个地区的小麦赤霉病菌群体进行分析的结果一致。
本研究中,基因流Nm为9.648,远大于1,说明群体间存在频繁的基因流动。小麦赤霉病属于气候型病害,频繁的基因交流可能与小麦赤霉病借气流、风雨传播有关。
[1] ULRIKE K,THOMAS M,ANDREAS U,etal.Impact of aggressiveness ofFusariumgraminearumandF.culmorumisolates on yield parameters and mycotoxin production in wheat [J].MycotoxinResearch,2011,27:195.
[2] 程顺和,张 勇,别同德,等.中国小麦赤霉病的危害及抗性遗传改良[J].江苏农业学报,2012,28(5):938.
CHENG S H,ZHANG Y,BIE T D,etal.Chinese wheat scab damage and genetic improvement of stress tolerance [J].JiangsuJournalofAgriculturalSciences,2012,28(5):938.
[3] 钱 路,安榆林,徐 梅,等.舞毒蛾不同地理群体基于AFLP分子标记的遗传分析[J].林业科学,2011,47(10):104.
QIAN L,AN Y L,XU M.Different geographic populations of gypsy moth based on AFLP markers [J].ForestryScience,2011,47(10):104.
[4] QUELLET T,SEIFERT K A.Genetic characterization ofFusariumgraminearumstrains using RAPD and PCR amplication [J].Phytopathology,1993,83:1003.
[5] QU B,LI H P,ZHANG J B,etal.Geographic distribution and genetic diversity ofFusariumgraminearumandF.asiaticumon wheat spikes throughout China[J].PlantPathology,2008,57(1):15.
[6] YANG L,VANDER L,YANG X,etal.Fusariumpopulation on Chinese barley show a dramatic gradient in mycotoxin profiles [J].Phytopathology,2008,98:719.
[7] 刘 恒,侯丽娟,马红娜,等.陕西省小麦禾谷镰刀菌的遗传多样性研究[J].植物病理学报,2010,40(6):615.
LIU H,HOU L J,MA H N,etal.Research on genetic diversity of wheatFusariumspp. in Shaanxi province [J].JournalofPlantPathology,2010,40(6):615.
[8] JUSTESEN A F,RIDOUT C J.HOVMOLLER M S.The recent history ofPucciniastriiformisf.sp.triticiin Denmark as revealed by disease incidence and AFLP markers [J].PlantPathology,2002,51(1):13.
[9] 吴发红,黄东益,黄小龙等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62.
WU F H,HUANG D Y,HUANG X L,etal.Comparison of DNA extraction methods of several fungi [J].ChineseAgriculturalBulletin,2009,25(8):62.
[10] 许 娟,丁克坚.安徽省小麦赤霉病菌生物学特性及遗传多样性研究[D].合肥:安徽农业大学,2012:6.
XU J,DING K J.Research on biological characteristics and genetic diversity of wheatFusariumspp.in Anhui province [D].Hefei:Anhui Agriculture University,2012:6.
[11] 徐沂春,胡绍庆,赵宏波.基于AFLP分子标记的不同类型野生桂花群体遗传结构分析[J].浙江农林大学学报,2014,31(2):217.
XU Y C,HU S Q,ZHAO H B.Analysis of genetic structure of different types of wild osmanthus populations based on molecular markers of AFLP [J].JournalofZhejiangForestryUniversity,2014,31(2):217.
[12] 胡光荣,赵纯森,廖玉才.我国小麦禾谷镰刀菌营养体亲合性与致病性研究[J].植物病理学报,2003,33(4):379.
HU G R,ZHAO C S,LIAO Y C.The vegetative compatibility and pathogenicity ofFusariumgraminearumisolates in wheat in China[J].JournalofPlantPathology,2003,33(4):379.
[13] GALE L R,CHEN L F,HEMICK C A,etal.Population analysis ofFusariumgraminearumfrom wheat fields in eastern China [J].Phytopathology,2002,92:1315.
Analysis of Genetic Diversity of Fusarium graminearum in Anhui Province by AFLP
LU Libin,CHEN Li,WAN Qiong,DING Kejian
(School of Plant Protection, Anhui Agricultural University, Hefei, Anhui 230036,China)
In order to understand the population different and genetic variation ofFusariumgraminearumin Anhui province, the genetic diversity of 68 strains was analyzed by AFLP, and the strains were divided into four groups according to their geographical distribution. The results showed that there were 245 bands amplified by eight pairs of primers, and the genetic distances among the tested strains were arranged in 0.014~0.021. There was no significant correlation between the genetic distance and the geographical distance of the four geographical populations in Anhui province. The Shannon information indexIwas 0.321, and the gene diversity indexHwas 0.193, which indicated that a certain level of genetic diversity existed inF.graminearumpopulation in Anhui. Analysis of molecular variance showed that the most genetic variation existed within populations(99.80%) and a little genetic variation existed among populations(only 0.20%). A lower genetic differentiation(Gst=0.049) existed among the four geographic populations, and a frequent gene exchange(Nm=9.648) existed among them. Compared with the genetic relationship between the southern population and the northern population ofF.graminearumin Anhui province, the genetic relationship between the northern population and the central population was closer.
Anhui;Fusariumgraminearum; Genetic diversity; Amplified fragment length polymorphism
2016-05-05
2016-05-20
国家公益性行业(农业)科研专项(201503130)
E-mail:867688050@qq.com 通讯作者:陈 莉(E-mail:chenli31029@163.com)
时间:2016-12-07
S512.1;S435
A
1009-1041(2016)12-1681-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161207.1751.038.html
