松墨天牛谷氨酰胺6-磷酸果糖酰胺转移酶基因克隆与表达
2016-12-30蔡紫玲吴华俊
蔡紫玲,吴华俊,林 同
(华南农业大学林学与风景园林学院,广东 广州 510642)
松墨天牛谷氨酰胺6-磷酸果糖酰胺转移酶基因克隆与表达
蔡紫玲,吴华俊,林 同*
(华南农业大学林学与风景园林学院,广东 广州 510642)
谷氨酰胺6-磷酸果糖酰胺转移酶(glutamine-fructose-6-phosphate aminotransferase,GFAT)是己糖胺通路(HBP)的限速酶, 参与几丁质的合成和蛋白质的糖基化。本研究利用RACE克隆了松墨天牛GFAT基因(MaGFAT),GenBank登录号为 KT362367,其长度为2624 bp,开放阅读框为2061 bp,编码686个氨基酸。序列对比分析显示MaGFAT与赤拟谷盗相似性最高,为88 %,在系统发育树上位于同一分支。采用RT-qPCR方法检测MaGFAT在松墨天牛不同组织及不同发育时期的表达情况,结果表明:MaGFAT在各虫态中,成虫中的表达量最高;在成虫部位中,翅的表达量最高;在幼虫各组织中,体壁的表达量最高。本文为研究GFAT结构与功能的关糸奠定基础,为阐明GFAT在松墨天牛几丁质合成中的作用提供参考。
松墨天牛;谷氨酰胺6-磷酸果糖酰胺转移酶;基因克隆;RT-qPCR
谷氨酰胺6-磷酸果糖酰胺转移酶(glutamine-fructose-6-phosphate aminotransferase,GFAT)是己糖胺通路(HBP)的限速酶[1],参与几丁质的合成和蛋白质的糖基化。葡萄糖进入细胞后先转变为6-磷酸果糖,在GFAT催化下生成6-磷酸葡糖胺,经过中间代谢环节,最终转化为二磷酸尿嘧啶N-乙酰氨基葡萄糖(UDP-GlcNAc)[2]。其中,UDP-GlcNAc是蛋白质糖基化的重要底物,也是几丁质(β-1,4-N-乙酰-D-葡萄胺(β-(1-4)-NAcGA))的活性前体。几丁质是细菌和真菌的细胞壁重要组成成分[3],也是节肢动物的表皮和中肠围食膜(PM)的主要成分[4]。Hornung 等指出GFAT在几丁质从头合成中起重要作用[5-7]。
松墨天牛(MonochamusalternatusHope),隶属于鞘翅目(Coleoptera),天牛科(Cerambycidae),主要危害马尾松(Pinusmassoniana),油松(P.tabulaeformis),黑松(P.thunbergii)等生长衰弱或新伐倒的针叶树,是松材线虫[Bursaphelenchusxylophilus(Steiner & Buhrer)]病的主要传播媒介昆虫[8-9]。
目前,GFAT的研究并不广泛,主要研究对象集中在人类、小鼠、酵母和节肢动物,未见有关松墨天牛GFAT的研究。本文从松墨天牛cDNA文库中克隆了GFAT基因,研究了该基因在松墨天牛各虫态、成虫6个部位、幼虫5个组织中的表达,旨在为研究GFAT结构与功能的关糸奠定基础,为阐明GFAT在松墨天牛几丁质合成中的作用提供参考。
1 材料与方法
1.1 松墨天牛
松墨天牛幼虫由广东省林科院惠赠,采用人工饲料饲养[10]。分别收集交配期成虫的触角、头(去除触角)、胸、足、翅、腹节等组织样品和幼虫的体壁、脂肪体、血淋巴、中肠、马氏管等组织样品;同时收集松墨天牛的3龄幼虫以及10 d蛹及羽化3 d的成虫。样品置液氮中迅速冷却后保存于-80 ℃冰箱备用。
1.2 主要试剂
E.Z.N.A.TMTotal RNA Kit II总RNA提取试剂盒购自OMEGA公司;3'-Full RACE Core Set with PrimeScriptTMRTase试剂盒、LATaqDNA聚合酶、pMD20-T Vector试剂盒、E.coliDH5 α Competent Cells、PrimeScript®RT reagent Kit With gDNA Eraser反转录试剂盒、SYBR®Premix ExTaqTM实时荧光定量试剂盒购自TaKaRa公司;通用型DNA纯化回收试剂盒、质粒提取试剂盒为天根生物有限公司产品;IPTG,X-Gal等试剂购自上海生工生物工程有限公司。
1.3 RNA的提取和反转录
按照RNA抽提试剂盒(Omega公司)使用说明,提取松墨天牛各样本的总RNA。经琼脂糖凝胶电泳和微量紫外分光光度仪(Nanodrop 2000)检测后,按PrimeScript®RT reagent Kit With gDNA Eraser反转录说明书合成单链cDNA,稀释10倍用作实时荧光定量PCR(RT-qPCR)的模板。
1.4 引物设计
根据本实验室构建的松墨天牛cDNA文库[11],筛选出一段谷氨酰胺6-磷酸果糖酰胺转移酶序列,以此序列为基础,利用Primer premier 5.0软件设计引物Outer:5′-ATCTCGCTCGTGATGTTCG-3′和Inner:5′-TATGAGGGACCCCGTTTA-3′,并利用试剂盒中的通用引物3′RACE Outer:5′-TACCGTCGTTCCACTAGTGATTT-3′和3′RACE Inner:5′-CGCGGATCCTCCACTAGTGATTTCACTATAGG-3′进行3′RACE。设计引物Forward(正向)(5′-TTGTGATGAGCGAAGACAGG-3′)和Reverse(反向)(5′-CGGCCAACACCTTAACTTTG-3′),以及内参基因引物β-actin Forward(正向)(5′-CTCTGCTATGTAGCCCTTGACTT-3′)和β-actin Reverse(反向)(5′-GGAGTTGTAGGTGGTTTCGTG-3′)用于RT-qPCR。引物合成由上海生物工程有限公司完成。
随着市场的发展和科学的进步,水利施工企业对人才的需求量急剧增加,人才培养已经成为了实现“人才强企”战略的主要手段。注重培养具有较强专业素质及发展潜力的管理人才、技术人才、一岗多技和一岗多能的复合型人才,对企业的发展至关重要。由于水利施工行业的特殊性,绝大多数员工均在施工一线工作,工作地点远离城镇且条件艰苦,工程项目多而分散,无法集中进行学习培训,这种人员的分散性决定了水利施工企业人才培养的难度。针对水利施工企业的上述特点,如何培养人才、留住人才,是摆在水利施工企业面前的难题。
1.5 基因克隆与序列分析
1.5.1 PCR与RACE 以合成的cDNA为模板,加入10×ExTaq聚合酶反应缓冲液2.5 μl(含Mg2+),正向和反向引物各0.5 μl(10 μmol/L),dNTP 2 μl(2.5 μmol/L),ExTaqDNA聚合酶0.5 μl(5 U/μl),加ddH2O至25 μl,混匀离心(3000 r/min 10s)后进行PCR扩增。
以特异性引物Outer及试剂盒中提供的通用引物3′RACE Outer进行第1轮PCR,特异性引物Inner及通用引物3′RACE Inner通过巢式PCR。PCR反应条件:94 ℃预变性3 min;94摄氏度30 s;55 ℃(第1轮)、58 ℃(巢式) 30 s、72 ℃ 1 min,35个循环;72 ℃延伸10 min。PCR产物经1 %琼脂糖凝胶电泳分析。回收目的片段、与pMD20-T载体连接、转化大肠杆菌,挑选阳性克隆测序。
1.5.2 序列测定 PCR及RACE产物经回收纯化后连接到pMD20-T克隆载体,进一步转化到感受态大肠杆菌DH5α中,经氨苄青霉素和蓝白斑筛选,37 ℃培养箱培养重组质粒12 h,提取白斑质粒DNA检测。测序由上海生物工程有限公司完成。
1.5.3 序列分析 测定序列拼接完成后,用ORF Finder程序(http://www.ncbi.nlm.nih.gov/projects/gorf/)搜索开放阅读框(ORF),Blast程序(http://blast.st-va.ncbi.nlm.nih.gov/Blast.cgi)进行相似性比对分析,ProtParam tool(http://web.expasy.org/protparam/)计算蛋白质的等电点与分子量,ProtScale(http://web.expasy.org/protscale/)分析蛋白质的疏水性,SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质信号肽,EBI的InterProScan(http://www.ebi.ac.uk/InterProScan/)分析蛋白家族, NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析磷酸化位点,DictyOGlyc 1.1 Serve(http://www.cbs.dtu.dk/services/DictyOGlyc/)预测糖基化位点, Coils(http://www.ch.embnet.org/software/COILS_form.htm )预测卷曲结构。
1.5.4 系统发育树 从NCBI (http: //www. Ncbi. nlm. Nih. gov /) GenBank数据库中检索GFAT的氨基酸序列,用DNAMAN软件对松墨天牛GFAT及其他昆虫GFAT进行相似性比对;用MEGA 4.0软件构建GFAT系统发育树(NJ 法)。


起始密码子ATG用下划线表示,终止密码子TAA以* 表示,特异性引物Outer以双下划线表示,特异性引物Inner以下划波浪线表示,20个丝氨酸磷酸化位点以圆形表示,8个苏氨酸磷酸化位点以矩形表示;6个酪氨酸磷酸化位点以三角形表示,加尾信号“AATAAA”用矩形表示图1 MaGFAT的核苷酸及推导的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of MaGFAT
用特异性引物Forward和Reverse,以微管蛋白(β-actin)基因为内参基因进行实时荧光定量PCR反应。实时荧光定量PCR反应体系为20 μl:10.0 μl SYBR Premix ExTaq,10.0 μmol/L的上、下游引物各0.5 μl,cDNA模板1 μl,ddH2O 7.2 μl,放入LightCycler480荧光定量PCR仪扩增。PCR反应条件为:95 ℃预变性5 min;95 ℃变性10 s、60 ℃复性20 s、共40个循环;40 ℃冷却30 s。设置ddH2O为阴性对照,每个样本3次重复。反应结束后采集目标基因的Ct值和2个内参基因的Ct平均值,利用 2-ΔΔCT相对定量法计算表达量[12]。采用Excel和DPS软件的Duncan’s单因素方差分析法对RT-qPCR数据进行统计分析。
2 结果与分析
2.1 松墨天牛GFAT的克隆及序列分析
本实验克隆了松墨天牛GFAT基因,GenBank登录号为 KT362367,命名为MaGFAT,其全长2624 bp(图1),其中包括开放阅读框(ORF)2061 bp和3’端非编码区563 bp,ORF编码686个氨基酸残基,推测的分子式为C3432H5500N938O1007S38,分子量为77 233.3,等电点为6.72,稳定系数为61.46,为稳定蛋白。疏水性最大值为2.911,最小值为-2.933,为亲水蛋白。GFAT有20个丝氨酸位点,8个苏氨酸位点,6个酪氨酸位点,无糖基化位点,无信号肽,形成8段螺旋卷曲。
2.2 序列相似性比对和系统发育树构建
将MaGFAT氨基酸序列与NCBI数据库中的16种昆虫GFAT氨基酸序列进行同源性比对(图2),其中,MaGFAT与赤拟谷盗(Triboliumcastaneum)相似性最高,为88 %,与毕氏粗角蚁(Cerapachysbiroi)的相似性为84 %,与其他昆虫的相似性都大于80 %。
基于17种昆虫的寡糖基转移酶亚基氨基酸序列构建的系统进化树显示(图3):松墨天牛与赤拟谷盗遗传距离最近,在同一分支;与菜蛾盘绒茧蜂(Microplitisdemolitor)等遗传距离较远。
2.3 MaGFAT的表达分析
用RT-qPCR分析了MaGFAT在不同虫态、成虫各部位和幼虫组织中的表达模式。MaGFAT在成虫的表达量最高,蛹和幼虫的表达量分别是成虫的0.59和0.29倍,基因表达在三者之间差异显著(P<0.005)(图4)。成虫各部位的表达模式为:翅膀的表达量最高,为对照的25.70倍,触角的表达量最低,为对照的1.23倍,头、胸、腹、足分别为对照的2.14、20.10、18.74、15.68倍,成虫各部位MaGFAT基因表达差异显著(P<0.05)(图5)。幼虫各组织的表达模式为:体壁的表达量最高,为对照的0.93倍,血淋巴的表达量最低,为对照的0.023倍,脂肪体、马氏管、中肠分别为对照的0.37、0.26、0.28倍,基因表达有显著差异(P<0.05)(图6)。图4~6中数据为平均数±标准误;柱上不同字母表示差异显著(P<0.05)。

Tribolium castaneum 赤拟谷盗(XP_008191288.1);Cerapachys biroi毕氏粗角蚁(XP_011340931.1) ; Acromyrmex echinatior顶切叶蚁(XP_011059147.1); Linepithema humile阿根廷蚁 (XP_012222258.1);Monomorium pharaonis法老蚁(XP_012523497.1);Harpegnathos saltator印度跳蚁(XP_011142953.1);Camponotus floridanus佛罗里达弓背蚁(XP_011262248.1);Bombus terrestris阿里山潜蝇茧蜂(XP_012163447.1);Apis florea欧洲熊蜂(XP_012345419.1);Fopius arisanus云南小蜜蜂(XP_011301753.1); Megachile rotundata苜蓿切叶蜂(XP_012142070.1);Athalia rosae锯蝇(XP_012264018.1);Nasonia vitripennis丽蝇蛹集金小蜂(XP_008204365.1);Microplitis demolitor菜蛾盘绒茧蜂(XP_008554199.1);Musca domestica家蝇(XP_005184307.1);Ceratitis capitata地中海实蝇(XP_012158557.1)图2 松墨天牛与其他16种昆虫GFAT氨基酸序列比对Fig.2 Amino acid sequence alignment of GFAT from M.alternatus and other insects
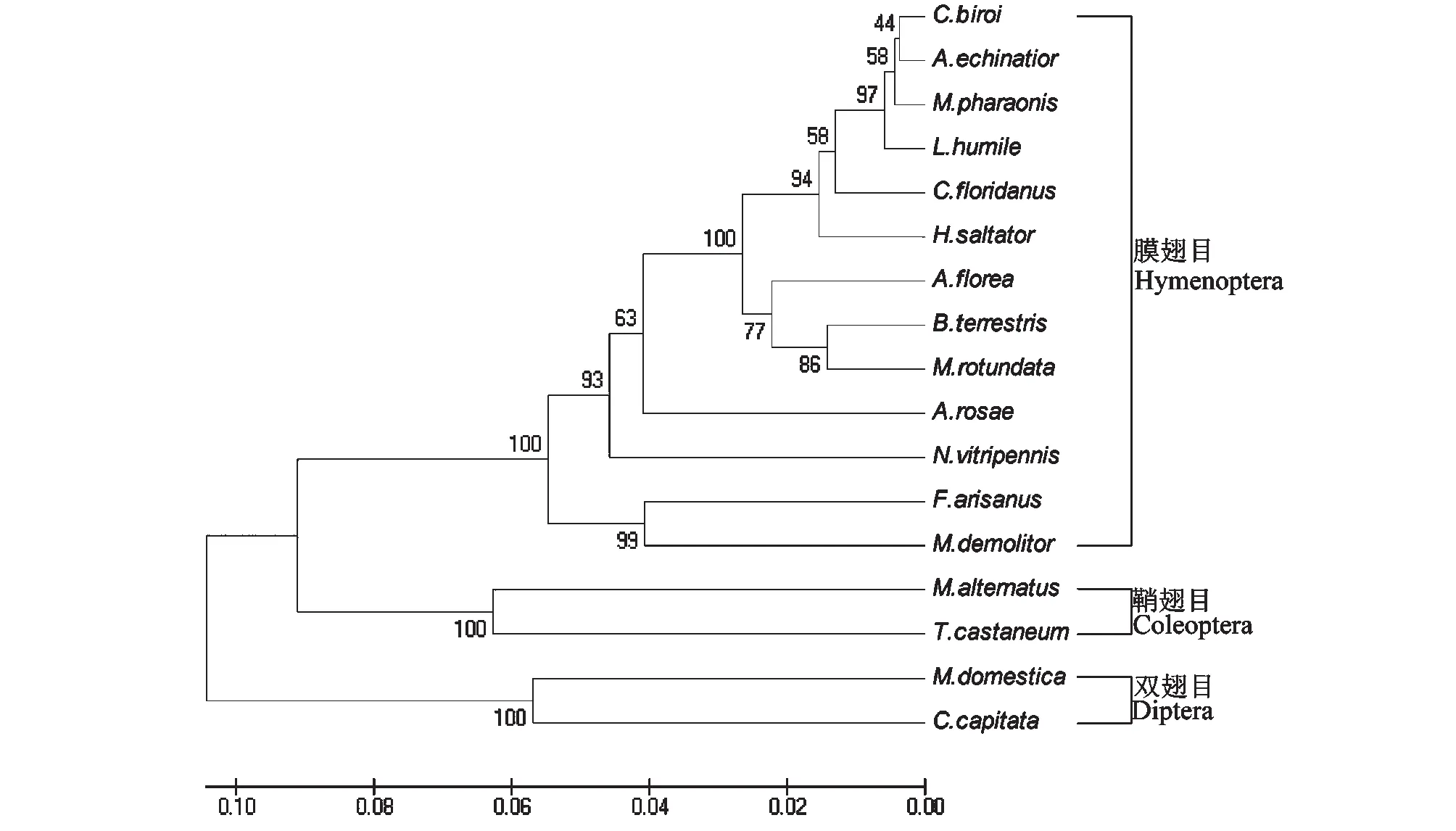
其昆虫名称和所用的GenBank序列号与表2相同图3 基于昆虫寡糖基转移酶亚基GFAT氨基酸序列构建的系统发育树Fig.3 Phylogenetic relationships of insects based on GFAT amino acids
3 讨 论
本论文克隆了松墨天牛的GFAT基因,分析了其表达模式,旨在为研究其在松墨天牛几丁质合成过程中的作用提供参考。
GFAT是调控己糖胺的重要限制酶,有高度同源性,几乎存在于每个有机体和组织中,可调节葡萄糖分解及摄取、糖原合成等,由cAMP依赖的蛋白激酶A调控。在哺乳动物中,当氨基己糖流量过多时,GFAT能致胰岛素产生拮抗[13-14]。在昆虫中,GFAT能调节几丁质的合成。几丁质合成过程中,除了GFAT外,还有7种酶参与,即海 藻 糖 酶 (trehalase)、己 糖 激 酶(hexokinase)、葡 萄 糖-6-磷 酸异 构 酶 (glucose-6-phosphate isomerase)、葡 糖 胺-6-磷 酸-N-乙 酰 转 移 酶(glucosamine-6-phosphate N-acetyltransferase)、磷乙酰氨基葡萄糖变位酶(phosphoacetylglucosamine mutase) 、UDP-N-乙酰葡糖胺焦磷酸化酶 (UDP-N-acetylglucosamine pyrophosphorylase) 和几丁质合成酶(chitin synthase)[15]。这其中,海藻糖酶和几丁质合成酶研究最多,而有关节肢动物GFAT的研究报道很少,只有长角血蜱(Haemaphysalis longicornis)的HIGFAT[16],黑腹果蝇(Drosophila.melanogaster)的Dmel/Gfat1,埃及伊蚊(Aedesaegypti)的AeGfat参与几丁质的合成报道[17-19]。

图4 MaGFAT在松墨天牛各虫态的表达Fig.4 Expression of MaGFAT in various instars of M. alternatus

图5 MaGFAT在松墨天牛成虫各部位的表达Fig.5 Expression of MaGFAT in various parts of M. alternatus adults
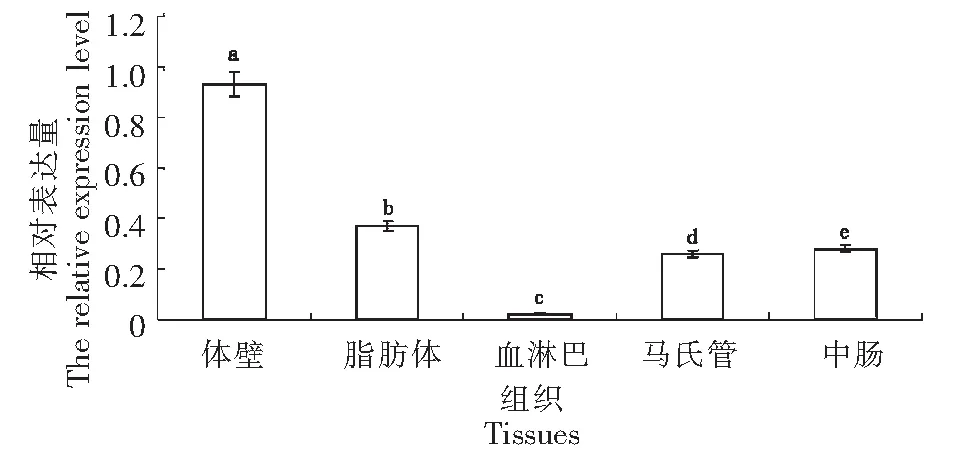
图6 MaGFAT在松墨天牛幼虫各组织中的表达Fig.6 Expression of MaGFAT in various tissues of M. alternatus
如本研究通过RT-qPCR检测MaGFAT在松墨天牛的不同组织部位和不同发育时期的表达情况。成虫身体各部位已发育成熟,检测结果显示MaGFAT在3种虫态中成虫的表达量最高,这说明相比于幼虫和蛹,松墨天牛成虫含有更多的几丁质,由于几丁质和蛋白质形成稳固的结构,因而可推测松墨天牛成虫比其他虫态对外界环境具有更强的适应和防御能力。类似地,MaGFAT在成虫部位中翅表达量最高,在幼虫组织中体壁的表达量最高,也是与几丁质在相应部位或组织中的功能有关。松墨天牛为鞘翅目昆虫,其前翅坚硬、骨化,其中大量表达的MaGFAT为丰富的几丁质的合成提供了可能,从而与前翅保护后翅和体背的功能相适应。
GFAT在昆虫中具有较高的同源性。Kato(2002年)对埃及伊蚊AeGFAT基因进行克隆和特征分析,发现AeGFAT的cDNA加尾信号AATAAA位于距PolyA 27 bp位置,氨基酸序列197~199位有保守序列“SPL”。据其推测,此序列“SPL”应为cAMP依赖蛋白激酶(PKA)调节AeGFAT活性位点[20]。松墨天牛MaGFAT的cDNA加尾信号AATAAA位于距PolyA 25 bp处(图1),同源比对分析表明MaGFAT与16 种昆虫的同源性大于80 %,同时在197~199位也发现有“SPL”(图2),据此笔者认为氨基酸序列197~199 位为GFAT的保守序列,但其功能有待研究。
[1]Marshall S, Bacote V, Traxinger R R. Discovery of a metabolic pathway mediating glucose-induced desensitization of the glucose transport system: role of hexosamine biosynthesis in the induction of insulin resistance[J]. The Journal of Biological Chemistry, 1991, 266:4706-4712.
[2]Mc Clain D A. Hexosamines as mediators of nutrient sensing and regulation in diabetes[J]. Journal of Diabetes and Its Complications, 2002,16(1):72-80.
[3]McMurrough I, Flores-Carreon A, Bartnicki-Garcia S. Pathway of chitin synthesis and cellular localization of chitin synthetase inMocorrouxii[J]. The Journal of Biological Chemistry, 1971, 246:3999-4007.
[4]Merzendorfer H, Zimoch L. Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases[J]. Journal of Experimental Biology, 2003, 206:4393-4412.
[5]Hornung D E, Stevenson J R. Changes in the rate of chitin synthesis during the crayfish molting cycle[J]. Comparative Biochemistry and Physiology, 1971, 40:341-346.
[6]Stevenson J R, Tschantz J A.Acceleration by ecdysone of premolt substages in the crayfish[J]. Nature, 1973, 242:133-134.
[7]Surholt B. Formation of glucosamine-6-phosphate in chitin synthesis during ecdysis of the migratory locustLocustamigratoria[J]. Insect Biochemistry and Molecular Biology, 1975(5):585-593.
[8]Zhao B G, Futai K, Sutherland J R, et al.Pine Wilt Disease[M]. Tokyo: Springer, 2008.
[9]刘 平,稽保中,刘曙雯,等. 松墨天牛和光肩星天牛染色体核型[J]. 昆虫知识, 2010, 47(2):299-307.
[10]许 雯, 罗淋淋, 吴华军, 等. 松墨天牛表皮蛋白基因的克隆及表达分析[J]. 昆虫学报, 2014, 57(5):515-521.
[11]韦春梅, 罗淋淋, 吴华俊, 等. 松墨天牛幼虫cDNA文库的构建及EST分析[J]. 基因组学与应用生物学,2014, 33(1):113-120.
[12]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods, 2001, 25(4):402-408.
[13]田金英, 李 江, 丛维娜, 等. 胰.岛素抵抗及高血糖对GFAT活性的影响[J]. 哈尔滨商业大学学报, 2007, 23(2):134-137.
[14]侯为开. 氨基己糖与胰岛素拮抗[J]. 国外医学.内分泌学分册, 1997(4):21-23.
[15]张文庆. 昆虫几丁质合成及其调控研究前沿[J]. 应用昆虫学报, 2011, 48(3):475-479.
[16]Xiaohong Huang, Naotoshi Tsuji, Takeharu Miyoushi, et al. Characterization of glutamine: fructose-6-phosphate aminotransferase from the ixodid tick, Haemaphysalis longicornis and its critical role in host blood feeding [J]. International Journal for Parasitology, 2007,37:383-392.
[17]Graack H R, Cinque U, Kress H. Functional regulation of glutamine:fructose-6-phosphate aminotransferase 1 (GFAT1) of Drosophila melanogaster in a UDP-N-acetylglucosamine and cAMP dependent manner[J]. Biochemical Journal, 2001, 360:401-412.
[18]Kato N, Dasgupta R, Smartt C T, et al. Glucosamine: fructose-6-phosphate aminotransferase: gene characterization, chitin biosynthesis and peritrophic matrix formation inAedesaegypti[J]. Insect Molecular Biology, 2002,11:207-216.
[19]Kato N, Mueller C R, Fuchs J F, et al. Regulatory mechanisms of chitin biosynthesis and roles of chitin in peritrophic matrix formation in the midgut of adultAedesaegypti[J]. Insect Biochemistry and Molecular Biology, 2006, 36:1-9.
[20]N.Kato, R.Dasgupta, C.T.Smartt, et al. Glucosamine:fructose-6-phosphate aminotransferase: gene characterization, chitin biosynthesis and peritrophic matrix formation inAedesaegypti[J]. Insect Molecular Biology, 2002, 11(3):207-216.
(责任编辑 李山云)
Isolation and Expression of Glutamine-Fructose-6-Phosphate Aminotransferase Gene fromMonochamusalternatus
CAI Zi-ling, WU Hua-jun, LIN Tong*
(College of Forestry and Landscape Architecture, South China Agricultural University, Guangdong Guangzhou 510642, China)
Glutamine-fructose-6-phosphate aminotransferase (GFAT) was a rate-limiting enzyme of hexosamine biosynthetic pathway, which had a regulatory role in chitin synthase and protein glycosylation. The GFAT gene ofMonochamusalternatus(MaGFAT, GenBanK accession number is KT362367) by RACE was cloned and sequenced, and its length was 2624 bp, including 2061 bp open reading frame encoding 686 amino acids. The sequence analysis showed thatMaGFAThad a high similarity withTriboliumcastaneumat 88 % amino acid level, and both of the GFAT ofM.alternatusandT.castaneumwere in the same branch of the phylogenetic tree. TheMaGFATexpression in different tissues and development period by RT-qPCR were detected. The results showed thatMaGFAThad the highest expression in adults among developmental periods, in wings among body parts of adults and in body wall among all larvae tissues. This result would provide references for investigating the relation between structure and function of GFAT and clarifying the potential role of GFAT which played in biosynthesis of chitin inM.alternatus.
Monochamusalternatus; Glutamine-fructose-6-phoshhate aminotransferase(GFAT); Gene cloning; RT-qPCR
1001-4829(2016)09-2131-07
10.16213/j.cnki.scjas.2016.09.021
2015-09-15
国家自然科学基金(31470653); 广东省自然科学基金(1414050001666)
蔡紫玲(1992-),女,广东茂名人 ,硕士研究生,主要从事昆虫分子生物学研究,E-mail:1274800271@qq.com,*为通讯作者, E-mail: lintong@scau.edu.cn。
Q966
A
