125I-OxLDL-Ab在正常小鼠及动脉粥样硬化动物模型体内的生物分布
2016-12-30刘子华樊彩云李凤林邓新荣徐燕华罗志福
刘子华,樊彩云,李凤林,邓新荣,徐燕华,罗志福
1.中国原子能科学研究院 同位素研究所,北京 102413;2.成都华神生物技术有限责任公司,四川 成都 610225
125I-OxLDL-Ab在正常小鼠及动脉粥样硬化动物模型体内的生物分布
刘子华1,樊彩云1,李凤林1,邓新荣1,徐燕华2,罗志福1
1.中国原子能科学研究院 同位素研究所,北京 102413;2.成都华神生物技术有限责任公司,四川 成都 610225
分别采用高效液相色谱法、紫外分光光度法对OxLDL-Ab进行定性、定量分析,评价125I-OxLDL-Ab在正常动物和动脉粥样硬化模型动物的体内分布。正常动物采用昆明小鼠,模型采用载脂蛋白E基因敲除的小鼠(apolipoprotein E-deficient mice, ApoE-/-)。高效液相色谱条件为:磷酸缓冲液(PB, 0.2 mol/L, pH=7.4)为流动相,流速1.0 mL/min,检测波长220 nm;紫外分光光度法测得蛋白浓度的标准曲线为:y=0.664 5x-0.008 3,r2=0.999 7。125I-OxLDL-Ab在正常小鼠体内分布实验结果表明:除甲状腺外,各器官的放射性摄取随时间延长而减少,无明显浓集;在注射125I-OxLDL-Ab后1 d各器官代谢消除超过2/3, 7 d后血液中完全清除。125I-OxLDL-Ab在ApoE-/-鼠体内的分布实验中采用w=2%的KI溶液封闭了甲状腺,消除了甲状腺高摄取的影响;靶器官肺有较高放射性摄取,且在注射后4~8 h显示出放射性浓集;除血外,其它各器官的靶器官/非靶器官的放射性摄取比值(T/NT)均大于1,其中T/Mu(肌肉)>8,显示出125I-OxLDL-Ab对靶器官有一定的选择性。标记抗体的体内靶向性是显像研究中至关重要的一环,要进一步用于动脉粥样硬化早期显像诊断,还需进一步提高靶器官/非靶器官的放射性摄取比值,提高其在体内与其抗原的亲和性。
氧化低密度脂蛋白单克隆抗体;动脉粥样硬化;125I;ApoE-/-小鼠;生物分布
动脉粥样化属于慢性炎症疾病,发病机制十分复杂,与基因相关[1]。目前的检测方法很多,各有利弊[2-3],多数诊断方法与动脉粥样化的诊断无直接对应性。介入性诊断结果准确,检查风险大,费用高。检查现状主要是根据病人的典型病史、临床症状,并结合仪器进行生化检查。抗体因为其高特异性,广泛地应用到疾病的靶向诊治中。放射性核素因其检查的高灵敏度及无创的诊疗优点[4],越来越多应用到疾病的检查中;放射性核素标记抗体同时具备了靶向性好、灵敏度高、检查方便的特点,在临床上应用前景广阔。用放射性核素标记抗体对动脉粥样化进行检查的研究为其早期诊断方案提供了一种新途径[5]。
目前学术界公认氧化低密度脂蛋白(oxidized low-density lipoprotein, OxLDL)在动脉粥样硬化的形成与发展过程中起关键作用[6]。OxLDL-Ab是一类以OxLDL作为抗原诱发自身机体免疫应答产生的抗体,针对不同位点的抗原决定簇产生的OxLDL-Ab也不同[7]。OxLDL-Ab与动脉粥样化关系的研究表明,患者体内OxLDL-Ab滴度与OxLDL的比值越高,动脉粥样硬化越趋于稳定,心脑血管疾病发生的危险性降低[8],这可能与它对OxLDL的特异亲和性相关。动脉粥样硬化发病早期病灶处有OxLDL异常浓集,可利用OxLDL-Ab将放射性核素载带到早期病灶-靶点,通过放射性核素示踪技术获得该疾病因子体内分布情况,获取病变部位和病变程度的信息,评价进行放射性显像诊断动脉粥样硬化的可能性。
放射性核素123I半衰期13.27 h,发射158.97 keV(83.3%)的γ射线,可与蛋白质等生物分子的酪氨酸残基发生取代反应而被键合到分子中,是标记抗体、进行体内显像的最佳核素之一,但因其需加速器制备,价格昂贵且半衰期短,往往用其同位素125I代替进行实验研究。125I在化学性质上与123I几乎相同[9],发射能量为27.472 keV的X射线和35.492 keV的γ射线,衰变方式是轨道电子俘获,半衰期59.407 d,对多数蛋白质的免疫活性辐射损伤影响小,标记物稳定性好。
本工作对制备的125I-OxLDL-Ab[10]进行动物体内研究,所用OxLDL-Ab[11]分子量为900 kDa,是IgM型免疫球蛋白,以五聚体存在,由二硫键连接,结构稳定,抗体特异性高,与其抗原OxLDL的亲和常数高达109L/mol,在体外的稳定性和活性极佳。用125I核素标记IgM型OxLDL-Ab的研究在国内尚未见其它报道,本工作拟在此基础上对制备的125I-OxLDL-Ab进行定性、定量分析,评价125I-OxLDL-Ab在正常动物和模型动物ApoE-/-鼠(载脂蛋白E基因敲除的小鼠)[12-13]体内的分布,为123I-OxLDL-Ab进一步用于动脉粥样硬化早期显像诊断提供研究基础。
1 实验部分
1.1 试剂和仪器
OxLDL-Ab,由成都华神生物技术有限责任公司提供;1,3,4,6-四氯-3α,6α-二苯甘脲,Sigma公司;Na125I溶液,美国Perkin Elmer Life Science公司;牛血清白蛋白(bovine serum albumin, BSA),北京国药有限责任公司;Sephadex G-25 M凝胶过滤预装柱(Pre-packed disposable PD-10, PD-10),瑞典Amersham Bioscience公司;UFC510096型超滤管,美国Millipore公司;Zorbax-GF450凝胶过滤色谱柱,美国Agilent公司。昆明小鼠:健康雄性,体重20~22 g,4~5周龄,由中国医学科学院动物研究所提供(清洁级)。载脂蛋白E基因敲除的小鼠(apolipoprotein E-deficient mice, ApoE-/-):雄性,体重18~22 g,4月龄,具有动脉粥样硬化斑块,由北京大学医学部动物实验中心提供(SPF级)。
Miniscan放射性薄层扫描仪,美国Bioscan公司;HPLC 1200型高效液相色谱仪,美国Agilent 公司;UV2450型紫外可见分光光度计,日本Shimadzu公司;RM905a活度计,中国计量科学研究院;LB-2722-2放射性色层扫描仪,德国Berthold公司;211型数字型酸度计,美国Orion research 公司;Research单道可调移液器,美国Eppendorf公司;AGBP211D型电子天平,精度为0.000 1,德国Sartorius公司。
1.2 OxLDL-Ab 的分析
1.2.1 OxLDL-Ab的纯度分析 采用HPLC法对生物样品OxLDL-Ab进行分析。将样品置于UFC510096型超滤管中,以3 000 r/min离心3 min,将浓缩后的抗体转移于无菌样品管中保存,待测。色谱条件:采用磷酸缓冲液(PB, 0.2 mol/L, pH=7.4)为流动相,流速1.0 mL/min;检测波长220 nm,检测时间30 min;进样量20 μL,平行实验3次。
1.2.2 OxLDL-Ab的浓度分析 采用紫外分光光度法测OxLDL-Ab样品的浓度:准确称取牛血清白蛋白0.25 g,用0.9%(质量分数)的氯化钠溶液稀释到250 mL,精确稀释成1 g/L标准蛋白质溶液。取9支试管编号,按表1配制系列溶液,混匀后分别测定各溶液在280 nm的吸光度,绘制吸光度-蛋白质浓度标准曲线;取浓缩后的OxLDL-Ab样品液约4 mL,测其280 nm处的紫外吸光度,根据标准曲线计算抗体准确浓度。
1.3125I-OxLDL-Ab的制备
采用Iodogen法标记抗体,取含40 μg 1,3,4,6-四氯-3α,6α-二苯甘脲的Iodogen管,依次将OxLDL-Ab、适量的PB(pH=7.4,0.2 mol/L)、Na125I(1.3×1010kBq/L)溶液置于Iodogen管进行取代反应,从反应管中移出反应液,静置数分钟待活化的碘稳定,采用凝胶过滤色谱法进行分离纯化,纸色谱法测定标记率和放化纯,采用新华1号层析纸,展开剂为80%甲醇-水体系,用放射性薄层扫描仪检测。
表1 标准溶液的配制
Table 1 Preparation of standard solution
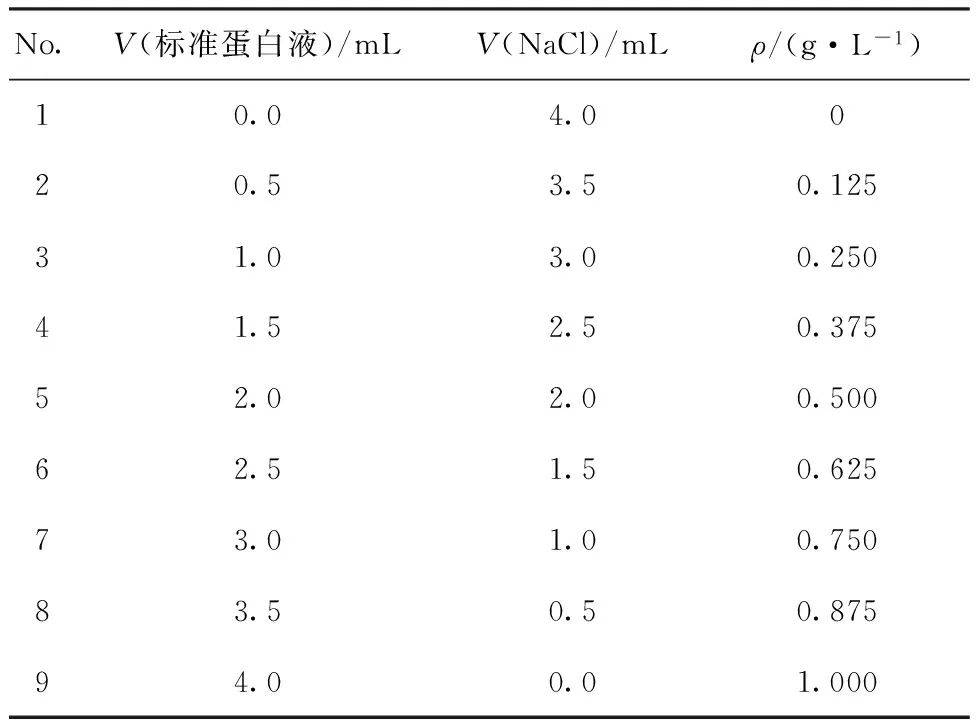
No.V(标准蛋白液)/mLV(NaCl)/mLρ/(g·L-1)10.04.0020.53.50.12531.03.00.25041.52.50.37552.02.00.50062.51.50.62573.01.00.75083.50.50.87594.00.01.000
1.4125I-OxLDL-Ab在动物体内的分布
1.4.1125I-OxLDL-Ab在正常动物体内的分布 取正常昆明小鼠28只,随机分为7组,每组4只,每只自尾静脉注射100 μL125I-OxLDL-Ab(370 kBq, 2.5×1010MBq/mol),记录注射时间,分别于注射后4 h、8 h 、1 d、2 d、3 d、5 d、7 d断颈处死动物,取血、心、肝、脾、肺、肾、甲状腺、血管(取左冠脉5~10 mm长)等主要脏器,称重,测量放射性计数,经衰变校正后计算每克组织百分注射剂量率(%ID/g )。
1.4.2125I-OxLDL-Ab在模型动物体内的分布 实验前2天,给所有的实验小鼠饮用w=2%的碘化钾水,封闭甲状腺。实验时,取ApoE-/-动脉粥样硬化小鼠21只,随机分为7组,每组3只,每只自尾静脉注射100 μL125I-OxLDL-Ab溶液(370 kBq,2.5×1010MBq/mol),在不同时间处死动物并测量血、心、肝、脾、肺、肾、甲状腺、血管等脏器的放射性计数,计算每克组织百分注射剂量率(%ID/g),实验方法同正常动物。
2 结果与讨论
2.1 OxLDL-Ab 的分析
2.1.1 OxLDL-Ab的纯度分析 样品的HPLC图示于图1。由图1可知:OxLDL-Ab有两个主要的色谱峰,第一峰保留时间为7.555 min,经确定为OxLDL-Ab的主峰;第二峰保留时间为11.593 min,为流动相NaH2PO4的色谱峰。流动相附近有少量杂峰,因为本实验是按分子量大小顺序出峰,可初步肯定杂质分子量很小,接近流动相,在标记制备中会被PD-10柱分离,不会对标记抗体产生影响,该批抗体纯度高。

图1 样品的HPLC图Fig.1 HPLC of the sample
2.1.2 OxLDL-Ab的浓度分析 紫外分光光度法绘制的标准曲线示于图2。由图2可知,标准蛋白的标准曲线为:y=0.664 5x-0.008 3,r2=0.999 7,计算得样品的质量浓度为0.432 g/L。
2.2125I-OxLDL-Ab的制备及评价
125I-OxLDL-Ab的标记率和放化纯度示于图3。如图3可知,制备的125I-OxLDL-Ab标记率为75%,放化纯度为98%,亲和常数Ka=(1.06±0.25)×10-10,该纯度可以进行体内分布研究。
2.3125I-OxLDL-Ab在动物体内的分布
2.3.1125I-OxLDL-Ab在正常动物体内的分布125I-OxLDL-Ab在正常动物体内的分布结果列入表2。由表2可知:注射后4 h甲状腺125I-OxLDL-Ab的每克组织百分注射剂量率最高为(19.280±2.914)%ID/g,且在7 d后仍有(7.215±5.818)%ID/g的高摄取,说明125I-OxLDL-Ab在体内的脱碘严重,甲状腺一直有很高的125I摄取,在以后的体内分布研究时应消除甲状腺高吸收的影响;125I-OxLDL-Ab的胃放射性摄取在4 h时为(15.686±2.962)%ID/g,8 h时降为(3.314±1.186)%ID/g;血液放射性摄取在4 h时为(9.611±1.295)%ID/g,1 d后仅为(2.908±0.379)%ID/g,超过三分之二的125I-OxLDL-Ab被代谢清除,到第7 d时血中计数很低,测得值为(0.062±0.013)%ID/g,说明125I-OxLDL-Ab已基本清除;除甲状腺外,各器官的放射性摄取随时间延长而减少,无明显浓集。

图2 标准曲线图Fig.2 Calibration curve
2.3.2125I-OxLDL-Ab在ApoE-/-鼠体内的分布125I-OxLDL-Ab在ApoE-/-鼠体内的分布结果列入表3。由表3可知:注射4 h后,甲状腺中125I-OxLDL-Ab的放射性摄取为(2.080±0.111)%ID/g,且随时间延长而降低,与其它组织器官无显著差异,说明封闭甲状腺避免了甲状腺对放射性碘离子的大量吸收,使体内的碘离子浓度增大,这可能会抑制125I-OxLDL-Ab脱碘的发生;血液中125I-OxLDL-Ab的放射性摄取在4 h时为(8.001±1.211)%ID/g,与正常动物相似,但1 d后血中放射性摄取率仍有(4.609±1.183)%ID/g,为4 h时的57%,正常动物注射后24 h时放射性摄取率降低了70%,提示模型动物血液OxLDL滴度高,OxLDL与125I-OxLDL-Ab发生分子结合而使其代谢清除变慢;注射1 d后标记抗体在胃中放射性摄取仍有(2.757±0.488)%ID/g ,相对于注射后降低不明显,可能跟标记抗体在体内的代谢途径有关,如标记抗体在体内脱碘、再分布等影响。而靶器官肺的放射性摄取在注射125I-OxLDL-Ab 后4~8 h增大,在4 h时为(6.014±1.101)%ID/g,比血放射性摄取低,8 h时为(8.936±2.294)%ID/g,高于血中的值,出现放射性浓集,1 d后随时间延长而摄取量降低,但仅次于血液含量,提示说明肺部毛细血管丛病变,有一定的靶向性;血管部位在4~8 h也有放射性浓集现象,由(4.098±0.731)%ID/g增大到(4.347±0.674)%ID/g;肝、肾等重要代谢器官125I-OxLDL-Ab放射性摄取低于血和肺;其它组织器官的值均随时间增加而降低,除靶器官肺和甲状腺外,注射后各时间点125I-OxLDL-Ab放射性摄取与正常动物体内分布结果无明显差异,考虑为正常代谢。
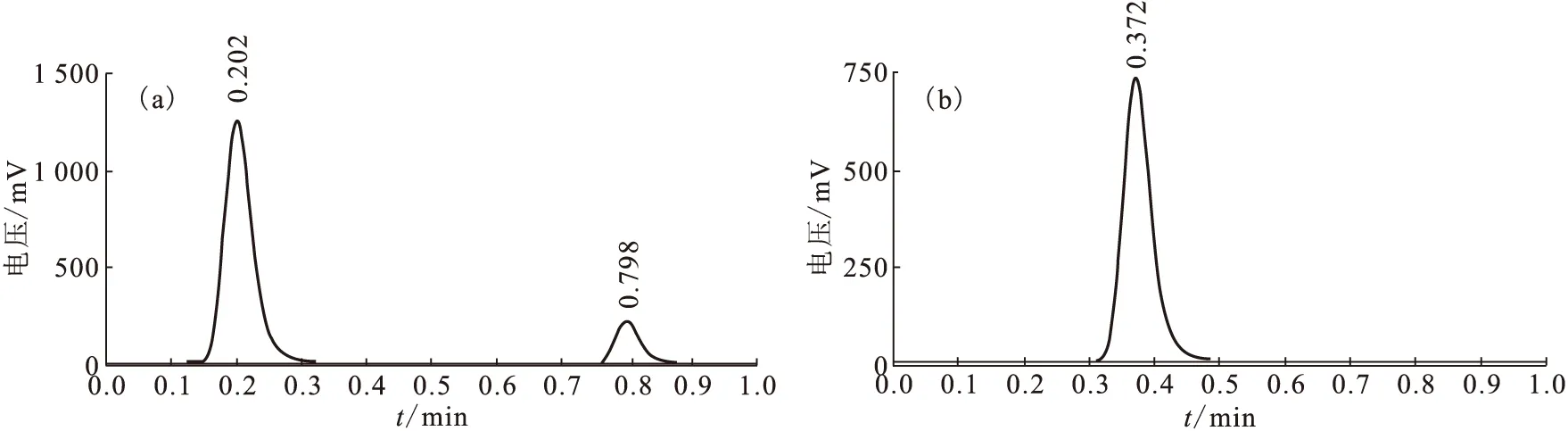
图3 125I-OxLDL-Ab的标记率(a)和放化纯度(b)Fig.3 Labeling yield(a) and radiochemical purity(b) of 125I-OxLDL-Ab
Table 2 Biodistribution of125I-OxLDL-Ab of normal miceinvivo

组织125I-OxLDL-Ab的每克组织百分注射剂量率/(%ID·g-1)4h8h1d2d3d5d7d血9.611±1.2956.209±0.7332.908±0.3791.177±0.1450.525±0.5250.133±0.0420.062±0.013心2.232±0.5071.142±0.2160.516±0.0860.225±0.0290.111±0.0100.032±0.0060.017±0.003肝脏2.802±0.4411.572±0.3630.765±0.1050.363±0.0620.256±0.0130.099±0.0310.059±0.013脾2.675±0.6791.079±0.2250.511±0.0730.220±0.0400.139±0.0270.051±0.0170.027±0.008肺3.529±0.5541.883±0.4470.867±0.1640.365±0.0260.282±0.1530.063±0.0180.032±0.008肾3.190±0.5721.879±0.4140.849±0.1470.388±0.0590.211±0.0180.078±0.0170.062±0.018胃15.686±2.9623.314±1.1860.631±0.1080.197±0.0440.216±0.0360.061±0.0120.030±0.007肠2.229±0.3421.056±0.1960.327±0.0630.130±0.0150.087±0.0100.070±0.0840.014±0.002肌肉0.876±0.1020.631±0.1580.239±0.0360.357±0.5350.097±0.0190.036±0.0340.011±0.009血管4.031±0.9092.262±0.4261.090±0.2340.436±0.1350.277±0.0770.060±0.0330.042±0.020骨1.943±0.1711.120±0.2560.475±0.0630.248±0.0580.161±0.0250.089±0.0590.044±0.007甲状腺19.280±2.914-37.272±10.94757.942±40.050-20.321±7.2837.215±5.818
注:n=4
表3125I-OxLDL-Ab在模型动物体内的分布
Table 3 Biodistribution of125I-OxLDL-Ab of atherosclerosis miceinvivo

组织125I-OxLDL-Ab的每克组织百分注射剂量率/(%ID·g-1)4h8h1d2d3d5d7d血8.001±1.2116.966±1.1064.609±1.1831.091±0.2640.504±0.0750.105±0.0340.085±0.025心1.617±0.2561.258±0.3000.793±0.2130.166±0.0490.093±0.0160.019±0.0050.018±0.005肝2.688±0.5102.800±0.6851.305±0.3720.323±0.0120.144±0.0290.065±0.0080.062±0.018脾2.808±0.3903.260±0.9131.447±0.2210.266±0.0590.124±0.0180.043±0.0040.039±0.010肺6.014±1.1018.936±2.2943.876±0.6200.509±0.1190.277±0.0760.072±0.0160.057±0.014肾3.582±0.5254.381±1.3031.837±0.4810.360±0.0850.177±0.0250.055±0.0100.050±0.012胃2.243±0.4202.794±0.6842.757±0.4880.195±0.0550.100±0.0270.015±0.0030.016±0.005肠1.945±0.2412.154±0.5551.250±0.2510.150±0.0450.057±0.0150.012±0.0020.010±0.005肌肉0.581±0.0400.590±0.1200.436±0.0900.055±0.0140.030±0.0040.008±0.0010.008±0.001血管4.098±0.7314.347±0.6741.866±0.5430.395±0.1120.198±0.0460.042±0.0080.041±0.011骨1.713±0.3051.840±0.3080.762±0.1910.130±0.0310.059±0.0150.016±0.0050.015±0.003甲状腺2.080±0.1111.804±0.3661.185±0.1540.230±0.0650.093±0.0130.120±0.0270.076±0.016
注:n=3
根据125I-OxLDL-Ab 在ApoE-/-鼠体内分布数据,做靶器官与非靶器官放射性摄取比值(T/NT)的柱形图,如图4所示。由图4可知:靶器官肺与血的T/NT比值小于1,不同时间点125I-OxLDL-Ab的T/Bl(血)含量比为0.462~1.300,提示动物模型血液中OxLDL抗原含量高,在下一步的斑块显像研究中可能会有内源性的干扰,需采用措施排除血液中OxLDL的干扰;除血外,肺与其它器官的T/NT比值均大于1.0,其中肝、肾的T/NT较低, 3 d内T/NT比值在1.344~3.024,这表明125I-OxLDL-Ab在靶器官肺中的靶向性较低,对以后的显像研究可能会产生干扰;而靶器官与肌肉的T/Mu(肌肉)值较高,为8.149~15.370,靶向性明显。
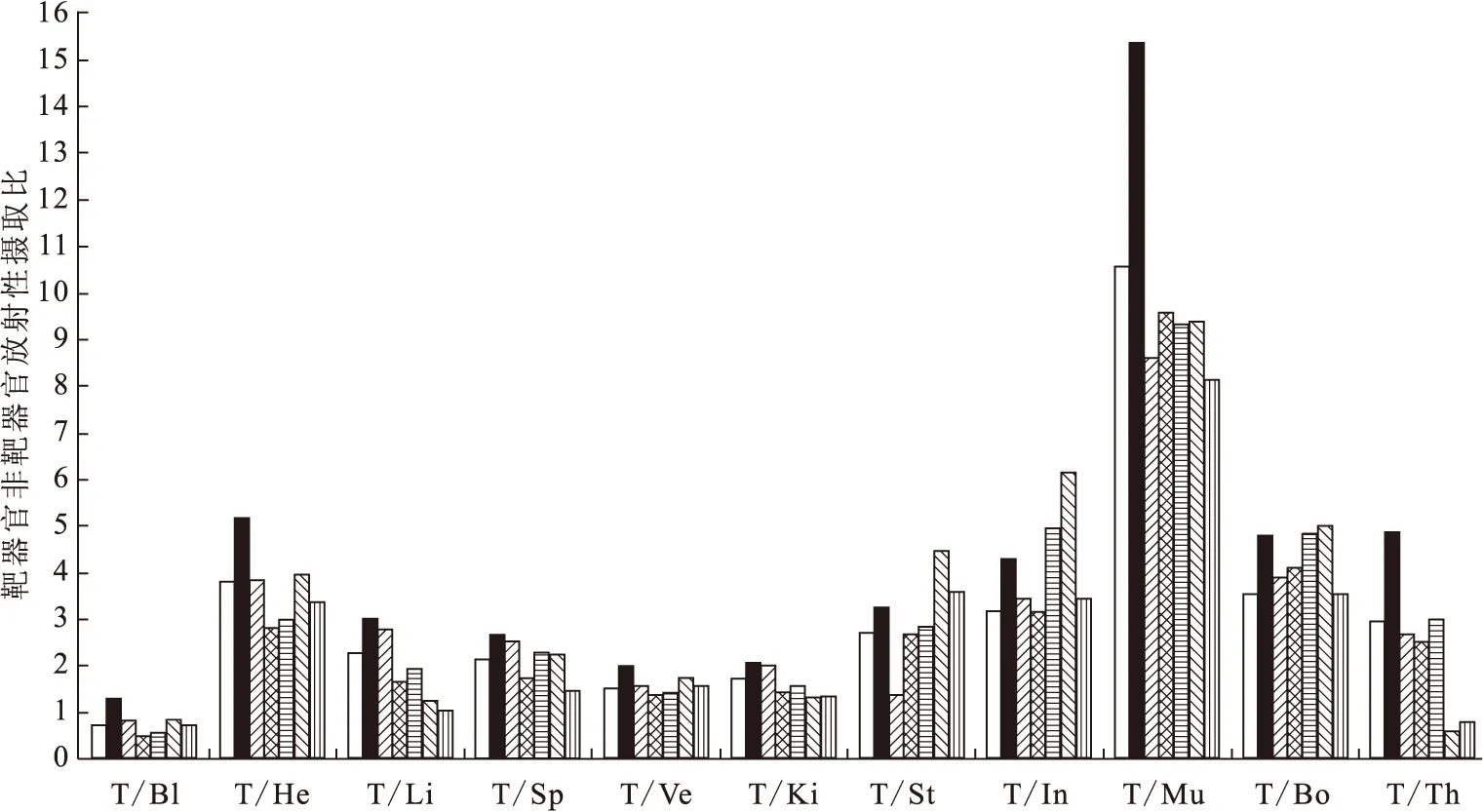
Bl——血,He——心,Li——肝,Sp——脾,Ve——血管,Ki——肾,St——胃,In——肠,Mu——肌肉,Bo——大腿骨,Th——甲状腺□——4 h,■——8 h,——1 d,——2 d,——3 d,——5 d,——7 d图4 125I-OxLDL-Ab在ApoE-/-鼠体内的主要器官T/NT比值Fig.4 Target/nontarget ratio of 125I-OxLDL-Ab of main organs of ApoE-/- mice
2.3.3 讨论 本实验所采用动物模型为载脂蛋白E基因缺陷的鼠,为高脂饮食型模型,属全身性动脉粥样硬化模型,因此对动脉粥样硬化易发部位冠脉血管也取样研究,实验发现冠脉部位没有明显斑块。对比125I-OxLDL-Ab在正常动物和模型动物的体内分布数据可知,肺在注射8 h时放射性浓集明显(正常(1.883±0.447)%ID/g,模型(8.936±2.294)%ID/g),血管在注射8 h时有一定放射性浓集(正常(2.262±0.426)%ID/g,模型(4.347±0.674)%ID/g)。实验数据显示对于本批实验模型来说,肺、血管均为125I-OxLDL-Ab的靶部位。125I-OxLDL-Ab与其抗原OxLDL在体外的活性好,在其模型动物分布中,肺、血管等在4~8 h时有放射性浓集现象,显示出125I-OxLDL-Ab在体内的靶向性,为其作为粥样硬化显像药物的研究起到积极作用。
3 结 论
采用仪器测定了OxLDL-Ab的纯度和浓度,保证了原料的质量。制备的125I-OxLDL-Ab在动脉粥样硬化动物模型的靶器官——肺(注射后4~8 h)有放射性浓集,可进一步进行体内靶向性研究,不排除其研发为动脉粥样硬化放射性显像诊断剂的可能性。
致谢:感谢韩世泉、梁端鹏、叶肇云、柳银黎、杨超一、冯婷婷等科研人员的帮助。
[1] Hansson G K. Inflammation, atherosclerosis, and coronary artery disease[J]. N Engl J Med, 2005, 352(16): 1685-1695.
[2] 张春东,勇强,李治安.动脉硬化的影像学检测方法[J].心肺血管病杂志,2008,27(5):313-316.
[3] Davies J R, Rudd J H F, Weissberg P L, et al. Radionuclide imaging for the detection of inflammation in vulnerable plaques[J]. J Am Coll Cardio, 2006, 47(8 Suppl): 57-68.
[4] Zahi A F, Valentin F, Konstantin N, et al. Computed tomography and magnetic resonance imaging for noninvasive coronary angiography and plaque imaging current and potential future concepts[J]. Circulation, 2002, 106: 2026-2034.
[5] 李学斌,郭继鸿.21世纪心血管疾病的诊治展望[J].新医学,2000,31(3):135-137.
[6] Boullier A, Bird D A, Chang M K, et al. Scavenger receptors, oxidized LDL and atherosclerosis[J]. Ann Cad Sci, 2001, 947: 214-222.
[7] Norata G D, Tonti L, Roma P, et al. Apoptosis and proliferation of endothelial cells in early atherosclerotic lesions: possible role of oxidized LDL[J]. Nutr Metab Cardiovasc Dis, 2002, 12(5): 297-305.
[8] Shoji T, Nishizawa Y, Fukumoto M, et al. Inverse relationship between circulating oxidized low density lipoprotein (OxLDL) and anti-oxLDL antibody levels in healthy subjects[J]. Atherosclerosis, 2000, 148(1): 171-177.
[9] 卢玉楷.简明放射性同位素应用手册[M].上海:上海科学普及出版社,2004:28.
[10]刘子华,邓新荣,徐燕华,等.125I标记氧化低密度脂蛋白抗体[J].同位素,2009,22(4):204-208.
[11]Xu Y H, Luo Z X. Development of methods for preparation of monoclonal antibody against oxidized low density lipoprotein[J]. China J Biol, 2007, 20 (9): 693-696.
[12]Plump A S, Smith J D, Hayek T, et al. Several hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells[J]. Cell, 1992, 71(10): 343-353.
[13]Ayala-Lopez W, Xia W, Varghese B, et al. Imaging of atherosclerosis in ApoE knockout mice: targeting of a folate-conjugated radiopharmaceutical to activated macrophages[J]. J Nucl Med, 2010, 51: 768-774.
Biodistribution of125I-OxLDL-Ab in Normal Mice and in Animal Models of AtherosclerosisinVivo
LIU Zi-hua1, FAN Cai-yun1, LI Feng-lin1, DENG Xin-rong1,XU Yan-hua2, LUO Zhi-fu1
1.Department of Isotope, China Institute of Atomic Energy, Beijing 102413, China;2.Chengdu Hoist Bio-tech Co. Ltd, Chengdu 610225, China
Anti-oxidized low-density lipoprotein antibody(OxLDL-Ab) was analysized with high performance liquid chromatography(HPLC) and ultraviolet spectrophotometry(UV). The biodistribution of125I-OxLDL-Ab was evaluated in both normal animals and animal models of atherosclerosis. Kunming mice were used as normal animals and ApoE knock-out mice (ApoE-/-mice) were used as animal models of atherosclerosis in the study of biodistribution. The optimum conditions of HPLC were as follows: phosphate buffer (0.2 mol/L, pH=7.4) was used as the mobile phase, the flow rate was 1 mL/min and the detection wavelength was 220 nm. The standard curve of concentration was obtained in the quantitative analysis of UV withy= 0.664 5x-0.008 3(r2=0.999 7). Biodistribution in normal animal show that organ uptakes decrease with time and no obvious accumulation is observed in organs except hypothyroid; over 2/3 uptake clear away in 24 h after injection and couldn’t be detected 7 d later. The hypothyroids of ApoE-/-mice are blocked by 2% KI solution to avoid their high uptake in the biodistribution of125I-OxLDL-Ab. Uptake in lung (the target organ) is high in the early 4-8 h after injection of125I-OxLDL-Ab. The ratio of target/organs is more than 1 except blood, and the ratio of target/muscle is more than 8, which show the selectivity of125I-OxLDL-Ab to the targeted organinvivo. Futher studies need to be done to evaluate the possibility125I-OxLDL-Ab as a SPECT imaging agent in diagnose of early stage of atherosclerosis.
OxLDL-Ab; atherosclerosis;125I ; ApoE-/-mice; biodistribution
2015-07-10;
2015-09-10
刘子华(1977—),女,山东烟台人,硕士,副研究员,从事放射性药物研究
TL923
A
0253-9950(2016)06-0378-07
10.7538/hhx.2016.YX.2015064
