微量热法研究硝酸体系中N,N-二甲基羟胺的热稳定性
2016-12-30卞晓艳晏太红李传博李辉波何喜红郑卫芳
曹 智,卞晓艳,晏太红,李传博,李辉波,何喜红,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
微量热法研究硝酸体系中N,N-二甲基羟胺的热稳定性
曹 智,卞晓艳,晏太红,李传博,李辉波,何喜红,郑卫芳*
中国原子能科学研究院 放射化学研究所,北京 102413
采用微量热仪研究了硝酸溶液中N,N-二甲基羟胺(DMHAN)的热稳定性,考察了溶液中硝酸浓度、DMHAN浓度和甲基肼(MMH)、空气和氮气气氛、金属元素等对DMHAN热稳定性的影响,并比较了相同条件下DMHAN和羟胺(HAN)的热稳定性。研究结果表明,HNO3浓度在1.5~3.0 mol/L和DMHAN浓度在0.05~0.8 mol/L时,DMHAN/HNO3体系起始反应温度(t0)随硝酸浓度的降低或随DMHAN浓度的升高而增加。当HNO3/DMHAN摩尔浓度比值分别为2.5~10和12.5~20时,DMHAN/HNO3体系反应热分别约为865.5 kJ/mol和683.4 kJ/mol,说明不同的HNO3/DMHAN摩尔浓度比值,引发DMHAN/HNO3体系内的各个反应权重不同从而导致体系放热不同。MMH作为支持还原剂,使DMHAN发生分解反应的时间明显滞后;空气、氮气气氛以及后处理流程中的铁和裂片元素锆、钌对DMHAN/HNO3体系分解反应无明显影响,不锈钢容器对DMHAN/HNO3分解反应有催化作用。
二甲基羟胺;热稳定性;微量热法
PUREX流程是当前核燃料后处理厂使用的主要流程[1]。铀钚分离和钚的反萃段中均采用还原法,为实现核燃料后处理分离过程废物的最小化,通常采用无盐还原试剂[2]。目前国外后处理厂通常采用羟胺(HAN),而我国近年来研究了一种新型无盐还原剂N,N-二甲基羟胺(DMHAN),具有比HAN还原Pu(Ⅳ)和Np(Ⅵ)速率快、还原Np(Ⅴ)至Np(Ⅳ)速率慢、还原速率受酸度影响小[1-4]、流程简单和废物量少等优点,并在PUREX流程中成功应用,以此构建了我国先进二循环流程APOR[3-5](advance process based on organic reductants)。
DMHAN由N、H、O和C原子组成,与HAN相同,属强还原剂,由其构成的还原溶液体系在存贮和使用过程的稳定性会受到温度、酸度及其它金属元素等因素影响。文献[6]报道,在一定条件下硝酸溶液中的HAN会发生自催化分解反应,同时硝酸浓度和容器(不锈钢、钛)也会加速其分解,从而影响其使用效率,甚至可能引发安全问题。目前HAN热稳定性研究已经较为成熟, 而针对DMHAN的研究主要是其应用过程中与Pu、Np、HNO2等的动力学过程和其辐照行为,热稳定性方面的研究报道较少[1-4,7]。DMHAN作为我国自主研发的新型还原剂,其热稳定性研究同样具有重要意义。
本工作采用微量热法考察了DMHAN和硝酸浓度、支持还原剂MMH、空气和氮气气氛、金属元素等因素对DMHAN热稳定性的影响,并与HAN稳定性进行对比研究。
1 实验部分
1.1 主要试剂和仪器
二甲基羟胺,由中国原子能科学研究院合成,产品经气质联用分析其纯度大于98%,水溶液浓度采用酸碱滴定的方法测定;单甲基肼(MMH),中国航空航天三院生产。其余试剂均为中国国药集团生产,分析纯。
C80微量热仪,法国塞塔拉姆仪器公司生产的热分析仪,可测量各类物理及化学过程的热效应,通过积分可得体系的放热量;T50自动滴定仪,梅特勒-托利多集团;GB204分析天平,精度10-4g,梅特勒-托利多集团。
1.2 实验方法
(1) 准确称重样品溶液后加到C80的样品池内,以α-氧化铝作为参比物。测试过程中根据研究内容选取不锈钢反应池或带玻璃套管的不锈钢反应池,以一定升温速率考察DMHAN和硝酸浓度、支持还原剂MMH等条件对 DMHAN/HNO3热稳定性影响。实验过程中考察的起始反应温度t0为样品放热峰斜率最大值处的切线与基线交点所对应的温度。为了消除硝酸自身反应的影响,以硝酸水溶液做为空白实验。实验结果表明硝酸水溶液的量热曲线平缓,在加热过程中没有明显的吸放热过程,对DMHAN/HNO3溶液的起始反应温度t0和放热量没有影响。
(2) 实验条件的选择:APOR流程中DMHAN和HNO3浓度范围分别是0.05~0.5 mol/L和0.4~1.45 mol/L。考虑到仪器测量的原因,为避免研究体系在100 ℃汽化对反应测定产生影响,选择DMHAN浓度和HNO3浓度范围分别为0.05~0.8 mol/L和1.5~3.0 mol/L,使研究体系的反应在100 ℃之前发生。
2 结果与讨论
2.1 硝酸浓度对DMHAN热稳定性影响
图1为不同硝酸浓度下,DMHAN/HNO3溶液发生分解反应的起始温度t0随硝酸浓度变化图。图1结果表明,硝酸浓度在1.5~3.0 mol/L时,硝酸浓度与起始反应温度成线性。DMHAN/HNO3溶液体系的起始反应温度t0随HNO3浓度增加而降低,表明DMHAN浓度相同时,硝酸浓度越高DMHAN越易发生分解反应。

c(DMHAN)=0.2 mol/L,c(HNO3)=1.5、2.0、2.5、3.0 mol/L;β=0.1 K/min图1 硝酸浓度对DMHAN热稳定性的影响Fig.1 Effect of HNO3 concentration on the thermal stability of DMHAN
2.2 DMHAN浓度对DMHAN热稳定性影响
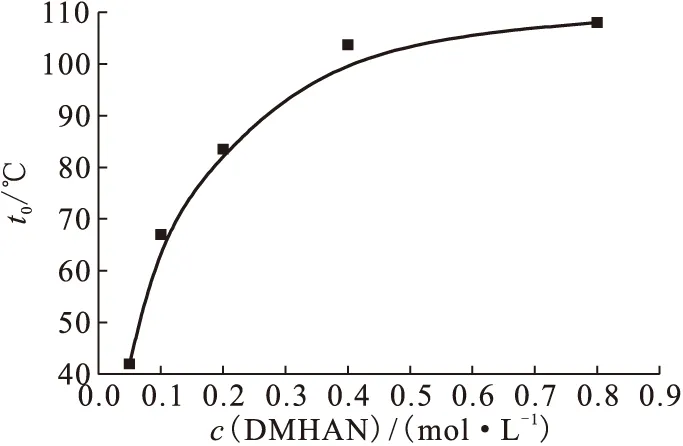
c(HNO3)=2.0 mol/L,c(DMHAN)=0.05、0.1、0.2、0.4、0.8 mol/L;β=0.1 K/min图2 DMHAN浓度对DMHAN热稳定性的影响Fig.2 Effect of DMHAN concentration on the thermal stability of DMHAN

2.3 HNO3/DMHAN摩尔浓度比对DMHAN热稳定性影响

c(HNO3)=1.5、2.0、2.5、3.0 mol/L,c(DMHAN)=0.05、0.1、0.2、0.4、0.8 mol/L;β=0.1 K/min图3 HNO3/DMHAN摩尔浓度比对DMHAN/HNO3体系反应放热的影响Fig.3 Effect of molar concentration ratios of DMHAN and HNO3 on the reaction heat of DMHAN/HNO3
图3显示不同HNO3/DMHAN摩尔浓度比值(r(HNO3/DMHAN))情况下,DMHAN/HNO3溶液分解反应放热量随HNO3/DMHAN摩尔浓度比值变化。图3结果表明,DMHAN/HNO3体系中,DMHAN/HNO3的反应热在HNO3/DMHAN摩尔浓度比值为2.5~10时相近,约为865.5 kJ/mol,但当HNO3/DMHAN摩尔浓度比值超过10时,DMHAN的反应热骤然下降,在HNO3/DMHAN摩尔浓度比值为12.5~20时相近,约为683.4 kJ/mol。据文献[7]中报道HAN发生分解反应时有两个反应同时进行,且这两个反应的产物和反应放热均不相同。DMHAN是HAN的二甲基取代物,化学结构与HAN相比较为复杂,可能DMHAN发生分解反应时有两个或两个以上的反应路径,当HNO3/DMHAN摩尔浓度比值不同时,各个反应进行的权重不同,导致体系整体放热不同,详细的DMHAN/HNO3分解反应机理还待进一步研究。
2.4 MMH对DMHAN热稳定性影响
表1为在有、无MMH存在情况下,DMHAN/HNO3体系反应得到的相关数据。由表1可见,通过比较起始反应温度t0、热流变化数据,发现在MMH存在条件下DMHAN/HNO3溶液的t0高,相对稳定,同时有支持还原剂的参与,体系发生反应时会放出更多热量。在MMH存在的DMHAN/HNO3体系中,其分解温度较高的主要原因可能是MMH比DMHAN易于同HNO2反应,不利于HNO2的积累,使体系稳定性上升,因此在后处理流程中MMH通常作为支持还原剂与还原剂一起使用。
表1 MMH对DMHAN热稳定性影响
Table 1 Effect of MMH on the thermal stability of DMHAN

c(MMH)/(mol·L-1)t0/℃放热量ΔH/(kJ·mol-1)083.5882.20.1104.61351.7
注:c(DMHAN)= 0.2 mol/L,c(HNO3)=2.0 mol/L;β=0.1 K/min
2.5 氮气和空气气氛对稳定性影响
目前对DMHAN/HNO3溶液体系分解反应的研究还不充分,其很多分解产物还不确定,采用气质联用技术对气体产物进行了分析,确定其气体产物中含有NO、N2O气体。文献[9]中报道HAN的分解产物为NOx,HAN在气态状态下存在反应(1),且气体产物NO易与空气中的O2发生反应,将会引发反应(2)—(4)。因此可以推测O2可能会参与DMHAN/HNO3的分解反应。如果空气中的O2对DMHAN/HNO3分解反应影响很大,则在有无氧气的条件下DMHAN分解反应的实验数据(t0、放热量)会不同。
2NH2OH(gas)+0.5O2=3H2O(gas)+N2
(1)
2NO+O2=2NO2
(2)
(3)
(4)
图4显示在空气气氛和氮气气氛中DMHAN/HNO3体系分解反应热流随温度变化。由图4可见,在两种气氛下,其分解反应的起始温度、放热峰大小接近,可以推断有两种可能性:一种是在此实验条件下空气中的氧对DMHAN/HNO3体系分解反应无明显影响;另一种可能性是该研究反应池体积较小,与气体接触面小,氧气的影响不明显。

c(DMHAN)=0.2 mol/L,c(HNO3)=3.0 mol/L;β=0.5 K/min图4 N2和空气气氛下对DMHAN热稳定性影响Fig.4 Effect of N2 and air on the thermal stability of DMHAN
2.6 金属元素对DMHAN稳定性的影响
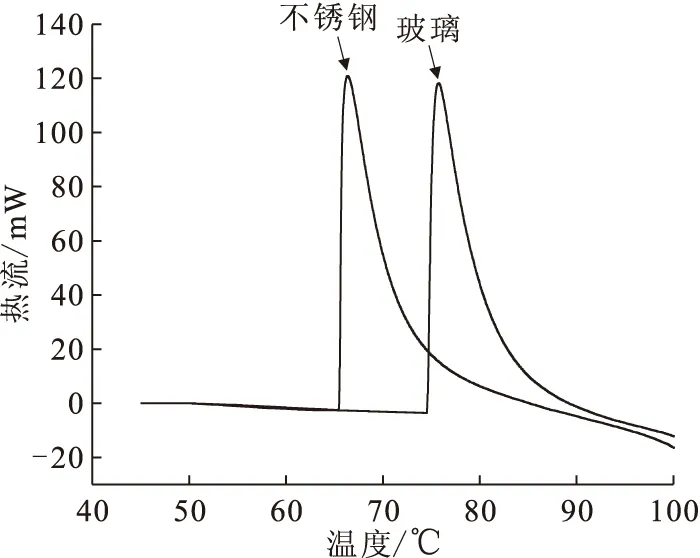
c(DMHAN)=0.2 mol/L,c(HNO3)=3.0 mol/L;β=0.5 K/min图5 不锈钢反应池和玻璃衬管反应池对DMHAN热稳定性影响Fig.5 Effect of stainless steel and glass on the thermal stability of DMHAN
文献[10-13]中报道多种金属元素对HAH的自催化反应有催化作用,核燃料后处理流程中通常使用不锈钢材质的储罐,所以研究不锈钢材料对DMHAN的分解反应是否具有催化作用对DMHAN的储存和使用具有重要意义。图5显示了DMHAN/HNO3体系在不锈钢反应池和带玻璃衬管反应池中分解反应热流随温度的变化。由图5可以看出,在不锈钢反应池内的DMHAN溶液反应的t0温度较低,说明不锈钢对DMHAN的分解反应有催化作用,可能是由于不锈钢由多种金属元素组成,其中的元素对DMHAN/HNO3分解反应有影响,但其详细催化机理还需进一步研究。
此外,核燃料后处理流程中在经过共去污循环后绝大部分裂片元素进入高放废液,只有少量锆、钌被萃入有机相而进入后续流程,同时在后处理流程中管路和设备长期使用过程中也会引入少量的金属离子(如铁离子),这些金属离子的存在可能会催化DMHAN/HNO3溶液的分解反应。因此研究了铁和裂片元素锆、钌对DMHAN/HNO3溶液分解反应的影响,实验结果列于表2。由表2可以看出,在有、无裂片元素锆、钌存在情况下,DMHAN/HNO3溶液的起始反应温度t0近似,说明裂片元素锆、钌对DMHAN/HNO3溶液的分解反应无明显催化作用。含金属离子体系的放热量高于无金属离子体系可能是由于金属离子参与反应导致体系放热量升高。从表2的结果还可以看出,铁离子使DMHAN/HNO3体系的起始反应温度略有升高,说明铁离子的存在对DMHAN/HNO3溶液的反应有抑制作用。
表2 Zr、Ru、Fe对DMHAN热稳定性影响
Table 2 Effect of Zr, Ru,Fe on the thermal stability of DMHAN
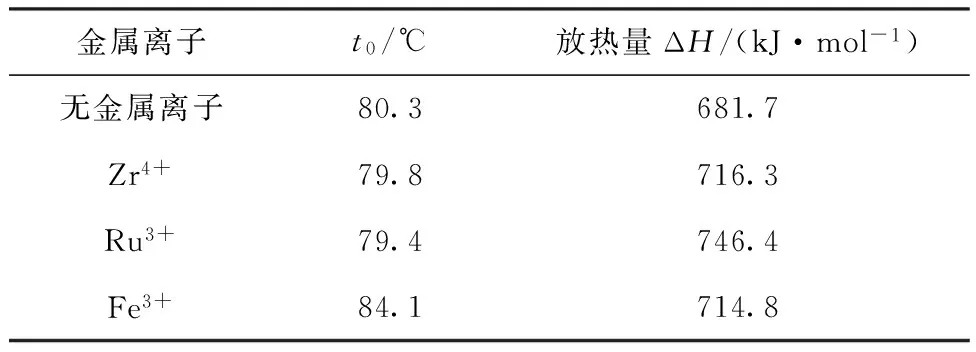
金属离子t0/℃放热量ΔH/(kJ·mol-1)无金属离子80.3681.7Zr4+79.8716.3Ru3+79.4746.4Fe3+84.1714.8
注:c(DMHAN)=0.1 mol/L,c(HNO3)=1.5 mol/L;β=0.1 K/min
2.7 DMHAN与HAN的稳定性比较
图6显示了DMHAN/HNO3和HAN/HNO3体系反应热流随温度的变化,反应得到的相关数据列于表3。表3结果表明:DMHAN的反应起始温度t0低于HAN,放热量明显高于HAN,说明DMHAN在相同条件下更易发生分解反应且反应更加剧烈。这是由于二甲基羟胺是羟胺衍生物,两个甲基代替了羟胺上的氢原子,甲基作为供电基团可使N原子具有更强的电负性,在酸性溶液中,DMHAN比羟胺更容易形成质子化产物,更易分解,稳定性没有HAN好。
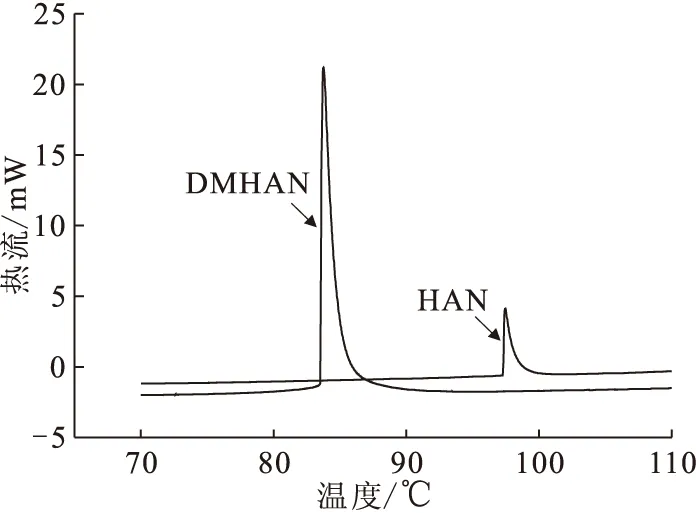
c(DMHAN)=0.2 mol/L,c(HAN)=0.2 mol/L,c(HNO3)=2.0 mol/L,β=0.1 K/min图6 HAN与DMHAN稳定性比较Fig.6 Thermal stability of HAN and DMHAN
Table 3 Thermal stability of HAN and DMHAN

反应体系t0/℃放热量ΔH/(kJ·mol-1)HAN/HNO397.2116.9DMHAN/HNO383.5882.2
3 结 论
(1) APOR流程中硝酸浓度在1.5~3.0 mol/L、DMHAN浓度在0.05~0.8 mol/L时,DMHAN/HNO3体系的热稳定性随硝酸浓度的降低或DMHAN浓度的升高而增加。HNO3/DMHAN摩尔浓度比值不同DMHAN/HNO3体系反应热不同, 可能是不同HNO3/DMHAN摩尔浓度比值使DMHAN/HNO3体系内各个反应权重不同。而支持还原剂MMH可以提高硝酸溶液中DMHAN的稳定性。
(2) 空气、氮气气氛和核燃料后处理流程中的铁、裂片元素锆和钌对DMHAN的热稳定性无明显影响,而不锈钢容器对DMHAN分解反应有催化作用,影响DMHAN的稳定性。同等条件下,HAN的热稳定性好于DMHAN。
[1] 何辉.N,N-二甲基羟胺在铀钚分离中的应用和计算机程序的开发[D].北京:中国原子能科学研究院,2001.
[2] 叶国安.Purex流程中有机无盐试剂的应用分析[J].原子能科学技术,2004,38(2):152-158.
[3] He H, Ye G A, Tang H B, et al. An advanced PUREX process based on salt-free reductants[J]. Radiochim Acta, 2014, 102: 127-133.
[4] Xiao S T, Li L, Ye G A, et al. An improvement in APOR process I: uranium/plutonium separation process[J]. Nucl Sci Tech, 2015, 26(4): 1-7.
[5] 任凤仪,周镇兴.国外核燃料后处理[M].北京:原子能出版社,2003.
[6] Harlow D G, Felt R E, Agnew S, et al. Technical report on hydroxylamine nitrate, DOE/EH-0555[R]. USA: US Department of Energy, 1998.
[7] 陈辉.N,N-二甲基羟胺和甲基肼辐解行为和机理研究[D].北京:中国原子能科学研究院,2010.
[8] 双红莹.N,N-二甲基羟胺在硝酸体系中化学稳定性的研究[D].北京:中国原子能科学研究院,2013.
[9] Cisneros L O, Rogers W J, Mannan M S, et al. Effect of air in the thermal decomposition of 50 mass% hydroxylamine/water[J]. J Hazard Mater, 2002, 95(1/2): 13-25.
[10]Wei C, Rogers W J, Mannan M S, et al. Thermal decomposition hazard evaluation of hydroxylamine nitrate[J]. J Hazard Mater, 2006, 130(1/2): 163-168.
[11]Iwata Y, Koseki H. Decomposition of hydroxylamine/water solution with added iron ion[J]. J Hazard Mater, 2003, 104: 39-49.
[12]Kumasaki M. Calorimetric study on the decomposition of hydroxylamine in the presence of transition metals[J]. J Hazard Mater, 2004, 115: 57-62.
[13]Kumasaki M, Fujimoto Y, Ando T. Calorimetric behaviors of hydroxylamine and its salts caused by Fe(Ⅲ)[J]. J Loss Prevent Process Ind, 2003, 16: 507-512.
Thermal Stability ofN,N-Dimethylhydroxylamine in Nitric Acid Solution by Microcalorimetry
CAO Zhi, BIAN Xiao-yan, YAN Tai-hong, LI Chuan-bo, LI Hui-bo,HE Xi-hong, ZHENG Wei-fang*
China Institute of Atomic Energy, P. O. Box 275(26), Beijng 102431, China
The thermal stability ofN,N-dimethylhydroxylamine(DMHAN) in the nitric acid solution was studied using micro calorimeter. The main influence factors including the nitric acid concentration, the concentration of DMHAN, MMH, atmosphere(air and nitrogen) and metals were studied and compared the thermal stability of DMHAN with HAN under the same conditions. The results show that the initial reaction temperature(t0) of DMHAN/HNO3(HNO3: 1.5-3.0 mol/L, DMHAN: 0.05-0.8 mol/L) is improved as the acidity reduces or the concentration of DMHAN increases. The reaction heat of DMHAN/HNO3is 865.5 kJ/mol and 683.4 kJ/mol respectively when the mole concentration ratios of HNO3to DMHAN are 2.5-10 and 12.5-20. This indicates the different ratio of HNO3to DMHAN makes the scale of reactions different in the DMHAN/HNO3, so it makes the different reaction heat. Holding reductant MMH make the induction period of the autocatalytic reaction become longer. The air, nitrogen atmosphere, Fe and the fission products (Zr, Ru) do not affect the decomposition of DMHAN, but the stainless steel make the DMHAN/HNO3show higher reactivity.
N,N-dimethylhydroxylamine; thermal stability; microcalorimetry
2016-01-26;
2016-08-19
曹 智(1987—),女,河北秦皇岛人,助理研究员,核燃料循环专业
*通信联系人:郑卫芳(1969—),男,江苏金坛人,博士,研究员,核燃料循环专业,E-mail: wfazh@ciae.ac.cn
O642.1
A
0253-9950(2016)06-0347-06
10.7538/hhx.2016.38.06.0347
