辐射防护剂和治疗剂的研究进展
2016-12-30刘红艳刘建功党旭红张忠新张慧芳左雅慧段志凯
刘红艳,刘建功,党旭红,张忠新,张慧芳,左雅慧,段志凯
中国辐射防护研究院,山西 太原 030006
辐射防护剂和治疗剂的研究进展
刘红艳,刘建功,党旭红,张忠新,张慧芳,左雅慧,段志凯
中国辐射防护研究院,山西 太原 030006
随着核能与核技术的迅速发展及广泛应用,人们接触电离辐射的机会日益增多。辐射防护剂和治疗剂的应用倍受关注,但目前使用的许多辐射防护剂和治疗剂都不太理想。研究人员一直致力于研究高效、低毒的天然辐射防护剂。本文主要关注了化学类、植物和天然中草药的辐射防护剂以及细胞因子和干细胞辐射治疗剂的应用前景。氨磷汀(WR-2721)及相关化合物最具市场前景,但是严重的不良反应限制其临床应用。植物提取物和天然中草药具有毒性小、价格相对低廉、可以口服给药,并且可以通过多种机制发挥作用的优势,因此成为国内外研究关注的热点。细胞因子治疗能够预防或减少急性辐射综合症(ARS)。间充质干细胞(MSC)具有分泌造血生长因子、重建造血微环境、低免疫原性、易于外源基因转染和表达等优点,将其应用于急性辐射损伤的临床治疗具有十分广阔的前景。因此,植物和中草药作为辐射防护剂和MSC作为放射治疗剂的协同应用可能是未来研究的趋势。
电离辐射;辐射损伤;辐射防护剂;间充质干细胞
随着核能与核技术应用的发展,人们遭受辐射损伤的潜在性风险大大增加,包括核辐射事故、宇宙空间探索、放射治疗和辐射加工等领域。急性辐射综合症(acute radiation syndrome, ARS)是人的全身或者大部分受到大剂量辐射(通常短时间内)后出现的一种严重疾病。在核辐射事故以及癌症治疗、放射诊断的辐射剂量较高时,可能导致一些急性放射性疾病症状,涉及神经与血管系统、造血系统及胃肠损伤的全身性疾病。
电离辐射对生物体的损伤,主要来自电离产生大量自由基后的间接作用和辐射能量传递直接作用导致DNA、蛋白质、脂质等生物大分子损伤。水在一定剂量的辐射反应中产生的大量自由基会损伤细胞内的膜系统,易造成人体免疫系统、生殖系统、神经系统和心血管系统伤害,引起多种常见的疾病,甚至引发变异或癌症的产生[1]。为了预防和减轻核辐射事故对身体健康的危害,研究辐射损伤防治手段,寻求有效的抗辐射损伤药物已成为一个迫切需要解决的问题。辐射防护剂和治疗剂在辐射防护中的主要作用机制示于图1。数十年来,人们对多种化合物、天然产物和生物制剂进行了抗辐射损伤研究,并取得一定成效。其中代表药物含巯基化合物氨磷汀(amifostine, WR-2721)已获美国食品药品监督管理局(Food and Drug Administration, FDA)批准上市,在临床上已用于肿瘤患者放疗前使用,但由于其药物副作用较大限制了其在临床中的应用。
植物和中草药等天然化合物广泛应用于医学中,具有毒性小,价格低,可以口服给药,并且可以通过调节免疫系统、血液系统等多种机制发挥作用的优势,研究发现,它们是较好的辐射防护剂。间充质干细胞(mesenchymal stem cells, MSC),是一种具有自我复制能力和多向分化潜能的成体干细胞,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注。目前急性放射病的治疗,临床主要使用一些支持疗法(包括输血、补液、电解质、抗生素)。细胞因子、生长因子和MSC等生物制剂治疗可通过调节免疫系统、分泌造血生长因子、重建造血微环境,具有低免疫原性、易与外源基因转染和表达等优点在辐射损伤的临床治疗中备受关注,MSC应用于急性辐射损伤的临床治疗具有十分广阔的前景[2-4]。本文将对近年来发展迅速的天然化合物辐射保护剂和生物制品类辐射治疗剂,以及可能的防护机制进行简要综述。
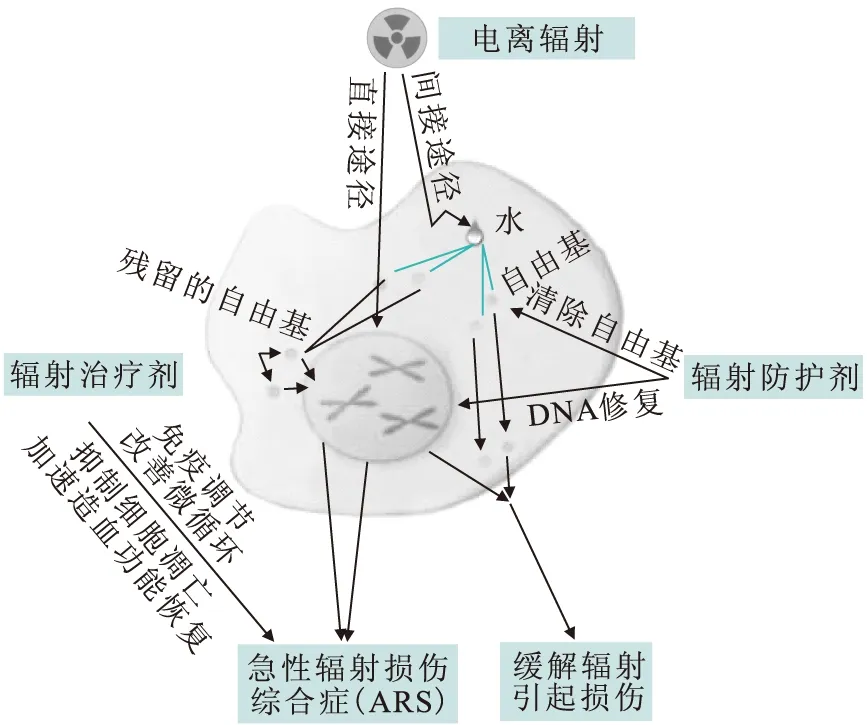
图1 辐射防护剂和治疗剂在辐射防护中的主要作用机制Fig.1 Main mechanism of radioprotector and radiation treatment agents
1 辐射防护剂
1.1 化学类辐射防护剂
由于广岛和长崎遭受原子弹爆炸的影响,大量人员死于急性放射病,幸存者也患了不同深度的慢性放射病。研究人员便开始致力于缓解核武器爆炸引发的巨大辐射危害。Patt等[5]最早报道在哺乳动物上半胱氨酸能预防急性放射损伤。此后,研究人员便开始关注此类化学成分及其衍生物。1.1.1 含硫化合物 在核军备竞赛期间,Walter-Reed陆军研究所研究人员从4 400多个化合物中筛选出的S-2(3-氨基丙基氨基)乙基硫代磷酸酯(WR-2721),也就是后来被称为分子防护剂的氨磷汀,是迄今为止最具市场前景的防护剂。1994年被批准为美国宇航员空间辐射防护药物,后于1996年获FDA批准上市,在临床上用于保护接受大剂量头颈部放射治疗患者的唾液腺,减轻急性口腔综合症,另外,在欧洲联盟,氨磷汀已被批准用于该适应症,但其副作用较大,包括低血压、恶心、呕吐、嗜睡、过敏性皮疹、发热、休克等缺点限制了其开发和使用。除含硫化合物和氨类化合物外,科研工作者把研究的化合物类别扩大到激素、植物和中草药,并发现这些化合物也有一定的辐射防护作用。
1.1.2 激素类 天然甾体激素或人工合成的非甾体激素在动物实验中表现出辐射防护的作用,且在照射前后给药都有效果,肿瘤放疗临床治疗中已将其用来减轻因放疗引起的白细胞降低的症状,并作为辐射事故应急医学处理急救药物进行储备。研究证实,异黄酮类化合物主要来源于豆类植物,生物活性强,且无毒,通过与雌激素受体结合而发挥其生物学活性[6]。这种异黄酮本身也是一种有效的抗氧化剂,可以减少微核形成,增加致死剂量照射的小鼠的存活率,从而发挥辐射防护作用[7]。河南“4·26”60Co源辐射事故导致1例重度、2例中度骨髓型急性放射病人,被照射后5 d给予苯甲酸雌二醇治疗,患者于照后91 d康复出院。
1.1.3 乌司他丁 乌司他丁是一种胰蛋白酶抑制剂,分子量67 kDa,最初从人尿中分离纯化,现广泛应用于急性腮腺炎和循环衰竭的治疗研究中。由于乌司他丁能够抑制释放炎性介质,改善血液微循环、介信号途径,放疗前给予乌司他丁可以阻止转化生长因子β(transforming growth factor-β, TGF-β)的信号传导途径,从而降低放疗引起的肺部损害[8]。同时,接受放疗前给予高剂量的乌司他丁可使炎症反应减少,抑制肺纤维化。这主要由于 TGF-β可以作用于成纤维细胞、巨噬细胞以及肺泡上皮,调控细胞增殖、抗炎作用及控制细胞外基质的稳定性[9]。然而,乌司他丁最佳适用剂量具有较高的毒性从而限制其广泛使用。
迄今为止似乎还没有发现较为理想的化学类辐射防护剂,现在研究的热点转向天然植物和中草药的防护效果。
1.2 植物和中草药辐射防护剂
理想的辐射防护剂应该是对人体安全、价格低廉、方便口服、能被迅速吸收,通过调节免疫系统、DNA损伤修复和清除自由基能力等方面发挥作用[4]。植物和天然中草药对辐射损伤的主要防护机制示于图2。植物和天然中草药具有上述优点,通常被认为是无毒,易于接受。因此,从植物和天然中草药中筛选理想的辐射防护剂成为目前研究的热点。
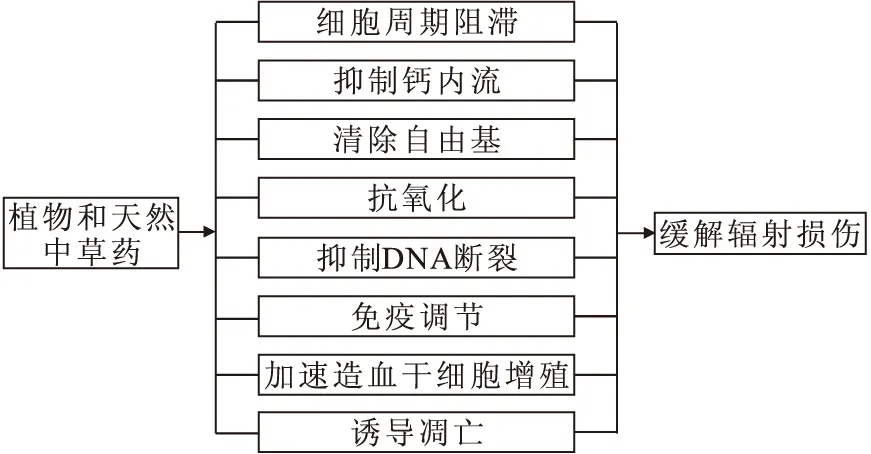
图2 植物及中草药在辐射防护中的机制Fig.2 Mechanism of plant and herbal medicine in radiation protection
1.2.1 沙棘 由于沙棘的营养、食用和药用价值都较高,已引起国内外营养学、细胞学、医药学、遗传学、防护学、生物化学等专家学者的极大关注。除用于制备饮料、化妆品、紫外线护肤产品,其药用功效主要集中在胃溃疡、心血管、肝脏疾病和癌症等方面[10]。沙棘富含200多种活性物质,主要包括维生素、胡萝卜素、类黄酮,必需的氨基酸、棕榈酸、硬脂酸、油酸和亚油酸甘油酯,微量元素和超氧化物等。沙棘抗辐射机理可归因于自由基清除、促进造血干细胞增殖和免疫增强作用[11-12]。进一步研究发现,浆果的乙醇提取物对致命60Co γ射线辐射诱发的体内和体外模型均有显著的防护作用[13]。此外,除了沙棘果浆活性成分,其种子油和叶提取物表现显著的抗氧化和免疫调节活性[14]。
1.2.2 白藜芦醇 白藜芦醇(反式3,5,4′-三羟基茋烯)是一种天然存在的多酚类化合物,主要来源于葡萄、花生、桑葚等植物。白藜芦醇在体外具有很强的抗氧化能力,能显著增加抗氧化酶超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)等和非酶类抗氧化物质,如还原型谷胱甘肽、维生素C、维生素E和β-胡萝卜素等的抗氧化作用,并降低脂质过氧化水平,清除和抑制自由基的产生,具有抗炎和抗肿瘤作用[15]。白藜芦醇可以调节脂类代谢,抑制氧化脂蛋白合成和减缓血小板聚集,在预防人类心血管疾病方面发挥着重要作用。它通过诱导激活半胱天冬酶和其他分子信号,包括CD95、丝裂原活化蛋白激酶(MAPK)和Bcl-2促进癌细胞凋亡,具体机制可能与诱导细胞凋亡、调节细胞周期、抑制血管生成、抑制核因子NF-kB和环氧合酶信号途径等有关。Carsten等[16]首次报道了白藜芦醇的抗辐射作用,主要能够诱导细胞凋亡,清除辐射诱发的自由基,抑制脂质过氧化物和细胞周期阻滞等途径达到抗氧化作用,同时其显著的抗氧化作用在许多疾病防治方面得到广泛应用。然而,白藜芦醇毒性较大,不能通过口服途径吸收,且在肠和肝脏中快速代谢,阻止白藜芦醇发挥生物活性,限制其应用[17]。
1.2.3 螺旋藻 螺旋藻是一种营养价值较高的蓝藻类低等生物,属于蓝藻门颤藻科,通常生长在非洲、亚洲、北美洲和南美洲的碱性环境中。由于其极高的营养价值而备受关注。螺旋藻富含多种维生素、矿物质、β-胡萝卜素、叶绿素和不饱和脂肪酸[18]。切尔诺贝利核事故后,研究发现每天服用5 g螺旋藻,一定时期后尿液中137Cs减少了近50%,表明该螺旋藻具有防辐射作用,促排作用可能与螺旋藻中金属硫蛋白有关[19]。此外用螺旋藻提取物C-藻蓝蛋白和多糖对正常组、γ射线照射组和贫血小鼠的外周血和骨髓造血细胞进行研究实验时,发现C-藻蓝蛋白和螺旋藻多糖可刺激白血细胞和骨髓细胞[20]。Hayashi等[21]研究表明,螺旋藻能增强骨髓细胞增殖活力。动物研究和临床研究表明,螺旋藻具有调节免疫系统,具有抗氧化、抗炎及抗肿瘤作用[22]。植物中的天然活性成分可通过止吐、抗炎、抗氧化、细胞增殖、伤口愈合、造血细胞刺激因子等多方面作用,对辐射损伤起到防护或修复的效果。
植物和天然中草药对辐射损伤的防护机制,主要是通过调节机体免疫力,诱导细胞发生周期阻滞,调节细胞DNA等损伤修复能力,诱导损伤严重或者修复失败的细胞发生凋亡。
2 辐射治疗剂
2.1 细胞因子
电离辐射能够引起造血系统损伤,减少血中中性粒细胞和血小板的数量,最终可导致败血症、出血、贫血和死亡[22]。研究发现,大剂量电离辐射损伤诱发的ARS 是一个涉及神经、血管、胃肠及造血系统的全身损伤性疾病。目前对于急性放射病治疗,除常规使用一些支持疗法之外,细胞因子对于预防和减轻ARS 有一定的效果[23-25]。造血生长因子(hematopoietic growth factors, HGF)对于缓解骨髓功能衰竭以及刺激造血功能恢复有一定效果,临床上使用最多的是粒细胞-巨噬细胞集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)和白细胞介素(IL)等[26],因为其能够抑制细胞凋亡,加速造血干细胞/祖细胞(hematopoietic stem cell and progenitor cells, HSPC)增殖和分化。IL-11于1997年被美国FDA批准用于辐射损伤的治疗[27]。研究表明,辐射损伤可以引起造血干细胞/祖细胞凋亡,在3~7 Gy剂量范围的全身照射时,由于HSPC 的大量死亡,细胞因子的应用受到一定限制,使得血细胞生成夭折于起始阶段。联合使用多种细胞因子对辐射损伤后HSPC的生长增殖起到重要作用。Drouet等[28]研究表明,多种细胞因子联合使用,能有效减少辐射诱发的HSPC 凋亡,改善残存HSPC 的造血功能。研究发现,给予混合细胞因子治疗受照射的猕猴,可以有效缓解HSPC 死亡,刺激造血功能恢复[29]。
2.2 间充质干细胞
间充质干细胞是干细胞的一种,具有多向分化潜能,体外诱导可以分化成外胚层、中胚层和内胚层细胞。最早见于骨髓,随后还发现其存在于多种组织中。由于MSC 的骨髓来源存在诸多问题,迫切需要寻找其他来源的MSC。Erices等[30]发现脐带血可以分离出一种细胞,表达MSC 相关的一些表面分子。后来发现脐带血中MSC 的含量较低,且脐血MSC 的分离过程会损失脐血造血干细胞,影响新生儿脐血冻存[31]。最近研究表明,脐带中存在大量的MSC,并以其来源广泛、无创伤、增殖能力强等特点明显优于骨髓[32]。
急性放射损伤患者最主要的表现是骨髓造血干细胞/祖细胞的缺乏和造血微环境的破坏,这种造血功能抑制贯穿于放射损伤的始终。因此,保存并促进残存干细胞的增殖、 改善造血微环境是减轻辐射引起造血功能损伤的关键因素。MSC 可以分泌多种造血相关因子,如IL-6、Flt-3L、SCF、G-CSF 和GM-CSF 等,输入MSC 后可以补充辐射所致的体内细胞因子相对不足。因此MSC 可能会改善和修复辐射引发的骨髓基质细胞和造血微环境的损伤,利于造血重建。Shi等[33]将MSC 移植到致死剂量照射的小鼠模型,发现其可以改善造血功能恢复,虽然其机制仍不清楚,但是表明植入的MSC可以参与骨髓的造血。造血干细胞对于急性辐射骨髓损伤的治疗效果显而易见,但是严格的骨髓配型及严重的移植抗宿主病限制造血干细胞的应用。研究发现,MSC 可以通过一些细胞因子、生长因子或某些受体有效抑制T 细胞活化及增殖,而同时MSC还可以分化成造血干细胞,直接参与骨髓造血。因此,MSC对于辐射诱发ARS更加有效[34]。
3 总结及展望
电离辐射易影响人体造血和免疫系统,0.5 Gy以上的剂量照射会造成免疫系统抑制。大剂量电离辐射损伤诱发的ARS 是一个涉及血液、心血管、神经和胃肠系统的综合症。ARS的支持治疗主要为药物止吐、止痛,输血、输体液等营养补充和感染防治。目前临床上仍然缺乏理想的抗辐射药物[35],因此,寻找广谱性、高效性、低毒性的新型辐射防护和辐射治疗药物,将植物和中草药作为放射保护剂、细胞因子和干细胞作为治疗剂的联合治疗策略将在研究和应用中显示出巨大的优势和潜力[36-37]。
[1] Balentova S, Adamkov M. Molecular, cellular and functional effects of radiation-induced brain injury: a review[J]. Int J Mol Sci, 2015, 16(11): 27796-27815.
[2] Dainiak N. Rationale and recommendations for treatment of radiation injury with cytokines[J]. Health Phys, 2010, 98(6): 838-842.
[3] 李明,王立升,罗庆良.间充质干细胞在急性辐射损伤治疗中的应用前景[J].中国实验血液学杂志,2007,15(4):905-908.
[4] 赵斌,张军帅,刘培勋.辐射防护剂研究现状及其进展[J].核化学与放射化学,2012,34(1):8-13.
[5] Patt H M, Tyree E B, Straube R L, et al. Crysteine protection against X irradiation[J]. Science, 1949, 110: 213-214.
[6] Dixon R A, Ferreira D. Genistein[J]. Phytochemistry, 2002, 60(3): 205-211.
[7] Zhou Y, Mi M T. Genistein stimulates hematopoiesis and increases survival in irradiated mice[J]. J Radiat Res, 2005, 46(4): 425-433.
[8] Katoh H, Ishikawa H, Hasegawa M, et al. Protective effect of urinary trypsin inhibitor on the development of radiation-induced lung fibrosis in mice[J]. J Radiat Res, 2010, 51(3): 325-332.
[9] Martin M, Lefaix J, Delanian S. TGF-beta1 and radiation fibrosis: a master switch and a specific therapeutic target?[J]. Int Radiat Oncol, 2000, 47(2): 277-290.
[10]Agrawala P K, Adhikari J S. Modulation of radiation-induced cytotoxicity in U 87 cells by RH-3 (a preparation of hippophaerhamnoides)[J]. Indian Journal of Medical Research, 2009, 130(5): 542-549.
[11]Cakir A. Essential oil and fatty acid composition of the fruits of hippophaerhamnoides L (sea buckthorn) and myrtuscommunis L from Turkey[J]. Biochem Syst Ecol, 2004, 32: 809-816.
[12]Geetha S, Ram M S, Sharma S K, et al. Cytoprotective and antioxidant activity of seabuckthorn (hippophaerhamnoides L.) flavones against tert-butyl hydroperoxide-induced cytotoxicity in lymphocytes[J]. J Med Food, 2009, 12(1): 151-158.
[13]Goel H C, Agrawal P K, Pathania V, et al. Immunomodulatory and cytoprotective role of RP-1 in gamma inradiated mice[J]. Mol Cell Biochem, 2003, 254(1-2): 73-81.
[14]Leskinen H M, Suomela J P, Yang B, et al. Regioisomer compositions of vaccenic and oleic acid containing triacylglycerols in sea buckthorn (hippophaerhamnoides) pulp oils: influence of origin and weather conditions[J]. J Agr Food Chem, 2010, 58(1): 537-545.
[15]Li Y, Cao Z, Zhu H. Upregulation of endogenous antioxidants and phase 2 enzymes by the red wine polyphenol, resveratrol in cultured aortic smooth muscle cells leads to cytoprotection against oxidative and electrophilic stress[J]. Pharmacological Research, 2006, 53(1): 6-15.
[16]Carsten R E, Bachand A M, Bailey S M, et al. Resveratrol reduces radiation-induced chromosome aberration frequencies in mouse bone marrow cells[J]. Radiat Res, 2008, 169(6): 633-638.
[17]Ye K, Ji C B, Lu X W, et al. Resveratrol attenuates radiation damage in caenorhabditiselegans by preventing oxidative stress[J]. J Radiat Res, 2010, 51(4): 473-479.
[18]Karkos P D, Leong S C, Karkos C D, et al. Spirulina in clinical practice: evidence-based human applications[J]. Evidence-based Complementary and Alternative Medicine, 2010, 2011(1): 1-4.
[19]Loseva L P, Dardynskaya I V. Spirulina-natural sorbent of radionucleides[C]∥6th Intl Congress of Applied Algology. Minsk: Research Institute of Radiation Medicine, 1993.
[20]Zhang H Q, Lin A P, Sun Y, et al. Chemo- and radio-protective effects of polysaccharide of spirulina platensis on hemopoietic system of mice and dogs[J]. Acta Pharmacol Sin, 2001, 22(12): 1121-1124.
[21]Hayashi O, Ono S, Ishii K, et al. Enhancement of proliferation and differentiation in bone marrow hematopoietic cells by spirulina (arthrospira) platensis in mice[J]. J Appl Phyco, 2006, 18: 47-56.
[22]Belay A. The potential application of spirulina (arthrospira) as a nutritional and therapeutic supplement in health management[J]. J Am Stat Assoc, 2002, 5: 27-48.
[23]Dainiak N, Waselenko J K, Armitage J O, et al. The hematologist and radiation casualties[J]. Hematology, 2003, 2003(1): 473-496.
[24]Moulder J E. Post-irradiation approaches to treatment of radiation injuries in the context of radiological terrorism and radiation accidents: a review[J]. Int J Radiat Biol, 2004, 80(1): 3-10.
[25]Waselenko J K, MacVittie T J, Blakely W F, et al. Medical management of the acute radiation syndrom: recommendations of the strategic national stockpile radiation working group[J]. Ann Intern Med, 2004, 140(12): 1037-1051.
[26]Hérodin F, Drouet M. Cytokine-based treatment of accidentally irradiated victims and new approaches[J]. Exp Hematol, 2005, 33(10): 1071-1080.
[27]Yi Z, Zhang Z H, Zhai S D, et al. Clinical application and advance of radiation protection and radiation treatment agents[J]. Chin J Drug Appl Monit, 2009, 6: 239-242.
[28]Drouet M, Mourcin F, Grenier N, et al. Single administration of stem cell factor, FLT-3 ligand, megakaryocyte growth and development factor, and interleukin-3 in combination soon after irradiation prevents nonhuman primates from myelosuppression: long-term follow-up of hematopoiesis[J]. Blood, 2004, 103(3): 878-885.
[29]刘建功,郭万龙,张淑贤,等.间充质干细胞在急性辐射损伤治疗中的作用综述[J].辐射研究与辐射工艺学报,2010,28(3):134-137.
[30]Erices A, Conget P, Minguell J J, et al. Mesenchymal progenitor cells in human umbilical cord blood[J]. 2000, 109(1): 235-242.
[31]Musina R A, Bekchanova E S, Belyavskii A V, et al. Umbilical cord blood mesenchymal stem cells[J]. Bull Exp Biol Med , 2007, 143 (1): 127-131.
[32]Wang L M, Tran I, Seshareddy K, et al. A comparison of human bone marrow-derived mesenchymal stem cells and human umbilical cord-derived mesenchymal stromal cells for cartilage tissue engineering[J]. Tissue Engineering, 2009, 15(8): 1-8.
[33]Shi M X, Li J, Liao L M, et al. Regulation of CXCR4 expression in human mesenchymal stem cells by cytokine treatment: role in homing efficiency in NOD/SCID mice[J]. Haematologica, 2007, 92(7): 897-904.
[34]Kemp K C, Hows J, Donaldso D C. Bone marrow-derived mesenchymal stem cells[J]. Leukemia and Lymphoma, 2005, 46(11): 1531-1544.
[35]Dainiak N. Rationale and recommendations for treatment of radiation injury with cytokines[J]. Health Phys, 2010, 98(6): 838-842.
[36]Arora R, Gupta D, Chawla R, et al. Radioprotection by plant products: present status and future prospects[J]. Phytotherapy Research, 2005, 19(1): 1-22.
[37]Jagetia G C. Radioprotective potential of plants and herbs against the effects of ionizing radiaton[J]. J Clin Biochem Nutr, 2007, 40(2): 74-81.
Recent Advances in Radioprotector and Radiation Treatment Agents Research
LIU Hong-yan, LIU Jian-gong, DANG Xu-hong, ZHANG Zhong-xin,ZHANG Hui-fang, ZUO Ya-hui, DUAN Zhi-kai
China Institute for Radiation Protection, Taiyuan 030006, China
With the rapid development of the nuclear industry widespread application of nuclear technology, the opportunity of person exposure to ionizing radiation is increasing. So much focus on radioprotector and radiation treatment agents. However, no ideal radioprotector and radiation treatment agents are available at present. Researchers attempted to find some effective approaches to protect and treat humans against such effects of ionizing radiation. This review mainly dwell on the radioprotective potential of chemicals, plant and herbs as well as cytokine, stem cell and their application prospects in radiation protection. Several chemical compounds and their analogues have been screened for their radioprotective ability, however, their high toxicity at optimum protective doses precluds their clinical use. The plant and natural products are usually less toxic, relatively cheap, can be orally administered and can act through multiple mechanisms due to the presence of many activated chemicals. Cytokine therapy is the main strategy capable of preventing or reducing the acute radiation syndrome (ARS), however, use of cytokines should be restricted, because ARS is a global illness that requires treatment of damages to all damage tissues. MSC is a promising approach developed in the laboratory, which is of great therapeutic potential due to their capacity, including secretion of hematopoietic cytokine, reconstruction hemopoietic microenvironment, poor-immunogenicity, ease of reception ectogenic gene transfection and expression. Concerted application of plant and herbs as radioprotectors and MSC as radiation treatment agents may be a promising approach in the future.
ionizing radiation; radiation injury; radioprotector; radiation treatment agents
2015-05-29;
2015-12-03
刘红艳(1985—),女,湖南常德人,助理研究员,从事放射医学与环境研究
TL752
A
0253-9950(2016)06-0321-06
10.7538/hhx.2016.YX.2015044
