锶污染土壤中耐锶菌株的筛选
2016-12-30赵雅平张生栋陈晓明丁有钱
赵雅平,张生栋,*,陈晓明,丁有钱,宋 游,张 燕
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.西南科技大学 核废物与环境安全重点实验室,四川 绵阳 621010
锶污染土壤中耐锶菌株的筛选
赵雅平1,张生栋1,*,陈晓明2,丁有钱1,宋 游1,张 燕1
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.西南科技大学 核废物与环境安全重点实验室,四川 绵阳 621010
通过固体培养基平板中锶的梯度变化,从某锶污染土壤中筛选出了26株细菌和20株放线菌。在含锶的液体培养基中,按照细菌对锶的吸附率和耐受性不同,对细菌和放线菌开展了进一步的筛选,并得到了四株对锶有较好耐受性的细菌。四株菌在24 h内的生长倍数超过30倍,对锶的吸附率皆超过20%。它们的最佳生长条件为pH=6.0~7.5、温度为20~40 ℃、锶初始质量浓度在0~2.0 g/L范围内。微生物的16S rDNA鉴定结果表明这四株菌皆为芽孢杆菌属。
污染土壤;耐锶性;细菌
自20世纪中叶以来,全球范围内多次的核试验和核事故,使放射性核素不可避免地进入到了环境(大气、水体和土壤)中。其中,核素90Sr半衰期长,在环境和生态中均有较大的迁移性,能够快速通过土壤而进入地下水中。Sr的化学性质与生命必需元素Ca相似,是典型的亲骨性元素,进入人体后,超过99%的90Sr会滞留于骨骼和牙齿中,易引起三致(致畸、致癌、致突变)变化[1]。
通常,受到放射性污染的土壤,可以根据放射性核素浓度的强弱、环境化学特性、沉积特性以及放射性半衰期的长短等特点,采用不同的方法去除其中的放射性核素[2]。在低放射性污染土壤的治理中,包括植物修复[3-4]、微生物修复[1,5-6]及其联合修复[7-8]的生物修复法越来越受到重视,尤其是微生物修复法是真正意义上的“绿色修复技术”。微生物修复土壤的机理主要是指微生物通过络合、沉积、氧化、还原、甲基化和脱甲基化等作用吸收和转化重金属,一方面可以减缓或阻碍重金属在土壤中的扩散和迁移,另一方面可以改变金属毒性,从而形成对重金属的解毒机制,以实现对污染土壤修复的目的。
放射性核素与微生物的相互作用研究已取得了一些重要进展[5,9-10],但是寻找和筛选对目标放射性核素有抗性并具有较强吸收能力的微生物仍是一个十分重要的研究方向。已有研究表明,对核素90Sr有吸附作用的微生物包括细菌[11-12]、酵母[13-14]、真菌[15]和藻类[16]等。Ngwenya等[11]利用硫酸盐还原菌(SRB) 提取核电站废水中的Sr,结果表明,厚度0.2 μm的细胞膜可吸附大约65%的Sr2+。Khani等[17]研究了死菌体Aspergillus terreus对废水中锶离子的吸附,最大吸附容量可达406 mg/g。
本工作拟从某锶加工厂附近的污染土壤中提取、分离和纯化出若干株耐锶细菌和放线菌,并通过进一步的筛选得到对锶有较高耐受性和吸附性的细菌菌株,同时进行菌株的鉴定与特定条件下菌株的生长行为研究,为进一步开展耐锶菌株对放射性90Sr的吸附研究提供支持。
1 实验部分
1.1 试剂和仪器
土壤样品,锶污染土壤来自某地锶加工厂附近0~15 cm深度的表层污染土壤,按照五点法取样,之后将土壤样品混合。培养基:(1) LB细菌培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,琼脂粉 15~20 g,加水至1 000 mL,pH=7.0~7.2;(2) 高氏放线菌培养基: 可溶性淀粉20 g,KNO31.0 g, NaCl 0.5 g,K2HPO4·3H2O 0.5 g, MgSO4·7H2O 0.5 g, FeSO4·7H2O 0.01 g,琼脂 20.0 g,加水至1 000 mL, pH=7.2~7.4。硝酸锶,分析纯,西陇化工股份有限公司。
ZWY-2102C型全温度恒温培养振荡器,上海智城分析仪器制造有限公司;GHP-9270型隔水式恒温培养箱,上海一恒科学仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;AC-CS12型垂直流双面操作洁净工作台,北京世安科林净化技术有限公司;TGL-10C型高速台式离心机,上海安亭科学仪器厂;DHG-9240A型电热鼓风干燥箱,上海一恒科学仪器有限公司;能量色散X射线荧光光谱仪,25 mm2SDD探测器,中国原子能科学研究院;JEM-6360LV型扫描电镜,日本日立公司JEOL公司。
1.2 实验方法
1.2.1 土壤的理化性质测定 实验中称取三份土壤样品,烘干后用恒重法测量土壤中的含水率,之后将样品放入马弗炉灼烧,并计算有机相损失率。灼烧后的样品研磨至粉末状,用X-射线荧光法测其中的化合物含量。称5 g土壤至25 mL蒸馏水中,150 r/min、振荡30 min后测定其pH值。
1.2.2 土壤中微生物的分离、初筛和纯化方法 称取5.0 g土壤,加入到45 mL带玻璃珠的灭菌蒸馏水中,并置于150 r/min、37 ℃的振荡培养箱中培养4 h。稀释土壤液为10-1、10-2和10-3三个梯度的土壤悬液[18]。分别涂布0.1 mL土壤悬液到细菌和放线菌的固体培养基平板上,平行样3个。细菌和放线菌固体培养基中硝酸锶的质量浓度分别为0、0.1、0.2、0.5、1.0、2.0 g/L。待菌生长出来后,挑取单个的菌,反复进行三线式培养纯化,直至获得纯培养菌株,分别接种于LB和高氏培养基斜面上,4 ℃冰箱保存。
1.2.3 耐锶细菌菌株的复筛 将纯培养的细菌菌株接种于50 mL的液体LB细菌培养基中,150 r/min和37 ℃条件下培养过夜,之后通过测定600 nm处的吸光度值(optical density 600, OD600)的办法,配制出OD600值为0.8的种子液。配制种子液菌量为10%(体积分数)、锶质量浓度为2.0 g/L的菌液100 mL,置于150 r/min、37 ℃的培养箱中培养24 h。实验0时刻和24 h后分别取样,用测光密度的方法测菌浓度。将菌液在8 000 r/min条件下离心5 min后取上清液,并稀释25倍后用X射线荧光法分析其中的锶浓度。
1.2.4 耐锶放线菌菌株的复筛 将纯培养的菌株接种于50 mL的放线菌培养基中,150 r/min和33 ℃条件下培养72 h。配制含0.03 g/L菌量、锶质量浓度为2.0 g/L的菌液100 mL,置于150 r/min、33 ℃的培养箱中培养96 h。实验0时刻和96 h后分别取样,菌液在75 ℃干燥箱中烘干至恒重,通过测菌干重的方法确定放线菌的生长量,锶浓度的测量同1.2.3节。
1.2.5 耐锶菌株生长曲线的测定 分别加OD600为0.8的种子液10 mL到四份90 mL 的LB空白培养基中,在37 ℃、150 r/min条件下培养。每隔一定的时间取出样品4 mL测其中的菌浓度。实验中的取样时间分别为30 min、1、3、5、7、9、11、13、24、33.5、48、57、72、81、96、144 h。
1.2.6 不同pH条件下耐锶菌株的生长实验 将液体LB培养基分别配制pH为2、4、6、7和8的体系。实验中配制菌液10%、锶质量浓度为2.0 g/L的样品100 mL,在37 ℃、150 r/min条件下培养24 h。0时刻和24 h后,分别取样分析其中的菌浓度,方法同1.2.3节。
1.2.7 不同温度下耐锶菌株的生长实验 配制菌量为10%、锶质量浓度为2.0 g/L的样品100 mL,分别在不同温度条件下,即10、20、37、45 ℃,150 r/min的条件下进行24 h的菌株生长实验。0时刻和24 h后,分别取样分析其中的菌浓度,方法同1.2.3节。
1.2.8 不同初始锶浓度下耐锶菌株的生长实验 配制菌量为10%,初始锶质量浓度分别为0、2.0、4.0、6.0、8.0、10.0 g/L 的菌液100 mL,在37 ℃,150 r/min条件下培养24 h。0时刻和24 h后,分别取样分析其中的菌浓度,方法同1.2.3节。
1.2.9 菌株的鉴定和系统发育树的构建 将试管斜面上培养的菌株委托上海生工生物工程技术服务有限公司进行核酸序列的测定,将所测得的16S rDNA序列与GenBank数据库中的已知菌株的16S rDNA序列进行搜索,选取同源性较高的典型菌株的16S rDNA序列作为参比对象,再用CLUSTALX软件进行多序列比对并计算供试菌株与参与菌株之间的序列相似性,通过MEG4.0软件构建供试菌与参比菌之间的系统发育树。
1.2.10 扫描电镜样品的制备与测量 将菌体放入3%(体积分数)的戊二醛固定液中,室温固定24 h;用磷酸缓冲液漂洗样品3~4次,之后用1%的锇酸溶液固定2 h;再用磷酸缓冲液、不同体积分数梯度的乙醇溶液(30%、50%、70%、80%、90%、100%)对样品进行脱水处理;脱水后的样品放入醋酸异戊酯中;最后样品经临界点法干燥;喷金镀膜后,即可观察。
2 结果和讨论
2.1 土壤的理化性质
土壤类型为紫色土壤。称重法分析表明,土壤含水率为11.2%,有机相和易挥发成分含量为7.5%,土壤酸度为pH=6.4,为偏酸性土壤。用X射线荧光法分析土壤中的主要化合物成分列入表1。由表1可知,每克土壤中元素锶的含量为6.2 mg,这比天然土壤中锶的平均含量0.3 mg/g要高了约20倍。
表1 土壤中的主要成份和含量
Table 1 Main composition and content in the soil

化合物w/%化合物w/%SiO266.54Al2O315.27Fe2O311.44K2O3.26TiO21.52CaO0.69SrO0.60MgO0.25SO30.11BaO0.11
土壤的pH值、水分、空气、温度、团聚体、矿质元素和有机质等因素都会影响土壤中菌种的活性和稳定性。其中pH 值和有机质是比较关键的两个因素,前者影响微生物活性,后者是微生物的营养源,同时土壤pH 值又会对有机质有影响进而干扰土壤微生物的活性。一般来说,pH值在中性范围内时土壤微生物活性最强,在强酸性或强碱性范围内其活性受到限制[19]。本工作中的土壤为弱酸性土壤,其中锶含量较高,说明其中生长的微生物都是耐弱酸并对锶元素有一定耐受性的菌种。
2.2 菌株的分离和纯化
将土壤悬液涂布在含锶的平板上,细菌生长4 d、放线菌生长14 d后,观察平板上菌株的生长情况。结果表明,随着固体培养基中锶浓度的增加,菌落变得干燥,面积或体积减小的趋势很明显,说明由于培养基中锶含量的增加,抑制了细菌或放线菌的生长;同时也提供了其它耐锶菌株生长的空间,因此有些种类的菌株开始在含较高锶浓度的平板上出现。选取在锶质量浓度0.5 g/L以后出现在平板上的菌作为耐锶的优势菌进行三线式培养,经过反复纯化,最终得到细菌26株、放线菌20株。
细菌的特点是表面光滑、湿润,菌液呈粘状,颜色以乳黄、乳白或半透明为主,形状是圆形或不规则形状,多以扁平为主,少部分是凸起或山包状。放线菌表面干燥,呈粉末状居多,也有茸毛状,菌落上多有射线状纹路,或周边有齿状,形状有圆形或不规则形状,有凸起,立体感强,颜色有白色、乳黄、亮黄、黑色、绿色等多种颜色。
2.3 土壤菌株的耐锶性筛选
2.3.1 细菌的复筛 实验中,将培养24 h的菌液取样分析,以得到过程中菌的浓度生长情况和对锶的吸附效果。26株细菌在24 h前后菌浓度的生长变化和对锶的吸附率结果示于图1、2。图1显示26株细菌在2.0 g/L的锶溶液中培养24 h后,菌浓度的增长倍数超过30倍的有6种:L4、L6、L10、L14、L16和L18。图2表明,在以上的6种菌中对锶的吸附率相对较高的菌为L4、 L10、L14和L18,吸附率分别为26.0%、24.0%、24.1%和17.7%。
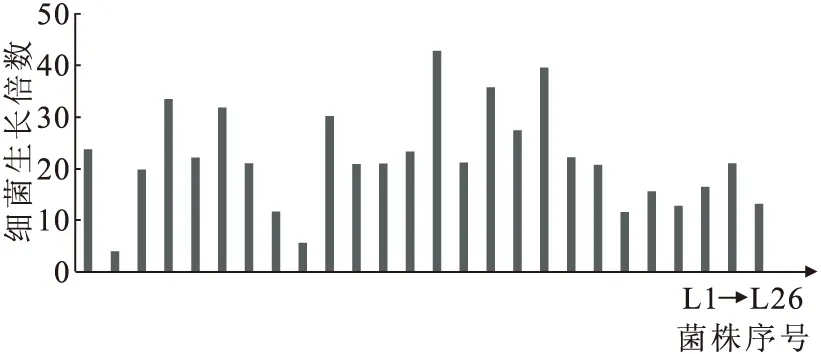
ρ0(Sr)=2.0 g/L图1 细菌生长24 h后菌浓度的增长倍数Fig.1 Magnification of bacteria concentrations in 24 h

图2 细菌生长24 h后对锶的吸附率Fig.2 Adsorption rate of Sr with the growth of bacteria in 24 h
2.3.2 放线菌的复筛 放线菌是在34 ℃的振荡培养箱中培养96 h,作为一个生长周期。培养前后菌浓度生长倍数和对锶的吸附率的结果示于图3、4。由图3、4可知,在20种放线菌中,菌浓度增长倍数最大的菌是G12,增长了28倍;对锶吸附率最大的菌是G3,吸附率为12%。

图3 放线菌生长96 h后菌的增长倍数Fig.3 Magnification of actinomyces concentrations in 96 h

图4 放线菌生长96 h后对锶的吸附率Fig.4 Adsorption rate of Sr with the growth of actinomyces in 96 h
从以上对细菌和放线菌的筛选结果来看,细菌相对于放线菌有较好的生长速率和对锶更高的吸附率。尤其菌株L4、 L10、L14和L18在2.0 g/L的锶溶液中,生长势态良好,对锶既有较高的耐受性也有较大的吸附率。因此,最终选择菌株L4、L10、L14和L18为有较好锶耐受性的菌株。
2.4 菌株的生长曲线
在150 h内分别跟踪了菌株L4、L10、L14和L18的生长情况,结果示于图5。由图5可知:在细菌生长的前12 h,是指数增长期,之后生长速率放慢;在生长的33 h附近,体系中菌浓度达到最大,之后菌的生长到达平台期或消亡期。四株菌株中,L14 繁殖速率快,菌的生命周期也较长;L4和L10的生长速率虽然不同,但它们的生长过程很近似,几乎同步时间到了菌浓度最大处,之后菌浓度逐渐减少;L18最先到达生长浓度最大值,凋亡速率也是明显快于其它几株菌。

▲——L4,*——L10, ■——L14,●——L18图5 菌株L4、L10、L14和L18的生长曲线图Fig.5 Magnification of bacteria concentration of L4, L10, L14 and L18 strains
2.5 不同pH条件下耐锶菌株的生长
不同初始pH条件下,各个菌株在含锶的培养基中培养24 h后,菌浓度的生长倍数示于图6。由图6可知:在pH=2.0和pH=4.0的初始酸度条件下,菌株几乎不生长;在pH=6.0和pH=8.0的初始条件下,菌的生长受到抑制;在pH为6.0~7.5范围内为菌的最佳生长条件。
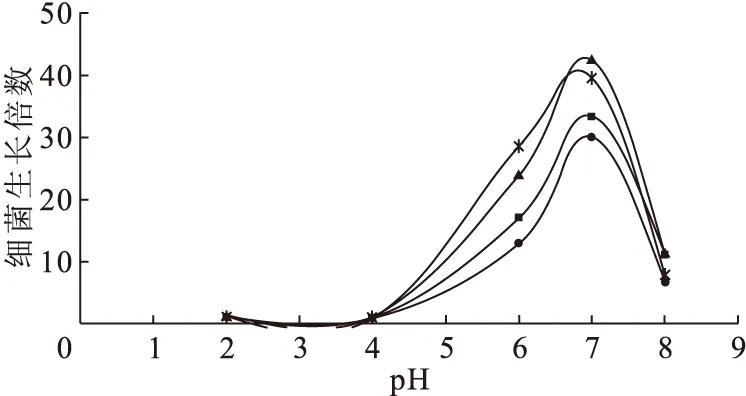
■——L4,●——L10,▲——L14,*——L18图6 在不同初始pH值时细菌培养24 h后的生长倍数Fig.6 Magnification of bacteria concentration after 24 h in different initial pH values
不同的微生物都有自己最合适的生长酸范围。微生物生长的pH环境会影响培养基中营养物质的离子化程度,进而影响营养物质的吸收,从而导致菌种的生长活性。在生物吸附过程中,pH会影响微生物膜表面电荷的性质及膜的通透性,影响生物官能团的活性和金属离子间的竞争,是影响生物吸附的最重要条件。
2.6 不同温度下耐锶菌株的生长
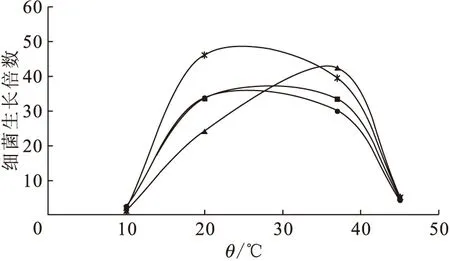
■——L4,●——L10,▲——L14,*——L18图7 不同温度下细菌培养24 h后的生长倍数Fig.7 Magnification of bacteria concentration after 24 h at different temperatures
不同实验温度下,各个菌株在含锶的培养基中培养24 h后,菌浓度的生长倍数示于图7。由图7可知,这四株菌在小于20 ℃和高于40 ℃的生长环境里,生长速率严重受阻,以至于在10 ℃和45 ℃的环境里会快速死亡,说明这四株菌都不耐低温和高温。
温度是影响微生物生长的最重要因素之一。通常,温度变化会影响酶促反应速率,即影响酶活性。同时温度影响细胞膜的流动性,温度高流动性大,有利于物质的运输;温度低,不利于物质运输,因此温度的变化会影响营养物质的吸收与代谢产物的分泌。这些都是最终影响细胞的合成和繁殖的重要因素。在微生物中,有一类是嗜冷或嗜热微生物,这与它们体内存在耐冷或耐热的酶、核酸或脂肪含量等有关。
2.7 不同初始锶浓度下耐锶菌株的生长
培养基体系中初始锶浓度不同时,24 h后各菌株菌浓度的变化示于图8。由图8可知,当体系中锶的初始质量浓度为2.0 g/L时,对菌生长的抑制作用很小;随着初始锶浓度的增加,抑制效应越来越明显;尤其当初始锶质量浓度大于8 g/L时,各个菌都停止生长。通过趋势的变化可以发现,虽然菌株L14和L18在低浓度锶(<2.0 g/L)时生长的很旺盛,但当锶浓度增大,两种菌株的生长则很快停滞;相比来说,菌株L4对大浓度锶则更有耐受性。
2.8 耐锶菌株的16S rDNA 全序列测定及系统发育树分析
16S rDNA普遍存在于原核生物细胞之中,为蛋白质合成的必要场所,其生理功能重要而恒定。细菌的16S rRNA结构的保守性能够反映生物物种的亲缘关系,为系统发育重建提供线索,16S rDNA可以通过PCR法扩增获得,从而得到菌株DNA序列的碱基对谱图。
将得到的菌株L4、L10、L14和L18的DNA序列与GenBank数据库中的BLASTN核酸序列查询库中的序列比较,结果显示,这四株菌的16S rDNA与芽孢杆菌属菌株的16S rDNA的序列高度同源。用CLUSTAL X选取同源性较高的典型菌株的序列进行相似性分析,最后得到了4株菌的生长发育树结构示于图9。由图9可知,菌株L4、L14 与L18在同一支,它们的同源性更为紧密一些。菌株L4 与蜡状芽孢杆菌亚种NR 121761、苏云金芽孢杆菌NR 043403的进化距离最为接近,同源性可达99%。菌株L10与沙芬西芽孢杆菌KM 817280、短小芽孢杆菌KC692169的进化同源性也达到99%。

(a)——L4,(b)——L10,(c)——L14,(d)——L18图8 不同初始锶浓度下各个菌株的生长情况Fig.8 Magnification of bacteria concentration in different initial concentration of Sr

图9 菌株L4、L10、L14和L18的16S rDNA系统发育树状图Fig.9 Phylogenetic tree based on 16S rDNA sequence of bacteria strain L4, L10, L14 and L18
2.9 菌株的形貌观察
菌株L4、L10、L14和L18的扫描电镜结果示于图10。由图10可知,菌株L4、L10和L18是柱状形貌,并且菌生长到一定程度会自行分裂为若干短柱状菌体,因此长度为1~10 μm不等;菌株L14也是由长菌体逐级分裂成的,但菌体形貌更为圆润,为椭圆形,长度上也较短。
3 结 论
(1) 从锶污染土壤中分离、纯化及筛选出了四株有较高耐锶性及对锶吸附率较好的菌株:L4、L10、L14、L18。
(2) 四个耐锶菌株在纯的培养基体系中的指数生长期为0.5 d,最大菌浓度出现在1.5 d。在含锶体系中,四个菌株的最佳生长条件为pH=6.0~7.5、温度为20~40 ℃、锶初始质量浓度在0~2.0 g/L。
(3) 四株菌的16S rDNA的全序列测序及系统发育树分析结果表明,它们都属于芽孢杆菌属,形貌观察结果表明它们都是柱状菌。
[1] 孙赛玉,周青.土壤放射性污染的生态效应及生物修复[J].中国生态农业学报,2008,16(2):523-528.
[2] 喻名德,杨春才.核试验场及其治理[M].北京:国防工业出版社,2007.
[3] 袁世斌.生物技术在放射性污染土壤修复中的研究进展[J].生物技术通讯,2008(Suppl):121-125.
[4] 田军华,曾敏,杨勇,等.放射性核素污染土壤的植物修复[J].四川环境,2007,26(5):93-96.
[5] 王建龙,陈灿.微生物还原放射性核素研究进展[J].核技术,2006,29(4):286-290.
[6] 王建龙.微生物与铯的相互作用及其在放射性核素污染环境修复中的应用潜力[J].核技术,2003,26(12):949-955.
[7] Entry J A,Watrud L S, Reeves M. Accumulation of137Cs and90Sr from contaminated soil by three grass species inoculated with mycorrhizal fungi[J]. Environ Pollut, 1999, 104(3): 449-459.

(a)——L4,(b)——L10,(c)——L14,(d)——L18图10 菌株的扫描电镜图(×10 000)Fig.10 SEM of four bacteria(×10 000)
[8] 袁世斌,周婷.硫杆菌对污染土壤中锶-90 溶出的影响[J].湿法冶金,2010,29(3):203-205.
[9] Mohapatra B R, Dinardo O, Gould W D, et al. Biochemical and genomic facets on the dissimilatory reduction of radionuclides by microorganisms: a review[J]. Miner Eng, 2010, 23: 591-599.
[10]Das N. Remediation of radionuclide pollutants through biosorption: an overview[J]. Clean-Soil, Air, Water, 2012, 40(1): 16-23.
[11]Ngwenya N, Chirwa E M N. Biological removal of cationic fission products from nuclear wastewater[J]. Water Sci Technol, 2011, 63(1): 124-128.
[12]代群威.辐照条件下模拟放射性核素Sr2+的微生物吸附研究[D].绵阳:中国工程物理研究院,2011.
[13]张伟.微生物对核素锶离子吸附行为研究[D].绵阳:西南科技大学,2007.
[14]Avery S V, Tobin J M. Mechanisms of strontium uptake by laboratory and brewing strains of saccharomyces cerevisiae[J]. Appl Environ Microb, 1992, 58(12): 3883-3889.
[15]Parekh N R, Poskitt J M, Dodd B A, et al. Sanchez, soil microorganisms determine the sorption of radionuclides within organic soil systems[J]. J Environ Radioact, 2008, 99(5): 841-847.
[16]李梅,徐瑾,刘志礼,等.锶诱导的氧化胁迫对叉鞭金藻(Dicrateria inornata)的影响[J].海洋与湖沼,2004,35(5):467-472.
[17]Khani M H, Pahlavanzadeh H, Alizadeh K. Biosorption of strontium from aqueous solution by fungus Aspergillus terreus[J]. Environ Sci Pollut Res, 2012, 19: 2408-2418.
[18]沈萍,范秀荣,李广斌.微生物学实验[M].北京:高等教育出版社,2001.
[19]黄瑞农编著.环境土壤学[M].北京:高等教育出版社,1994.
Screening of Microorganism From Contaminated Soil
ZHAO Ya-ping1, ZHANG Sheng-dong1,*, CHEN Xiao-ming2,DING You-qian1, SONG You1, ZHANG Yan1
1.China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China;2.Nuclear Wastes and Environmental Safety Laboratory,Southwest University of Science and Technology, Mianyang 621010, China
Through the method of changing Sr concentration in solid medium gradually, 26 strains bacteria and 20 strains actinomyces were isolated from the strontium contaminated soil. Four strains of strontium-resistance bacteria have been selected by the further studies in liquid culture. Magnifications of four bacteria concentration are all more than 30 times and adsorption rates of Sr are more than 20%. The study results show that the bacteria’s optimum growth condition are pH=6.0-7.5,θ=20-40 ℃,ρ0(Sr)=0-2.0 g/L. Identification results show that the microorganism are all subject to Bacillus according to analysis results of 16S rDNA.
contaminated soil; strontium-resistance; bacteria
2015-04-16;
2015-05-13
赵雅平(1977—),女,甘肃兰州人,博士,副研究员,核燃料循环与材料专业
*通信联系人:张生栋(1966—),男,甘肃景泰人,研究员,核燃料循环与材料专业,E-mail: zhangsd@ciae.ac.cn
X591
A
0253-9950(2016)06-0371-07
10.7538/hhx.2016.YX.2015031
