骨髓间充质干细胞细胞周期同步化的方法及对向神经细胞分化的影响①
2016-12-29李曼丽赵文高钰丹段红梅杨朝阳李晓光
李曼丽,赵文,高钰丹,段红梅,杨朝阳,李晓光,
骨髓间充质干细胞细胞周期同步化的方法及对向神经细胞分化的影响①
李曼丽1,赵文2,高钰丹2,段红梅1,杨朝阳2,李晓光1,2
目的分析不同处理条件下细胞同步化于G0/G1时期的效果以得到最佳的同步化条件,并研究同步化对骨髓间充质干细胞(BMSCs)在碱性成纤维细胞因子(bFGF)的作用下分化为神经细胞的影响。方法分离培养成年大鼠BMSCs,5%、1%、0.5%、0.1%、0胎牛血清(FBS)分别处理24 h、48 h。PI染色后经流式细胞仪检测细胞周期各时相细胞所占比例,与正常培养条件(10%FBS)处理下对比。得到最佳处理条件后,bFGF处理3 d、7 d,免疫荧光细胞化学方法检测Nestin和Tuj-1的表达。结果成年大鼠BMSCs原代提取,经传代后,细胞形态为长梭形。不同处理条件下G1/G0期细胞比例均高于正常培养条件,1%FBS处理48 h时G1/G0期细胞比例为(94.274±0.468)%,达最高峰(F=39.91,P<0.001)。bFGF诱导3 d后,细胞周期同步化后的Nestin+细胞数显著高于未同步化的细胞数[(80.3±2.4)%vs.(12.1±1.5)%](F=28.25,P<0.001);bFGF诱导7 d后,同步化后的Tuj-1+细胞数显著高于未同步化的细胞数[(74.8±3.2)%vs.(19.3±2.5)%](F=17.95,P<0.001)。结论1%FBS处理48 h是将BMSCs同步化于G0/G1期的最佳条件。细胞周期同步化于G0/G1期能够提高BMSCs向神经细胞分化的比例。
骨髓间充质干细胞;细胞周期;同步化;血清饥饿法;神经分化;大鼠
[本文著录格式]李曼丽,赵文,高钰丹,等.骨髓间充质干细胞细胞周期同步化的方法及对向神经细胞分化的影响[J].中国康复理论与实践,2016,22(12):1399-1403.
CITED AS:LiML,ZhaoW,Gao YD,etal.Cell cycle synchronization Methods of bonemarrow mesenchymalstem cellsand itseffect on neuraldifferentiation[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(12):1399-1403.
骨髓间充质干细胞(bonemesenchymal stem cells, BMSCs)来源于骨髓,是骨髓中区别于造血干细胞的具有多向分化潜能,能够向骨、软骨、肌肉、韧带、肌腱、脂肪及基质,甚至跨越胚层向神经组织分化的细胞[1-8]。Woodbury等发现,在特定诱导条件下,来源于成年鼠和人的BMSCs可以分化为神经元[9-10]。由于其来源广泛并具有多向分化潜能,已经成为基因治疗或组织工程[11-14]的细胞资源。但是,骨髓中BMSCs含量极少,占骨髓有核细胞总数的0.001%~0.1%,故在有限的细胞数量中提高细胞分化比例成为组织工程及细胞体内、体外实验的重中之重。
细胞进入或退出细胞周期与细胞命运息息相关[15]。G0/G1期是细胞进入或退出细胞周期的关键时期。细胞周期关键的限制位点在G1期末期。如果细胞通过这一限制点,将几乎无一例外地完成细胞周期。而如果通过某些抑制手段来阻断细胞周期使其停留在G1期,则能促进分化[16]。相较于物理和化学方法将BMSCs细胞周期阻滞在G0/G1期,血清饥饿法对于细胞的伤害较小。
碱性成纤维细胞生长因子(basic fibroblastgrow th factor,bFGF),又称FGF-2,具有促进神经组织生长发育、血管生成、创伤愈合和组织修复等作用[17]。有研究利用bFGF结合多聚赖氨酸成功将BMSCs诱导为神经丝蛋白(nerve fibers,NF)阳性的神经元样细胞。
本实验通过BMSCs的黏附特性,采用全骨髓贴壁培养法提取BMSCs[18-19]。流式细胞仪检测在不同胎牛血清(fetal bovine serum,FBS)浓度下,不同处理时间时处于G0/G1时相的细胞比例,从而确定最佳的处理条件。本研究还利用bFGF诱导细胞周期同步化组和未同步化组,于不同的诱导时间检测其向神经细胞分化的能力和区别,探索采用血清饥饿法同步化BMSCs于G0/G1期的最优条件,为提高BMSC的分化比例提供基础。
1 材料和方法
1.1 实验动物
Wistar成年大鼠6只,体质量200 g,购自首都医科大学实验动物部,许可证号SYXK(京)2013-0004。
1.2 实验方法
1.2.1 大鼠BMSCs提取、培养和传代
1.2.1.1 提取和培养
成年Wistar大鼠腹腔注射4%水合氯醛6m l/kg麻醉。分离股骨和胫骨,去除股骨和胫骨上多余肌肉、血管、筋膜等并暴露骨两端,含青链霉素双抗PBS冲洗3次后,于PBS中浸泡。注射器吸取含10%FBS的DMEM培养基从股骨和胫骨中将骨髓细胞冲洗出来,10m l DMEM培养基于湿润的37℃ CO2培养箱中培养。24 h后细胞全换液,去除不贴壁细胞,继续培养。
1.2.1.2 传代
待细胞生长至80%~90%细胞融合时,用含有双抗的PBS洗涤3次,每皿中加入胰酶+乙二胺四乙酸(ethylene diam ine tetraacetic acid,EDTA)2m l晃匀,保证每个细胞都能接触到。2m in后,相差显微镜下观察细胞由长梭形变为圆形时,每皿加入等体积含10% FBS的DMEM培养基终止消化,1000 r/m in离心5 m in,弃上清后将沉淀均分到两个培养皿中,分别加入10m l培养基于湿润的37℃5%CO2培养箱中培养。待细胞培养至80%~90%细胞融合状态时,同样的方法传代至P3代备用。
1.2.2 流式细胞仪检测细胞表面标记
收获P3代生长状态良好细胞,0.25%胰酶消化2 m in,4℃、1000 r/m in离心5m in,PBS(含青链霉素双抗)清洗细胞3次,计数细胞,弃上清加入荧光标记一抗(PE-Cy5-labeled anti-Rat CD45/FITC-labeled anti-Rat CD90),平均每1×106个细胞加1μl,冰上孵育40m in后,PBS洗涤1次,5m in,上机检测,PBS洗涤细胞3次,除去未结合抗体,PBS 500µl重悬细胞,流式细胞仪进行检测分析。
1.2.3 大鼠BMSCs血清饥饿处理
P3代细胞种植于六孔板中,待细胞贴壁后分组处理。分组情况如下:5%、1%、0.5%、0.1%、0 FBS处理24 h;5%、1%、0.5%、0.1%、0 FBS处理48 h。
1.2.4 大鼠BMSCs细胞周期检测
待处理结束后,PBS洗涤3次。每孔0.25%胰酶+ EDTA 0.5m l消化处理2m in,待细胞由长梭形慢慢形变为圆形时,加入含10%FBS的DMEM培养基终止消化,吹打细胞至悬浮。收集细胞至1.5m l EP管中。1000 r/m in离心10 m in,弃上清,PBS重悬细胞后1000 r/m in离心10m in,弃上清后,边震荡边快速加入70%乙醇至充分混匀,4℃固定细胞2 h以上。将经过固定的细胞1000 r/m in离心5m in,重复2次,弃上清加入RNase1m l37℃反应30m in,冷却至室温。每管中加入PI染液100μl,30 s后,EPICSXL coulter流式细胞仪(美国贝克曼库尔特)上机检测。
1.2.5 BMSCs的诱导分化
P3代细胞种植于包被有左旋多聚赖氨酸(SIGMA)的盖玻片上,待细胞贴壁后向培养基中添加20 ng/m l bFGF(SIGMA),2~3 d半量换液一次。采用免疫荧光细胞化学方法,3 d后检测神经干细胞标志物Nestin的表达;7 d后检测神经细胞标记物Tuj-1的表达。
1.2.6 免疫荧光
4%多聚甲醛4℃固定40m in,0.3%TritonX-100破膜5m in,之后用1%封闭用山羊血清室温封闭30 m in,加入相应一抗(Nestin 1∶100,M ILLIPORE;Tuj-1多克隆抗体1∶200),37℃孵育2 h,加入A lexa594和Alexa488标记的山羊抗兔或小鼠荧光二抗(1∶300,INVITROGEN公司),37℃避光孵育1 h,Hoechst33342(1∶1500,SIGMA公司)复染核,50% PB甘油封片,BX51荧光显微镜(OLYMPUS)下观察照相。
1.3 统计学分析
2 结果
2.1 大鼠BMSCs形态和生长特征
原代提取24 h后,细胞贴壁且两端有较长突起,胞核卵圆形,细胞呈克隆样生长,形成大小不一的集落,前期生长缓慢,达到80%~90%汇合后传代。传代后细胞增殖较快,呈均匀分布生长,形态为长梭形,10~14 d传至P3代细胞形态,呈长梭形。见图1~图2。
2.2 大鼠BMSCs的鉴定
第3代BMSCs 95%以上的细胞为CD45-/CD90+细胞。即95%以上为BMSCs。见图3。

图1 BMSCs原代细胞形态(相差显微镜,200×)
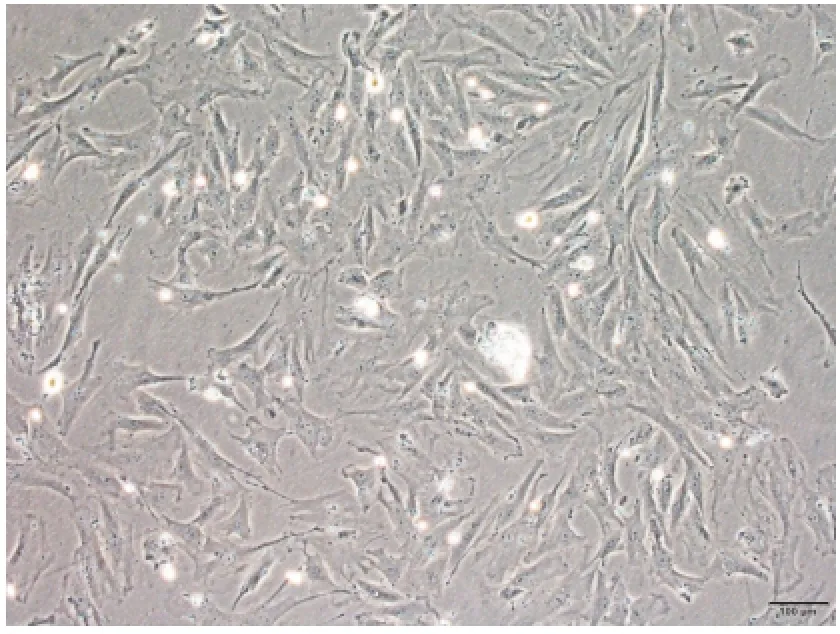
图2 P3代细胞形态(相差显微镜,200×)
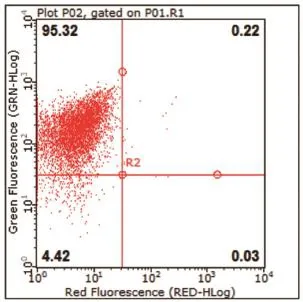
图3 流式双标鉴定BMSCs
2.3 大鼠BMSCs血清同步化条件优化
各处理条件下,G1/G0期细胞数目与正常培养状态即10%FBS处理下都有所增加。见表1。其中1% FBS处理48 h时,G1/G0期细胞所占比例为94.27%,达到最高值(F=39.91,P<0.001)。见表1。
2.4 细胞周期同步化于G0/G1期对BMSCs向神经细胞分化的影响
基于以上研究,我们选择1%FBS处理48 h为最佳处理条件,并命名为同步化组,同时将10%FBS条件定义为非同步化组。bFGF诱导3 d后,同步化组中Nestin+细胞比例显著高于非同步化组[(80.3±2.4)%vs. (12.1±1.5)%](F=28.25,P<0.001)。诱导7 d后,同步化组Tuj-1+细胞数显著高于非同步化组[(74.8±3.2)%vs. (19.3±2.5)%](F=17.95,P<0.001)。见图4。

图4 bFGF诱导3 d和7 d后Nestin+和Tuj-1+的表达情况

表1 不同浓度FBS处理24 h、48 h时各细胞周期时相细胞所占比例(%)
3 讨论
BMSCs具有广泛的临床应用前景。基于干细胞的治疗在临床中已取得良好的效果,白血病和某些癌症治疗中都应用到干细胞。理论上,囊胚内细胞层分离的胚胎干细胞是细胞治疗的最佳细胞资源,但由于受伦理学限制及潜在的致畸性和成瘤的可能,应用受到限制。BMSCs由于能够取自自体,避免了上述问题,成为热门资源;目前主要应用于局部移植、系统移植、结合干细胞的基因治疗及组织工程领域中。李晓峰等在大面积的骨缺损骨折中应用自体体外扩增的BMSCs局部移植获得成功[19],BMSCs治疗椎骨骨性融合也取得良好效果。在心血管疾病中,BMSCs治疗外周动脉疾病引起的继发性缺血性疾病、冠状动脉疾病获得巨大的成功[20]。
间充质干细胞(mesenchymal stem cells,MSCs)主要来源于骨髓,临床上人类的MSCs一般从髂前上棘抽取[21]。骨髓中MSCs所占比例相当少,大约为0.0001%,通过细胞培养技术分离和扩增。目前分离MSCs的方法主要有密度梯度离心、免疫磁珠分选、贴壁培养法等。本实验采用的是全骨髓贴壁培养法,利用MSCs在塑料制品中贴壁生长并形成类似成纤维细胞的形态,经传代后,细胞扩增速度较快[23]。研究者们使用MSCs的方法各异,进一步标准化的分离过程仍有待于对其生物学特征和机制的深入研究。
骨髓来源MSCs细胞构成复杂,为了得到纯度较高的MSCs,急需对得到的MSCs进行鉴定。鉴定方法主要有三种。①BMSC具有在塑料制品中的贴附性。②具有能够向骨、软骨、脂肪等细胞的分化能力。③利用细胞表面抗原标志,排除造血干细胞特征。本实验中采用CD45和CD90共标的方法,利用CD45排除造血干细胞可能,CD90为干细胞表面标记。95%以上的细胞表达CD90并且为CD45阴性。如此,即可鉴定我们提取的细胞为BMSCs。
细胞周期对于调控细胞的增殖和分化非常重要。G0/G1期为细胞走向增殖还是分化的关键限制点。细胞通过本限制点后将无一例外的走向增殖[22-23]。为了分化,在G1期,细胞需要离开细胞周期而进入G0期[24-25]。这表明,通过某些细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK)抑制剂的过表达来阻断细胞周期使其停留在G1期,能促进分化,而驱动细胞通过G1期能抑制分化[26]。本研究的目的为探索将BMSCs的细胞周期同步化在G1/G0期的最优条件,即尽可能多地将细胞阻滞在G1/G0期,使更多的细胞走向分化,从而提高细胞分化比例。本研究结果也说明了这个问题,即细胞周期同步化于G0/G1期能够促进更多的BMSCs在bFGF的诱导作用下走向分化。
研究发现,降低血清浓度可以提高G1/G0期细胞比例,但是BMSCs的生长是需要一定浓度血清的,降低血清浓度虽然能够提高G1/G0期细胞比例,但是同样造成了一定程度上细胞活性的降低,所以寻找最佳的处理条件非常关键。本研究在比较不同浓度的处理条件后发现,1%FBS处理48 h不仅能够最大程度提高G1/G0期细胞比例,同时还能保持较好的细胞活力。
细胞周期同步化是指将正常生长的细胞通过物理、化学或是其他方法改变细胞周期进程,使大部分的细胞处于某一个特定的时期。有研究显示,利用RoscovitineATP竞争性抑制剂与ATP竞争CDK的ATP结合位点抑制CDK的活性(CDK1、CDK2、CDK5、CDK7)能够将细胞阻滞在G0/G1期。但是,外源性的化学试剂对细胞的损伤无法估计。血清饥饿法同步化细胞,不添加任何外源化学试剂,对细胞的损伤较小,是目前研究者们普遍采取的方法。但处理条件的不确定为同步化细胞制造了障碍,本研究确定了采用血清饥饿法同步化细胞的最佳条件。
综上所述,本研究提供了一种区别于物理、化学方法的同步化BMSCs的方法,并确定了最佳的处理条件。为进一步研究BMSCs高比例分化为目标细胞提供了方法,为BMSCs应用于临床研究奠定了细胞基础。
[1]Pittenger MF,M ackay AM,Beck SC,et al.M ultilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411): 143-147.
[2]Ding Z,Liu X,Ren X,etal.Galectin-1-induced skeletalmuscle celldifferentiation of mesenchymal stem cells seeded on an acellular dermal matrix improves injured anal sphincter[J].Discov Med,2016,21(117): 331-340.
[3]Özdal-Kurt F,Tuğlu I,Vatansever HS,etal.The effectof different implantbiomaterialson the behavior of canine bonemarrow stromal cells during their differentiation into osteoblasts[J].Biotech Histochem, 2016,91(6):412-422.
[4]Zhang LY,Xue HG,Chen JY.Genistein induces adipogenic differentiation in human bone marrow mesenchymal stem cells and suppresses their osteogenic potential by upregulating PPARγ[J].Exp Ther Med, 2016,11(5):1853-1858.
[5]Kokai LE,Rubin JP,Marra KG.The potentialof adipose-derived adult stem cells as a source of neuronal progenitor cells[J].Plast Reconstr Surg,2005,116(5):1453-1460.
[6]Zhou S,Eid K,Glowacki J.Cooperation between TGF-beta and Wnt pathways during chondrocyte and adipocyte differentiation of human marrow stromalcells[J].JBoneM iner Res,2004,19(3):463-470.
[7]Oliveira JM,Rodrigues MT,Silva SS,et al.Novel hydroxyapatite/chitosan bilayered scaffold for osteochondral tissue-engineeringapplications:scaffold design and its performance when seeded w ith goat bone marrow stromalcells[J].Biomaterials,2006,27(36):6123-6137.
[8]Traktuev DO,Parfenova EV,Tkachuk VA,et al.Adipose stromal cells-plastic type of cells w ith high therapeutic potential[J].Tsitologiia, 2006,48(2):83-94.
[9]Li B,Duan P,Li C.Role of autophagy on bonemarrow mesenchymal stem-cell proliferation and differentiation into neurons[J].Mol Med Rep,2016,13(2):1413-1419.
[10]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61(4):364-370.
[11]段红梅,杨朝阳,李晓光,等.壳聚糖-碱性成纤维细胞生长因子载体诱导骨髓间充质干细胞向神经细胞分化[J].中国康复理论与实践, 2011,17(4):329-333.
[12]涂晓萌,段红梅,饶家声,等.碱性成纤维细胞生长因子-壳聚糖载体诱导成年大鼠骨髓间充质干细胞向神经细胞的转化[J].中国康复理论与实践,2013,19(10):916-921.
[13]王聪,杨朝阳,段红梅,等.碱性成纤维细胞生长因子壳聚糖载体诱导神经干细胞向神经元分化并形成突触的研究[J].中国康复理论与实践,2015,21(4):406-411.
[14]Caviness VS Jr,Sidman RL.Time of origin or corresponding cell classes in the cerebral cortex of normaland reelermutantm ice:an autoradiographic analysis[J].JComp Neurol,1973,148(2):141-151.
[15]Bilitou A,Ohnuma S.The role of cell cycle in retinaldevelopment:cyclin-dependent kinase inhibitors coordinate cell-cycle inhibition, cell-fate determination and differentiation in the developing retina[J]. Dev Dyn,2010,239(3):727-736.
[16]Lange C,Huttner WB,Calegari F.Cdk4/cyclinD1 overexpression in neural stem cells shortens G1,delays neurogenesis,and promotes the generation and expansion of basal progenitors[J].Cell Stem Cell, 2009,5(3):320-331.
[17]Gu Y,Xue C,Zhu J,et al.Basic fibroblastgrow th factor(bFGF)facilitates differentiation of adult dorsal root ganglia-derived neural stem cells toward Schwann cells by binding to FGFR-1 through MAPK/ERK activation[J].JMolNeurosci,2014,52(4):538-551.
[18]杨丽,张荣华,谢厚杰,等.建立大鼠BMSC稳定分离培养体系与鉴定[J].中国组织工程研究与临床康复,2009,13(6):1064-1068.
[19]李晓峰,赵劲民,苏伟,等.大鼠BMSC培养与鉴定[J].中国组织工程研究与临床康复,2011,15(10):1721-1725.
[20]White IA,Sanina C,Balkan W.Mesenchymal stem cells in cardiology[J].MethodsMol Biol,2016,1416:55-87.
[21]Deb A,Wang S,Skelding K,etal.Bonemarrow-derived cardiomyocytes are present in adult human heart:study of gender-mismatched bone marrow transplantation patients[J].Circulation,2003,1079(9): 1247-1249.
[22]M icheli L,Ceccarelli M,Farioli-Vecchioli S.Control of the normal and pathological development of neural stem and progenitor cells by the PC3/Tis21/Btg2 and Btg1 Genes[J].JCell Physiol,2015,230(12): 2881-2890.
[23]Yamada T,M inoda R,Miwa T,etal.Neurogenesisof the spiralganglion cells in the cochlea requires the transcriptional cofactor TIS21[J]. Neurosci Lett,2015,584:265-269.
[24]Kuypers NJ,Bankston AN,Howard RM.Remyelinating oligodendrocyte precursor cellmiRNAs from the Sfmbt2 cluster promote cell cycle arrestand differentiation[J].JNeurosci,2016,36(5):1698-1710.
[25]An Q,Han C,Zhou Y,etal.In vitro effects ofm itomycin C on the proliferation of the non-small-cell lung cancer line A549[J].Int JClin Exp Med,2015,8(11):20516-20523.
[26]Ohnuma S,Hopper S,Wang KC,etal.Co-ordinating retinalhistogenesis:early cell cycle exit enhances early cell fate determination in the Xenopus retina[J].Development,2002,129(10):2435-2446.
Cell Cycle Synchronization Methods of BoneM arrow M esenchymal Stem Cellsand Its Effecton NeuralDifferentiation
LIMan-li1,ZHAOWen2,GAO Yu-dan2,DUANHong-mei1,YANG Zhao-yang2,LIXiao-guang1,2
1.Departmentof BiomedicalEngineering,Schoolof BiologicalScienceand Medical Engineering,Beihang University,Beijing 100191,China;2.Departmentof Neurobiology,CapitalMedical University,Beijing 100069,China
ObjectiveTo analyze theeffectof different treatmentconditionson cells synchronization in G0/G1 phase to get thebestcondition,and to explore its effect on neural differentiation of bonemarrow mesenchymal stem cells(BMSCs)induced by basic fibroblast grow th factor(bFGF).MethodsBMSCswere isolated and cultured in 5%,1%,0.5%,0.1%,0 fetalbovine serum(FBS)respectively,for 24 hours and 48 hours.A fter PIstaining,cell cycle proportions of each phasewere detected by flow cytometry,and were compared with the normal group(10%FBS).A fter the optimal treatment condition was got,20 ng/m l bFGFwas added into synchronization group and unsynchronization group 3 days and 7 days,respectively.The expression of Nestin and Tuj-1 were detected with immunofluorescence.ResultsAdult rat BMSCswere isolated from bonemarrow and cultured,after passage,the cellswerew ith long spindle shape.Compared with the normal group,the cell proportion of G1/G0 phase increased under different treatments,peaked with(94.274±0.468)%under 1%FBS,48 hours(F=39.91,P<0.001).AfterbFGF induction for3 days,the Nestin+cellnumberwas higher in the synchronization group than in theunsynchronization group[(80.3±2.4)%vs.(12.1±1.5)%](F=28.25,P<0.001).A fter bFGF induction for 7 days,the Tuj-1+cell numberw as higher in the synchronization group than in the unsynchronization group[(74.8±3.2%)%vs.(19.3±2.5)%](F=17.95,P<0.001).Conclusion1%FBS,48 hours is the optimal condition to BMSCs synchronization in G0/G1 phase,which can promote the neural differentiation of BMSCs.
bonemarrow mesenchymalstem cells;cell cycle;synchronization;serum starvation;neuraldifferentiation;rats
10.3969/j.issn.1006-9771.2016.12.007
R329.2
A
1006-9771(2016)12-1399-05
2016-06-17
2016-08-01)
1.国家“863”计划项目(No.2012AA 020206);2.国家自然科学基金面上项目(No.31271037);3.国家自然科学基金国际合作与交流项目(No.31320103903);4.“十二五”国家科技支撑计划项目(No.2012BAI17B04);5.高等学校全国优秀博士学位论文作者专项资金资助项目(No.201356);6.国家国际科技合作专项项目(No.2014DFA 30640);7.国家自然科学基金委员会资助项目(No.31130022)。
1.北京航空航天大学生物与医学工程学院,北京市100191;2.首都医科大学基础医学院,北京市100069。作者简介:李曼丽(1985-),女,汉族,河北安新县人,博士研究生,主要研究方向:干细胞的诱导分化。通讯作者:李晓光。E-mail:lxgchina@sina.com。
