疫苗生产中纯化水与注射用水的质量控制研究
2016-12-29方朝东邱文娜熊吉滨李健峰
方朝东,邱文娜,李 磊,饶 玲,熊吉滨,李健峰
(江苏泰州医药高新技术产业园区疫苗工程中心,江苏 泰州 225300)
疫苗生产中纯化水与注射用水的质量控制研究
方朝东,邱文娜,李 磊,饶 玲,熊吉滨,李健峰
(江苏泰州医药高新技术产业园区疫苗工程中心,江苏 泰州 225300)
目的 研究纯化水和注射用水作为生物制品生产中主要原辅料的质量控制标准。方法 分别在纯化水和注射用水不同水点取样,按2015年版《中国药典(二部)》最新规定进行检测,连续3周对其进行质量监测。结果纯化水和注射用水的各项质量指标均符合规定。结论 该水系统制备出来的纯化水和注射用水质量优良,可用于疫苗生物制品生产。
疫苗生产;纯化水;注射用水;质量控制
纯化水和注射用水是疫苗等生物制品乃至药物制剂行业中用途最广、用量巨大的一种原辅料,其质量好坏将直接影响终产品的质量[1-2]。2015年版《中国药典(二部)》对纯化水、注射用水、灭菌注射用水的检测方法及质量标准分别都有明确规定[3],并修订了纯化水和注射用水微生物限度检查项目。将营养琼脂培养基和玫瑰红钠琼脂培养基修订为低营养的R2A琼脂培养基,提高了微生物的检出率,与《欧洲药典》(EP)一致[4-5]。与EP不同的是,《中国药典》暂未对纯化水中细菌内毒素作明确要求。目前,国内学者主要研究纯化水或注射用水中微生物限度或制水工艺方面[6-9],尚缺乏对纯化水和注射用水进行全面质量研究的报道。为保证疫苗生产工艺用水质量,笔者依据《中国药典》要求对整个纯化水和注射用水系统进行了全面质量监测。现报道如下。
1 仪器与试药
1.1 仪器
二级反渗透纯化水制备系统(山东潍坊精鹰医疗器械有限公司);纯化水分配系统、多效蒸馏水机和注射用水分配系统(吉林省华通制药设备有限公司);1300 A2型生物安全柜(Thermo Fisher);S230-B型电导率仪(Mettler Toledo);5000Toci型总有机碳(TOC)分析仪(MettlerToledo);TAL-40D型试管恒温仪(湛江安度斯生物有限公司);GNP-9080型隔水式恒温培养箱(上海精宏实验设备有限公司);DK-S26型恒温水浴锅(上海精宏实验设备有限公司);LS-O610型烘箱(Fisher Labserv);pH700型酸度计(Eutech);SX-500型高压蒸汽灭菌锅(Tomy)、三联过滤器(Sartorius,Combisart)。
1.2 试药
鳌试剂(湛江安度斯生物有限公司,批号为1412242);细菌内毒素检查用水(中国食品药品检定研究院,批号为160006-201401);细菌内毒素工作标准品(中国食品药品检定研究院,批号为 150601-201478);R2A琼脂培养基(青岛高科园海博生物技术有限公司,批号为20151112);pH=7.0氯化钠-蛋白胨缓冲液(北京索莱宝科技有限公司,批号为20150208);其余试剂均为分析纯。
2 方法与结果
2.1 纯化水与注射用水的制备与分配
原水先后经石英砂和活性炭过滤器后,进入一级反渗透和二级反渗透膜,制备纯化水(在线电导率仪检测电导小于2 μs/cm),放行进入纯化水罐,通过纯化水分配系统送至各使用点。注射水机采用五效蒸馏器,以纯化水为水源,制备的注射用水进入注射用水水罐,通过注射用水分配系统送至各使用点。纯化水和注射用水分配系统总送与总回分别设有取样阀。水系统可采取自动控制和手动控制两种模式,一般采取自动控制模式,且水系统持续运行。
2.2 取样计划
纯化水和注射用水的总进水口、总送水口与总回口均为每周必须监测点,每周取样1批次,纯化水和注射用水每批次均选择2个使用点取样,连续3周即覆盖所有使用水点。
2.3 取样方法
在车间正常生产和水机正常运行情况下,检验人员按取样计划负责取样。取样前用75%乙醇棉球擦拭取样口内外壁,打开取样阀排水至少3 min,灭菌玻璃瓶取水前需用水样进行润洗至少3次。每个取水点取3瓶平行样品,每份取样量不少于 300 mL,取样结束立即盖好瓶盖。用于TOC检测的水样在取样时应尽量取满,以减少水面上部空气对水样的影响。另外,对细菌内毒素检查用取样试管应提前采取高温措施以去除热原。
2.4 检测项目及质量标准
纯化水和注射用水的检测项目及质量标准见表1,参照2015年版《中国药典(二部)》规定进行检测。理化检查项目当天完成,纯化水细菌内毒素检查与注射用水同法操作,采用凝胶试验法。进行电导率检测前,先将水样温度加温至25℃,再用离线式电导率仪对其进行检测。微生物限度检查(薄膜过滤法)应在取样结束2 h内进行,取纯化水水样10 mL,用pH=7.0的无菌氯化钠-蛋白胨缓冲液稀释至100 mL,配制成供试液,取10 mL供试液加入已加100 mL缓冲液的滤杯通过薄膜过滤,接着用缓冲液冲洗滤杯及膜3次(每次100 mL),取出滤膜,菌面朝上,贴于R2A琼脂培养基表面(Φ=90 mm),同时取缓冲液100 mL薄膜过滤,作为阴性对照,每个样品平行做2个皿,置32℃培养箱中培养至少120 h。注射用水微生物限度检查则取注射用水水样100 mL直接进行薄膜过滤,其他操作步骤同纯化水检测。

表1 2015年版《中国药典(二部)》中纯化水和注射用水质量标准
2.5 结果
2.5.1 纯化水和注射用水的检测结果
连续3批次纯化水和注射用水的性状、酸碱度(pH)、硝酸盐、亚硝酸盐、氨、不挥发物和重金属检查项目检测结果均合格,其细菌内毒素、电导率、总有机碳和微生物限度检查检测结果见表2。结果表明,纯化水和注射用水系统制备和分配循环的纯化水和注射用水各项质量指标均符合药典规定。
2.5.2 纯化水不同温度、不同贮存时间检测结果
纯化水按取样标准操作规程取样密封后,分别在4℃和30℃条件下(综合季节气候变化考虑,冬天最低水温4℃,夏天最高水温30℃)贮存不同时间,对其电导率、TOC和微生物主要指标进行分析,同时对纯化水中细菌内毒素进行检测,结果见表3。结果表明,纯化水在4℃条件下贮存72 h电导率、TOC和微生物限度各项指标均合格,细菌内毒素均小于0.25 EU/mL。随着贮存时间的延长,其电导率波动变化不大,TOC仅呈缓慢上升趋势。与4℃条件下比较,在30℃条件下贮存,不同点主要体现在微生物方面,纯化水贮存48 h仍合格,但贮存72 h微生物总数超标。
2.5.3 注射用水不同温度、不同贮存时间检测结果
注射用水取样结束后立即密封,分别在4℃、30℃和70℃不同温度下贮存72 h,注射用水中细菌内毒素、电导率、TOC和微生物各项指标仍合格,随贮存时间的延长,电导率和TOC在不同温度下并无明显变化趋势,均未检出微生物。见表4。
3 讨论
纯化水和注射用水是疫苗生产中用量巨大的辅料,《药品生产质量管理规范(2010年修订)》建议:“纯化水采取循环,注射用水采取70℃以上保温循环[10]。其在制备、贮存和使用过程中微生物容易繁殖,微生物或其代谢产物会严重影响药品质量”[11],因此加强对工艺用水的质量控制显得尤为重要。药典自2005年版增加微生物限度检查项目,2010年版新增电导率、TOC项目,以及 2015年版的修订,且 2016年版《美国药典》(USP39)将接受应用微生物在线检测仪对制药用水中微生物进行实时监测的方法,均体现国内外医药卫生管理部门一直致力于逐步提高纯化水和注射用水的质量标准,改进检测方法以利于快速并准确地对水质情况进行监控。
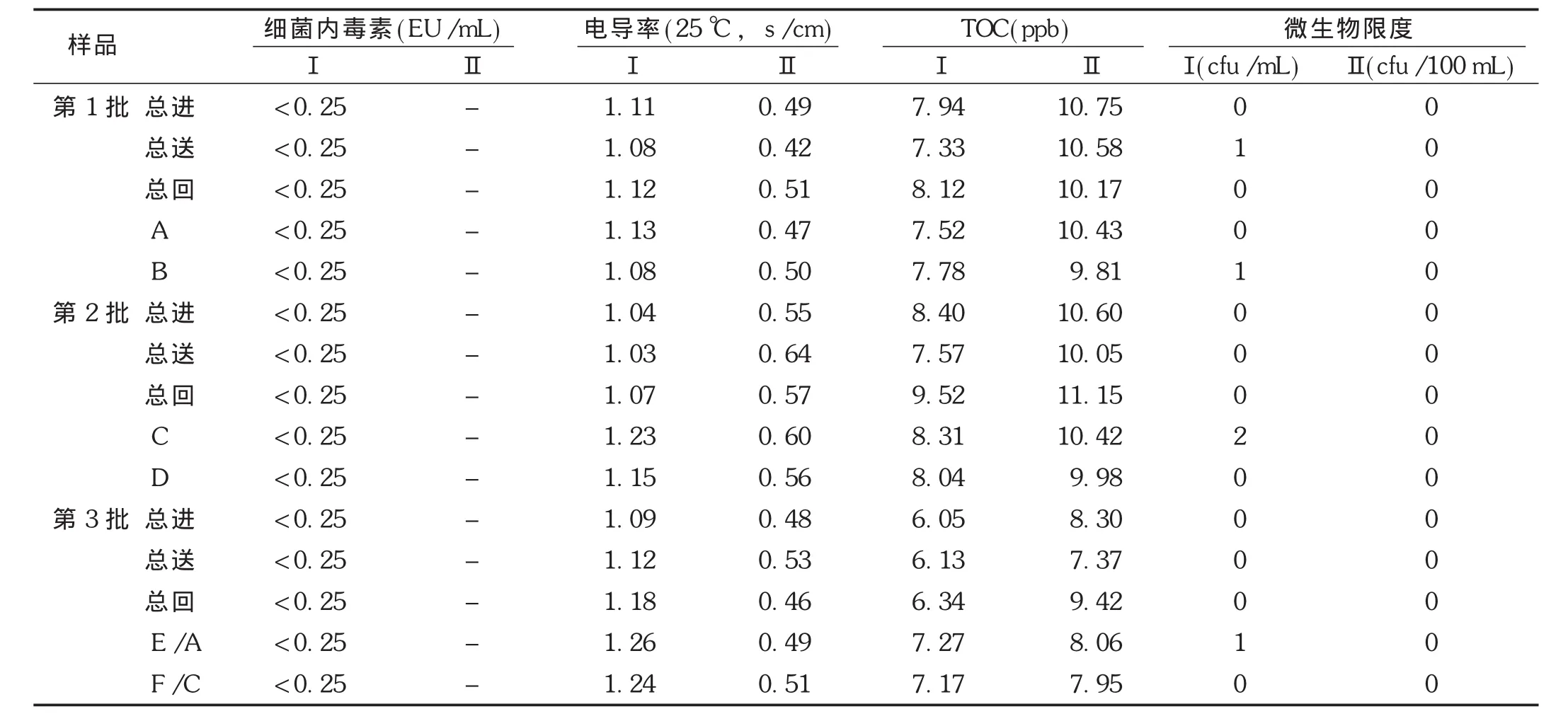
表2 纯化水和注射用水检测结果
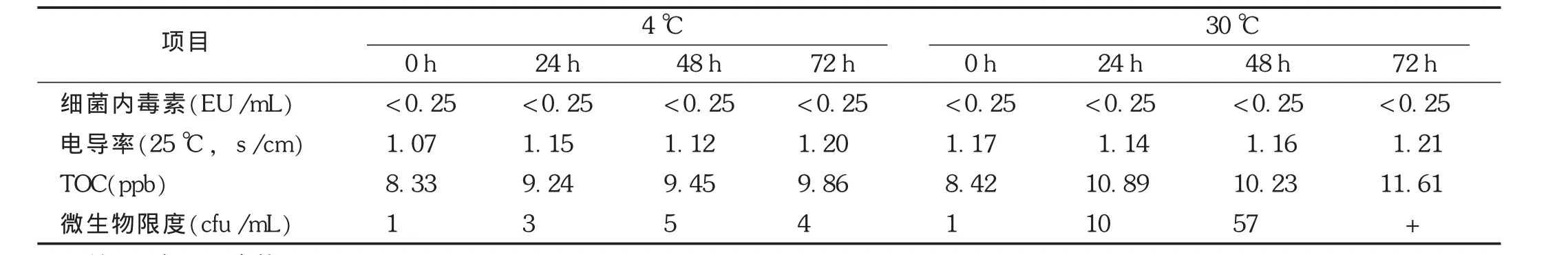
表3 纯化水不同温度下贮存检测结果
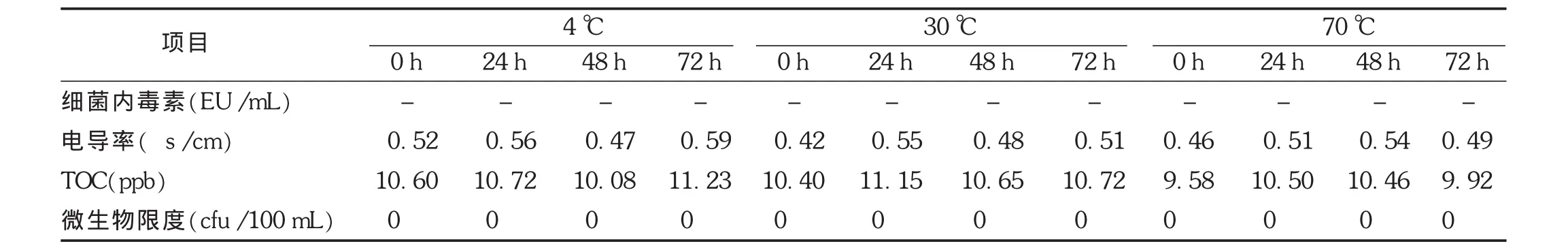
表4 注射用水不同温度下贮存检测结果
本研究结果发现,纯化水中微生物极少,其微生物限度值已十分接近注射用水的微生物限度值,电导率平均值不到1.20 μs/cm,远低于药典规定的5.1 μs/cm;TOC平均值不超过10 ppb,也是远低于药典规定的500 ppb;纯化水各指标(包括细菌内毒素)均达到我国药典关于注射用水的要求,实际使用中能否当注射用水使用有待进一步验证研究。注射用水的电导率和TOC同样远低于药典的规定;另外,与纯化水TOC比较,注射用水TOC略高,可能与注射用水的蒸馏工艺有关,尚无明确的解释。结果提示,经二级反渗透制得的纯化水及由其蒸馏而制得的注射用水非常优质,可放心应用于疫苗等生物制品的生产。4℃低温贮存纯化水明显能抑制水中细菌的繁殖,在常温下保存时间最好不超过48 h。TOC随贮存时间的增加呈缓慢上升趋势,与孙晶晶等[12]结果一致,在一定程度上反映了纯化水中微生物的情况。30℃条件下,72 h纯化水中微生物超标,但细菌内毒素和TOC均未超标,可能与水中微生物暂未分解有关,纯化水中微生物超标可大大增加注射用水中细菌内毒素不合格的几率。与纯化水不同,注射用水在不同温度下贮存72 h仍合格,可能因注射用水中无微生物,检测时可考虑增加样品取样量对其进一步进行验证。
综上所述,在生产过程中应通过测定纯化水和注射用水的电导率、TOC、细菌内毒素和微生物总数等各项指标,定期对设备进行检查、维护和更新[13],以便系统掌握水质基本情况。综合验证数据和长年积累的数据,建立切合实际的电导率、TOC、微生物等指标的警戒限和纠偏限,以全面控制其质量及水系统的持续有效运行,最大限度降低因水质量问题而导致产品不合格的风险。
[1]李 华,龙亚秋,杨 芳.医院制剂生产中纯化水的制备与质量控制[J].中国药业,2012,21(8):59-61.
[2]陈树新,莫玉芳,蔡先东,等.注射用水微生物含量与贮存温度、方式及时间的关系[J].中国药业,2011,20(5):36-37.
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2015:579-702.
[4]杨晓莉,李 辉,绳金房.中、美、英、欧药典制药用水微生物检查法对比研究[J].西北药学杂志,2013,28(5)515-517.
[5]欧洲药典委员会.欧洲药典8.0(二卷)[M].欧洲药品质量管理局,2014:3 561-3 563.
[6]余 鹏,吴磊明,刘 丹,等.二级反渗透法制备纯化水的质量考察[J].中国医药科学,2013,3(4):147-148.
[7]李 珏,洪利娅,王知坚,等.制药用水微生物限度检查新方法的研究[J].药物分析杂志,2014,34(2):376-379.
[8]陈树新,陈文伟,庞佩珊,等.注射用水循环系统用水点水温控制及效能研究[J].今日药学,2011,21(8):480-483.
[9]金宝华,姜 琳,张丽梅,等.纯化水微生物限度检查方法优选[J].首都食品与医药,2015(6):44-48.
[10]国家卫生部.药品生产质量管理规范(2010年修订)[M].北京:人民卫生出版社,2011:14.
[11]邱凯峰,罗俊丽,罗嘉玲.医院制剂生产中纯化水的质量控制[J].中国实用医药,2009,4(25):55-56.
[12]孙晶晶,柯云玲,邵益丹,等.不同贮存条件对纯化水质量的影响[J].中国消毒学杂志,2014,31(4):353-355.
[13]闫秀红 .制药工艺用水制备流程分析[J].黑龙江科学,2015,6(2):62-63.
Quality Control of Purified Water and Water for Injection in Vaccine Production
Fang Chaodong,Qiu Wenna,Li Lei,Rao Ling,Xiong Jibin,Li Jianfeng
(Vaccine Engineering Center of Taizhou Medical Hi-Tech Development Zone,Taizhou,Jiangsu,China 225300)
Objective To analyze the quality control standard of purified water and water for injection used in biological products as raw materials.M ethods The samples were collected from different sampling points respectively and examined referring to the latest regulations of ChP 2015 edition,and the quality of water was detected for 3 weeks.Results The quality index of the pure water and water for injection all accorded with the standard.Conclusion Excellent quality of water can be prepared by the water system and fits for the biological products.
vaccine production;purified water;water for injection;quality control
TQ460.6+3
A
1006-4931(2016)11-0069-04
方朝东(1985-),男,江苏泰州人,硕士研究生,主管药师,主要从事生物制品研发及检测工作,(电话)0523-86200368。
2015-10-14)
