灯盏乙素抑制热应激诱导猪肾小管上皮细胞凋亡研究
2016-12-27丛霞李华涛陈健伟张东君曹荣峰田文儒
丛霞,李华涛,陈健伟,张东君,曹荣峰,田文儒*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.肥城市畜牧兽医局,山东肥城 271600)
灯盏乙素抑制热应激诱导猪肾小管上皮细胞凋亡研究
丛霞1,李华涛1,陈健伟1,张东君2,曹荣峰1,田文儒1*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.肥城市畜牧兽医局,山东肥城 271600)
灯盏乙素(Scu)为灯盏花中提取的单一黄酮类化合物,具有清热解毒和保护细胞免受热应激损伤的作用。试验将不同浓度Suc培养的猪肾小管上皮细胞(LLC-PK1)在42℃下热应激1 h,采用RNA干扰法沉默细胞HSP72基因表达,荧光定量PCR和Western blot检测细胞热休克蛋白(HSP)70、Bcl-2、Bax、细胞色素C(Cyt-c)和caspase-3裂解。结果表明,Scu显著增加细胞Bcl-2蛋白和HSP70蛋白水平,增加Bcl-2/Bax比值,抑制Cyt-c的释放及pro-caspase-3裂解和caspase-3表达;但沉默HSP70后,细胞Cyt-c释放和caspase-3表达均显著增加。由此可知,Scu抑制LLC-PK1凋亡,保护细胞免受热应激损伤。
灯盏乙素;LLC-PK1;凋亡;热应激;HSP70
肾脏疾病如急性肾小管阻塞、慢性痛风性肾病、尿酸肾结石等,可引起肾脏组织损害,炎性细胞浸润,导致肾功能损伤。Choe等研究认为,细胞凋亡可能是肾脏(尤其是肾小管上皮)细胞损伤发病机制之一[1]。细胞凋亡具有两个主要调节途径,即死亡受体诱导的外源性和线粒体小体介导的内源性途径。Bax和Bcl-2在线粒体介导的凋亡途径中发挥重要作用,能调节线粒体外膜通透性,使细胞色素C(Cyt-c)释放到细胞质中。Cyt-c促进凋亡蛋白酶激活因子活化并激活caspase-9,促进procaspase-3裂解成caspase-3,导致蛋白水解和细胞凋亡[2]。在内源性途径中,HSP70能稳定部分变性蛋白,去除不可逆损伤蛋白,维持细胞正常功能并抑制热应激引起细胞凋亡。Bcl-2/Bax值是肾小管上皮细胞发生凋亡关键因素[3]。HSP70可阻止应激反应中Bax易位,抑制线粒体释放Cyt-c及caspase-3激活[4-5]。HSP70与线粒体释放的另一个凋亡诱导因子结合形成复合物,可阻止细胞染色质聚集和细胞凋亡[6]。
灯盏乙素(Scu)是灯盏花中提取的单一黄酮类化合物,在中医临床上广泛用于治疗心血管疾病[7]。Zhang等研究表明,Scu能抑制线粒体功能损伤和大脑缺血再灌注损伤所诱导的细胞凋亡[8],通过上调Bcl-xL表达和降低caspase-3活性而抑制CoCl2诱导的PC12细胞凋亡[9],Scu保护热应激诱导的细胞损伤研究报道鲜见,对Scu解热作用及机制研究较少。
本文采用RNA干扰、实时定量PCR和western blot方法,研究Scu对受热应激LLC-PK1细胞Bcl-2、Bax、HSP70、cyt-c和pro-caspase-3表达影响,为阐明Scu保护热应激引起细胞损伤的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料
猪肾小管上皮细胞(Pig kidney proximal tubular,LLC-PK1,美国ATCC细胞库第三代细胞)购自上海复祥生物科技有限公司;灯盏花乙素(Scutellarin,Scu)购自江西南昌制药工程中心;高糖DMEM培养基和胰蛋白酶购自美国GIBCO公司;胎牛血清购自美国HyClone公司;RNA提取试剂盒和反转录试剂盒分别购自原平皓生物有限公司和日本TaKaRa公司;LightCycler®480 SYBR GreenⅠMaster购自美国Roche公司;抗Bcl-2(sc-492)、Bax(sc-526),HSP70(sc-1060)、细胞色素C(sc-8385)、pro-caspase-3(ab90437)、caspase-3(ab13847)和GAPDH(sc-48166)抗体均购自美国Santa Cruze公司;兔抗羊、羊抗兔IgGHRP(二抗-辣根过氧化物酶)购自美国Jackson Immuno Research公司;Western及IP细胞裂解液、一抗二抗去除液和ECL荧光底物试剂盒均购自碧云天生物制品有限公司。
1.1.2 细胞培养及处理
LLC-PK1细胞在DMEM培养液中培养于37℃,含5%CO2培养箱中,DMEM培养液含5%胎牛血清并分别加入100 U·mL-1和100 μg·mL-1青、链霉素。将Scu溶解在DMSO中,使用时稀释终浓度为0.1%DMSO完全培养基。将细胞培养24 h后42℃热应激1 h处理,37℃下恢复6 h,收获细胞并作相应试验。
1.2 试验方法
1.2.1 Scu最佳浓度筛选
将LLC-PK1细胞(5×103·孔-1)接种于96孔培养板并培养24 h,再用含不同浓度Scu(10-3~10-7mol·L-1)完全培养基孵育24 h,CCK-8试剂盒检测细胞活力,具体操作方法参照试剂盒说明书。测定A450nm波长吸光度,取3次重复试验平均值。
1.2.2 siRNA干扰HSP70基因表达
将浓度为10 nm的HSP70干扰RNA(siRNAs,见表1)和QIAGEN转染试剂混合后,按照说明书操作程序转染细胞,转染细胞在37℃下培养12 h,42℃热应激1 h,然后在37℃下恢复6 h后收获细胞,Western blot法检测细胞HSP70表达水平,分析HSP70沉默效率,筛选最佳干扰RNA。
1.2.3 荧光定量PCR
按照RNA提取试剂盒说明,提取Scu和热应激处理细胞总RNA,按照试剂盒(TaKaRa)说明反转录,反应体系(20 μL)为:总RNA 7 μL;Random hexamer引物(0.2 μg·μL-1)1 μL;DEPC处理水4 μL;5×Reaction Buffer 4 μL;RibolockTMRNase抑制剂1 μL;10 mmol·L-1dNTP Mix 2 μL;M-MLV反转录酶1 μL。
将合成的cDNA产物作系列浓度梯度稀释,Roche LightCycler 480Ⅱ荧光定量PCR仪作定量反应,PCR反应体系(10 μL)为:ddH2O 3.6 μL;SYBRGreen Real time PCR Master Mix 5 μL;上下游引物(上海生工生物技术有限公司合成,20 pmol·μL-1)各0.2 μL(见表2);cDNA 1 μL。PCR反应条件为:95℃10 min,95℃5 s,60℃30 s,72℃,30 s共45个循环。反应结束后,各组细胞以β-actin作内参基因,用2-ΔΔCt法定量分析[10]。
1.2.4 蛋白印迹分析
将细胞培养皿中培养液吸掉,加入2 mL PBS(0.01 moL·L-1,pH 7.2~7.3)清洗2次,去除PBS后将培养皿置于冰上,每培养皿细胞中加入0.5 mL终裂解液,吹打、混匀。裂解后将裂解液移至1.5 mL离心管中,4℃,14 000 r·min-1离心5 min。取离心后上清液用2×SDS样品缓冲液1∶1稀释,煮沸使蛋白变性。然后在5%浓缩胶、12%分离胶、电压为110 V条件下SDSPAGE电泳2 h。将细胞样品中蛋白质经电泳分离后,转移至PVDF膜上(4℃,220 mA,2 h),在TBST缓冲液中漂洗3次,每次5 min,将膜置于10%牛血清白蛋白(BSA)中室温封闭2 h,根据PVDF膜孔径加一抗(1∶1000稀释),4℃下孵育过夜,用TBST漂洗膜3次,每次5min;加入与一抗稀释后相同量的二抗IgG-HRP,室温反应1 h,经TBST漂洗3次,每次5 min,待ECL发光试剂显色后拍照鉴定,用BandScan 5.0软件灰度分析。

表1 试验中使用的siRNA核苷酸片段Table 1The primer sequences of siRNA used in the experiment
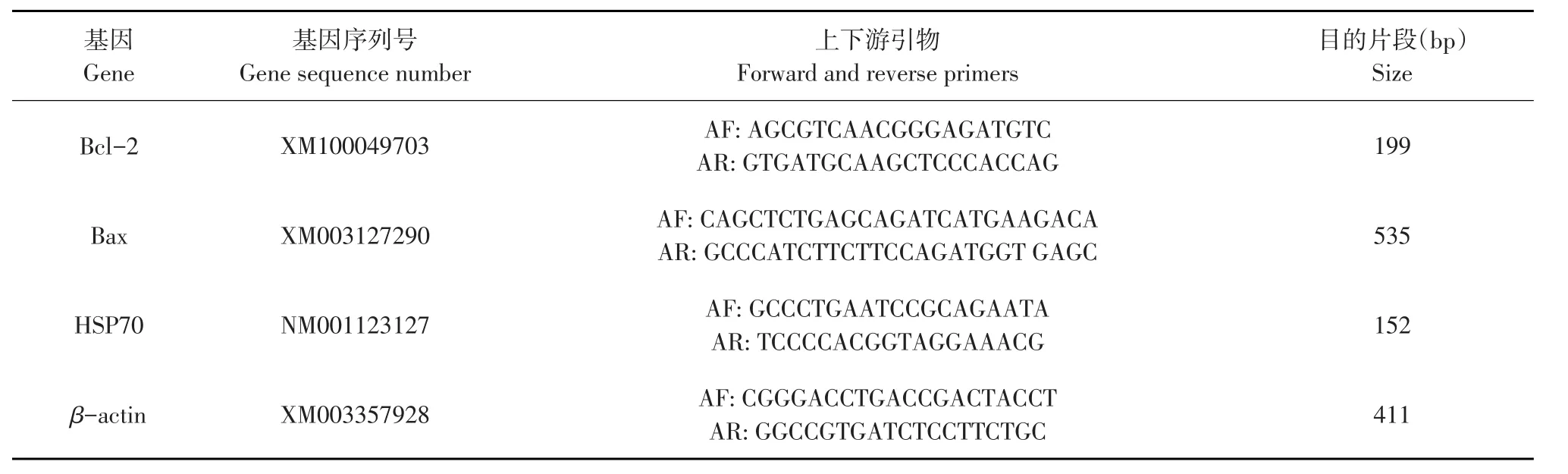
表2 荧光定量PCR引物Table 2The primer sequences used in real time PCR
1.2.5 统计分析
用SPSS 12.0软件作方差分析,试验数据用-X± SD表示,t检验做均数间比较,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果与分析
2.1 Scu对细胞存活率影响
CCK-8法检测Scu检测处理后细胞活力,以确定Scu对LLC-PK1细胞毒副作用。结果发现,当Scu浓度为10-6~10-7mol·L-1时,对细胞存活率无显著(P>0.05)影响(见图1),当Scu浓度增加至10-3~10-5mol·L-1时,细胞活力显著(P<0.05)下降。
2.2 热应激对细胞凋亡相关因子表达影响
Western blot检测结果表明,与对照组比,热应激使细胞Bax和Bcl-2蛋白表达显著(P<0.05)升高(见图2),使Bcl-2/Bax蛋白比值显著(P<0.05)下降;此外,细胞受热应激后,cyt-c释放量和pro-caspase-3裂解量均显著(P<0.05)高于对照组。
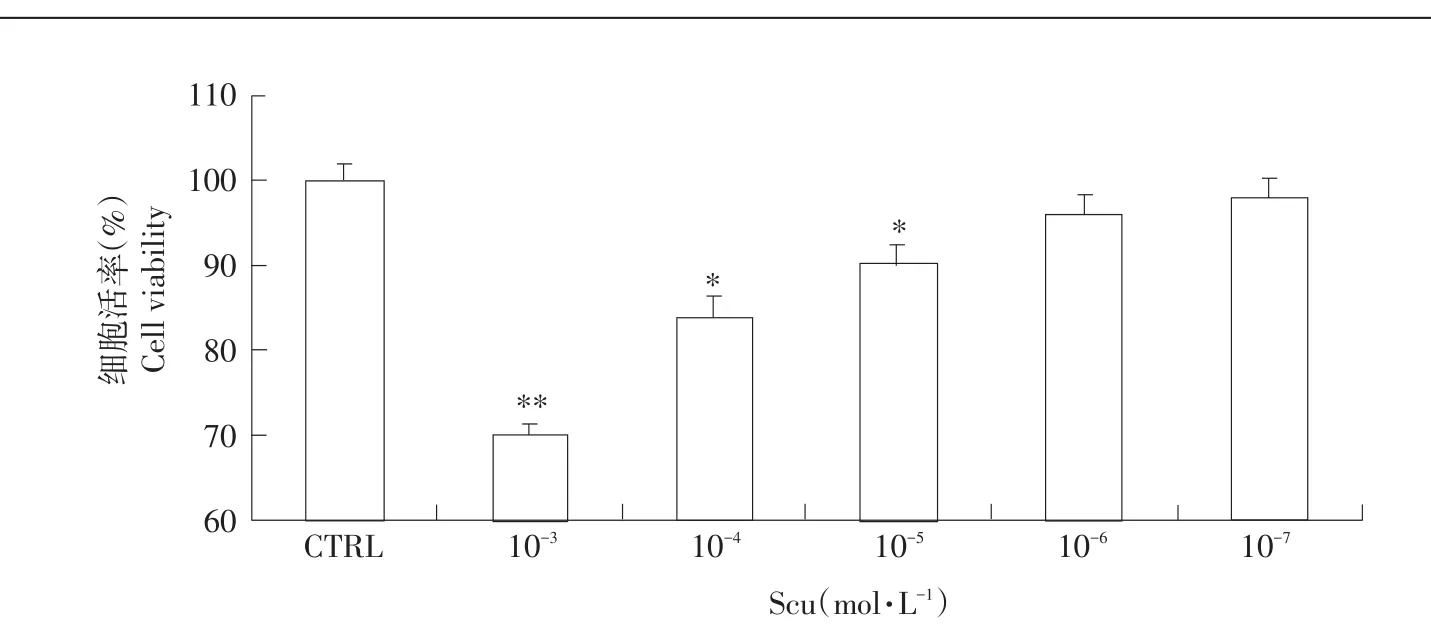
图1 不同浓度Scu对LLC-PK1细胞活力影响Fig.1Effects of different concentration of Scu on LLC-PK1 cells viability
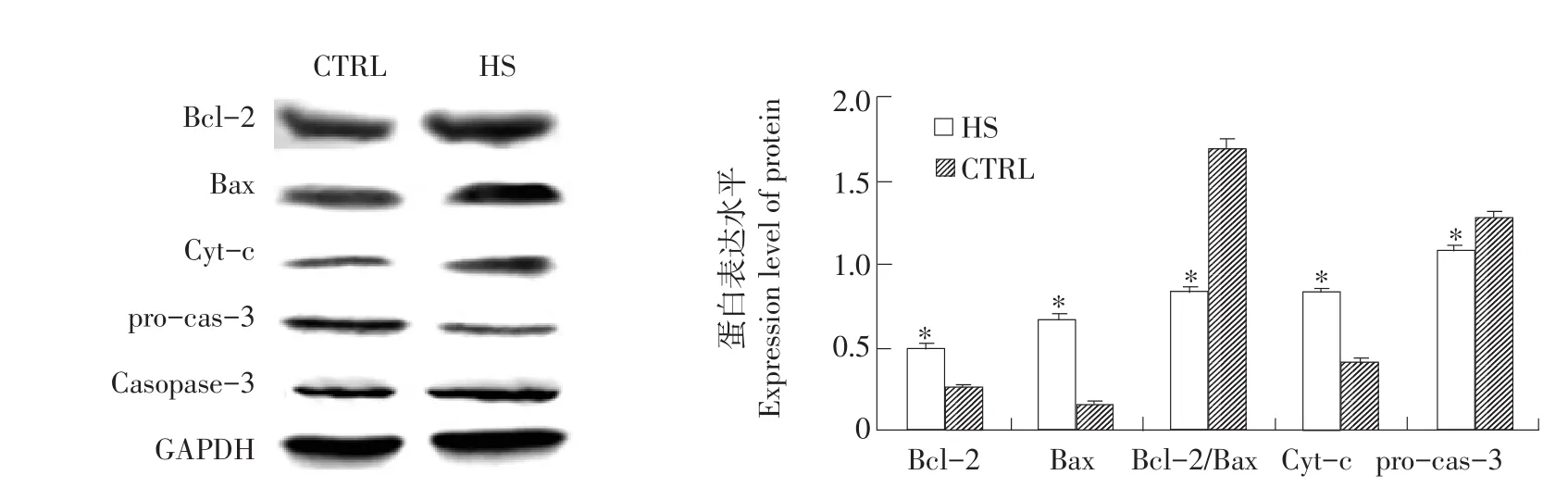
图2 热应激对细胞Bcl-2、Bax、cyt-c、pro-caspase-3和caspase-3蛋白表达影响Fig.2Effects of heat stress on Bcl-2,Bax,cyt-c,pro-caspase-3 and caspase-3 protein expression
2.3 Scu对受热应激细胞Bcl-2、Bax及HSP70 mRNA表达影响
qRT-PCR检测结果显示,与热应激组比,Scu处理组(ScuM)细胞Bcl-2 mRNA表达显著(P<0.05)升高(见表3),而Bax mRNA表达则显著(P<0.05)降低(见表3),并且Bcl-2/Bax mRNA比值也显著(P<0.05)升高(见表3);值得注意的是,Scu(ScuM,P<0.01;ScuL,P<0.05)处理,比热应激组显著增加HSP70 mRNA表达,而当Scu浓度增加(ScuH)时,表达差异不显著(P>0.05)(见表3)。

表3 Scu对热应激细胞Bcl-2、Bax及HSP70 mRNA表达水平影响Table 3Effects of Scu on Bcl-2,Bax and HSP70 mRNA expression
2.4 对热应激细胞Bcl-2、Bax及HSP70蛋白表达影响
Western blot检测结果(见图3)发现,与热应激组比较,Scu处理组(ScuM)细胞Bcl-2蛋白表达显著(P<0.05)升高,而Bax蛋白表达则显著(P<0.05)降低;Scu处理组(ScuM和ScuL)细胞Bcl-2/Bax蛋白比值以及HSP70蛋白和pro-caspase-3的表达量均显著升高,而cyt-c含量和caspase-3表达量则显著(P<0.05)降低(见表4)。
2.5 siRNA对细胞热应激后HSP70表达抑制
Western blot检测发现,与热应激组比较,siRNA0、siRNA2、siRNA3和siRNA4组细胞HSP70蛋白表达均无显著差异,仅siRNA1组细胞HSP70蛋白表达极显著(P<0.01)下降,抑制率为87.3%(见图4)。
2.6 沉默HSP70对Scu抗细胞凋亡相关蛋白表达影响
Western blot检测结果(见图5)显示,与单纯热应激组相比,转染siRNA组细胞cyt-c、procaspase-3和caspase-3蛋白表达均无显著(P>0.05)变化;而Scu(ScuM)可显著(P<0.05)抑制热应激诱导的cyt-c释放及pro-caspase-3裂解,显著(P<0.05)降低caspase-3表达。沉默HSP70后,阻止Scu降低线粒体释放cyt-c作用,细胞质中cyt-c量显著(P<0.05)升高;pro-caspase-3裂解显著(P<0.05)升高;caspase-3表达显著(P<0.05)升高。
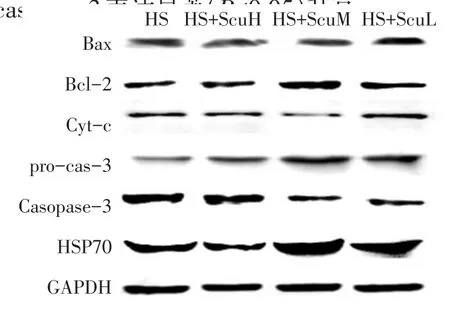
图3 Scu对热应激细胞Bcl-2、Bax及HSP70蛋白表达影响Fig.3Effects of Scu on Bcl-2,Bax,cyt-c,pro-caspase-3, caspase-3 and HSP70 protein expression
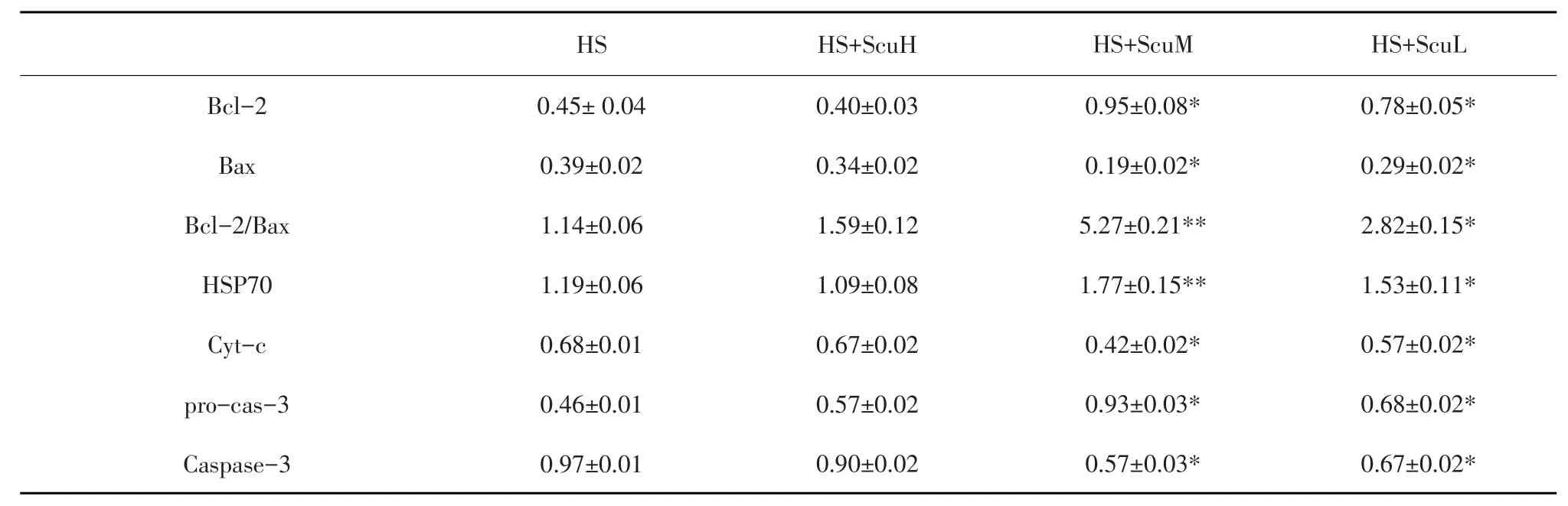
表4 Scu对热应激细胞Bcl-2、Bax及HSP70蛋白表达的影响Table 4Effects of Scu on Bcl-2,Bax,cyt-c,pro-caspase-3,caspase-3 and HSP70 protein expression
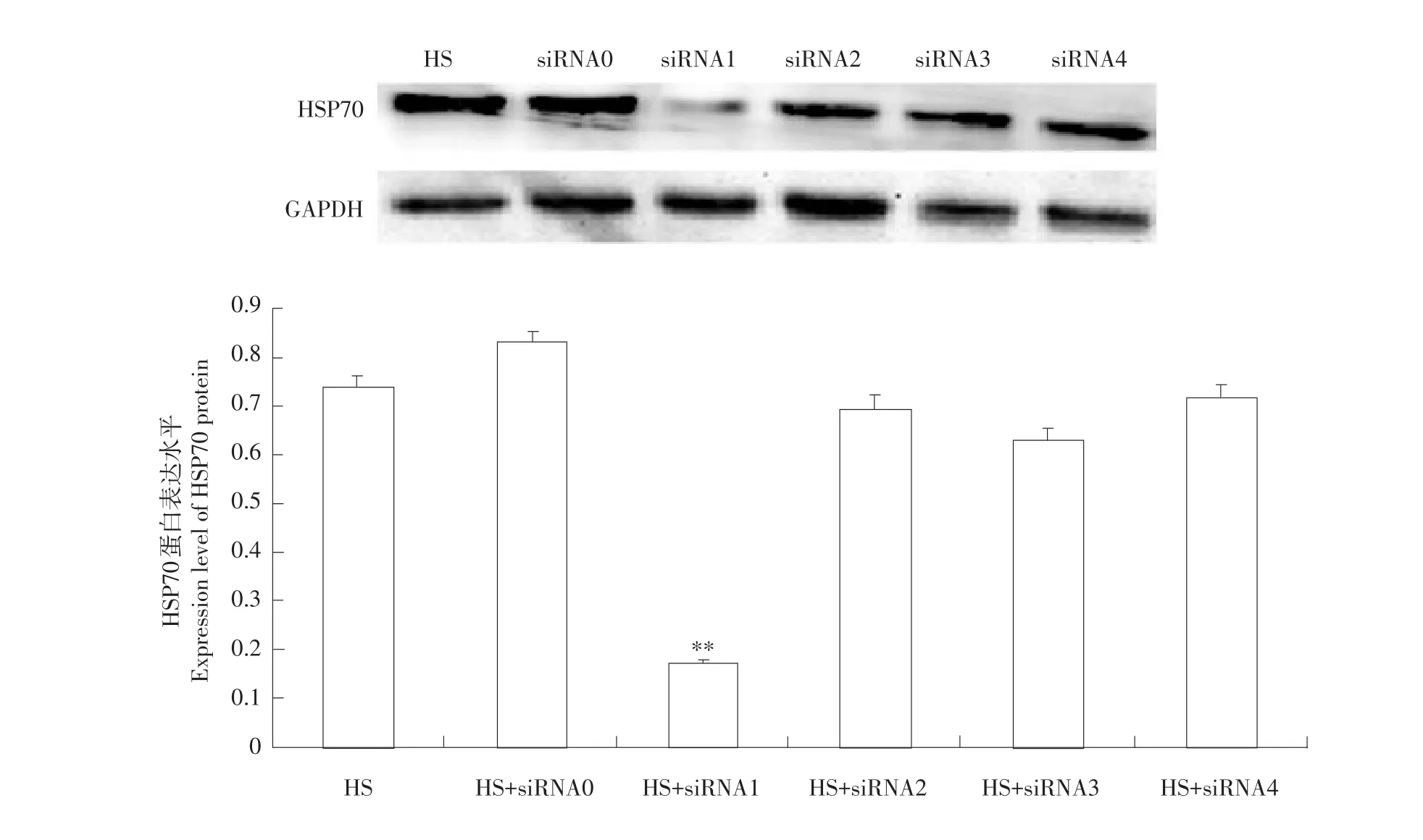
图4 不同siRNA片段对细胞热应激后HSP70蛋白表达影响Fig.4Effect of different siRNA on relative amount of HSP70 protein expression
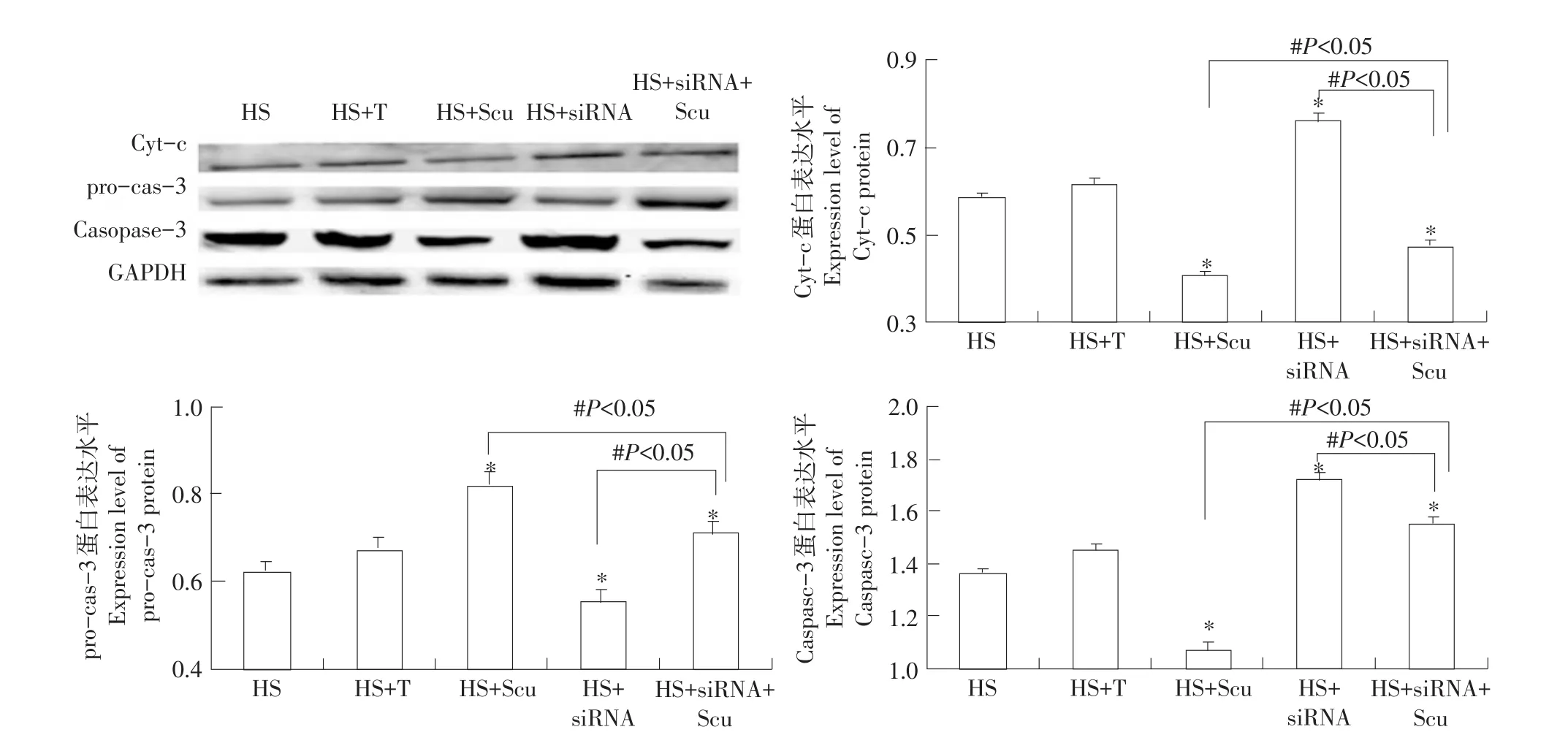
图5 沉默HSP70对Scu抗细胞凋亡相关蛋白表达的影响Fig.5Silence HSP70 affect expression of apoptotic relative proteins
3 讨论与结论
Bax和Bcl-2是重要细胞凋亡调节因子,其中Bcl-2是抗凋亡基因,Bax可抑制Bcl-2蛋白作用,其过度表达可促使细胞凋亡,Iwayama等研究认为,Bax通过与Bcl-2形成异源二聚体颉颃Bcl-2保护效应而促使细胞凋亡,Bcl-2和Bax蛋白比值决定细胞是否凋亡,Bcl-2/Bax值升高抑制细胞凋亡。因此,Bcl-2/Bax值是细胞凋亡阈值的关键因素[11]。本研究发现,热应激时Scu通过下调Bax并上调Bcl-2蛋白表达,提高Bcl-2/Bax值,表明Scu能缓解由热应激导致的细胞损伤,抑制LLC-PK1细胞凋亡。同时,热应激诱导LLC-PK1细胞释放Cyt-c,进一步激活caspase-9,使pro-caspase-3裂解成活化caspase-3,启动细胞凋亡。Caspase-3在细胞凋亡中发挥重要作用,是细胞凋亡主要效应执行者,一旦活化,凋亡不可逆转。Pro-caspase-3裂解激活caspase-3依赖于从线粒体中释放的cyt-c,激活的caspase-3可水解包括细胞调节、细胞信号转导、DNA修复、细胞存活等环节重要蛋白,使细胞表现为凋亡特有的形态学及生物化学特征。刘萍等研究发现,Scu可增加H2O2诱导的PC12 Bcl-2 mRNA表达,减弱caspase-3酶活性,降低P12细胞凋亡率[12]。徐华等研究证实,灯盏花素对顺铂肾毒性的保护作用机制与Bcl-2/Bax值相关[13]。说明Scu可通过提高Bcl-2表达,降低pro-caspase-3裂解水平发挥对细胞的保护作用。Hanqing C等研究发现,Scu对SAP大鼠肾小管细胞损伤具有明显保护作用[14]。本研究发现,一定浓度Scu可抑制LLC-PK1细胞Cyt-c的释放和caspase-3表达,原因是Scu改变细胞线粒体外膜通透性,抑制细胞色素C释放。本试验结果证实,Scu预处理可减少热应激诱导的LLCPK1细胞凋亡。
HSP70是机体在应激情况下迅速合成的蛋白质,被视为热应激过程中保护细胞的主要分子之一。HSP70能保护细胞免受高温损伤、提高细胞耐热性,HSP70可抑制凋亡小体形成,抑制细胞凋亡,提高细胞存活率。此外,HSP70还能直接保护H2O2和顺铂诱导的LLC-PK1细胞损伤[15]。热应激能够诱导LLC-PK1细胞高表达HSP70[16]。本研究发现,Scu能增加LLC-PK1细胞HSP70表达。这可能是Scu使细胞耐热,因为HSP70能修复应激损伤并恢复错误折叠蛋白[17]。本研究推测,Scu对细胞保护作用可能是由于:①Scu上调HSP70表达,修复细胞内变性Bcl-2蛋白,防止其被降解[18];另一方面,HSP70过表达有效促进核仁素上调,稳定Bcl-2 mRNA表达[19],促进Bcl-2表达,发挥凋亡抑制功能。②Scu上调HSP70表达,阻止Bax转移至线粒体[20],使线粒体膜电位趋于稳定[21],阻止cyt-c释放,抑制pro-caspase-3裂解,发挥细胞保护作用。
为证实Scu是否通过上调细胞HSP70表达起保护作用,本文用RNA干扰方法沉默HSP70表达,结果发现,单纯热应激诱导的HSP70表达不影响细胞线粒体释放Cyt-c及pro-caspase-3裂解,但沉默HSP70的表达可阻断Scu对细胞保护作用。说明Scu通过上调HSP70表达而对LLC-PK1细胞热应激损伤起保护作用。这可能是在氧化应激条件下,HSP70通过上调Bcl-2/Bax值,抑制线粒体膜电位改变,阻止cyt-c释放;此外,HSP70可与凋亡蛋白酶激活因子(Apaf-1)竞争性结合,抑制cyt-c与Apaf-1结合,阻止下游caspase-9激活caspase-3,最终阻止细胞凋亡。Liang等研究表明,细胞内钙离子增加可激活钙/钙调蛋白(CaM)和钙/钙调蛋白依赖的蛋白激酶II(CaMKII)信号通路[22],进一步诱导HSP70表达[23-24]。增加细胞内钙离子水平可以诱导HSP70表达[25]。本研究发现,热应激时siRNA不能完全阻断Scu降低Cyt-c释放和procaspase-3裂解作用。然而,Scu可降低活性氧生成,抑制p38 MAPK活化[9],防止Bax易位到线粒体及Cyt-c释放[26]。因此推测,Scu对LLC-PK1细胞保护作用还可能通过p38 MAPK信号转导通路,有效抑制热应激对LLC-PK1细胞的氧化及对细胞线粒体损伤实现,此亦有待深入研究的方向之一。
[1]Choe J Y,Park K Y,Kim S K.Oxidative stress by monosodium urate crystals promotes renal cell apoptosis through mitochondrial caspase-dependent pathway in human embryonic kidney 293 cells:mechanism for urate-induced nephropathy[J].Apoptosis, 2015,20(1):38-49.
[2]Sanz A B,Santamaria B,Ruiz-Ortega M,et al.Mechanisms of renal apoptosis in health and disease[J].J Am Soc Nephrol,2008, 19(9):1634-1642.
[3]Chao D T,Korsmeyer S J.BCL-2 family:Regulators of cell death [J].Annu Rev Immunol,1998,16:395-419.
[4]Li C Y,Lee J S,Ko Y G,et al.Heat shock protein 70 inhibits apoptosis downstream of cytochrome c release and upstream of caspase-3 activation[J].J Biol Chem,2000,275(33):25665-25671.
[5]Gotoh T,Terada K,Oyadomari S,et al.hsp70-DnaJ chaperone pair prevents nitric oxide-and CHOP-induced apoptosis by inhibiting translocation of Bax to mitochondria[J].Cell Death Differ,2004,11(4):390-402.
[6]Ravagnan L,Gurbuxani S,Susin S A,et al.Heat-shock protein 70 antagonizes apoptosis-inducing factor[J].Nat Cell Biol,2001,3 (9):839-843.
[7]Pan Z,Zhao W,Zhang X,et al.Scutellarin alleviates interstitial fibrosis and cardiac dysfunction of infarct rats by inhibiting TGFbeta1 expression and activation of p38-MAPK and ERK1/2 [J].Br J Pharmacol,2011,162(3):688-700.
[8]Zhang H F,Hu X M,Wang L X,et al.Protective effects of scutellarin against cerebral ischemia in rats:Evidence for inhibition of the apoptosis-inducing factor pathway[J].Planta Med,2009,75(2):121-126.
[9]Wang L X,Zeng J P,Wei X B,et al.Effects of scutellarin on apoptosis induced by cobalt chloride in PC12 cells[J].Chin J Physiol,2007,50(6):301-307.
[10]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T))Method[J].Methods,2001,25(4):402-408.
[11]Iwayama H,Ueda N.Role of mitochondrial Bax,caspases,and MAPKs for ceramide-induced apoptosis in renal proximal tubular cells[J].Mol Cell Biochem,2013,379(1-2):37-42.
[12]刘萍,洪浩.灯盏乙素抑制过氧化氢诱导PC12细胞凋亡及机制[J].中国临床药理学与治疗学,2008,13(3):283-287.
[13]徐华,常陆林,马天江,等.灯盏花素对肾损害小鼠肾组织细胞凋亡及相关蛋白的影响[J].中国实验方剂学杂志,2013,19(6): 260-263.
[14]Hanqing C,Xiping Z,Jingmin O,et al.Research on scutellarin parenteral solution's protective effects in rats with severe acute pancreatitis and multiple organ injuries[J].Inflammation,2012, 35(3):1005-1014.
[15]Komatsuda A,Wakui H,Oyama Y,et al.Overexpression of the human 72 ku heat shock protein in renal tubular cells confers resistanceagainstoxidativeinjuryandcisplatintoxicity[J]. Nephrol Dial Transplant,1999,14(6):1385-1390.
[16]Li C Y,Lee J S,Ko Y G,et al.Heat shock protein 70 inhibits apoptosis downstream of cytochrome c release and upstream of caspase-3 activation[J].J Biol Chem,2000,275(33):25665-25671.
[17]Jiang B,Liang P,Deng G,et al.Increased stability of Bcl-2 in HSP70-mediated protection against apoptosis induced by oxida-tive stress[J].Cell Stress Chaperones,2011,16(2):143-152.
[18]Samali A,Cotter T G.Heat shock proteins increase resistance to apoptosis[J].Exp Cell Res,1996,223(1):163-170.
[19]王慷慨,蒋磊,刘可,等.热休克蛋白70对氧化应激所致核仁素裂解的影响[J].中国动脉硬化杂志,2004,12(4):373-377.
[20]Stankiewicz A R,Lachapelle G,Foo C P,et al.Hsp70 inhibits heat-induced apoptosis upstream of mitochondria by preventing Bax translocation[J].J Biol Chem,2005,280(46):38729-38739.
[21]Yi X,Yin X M,Dong Z.Inhibition of Bid-induced apoptosis by Bcl-2.tBid insertion,Bax translocation,and Bax/Bak oligomerization suppressed[J].J Biol Chem,2003,278(19):16992-16999.
[22]Liang R,Liu X,Wei L,et al.The modulation of the excitability of primary sensory neurons by Ca(2)(+)-CaM-CaMKII pathway[J]. Neurol Sci,2012,33(5):1083-1093.
[23]Peng W,Zhang Y,Zheng M,et al.Cardioprotection by CaMKII-deltaB is mediated by phosphorylation of heat shock factor 1 and subsequent expression of inducible heat shock protein 70[J].Circ Res,2010,106(1):102-110.
[24]Huang M,Wei J N,Peng W X,et al.The association of CaM and Hsp70 regulates S-phase arrest and apoptosis in a spatially and temporally dependent manner in human cells[J].Cell Stress Chaperones,2009,14(4):343-353.
[25]Wong V K,Li T,Law B Y,et al.Saikosaponin-d,a novel SERCA inhibitor,induces autophagic cell death in apoptosis-defective cells[J].Cell Death Dis,2013(4):720.
[26]Van Laethem A,Van Kelst S,Lippens S,et al.Activation of p38 MAPKisrequiredforBaxtranslocationtomitochondria, cytochrome c release and apoptosis induced by UVB irradiation in human keratinocytes[J].Faseb J,2004,18(15):1946-1948.
Study on scutellarin attenuates heat stress-induced apoptosis in LLC-PK1 cells/
CONG Xia1,LI Huatao1,CHEN Jianwei1,ZHANG Dongjun2,CAO Rongfeng1,TIAN Wenru1(1.School of Animal Science and Veterinary Medicine,Qingdao Agricultural University, Qingdao Shandong 266109,China;2.Veterinary and Animal Husbandry Department Feicheng, Feicheng Shandong 271600,China)
Scutellarin(Scu)is known to abate fever in the clinical practice of Traditional Chinese Medicine.The primary cultured pig kidney proximal tubular(LLC-PK1)cells incubated with(or without) various concentrations of Scu were heat-stressed at 42℃for 1 h to make heat shock injury cellular model.RNAi technique was used to silence heat shock protein(HSP)70 mRNA expression.The HSP70,Bcl-2,Bax,cytochrome c(cyt-c)and pro-caspase-3 cleavage of the cells were all detected by using real-time PCR and Western blot aimed to examine the effects of Scu on heat-stressed LLC-PK1 cells and to explore its possible mechanism.The results showed that Scu significantly increased the levels of Bcl-2 and HSP70 protein,the ratio of Bcl-2 to Bax,and inhibited the release of cyt-c,procaspase-3 cleavage as well as caspase-3 expression.Interestingly,caspase-3 expression and release of cyt-c were dramatically increased in the cells with HSP70 RNA interference.These results demonstrate that Scu protects LLC-PK1 cells against heat stress,possibly by up-regulating HSP70 expression.
scutellarin;LLC-PK1;apoptosis;heat stress;HSP70
S853.72
A
1005-9369(2016)11-0059-07
时间2016-11-30 15:18:38[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161130.1518.002.html
丛霞,李华涛,陈健伟,等.灯盏乙素抑制热应激诱导猪肾小管上皮细胞凋亡研究[J].东北农业大学学报,2016,47(11):59-65
Cong Xia,Li Huatao,Chen Jianwei,et al.Study on scutellarin attenuates heat stress-induced apoptosis in LLC-PK1 cells [J].Journal of Northeast Agricultural University,2016,47(11):59-65.(in Chinese with English abstract)
2016-09-16
国家自然科学基金(31572590,31502138);山东省自然科学基金(BS2015NY001);山东省高等学校科技计划项目(J15LF03)
丛霞(1962-),女,高级实验师,硕士,研究方向为动物生殖生理与生殖疾病。E-mail:780010688@qq.com
*通讯作者:田文儒,教授,博士生导师,研究方向为动物生殖生理与生殖疾病。E-mail:wrtian@126.com
