兔抗猪繁殖与呼吸综合征病毒血清在Marc-145细胞上对病毒复制影响
2016-12-27赵孟孟孙龙陈耀张雅张二芹冯松林张桂红
赵孟孟,孙龙,陈耀,张雅,张二芹,冯松林,张桂红*
(1.河南农业大学牧医工程学院,郑州 450002;2.华南农业大学兽医学院,国家生猪种业工程技术研究中心,广东省动物源性人兽共患病预防与控制重点实验室,广州 510642)
兔抗猪繁殖与呼吸综合征病毒血清在Marc-145细胞上对病毒复制影响
赵孟孟1,2,孙龙2,陈耀2,张雅1,张二芹1,冯松林2,张桂红2*
(1.河南农业大学牧医工程学院,郑州 450002;2.华南农业大学兽医学院,国家生猪种业工程技术研究中心,广东省动物源性人兽共患病预防与控制重点实验室,广州 510642)
制备兔抗猪繁殖与呼吸综合征病毒抗血清,探索其对病毒复制影响,通过大量培养猪繁殖与呼吸综合征病毒XH-GD株病毒,高速离心后蔗糖梯度纯化浓缩并免疫新西兰大白兔,4免后采集抗血清,ELISA法测定效价。同时将抗血清与病毒共同孵育接种Marc-145细胞,荧光定量PCR和TCID50测定病毒复制情况。成功制备兔抗猪繁殖与呼吸综合征病毒抗血清,效价达1∶640,抗血清可以在mRNA水平和TCID50上降低病毒滴度。结果表明,兔抗猪繁殖与呼吸综合征病毒抗血清可以在Marc-145细胞上抑制猪繁殖与呼吸综合征病毒复制。
猪繁殖与呼吸综合征病毒;抗血清;Marc-145细胞;复制;滴度
猪繁殖与呼吸综合征(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种接触性传染病,主要特征为母猪厌食、发热、产弱仔、流产等繁殖障碍和仔猪及各年龄段猪只呼吸道症状。PRRSV根据抗原性差异分为欧洲型和美洲型,我国主要流行美洲型。猪繁殖与呼吸综合征病毒基因组主要编码10个开放阅读框(Open reading frame,ORF)[1-3]。从5'端到3'端依次为ORFla、ORFlab和ORF2~ORF7,ORF2~ORF7编码病毒结构蛋白,其中ORF2~ORF5编码病毒的糖基化蛋白,ORF6编码膜基质蛋白,ORF7编码核衣壳N蛋白。ORF1a可继续水解为Nsp1a,Nsp1b,Nsp2~Nsp6,Nsp7a,Nsp7b,Nsp8,ORFlab水解为Nsp9、Nsp10、Nsp11、Nsp12[4-6]。
PRRSV自1987年美国首次报道后[7],1996年我国首次报道[8],2006年暴发,对养猪业造成重大经济损失。主要病原是Nsp2缺失30氨基酸的变异株高致病性猪繁殖与呼吸综合征病毒[9-11],2015年我国出现新NVDC-30毒株[12]。该病毒GP5蛋白、Nsp2不断变异,非结构蛋白变异较少[13-15],新的亚型使该病难以诊断和防控;抗体依赖增强(ADE)效应[16],疫苗研发受阻,缺少高效药物和疫苗。
目前国内主流检测方法主要是酶联免疫吸附试验(ELISA)检测方法,主要依赖进口,成本较高,国产试剂稳定性较差,批间差异大,其他诊断方法主要包括聚合酶链式反应(PCR)、间接免疫荧光(IFA)、病毒分离、LAMP检测方法、免疫过氧化物酶单层细胞试验(IPMA)方法、血清中和试验、胶体金免疫层析方法、基因芯片技术等。其中聚合酶链式反应(PCR)主要针对病毒核酸,不能鉴别病毒活性,容易产生假阳性等问题,病毒分离方法虽准确可行,但繁琐且用时较长。LAMP检测方法容易产生假阳性,IPMA方法受人为影响因素大,血清中和试验敏感性较差,不适用急性感染。胶体金免疫层析方法在猪繁殖与呼吸综合征病毒上因为敏感性和特异性以及不能检测欧洲株病毒等原因尚未大范围推广。基因芯片技术对设备要求较高。间接免疫荧光方法主要特异针对病毒结构蛋白和非结构蛋白,特异性和免疫原性良好,为多数实验室采用,是官方检测方法之一。针对N蛋白、Nsp9蛋白、Nsp7蛋白的间接免疫荧光检测方法,仅针对特定蛋白而非全病毒,病毒感染量低则很难检测,临床样品获得的猪阳性血清可能污染其他病毒,影响检测结果。
为更加准确、简易诊断该病,本试验将高致病性毒株纯化后制备成油佐剂抗原免疫新西兰大白兔,获得抗血清,一方面避免猪源病毒污染,另一方面覆盖多个病毒蛋白表位,减少假阴性概率,鉴定病毒抑制作用,为准确诊断猪繁殖与呼吸综合征奠定基础。
1 材料与方法
1.1 材料
PRRSVXH-GD种毒(GenBank登录号EU624117)、猪阳性血清、阴性血清、兔阴性血清、Mac-145细胞由农业部兽用疫苗创制重点实验室保存;试验动物为4只新西兰大白兔购自广东省实验动物中心;高糖DMEM培养液、胎牛血清、胰酶,双抗购自Gibco公司;细胞培养瓶,96孔细胞培养板购自Corning公司;辣根过氧化物酶标记山羊抗兔IgG,山羊抗猪IgG,异硫氰酸荧光素标记的山羊抗兔IgG,山羊抗猪IgG购自北京博奥森生物技术有限公司产品;弗氏完全佐剂与弗氏不完全佐剂购自Sigma公司;脱脂奶粉,TMB,4%多聚甲醛,Trition-X 100,DAB显色液,考马斯亮蓝G-250,脱色液以及国产分析纯试剂购自北京鼎国生物有限公司;MMLV反转录酶,SYBR®Premix Ex Taq(Tli RNaseH Plus),dNTP购自Takara公司;TRIzol购自Life Technology公司。
1.2 方法
1.2.1 病毒培养
将Marc-145细胞在细胞培养瓶中单层培养,生长至80%并且状态较好时,以1个病毒感染复数(Multiplicity of infection,MOI)剂量接种PPRRV XH-GD毒株,37℃5%CO2培养箱中吸附1 h,PBS清洗3次,之后加入含2%胎牛血清(FBS)维持液,48 h之后反复3次冻融细胞,4℃10 000 r·min-1离心30 min,弃沉淀和细胞碎片,收集上清中病毒液,-80℃保存。
1.2.2 病毒浓缩与纯化
取上述病毒培养液4 L,高速离心机中40 000 r·min-1速度离心5 h,参照文献[17]制备20%、35%、50%浓度蔗糖溶液各2 mL,注射器注入10 mL离心管中,将超离后重悬液1 mL加入梯度蔗糖上层,4℃、40 000 r·min-1离心4 h,收集各层溶液至新离心管,添加PBS至10 mL,4℃、50 000 r·min-1离心1 h去蔗糖,沉淀用1 mL PBS重悬,纯化后病毒用于SDS-PAGE蛋白电泳分析,并分别和等量弗氏完全佐剂与不完全佐剂混合制成免疫用抗原。
1.2.3 SDS-PAGE蛋白电泳分析
配制12%分离胶和5%积层胶,SDS-PAGE电泳检测。将瞬时离心后样品用微量移液器加样,每个泳道最大上样量为20 μL。样品在积层胶为恒压80 V,待染料进入分离胶后电压加至120 V,直到染料抵达分离胶底部,断开电源。电泳结束后,取出凝胶,做好标记,考马斯亮蓝G-250染色液缓慢震荡染色1 h,弃去染液,将凝胶在清水中漂洗数次,加入考马斯亮蓝脱色液。为脱色完全,脱色过程需更换脱色液数次,脱色完毕后将凝胶在清水中漂洗数次,观察分析结果。
1.2.4 免疫接种
参照文献[18]进行免疫,每只新西兰大白兔免疫100 μg,初免后2周二免,二免后2周三免,三免后2周四免,四免后心脏采血,37℃静置20 min,分离血清。
1.2.5 ELISA效价测定
①发包被:用包被液将上述纯化样品稀释至10 μg·mL-1作为抗原,于酶标板中每孔加入200 μL,盖好,4℃条件下过夜。②洗涤:次日,除去孔内抗原溶液,每孔加入洗涤液200 μL,震荡1 min,甩干洗涤液,重复3~4次。③加入一抗:将血清(对照血清和免疫血清)用稀释液作10倍倍比稀释,然后于每孔内分别依次加入不同稀释倍数抗体稀释液200 μL,盖好,平板置37℃温箱保温2~3 h。④洗涤:反应完毕,洗涤液洗孔4次。甩干洗涤液。⑤加入酶标二抗:用稀释液将酶标二抗1∶20 000倍稀释,置37℃温箱保温1 h。反应完毕如前所述,洗涤液洗板4次。⑥显色:根据TMB底物显色试剂盒说明书配制TMB显色工作液。每孔加入100 μL底物显色工作液,室温避光孵育30 min,反应产物呈蓝色。每孔加50 μL终止液,此时蓝色产物变为亮黄色。⑦读数:将酶标板置于酶标仪中,450 nm波长下读取数据。
1.2.6 间接免疫荧光试验(IFA)测定抗血清特异性
将PRRSV病毒XH-GD毒株以1个病毒感染复数(MO)剂量感染长至约80%的Marc-145细胞,24 h后,4%多聚甲醛固定20 min,0.25%Triton-x100通透细胞20 min,5%脱脂奶粉封闭1h之后将抗血清1: 100稀释后作为一抗,二抗为1∶100稀释异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)标记的羊抗兔IgG,37℃反应1 h,通过IFA试验验证抗血清特异性,同时设置猪血清阳性对照和各阴性血清对照,方法同上,荧光显微镜下观察。
1.2.7 过氧化物酶单层细胞试验(IPMA)试验测定抗血清特异性
将PRRSV病毒XH-GD毒株以1个病毒感染复数剂量感染长至约80%的Marc-145细胞,24 h之后,4%多聚甲醛固定20 min,0.25%Trition-x100通透细胞20 min,然后5%脱脂奶粉封闭1 h,将抗血清1∶150倍稀释后作为一抗,二抗为1∶200稀释辣根过氧化物酶(Horseradish peroxidase,HRP)标记的羊抗兔IgG,37℃反应1 h,通过IPMA验证抗血清的特异性,同时设置猪血清阳性对照和各种阴性血清对照,方法同上,显微镜下观察拍照。
1.2.8 抗血清与病毒孵育
将抗血清与PRRSV XH-GD株以同等剂量混合,37℃反应1 h,之后以1个MOI的剂量混合孵育接种长满单层的Marc-145细胞,吸附2 h后弃上清,PBS清洗3次,加入2%维持液。
1.2.9 荧光定量PCR测定病毒N蛋白mRNA表达水平
接毒36 h后,细胞单层加入750 μL TRizol试剂,置于DEPC水处理1.5 mL灭菌离心管中,按照Invitrogen公司Trizol®Reagent RNA提取试剂的使用说明书操作,提取病毒总RNA。反转录参照宝生物工程(大连)有限公司M-MLV反转录酶使用说明书反转录:RNA 9.5 μL,RNase Inhibitor 0.5 μL,5× MLV Buffer 4.0 μL,dNTPs 4.0 μL,M-MLV 1.0 μL,反转录引物1.0 μL。混匀后,置42℃水浴1 h,冰浴2 min,反转录产物(cDNA)直接进行qPCR反应或-20℃保存备用。
以反转录样品为模板进行PCR反应,PCR体系20 μL:SYBR®Premix Ex Taq(Tli RNaseH Plus)(2×)10.0 μL,上、下游引物各0.4 μL,ROX Reference DyeⅡ(50×)0.4 μL,DNA模板2 μL,ddH2O 6.8 μL,扩增条件:94℃预变性5 min,1个循环;94℃变性10 s,55℃退火20 s,72℃延伸30 s,40个循环。另外PRRSV N蛋白荧光定量引物为qN-F:5' AAACCAGTCCAGAGGCAAGG 3',qN-R:5'GCAAA CTAAACTCCACAGTGTAA 3',甘油醛-3-磷酸脱氢酶GAPDH荧光定量引物为qGAPDH-F:5'CTGCCG CCTGGAGAAACCT 3',qGAPDH-R:5'GCTGTAG CCAAATTCATTGTCG 3',上述引物均由上海立菲生物科技有限公司合成。
1.2.10 病毒滴度TCID50测定
在96孔细胞培养板上接种Marc-145细胞,待细胞生长至85%以上用样品接种。每个样品做10倍梯度的倍比稀释(即10-1~10-8倍比稀释,每个稀释度接种8孔,100 μL·孔-1)。接毒后,将细胞板放置37℃、5%CO2细胞培养箱中孵育1.5 h。孵育完毕后弃去病毒液,补入含2%新生牛血清的DMEM,放置于37℃、5%CO2细胞培养箱中继续培养。连续观察2~7 d,记录每个稀释度发生细胞病变孔数,重复3次求平均值,按照Reed-Muench法计算各样品TCID50。
1.2.11 数据分析
荧光定量数据采用2-ΔΔCt方法计算,荧光定量和TCID50数据采用Graphpad Prism 5软件分析,*代表P<0.05,差异显著,具有统计学意义。
2 结果与分析
2.1 细胞病变与离心结果
PRRSV接种到长满单层的Marc-145细胞,36 h后Marc-145细胞出现病变,与对照组相比,主要表现为细胞聚集,破裂,分布不均匀,结果见图1。病毒浓缩后经SDS-PAGE电泳分析结果见图2,可见与病毒结构蛋白大小相似的条带,表明病毒纯化结果较好,与预期一致,其中病毒结构蛋白主要集中在15~30 ku。

图1 Marc-145细胞病变图Fig.1CPE of Marc-145 cells
2.2 抗血清效价与间接免疫荧光试验结果
间接ELISA测定结果表明抗血清效价为1∶640,间接免疫荧光试验结果表明以猪阳性血清对照为一抗的细胞出现可见绿色荧光,以猪阴性血清为一抗的对照无可见荧光,以兔高免血清为一抗的细胞出现绿色荧光,主要围绕在细胞核附近,以兔阴性血清为一抗的细胞样品无绿色荧光。结果表明阴阳对照组成立,制备的抗血清可以和病毒感染的Marc-145反应,结果见图3。
2.3 IPMA试验结果
IPMA试验结果表明以猪阳性血清对照为一抗细胞出现可见棕色阳性细胞,以猪阴性血清为一抗对照无可见棕色阳性细胞,以兔阳性血清为一抗细胞样品出现棕色阳性细胞,以兔阴性血清为一抗细胞样品无棕色阳性细胞。结果表明阴阳对照组成立,结果可靠,制备的抗血清可和病毒感染的Marc-145反应结果见图4。
2.4 TCID50变化
高免血清和病毒孵育结束后接毒Marc-145细胞,36 h后收集细胞上清作TCID50试验,与阴性血清孵育的对照组相比,孵育高免血清Marc-145细胞上病毒滴度低于孵育阴性血清细胞,统计学差异显著,结果见图5。
2.5 PRRSV N蛋白mRNA表达水平变化
高免血清和病毒孵育结束后接毒Marc-145细胞,36 h后收集单层细胞作荧光定量试验,与阴性血清孵育的对照组相比,孵育高免血清的Marc-145细胞上的病毒N蛋白mRNA水平低于孵育兔阴性血清细胞,统计学差异显著,M结果见图16。
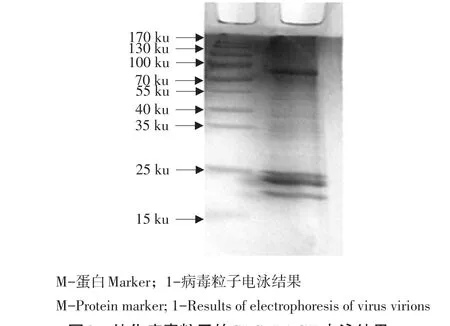
图2 纯化病毒粒子的SDS-PAGE电泳结果Fig.2Results of SDS-PAGE of purified virus virions

图3 抗血清间接免疫荧光图结果Fig.3IFA result of hyper-immune serum

图4 抗血清IPMA结果Fig.4IPMA result of hyper-immune serum

图5 病毒滴度差异Fig.5Variance of viral titer
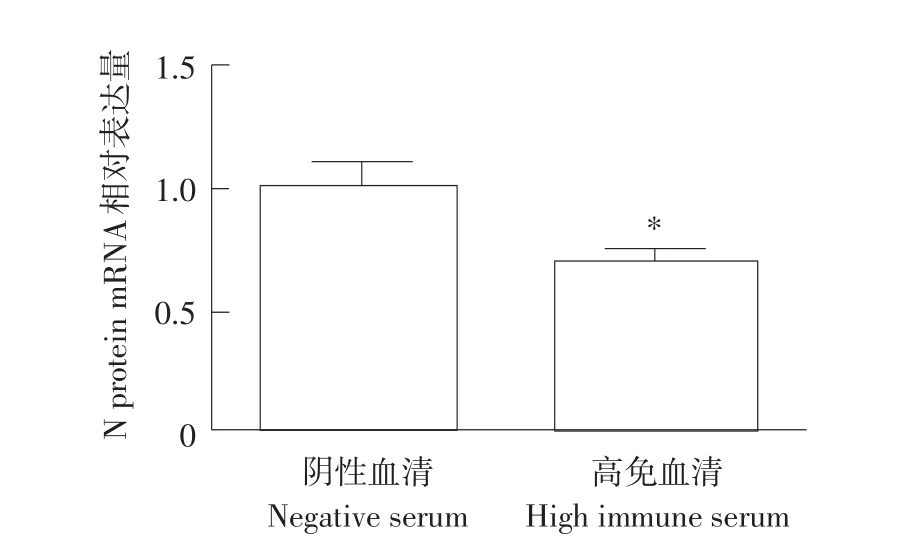
图6 N蛋白mRNA水平变化Fig.6mRNA level of N gene
3 讨论与结论
本试验将高致病性猪繁殖与呼吸综合征病毒增殖后,经乳化制成油佐剂抗原多次免疫兔子,获得兔抗PPRSV效价达1∶640抗血清,该抗血清可识别感染细胞天然病毒,与病毒孵育后可抑制病毒在细胞中复制,为建立准确、快速、敏感的PRRSV检测方法并确定检测试剂奠定基础。
将全病毒免疫兔子后产生针对PRRSV抗体,病毒内部部分蛋白在机体内产生中和抗体抑制病毒,中和抗体抑制PRRSV活性,抑制病毒在Marc-145中复制。该蛋白可能是GP5蛋白,也可能是其他中和蛋白或多种蛋白混合物,也可能是抗血清封闭受体结合位点,阻碍病毒入侵[19]。
IFA和IPMA两种方法的灵敏度存在差异,IFA灵敏度高于IPMA,可能与各方法显色差异相关,比较后可知IFA发热灵敏度略高于IPMA方法。
特异性抗血清制备方法上,一般抗原制备纯度决定特异性优劣,如果纯化不完全,会降低抗血清特异性,制备单克隆抗体同理[20]。无高纯度抗原,不利于制备高纯度免疫产物。
在大量制备病毒过程中,病毒滴度影响病毒完整性或免疫原性,因此应保持较好细胞状态以利病毒复制,另外收毒时间最好控制在一半细胞出现病变时,一般为36或48 h,此时滴度处于较高水平,细胞较少脱落,比较适宜收毒。
在测定抗血清对病毒复制影响方面,本试验采用TCID50结合荧光定量方法测定PRRSV N蛋白mRNA水平,结果表明均明显抑制,由于荧光定量方法敏感,操作要求较高,因此在操作过程中应多次重复试验。如果病毒滴度差异较大,通过TCID50可比较差异。如果差异较小,因操作问题无法获得明显差异,需通过噬斑试验准确测定病毒粒子数目得出统计学差异。
本试验得到的抗血清可在体外抑制PRRSV复制,在疾病发生过程中紧急接种抗血清可控制疾病蔓延。如果证明有效,分离有效成分,可在一定程度上抑制PRRSV传播。设计针对病毒蛋白的药物和制剂将成为未来控制PRRSV的新方向[21-24]。
本试验成功制备兔抗猪繁殖与呼吸综合征病毒的抗血清,可识别感染细胞的天然病毒,也可中和病毒,为建立诊断方法奠定基础。
[1]Andreyev V G,Wesley R D,Mengeling W L,et al.Genetic variationandphylogeneticrelationshipsof22porcine reproductive and respiratory syndrome virus(PRRSV)field strains based on sequence analysis of open reading frame 5[J].Arch Virol,1997,142(5):993-1001.
[2]Kim H S,Kwang J,Yoon I J,et al.Enhanced replication of porcine reproductive and respiratory syndrome(PRRS)virus in a homogeneous subpopulation of MA-104 cell line[J].Arch Virol, 1993,133(3-4),477-483.
[3]Cavanagh D.Nidovirales:a new order comprising Coronaviridae and Arteriviridae[J].Arch Virol,1997,142(3):629-633.
[4]den Boon J A,Faaberg K S,Meulenberg J J,et al.Processing and evolution of the N-terminal region of the arterivirus replicase ORF1a protein:identification of two papainlike cysteine proteases [J].J Virol,1995,69(7):4500-4505.
[5]Snijder E J,Meulenberg J J.The molecular biology of arteriviruses [J].J Gen Virol,1998,79(5):961-979.
[6]Meulenberg J J,Petersen en Besten A,de Kluyver E,et al. Molecular characterization of Lelystad virus[J].Vet Microbiol, 1997(1-4),55:197-202.
[7]Benfield D A,Nelson E,Collins J E,et al.Characterization of swine infertility and respiratory syndrome(SIRS)virus(isolate ATCC VR-2332)[J].J Vet Diagn Invest,1992,4(2):127-133.
[8]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996(2):1-5.
[9]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2006,2(6):e526.
[10]Zhou L,Chen S,Zhang J,et al.Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China[J]. Virus research,2009,145:97-105.
[11]Zhou L,Zhang J,Zeng J,et al.The 30-amino-acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence [J].J Virol,2009,83(10):5156-5167.
[12]Zhou L,Wang Z,Ding Y,et al.NADC30-like Strain of Porcine Reproductive and Respiratory Syndrome Virus,China[J].Emerg Infect Dis,2015,21(12):1957-1936.
[13]李嘉彬,赵孟孟,李玉谷,等.猪繁殖与呼吸综合征病毒变异株FS的分离鉴定与全基因组序列分析[J].中国畜牧兽医,2012, 39(3):60-64.
[14]Zhao M M,Ning Z Y,Wang H et al.Sequence analysis of NSP9 gene of 25 PRRSV strains from Guangdong province,subtropical southern China[J].Virus Genes,2013,46(1):88-96.
[15]Rascon-Castelo E,Burgara-Estrella A,Mateu E,et al.Immunological features of the non-structural proteins of porcine reproductive and respiratory syndrome virus[J].Viruses,2015,7(3):873-886.
[16]Yoon K J,Wu L L,Zimmerman J J,et al.Antibody-dependent enhancement(ADE)of porcine reproductive and respiratory syndrome virus(PRRSV)infection in pigs[J].Viral Immunol 1996, 9(1):51-63.
[17]杨立清,张晋,卢立新,等.蔗糖梯度离心法纯化Vero细胞乙脑疫苗的纯度分析及与层析法的比较[J].微生物学免疫学进展, 2004,32(4):11-13.
[18]邓大旺,陈丽萍,崔健扬.浅析兔抗猪高致病性蓝耳病高免血清的制备和鉴定[J].中国畜牧兽医文摘,2012,28(5):43-46.
[19]曹宗喜,焦培荣,林哲敏,等.Marc-145细胞CD163基因克隆及其真核表达质粒构建[J].东北农业大学学报,2013,44(6):28-31.
[20]赵孟孟,张二芹,冯松林,等.猪繁殖与呼吸综合征病毒NSP9蛋白单克隆抗体制备与鉴定[J].东北农业大学学报,2016,47 (7):63-69.
[21]Cong Y,Huang Z,Sun Y,et al.Development and application of a blocking enzyme-linked immunosorbent assay(ELISA)to differentiate antibodies against live and inactivated porcine reproductive and respiratory syndrome virus[J].Virology,2013,444:310-316.
[22]Liu H,Wang Y,Duan H,et al.An intracellularly expressed Nsp9-specificnanobodyinMARC-145cellsinhibitsporcine reproductive and respiratory syndrome virus replication[J].Vet Microbiol,2015,181:252-260.
[23]Gao L,Zhang W W,Sun Y P,et al.Cryptoporus volvatus extract inhibits porcine reproductive and respiratory syndrome virus (PRRSV)in vitro and in vivo[J].PLoS One,2013,8(5):e63767.
[24]Xie J,Zhou H,Cui J,et al.Inhibition of porcine reproductive and respiratory syndrome virus by specific siRNA targeting Nsp9 gene
Effect of antiserum of PRRSV on the replication of PRRSV in Marc-145 cells/
ZHAO Mengmeng1,2,SUN Long2,CHEN Yao2,ZHANG Ya1,ZHANG Erqin1,FENG Songlin2,ZHANGGuihong2(1.Schoolof AnimalScienceandVeterinaryMedicin,Henan Agricultural University,Zhengzhou 450002,China;2.Key Laboratory of Zoonosis Prevention and Control of Guangdong Province,National Engineering Research Center for Breeing Swine Industry,School of Veterinary,South China Agricultural University,Guangzhou 510642,China)
In order to verify whether hyper-immune serum of PRRSV has an influence on the replication of PRRSV,hyper-immune serum was prepared,PRRSV XH-GD strain were cultured,then centrifuged with high speed,the purified viruses were used to immunize the New Zealand rabbits to raise antibody.New Zealand rabbits were immunized intraperitoneally(i.p.)plus Freund's complete adjuvant.Antiserum was collected from the rabbits that had been placed under terminal halothane anesthesia.Antiserum titer was 1:640,the antiserum was incubated with virus,then qPCR and TCID50 used to evulate the titer of virus.The results showed that antiserum could inhibit the replication of PRRSV at the mRNA lever,so hyper-immune serum of PRRSV was able to inhibit the replication ofPRRSV in Marc-145 cells.
PRRSV;hyper-immune serum;Marc-145 cells;replication;titer
S852.6
A
1005-9369(2016)11-0052-07
时间2016-12-1 14:48:30[URL]http://www.cnki.net/kcms/detail/23.1391.S.20161201.1448.020.html
赵孟孟,孙龙,陈耀,等.兔抗猪繁殖与呼吸综合征病毒血清在Marc-145细胞上对病毒复制的影响[J].东北农业大学学报,2016, 47(11):52-58.
Zhao Mengmeng,Sun Long,Chen Yao,et al.Effect of antiserum of PRRSV on the replication of PRRSV in Marc-145 cells [J].Journal of Northeast Agricultural University,2016,47(11):52-58.(in Chinese with English abstract)
2016-09-13
国家自然科学基金项目(31272564);公益性行业(农业)科研专项经费(201203039);国家生猪现代农业产业技术体系项目(CARS-36);国家重点研发计划课题(2016YFD0500707)
赵孟孟(1986-),男,博士,研究方向为猪繁殖与呼吸综合征病毒的致病机理。E-mail:zhaomengmeng502@163.com
*通讯作者:张桂红,教授,研究方向为动物传染病,E-mail:guihongzh@scau.edu.cn
