能谱CT在鉴别小肠腺癌和原发小肠淋巴瘤中的临床价值
2016-12-27杨创勃
杨创勃
李新胜2LI Xinsheng
任成龙1REN Chenglong
段海峰1DUAN Haifeng
于 勇1YU Yong
张喜荣1ZHANG Xirong
王海屹3WANG Haiyi
作者单位
1. 陕西中医药大学附属医院医学影像科 陕西咸阳 712000
2. 陕西省核工业二一五医院医学影像科 陕西咸阳 712000
3. 解放军总医院放射诊断科 北京 100853
能谱CT在鉴别小肠腺癌和原发小肠淋巴瘤中的临床价值
杨创勃1YANG Chuangbo
李新胜2LI Xinsheng
任成龙1REN Chenglong
段海峰1DUAN Haifeng
于 勇1YU Yong
张喜荣1ZHANG Xirong
王海屹3WANG Haiyi
作者单位
1. 陕西中医药大学附属医院医学影像科 陕西咸阳 712000
2. 陕西省核工业二一五医院医学影像科 陕西咸阳 712000
3. 解放军总医院放射诊断科 北京 100853
中国医学影像学杂志
2016年 第24卷 第11期:834-838
Chinese Journal of Medical Imaging 2016 Volume 24 (11): 834-838
目的探讨宝石能谱CT在鉴别小肠腺癌(SBA)和原发性小肠淋巴瘤(PSIL)中的临床价值。资料与方法回顾性分析2013年1月-2015年10月陕西中医药大学附属医院手术确诊的17例SBA患者和临床介入超声引导下穿刺确诊的11例PSIL患者动脉期(AP)、静脉期(VP)扫描图像,应用能谱CT基物质分离平台观察碘基图上动、静脉双期肿瘤碘含量(IC)及相同层面腹主动脉(或较大动脉)IC,计算动、静脉双期标准化碘浓度比(NIC)、能谱曲线斜率(λHU)及40~140 keV(间隔10 keV)下的CT值。记录各参数并进行统计学分析,同时运用ROC曲线评估各项指标的诊断效能。结果SBA与PSIL在动脉期IC、NIC及λHU差异均有统计学意义(P<0.05);SBA患者动、静脉双期的IC、NIC和λHU、40~60 keV的CT值均高于PSIL患者,差异有统计学意义(P<0.05);70~140 keV动、静脉双期CT值差异无统计学意义(P>0.05)。在动脉期,以IC为1.38 mg/ml作为阈值鉴别SBA和PSIL时,ROC曲线下面积(AUC)为0.93、敏感度94%、特异度85%,明显高于常规CT(AUC 0.63、敏感度62%、特异度60%),相当于单能量70 keV时的图像质量。结论SBA与PSIL在AP具有不同的IC、NIC和λHU,动、静脉期40~60 keV的CT值也存在差异。能谱CT成像可成为临床鉴别SBA与PSIL的一种新方法。
肠肿瘤;腺癌;小肠;淋巴瘤;体层摄影术,X线计算机;诊断,鉴别
小肠腺癌(small bowel adenocarcinoma,SBA)与原发小肠淋巴瘤(primary small intestinal lymphoma,PSIL)均为小肠较常见的恶性肿瘤,但两者的临床治疗方法截然不同[1]。如SBA对放化疗不敏感,常需早期手术切除治疗;而PSIL对放化疗较为敏感,故首选放化疗,不需要手术。另外,这两种疾病的临床症状一般较为隐匿,且不具有特异性,从而导致早期诊断率显著降低,预后疗效受到严重不良影响[2]。因此,术前对这2种肿瘤进行鉴别具有重要意义。临床工作中,肠道内窥镜在小肠病变检查中受限,大多依靠口服小肠造影剂或小肠插管钡剂造影,使术前诊断较为困难。目前SBA与PSIL鉴别诊断主要依靠影像形态学差异;但当两者影像学表现不典型时,鉴别往往较为困难。本研究通过对SBA和PSIL患者行能谱CT扫描,利用能谱CT多参数定量分析SBA和PSIL的异同,分析各参数在鉴别诊断中的诊断效能。
1 资料与方法
1.1 研究对象 收集2013年1月-2015年10月陕西中医药大学附属医院手术确诊的17例SBA患者(SBA组)和临床介入超声引导下穿刺确诊的11例PSIL患者(PSIL组)。其中SBA组男11例,女6例;年龄39~75岁,平均(61.4±17.5)岁。PSIL组男7例、女4例,年龄36~69岁,平均(58.7±10.2)岁。两组患者中19例有不同程度腹痛、便血(隐血阳性),16例有发热、呕吐等,经过全面细致的检查后均未发现其他系统重大疾病。两组患者年龄、性别差异无统计学意义(P>0.05),临床症状无特异性。
1.2 检查前准备 患者检查前1周无服用钡剂或其他重金属药物史。检查前2 d开始少渣饮食,根据患者病情,禁食8~12 h,检查前1 d晚用1500 ml开水泡番泻叶50 mg口服,及时排便,使排便无粪便等内容物为最佳。检查前l h内饮水2000 ml。检查前10~20 min饮水600~1000 ml,以扩张胃及十二指肠。3例患者疑似肠梗阻而禁食,未饮水,直接行CT增强扫描。
1.3 仪器与方法 采用GE Discovery CT 750HD仪行屏气螺旋扫描,范围上至膈面,下到耻骨联合。扫描参数:先行常规平扫,再以GSI-27协议行增强扫描,管电压140 kVp和80 kVp,瞬切时间0.5 ms,管电流600 mA,螺距1.375∶1,旋转时间0.8 s/r。图像重建为虚拟单光子图像,层厚1.25 mm,层间距1.25 mm,标准算法。采用URICH高压注射器经肘静脉注射碘海醇(300 mgI/ml)(中国,江苏恒瑞医药),剂量0.8~1.0 ml/kg,速度3~4 ml/s,于腹腔干开口层面进行感兴趣区(ROI)智能监测,于注射造影剂15 s后进行监测扫描,当ROI阈值超过90 HU,启动GSI动脉期容积扫描,再延迟30 s后行GSI静脉期扫描,分别获得动脉期、静脉期的GSI图像。
1.4 图像后处理分析与数据测量 两组患者术前行GSI双期增强扫描,将双期增强薄层单能量图像分别导入GE AW4.6工作站,通过GSI Viewer基物质分析软件获得动脉期、静脉期碘基图,后处理统计人员由工作5年以上的高年资技师及工作10年以上的中级以上职称放射医师完成。采用双盲法统计动脉期、静脉期单能量40~140 keV时病灶的CT值(间隔10 keV)及碘浓度(Iodine concen-tration,IC),并计算标准化后的碘浓度(normalized iodine concentration,NIC,NIC=同层面肿瘤IC/同层面大动脉IC),统计动脉期、静脉期单能量40、90 keV时病灶的CT值,并计算动脉期、静脉期的能谱曲线斜率[λHU,λHU=(40 keV CT值-90 keVCT值)/50],选择图像质量较高的肿瘤最大层面取ROI,测量时应避开各种干扰因素,如病灶的坏死、钙化、强化的血管及因气、液交界而产生的界面伪影等部位。所有ROI固定为圆形,大小约占增厚肠壁的2/3。同时选取腹腔干层面或髂动脉层面的ROI作为参照标准,以增强后各期病灶碘浓度与同期较大动脉碘浓度的比值作为标化碘浓度比,每个病灶一般测量3次,取平均值。处理意见不统一时,协商后达成一致。观察肿瘤在单能量图像时λHU的异同以及两组病灶间碘基值及病灶在不同单能量下CT值的差异。
1.5 统计学方法 采用SPSS 17.0软件,计量资料经检验符合正态分布,故对SBA和PSIL动脉期和门脉期的IC、NIC、λHU、11个单能量组的CT值进行t检验,P<0.05表示差异有统计学意义。绘制ROC曲线并计算曲线下面积(AUC),统计各参数的诊断效能及Youden指数。
2 结果
2.1 多参数统计结果 SBA组在动脉期、静脉期的IC、NIC 和λHU均高于PSIL,差异有统计学意义(P<0.05)。SBA组在动、静脉期单能量40~60 keV 的CT 值均高于PSIL组,差异有统计学意义(P<0.05);在70~140 keV动脉期、静脉期CT 值差异无统计学意义(P>0.05)。见表1、2,图1、2。
2.2 各参数敏感度及特异度 SBA和PSIL动脉期IC、NIC和λHU的ROC曲线AUC分别为0.934、0.913和0.769;静脉期分别为0.681、0.875、0.794。其诊断的敏感度、特异度及Youden指数见表3。SBA与PSIL在动脉期单能量40~70 keV时CT值的ROC曲线AUC分别为0.894、0.813、0.781、0.638(图3);静脉期0.813、0.806、0.756、0.325。其诊断的敏感度、特异度及Youden指数见表3。
在动脉期以IC为1.38 mg/ml作为阈值鉴别SBA和PSIL时,ROC曲线AUC为0.93、敏感度为94%、特异度为85%,明显高于单能量70 keV(相当于常规CT 120 kVp扫描图像)。单能量70 keV时CT值的AUC仅为0.63、敏感度为62%、特异度为60%。
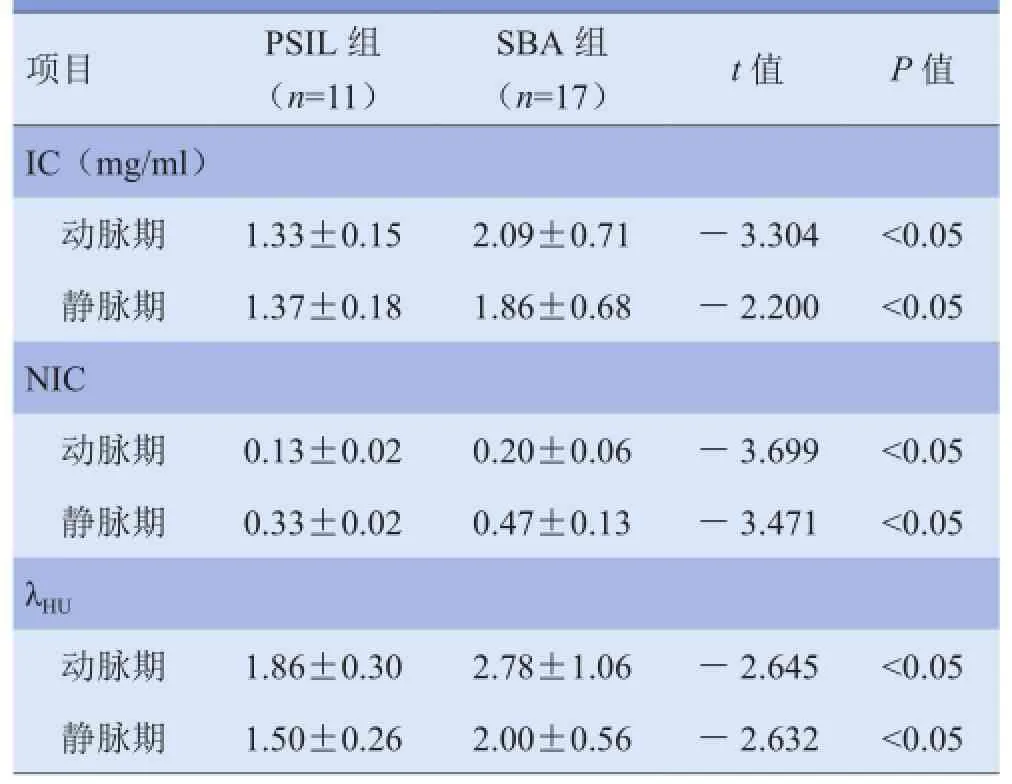
表1 PSIL与SBA能谱CT多参数比较
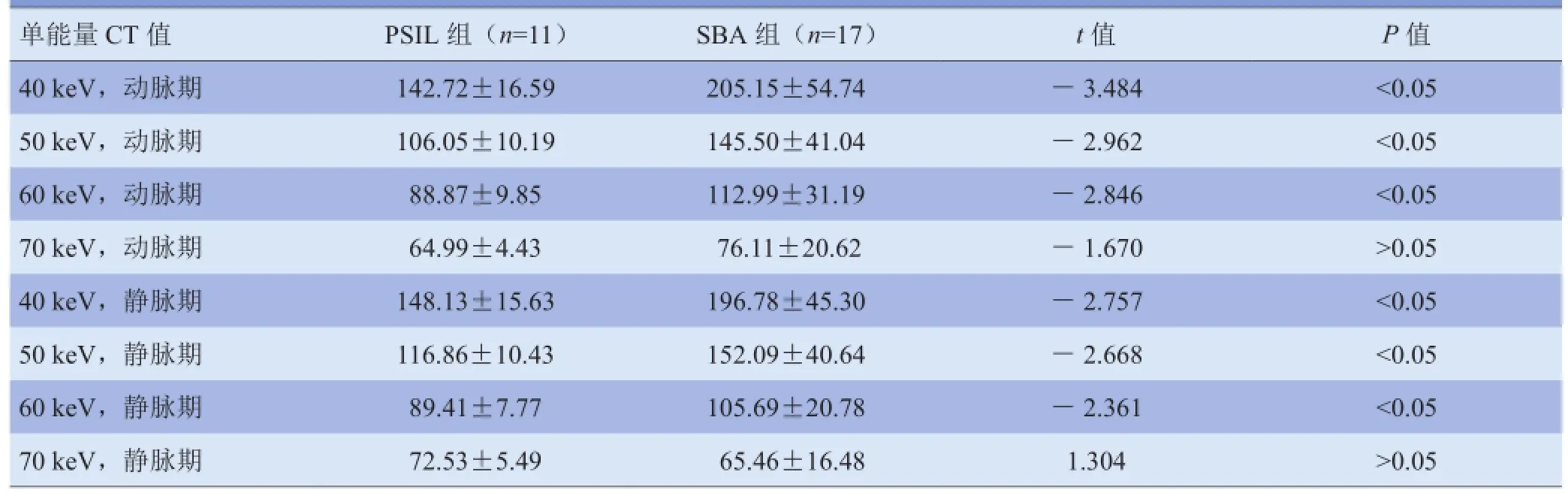
表2 PSIL与SBA能谱CT单能量CT值比较
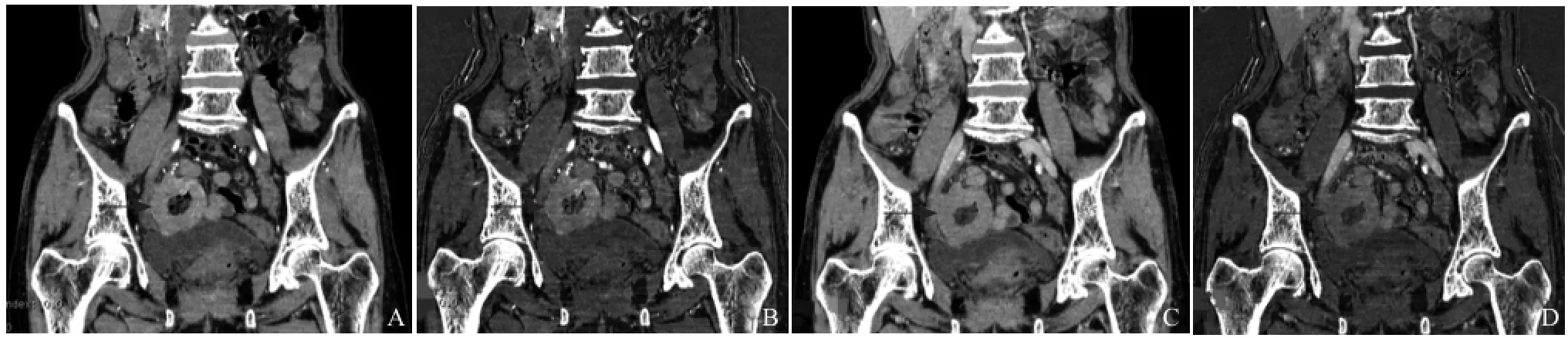
图1 女,67岁,右下腹盆腔回肠原发性淋巴瘤。动脉期示回肠局部肠壁环形增厚但腔无狭窄,肠壁柔软,明显强化,管腔扩张(箭,A);动脉期碘基图局部肠壁的亮暗代表碘含量的分布(箭,B);静脉期显示肿瘤密度趋向均匀(箭,C);静脉期碘基图反映静脉期肿瘤的碘含量(箭,D)
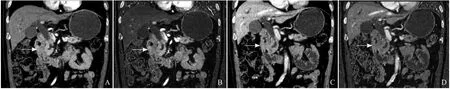
图2 男,55岁,十二指肠降部腺癌。动脉期示十二指肠降部肠壁增厚、僵硬,明显不均匀强化,管腔狭窄,局部黏膜皱襞破坏(箭,A),十二指肠乳头区侵犯,胰管、胆总管扩张(箭,A);动脉期碘基图示肿瘤不均匀强化,肿瘤血功丰富,碘含量分布欠均匀(箭,B);静脉期显示肿瘤密度不均匀明显降低(箭,C);静脉期碘基图显示肿瘤密度降低,碘含量不均匀下降(箭,D)
3 讨论
SBA早期手术治疗治愈率高。但由于早期诊断较为困难,故一般切除率仅约为40%,且放化疗效果不佳[3]。PSIL无需手术,对放化疗敏感,故早期对两者准确诊断显得尤为重要,可显著提高小肠肿瘤诊治水平、改善患者预后。小肠病变在术前往往不能得到病理活检,临床只能依靠病变的基本特征及常规影像学表现进行一般的鉴别诊断[4-7]。如SBA主要表现为管壁僵硬、毛糙,管腔向心性狭窄,病灶相对较局限,肠壁增厚较PSIL欠明显,但较僵硬,易引起肠梗阻;而PSIL病变肠管相对较长,周围浸润少,病灶边界较光滑,肠腔周围存在脂肪层,典型的可出现动脉瘤样扩张改变,很少引起肠梗阻[1,8]。传统影像学检查仅依靠病变形态、大小、密度或增强特征等形态学或精细解剖学进行诊断;但当缺乏典型影像学表现时,两者均表现为类似肠壁的增厚,从而增加了鉴别诊断的难度。

表3 能谱CT诊断PSIL与SBA的各参数诊断效能比较
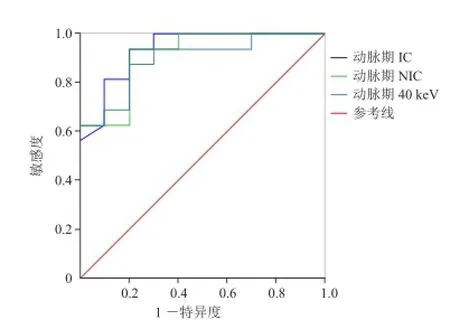
图3 PSIL与SBA的动脉期IC、NIC和40 keV CT值的ROC曲线
能谱CT扫描是一种基于双能、可进行能量分析、多参数成像的技术[9-12]。它将5维空间(X、Y、Z、时间和能量)多参数成像和功能成像模式带入传统CT诊断,改变了传统影像仅依靠解剖影像的形态特征及单一参数CT值进行诊断的模式。能谱CT高低压瞬切技术可得到101组不同单能量图像(40~140 keV共101组),单能量成像及其能谱分析具有极高的组织成分区分能力,在提供水、碘、钙、脂、血基等不同成像条件下,实现初步的物质分离[13-16]。因此,根据能谱成像的物质分离原理可获得更多的参数。定量地区分两者,使CT从传统形态学诊断模式进入到了功能、微循环、代谢等多参数,多模态的诊断时代[17-19]。
能谱CT基物质分离主要为碘和水配对,能谱CT对物质中碘的含量变化较为敏感,可准确反映基物质中的碘含量变化,并可以测量病灶的碘浓度等基物质含量[20-21]。本研究中SBA和PSIL在动脉期和静脉期碘浓度值的比较均有显著性差异,表现为SBA的IC、NIC、λHU均高于PSIL,可能与这两种肿瘤的组织病理基础相关。SBA是一种实体肿瘤,起源于毛细血管丰富的黏膜层,经黏膜下层向肌层及浆膜层侵犯,肿瘤血窦丰富;而PSIL起源于黏膜下的间叶组织,细胞间排列致密,血窦不丰富,故本研究患者动脉期PSIL的IC、NIC、λHU均明显低于SBA。动脉期反应肿瘤毛细血管的密度,静脉期反映肿瘤毛细血管的廓清和肿瘤间质成分含量,因此也可说明肿瘤强化的特征与肿瘤病理基础相关。本研究中SBA与PSIL在动、静脉期40~60 keV的单能量CT值差异有统计学意义,SBA高于PSIL;而在70~140 keV单能量的CT值低于PSIL,差异无统计学意义。这可能与高单能量时X线能量过高、穿透力强,掩盖了各组织成分之间的细微差别有关。有研究证实70 keV单能量图像与质量控制图像、120 kVp混合能量图像相当,三者X线能量以及穿透力相近,故本研究以70 keV的单能量图像代替常规CT 120 kVp的混合能量图像,避免患者重复扫描,造成辐射剂量增加。这也解释了常规CT通过单一参数CT值鉴别SBA和PSIL较为困难的原因;而单能量40~60 keV能量较低,对两者的鉴别明显优于常规CT[22]。既往研究表明,SBA和PSIL在动脉期和门脉期水含量均无显著差异,较为恒定,故本研究不再将水浓度列入研究对象。
另外,本研究中动脉期IC、NIC及40 keV下的CT值对鉴别两者均有较高的敏感度和特异性,这与肿瘤的病理组织基础有很大的相关性。SBA组织实质成分多,肿瘤血窦丰富,不成熟的毛细血管密度大;而PSIL组织间质成分多,细胞排列密集,血窦不太丰富,强化幅度低,但造影剂排空延迟。导致两者的IC、NIC等参数可能出现差异。其次,IC、NIC除与肿瘤组织特性有很大关系之外,还受造影剂总剂量、患者心功能差异等因素的影响。因此,本研究以肿瘤同平面的大动脉作为参照,获得同期大动脉的NIC,以减少其他因素带来的干扰。
本研究样本量较少,且未对两者的分化程度进行研究。因此在以后的研究中,有待于进一步扩大样本量,并对肿瘤的分级以及发生在小肠的其他肿瘤进行研究。
[1] 娄启田, 钱海峰. 小肠淋巴瘤与小肠腺癌的多层螺旋CT诊断及鉴别诊断. 实用医学杂志, 2010, 26(24): 4553-4555.
[2] 陈祥民, 安鹏, 王立忠, 等. 原发性十二指肠腺癌的CT与低张十二指肠造影表现的比较. 中华放射学杂志, 2001, 35(4): 270-272.
[3] Korman MU. Radiologic evaluation and staging of small intestine neoplasms. Eur J Radiol, 2002, 42(3): 193-205.
[4] Levine MS, Rubssin SE, Pantonggrag-Brown L, et al. Non-Hodikin's Lymphoma of the gastrointestinal tract: radiographic findings. Am J Roentgenol, 1997, 168(1): 165-172.
[5] 夏淦林, 冯峰. 胃肠道淋巴瘤的影像学表现及特征. 临床放射学杂志, 2009, 28(5): 663-666.
[6] 卢春燕, 闵鹏秋, 刘荣波. 原发性胃肠道淋巴瘤的CT诊断.国外医学:临床放射学分册, 2003, 26(2): 96-99.
[7] Nagi B, Verma V, Vaiphei K, et al. Primary small bowel tumors: a radiologic-pathologic correlation. Abdom Imaging, 2001, 26(5): 474-480.
[8] 赵雪松, 缪飞, 杨燕萍, 等. CT能谱成像在小肠间质瘤和淋巴瘤鉴别诊断中的应用价值. 中国医学计算机成像杂志, 2013, 19(1): 38-42.
[9] 王明亮, 林晓珠, 缪飞, 等. CT能谱成像对物质内碘含量测定的价值:体模研究. 中国医学计算机成像杂志, 2011, 17(2): 172-175.
[10] 杜祥颖, 李倩文, 王艳, 等. CT能谱成像中利用能谱曲线进行碘定量分析. 放射学实践, 2013, 28(6): 616-618.
[11] 叶伦, 叶奕兰, 冉艮龙, 等. 宝石能谱CT的成像原理及临床应用. 中华临床医师杂志(电子版), 2013, 7(19): 8919-8921.
[12] 杨创勃, 牛四强, 贾永军, 等. 基于支持向量机的甲状腺结节能谱研究. 中国医学影像学杂志, 2015, 23(3): 231-234, 240.
[13] 潘梁, 刘松, 何健, 等. CT能谱成像在胃癌术前精确T分期中的应用. 实用放射学杂志, 2014, 30(7): 1144-1146, 1153.
[14] 夏平, 陈刚, 郝敬明, 等. 能谱CT扫描技术在肺良恶性病变鉴别诊断中的初步研究. 实用放射学杂志, 2015, 31(3): 473-476.
[15] 张静, 林晓珠, 徐学勤, 等. CT能谱成像在胰岛素瘤诊断中的初步研究. 放射学实践, 2012, 27(3): 250-253.
[16] 陈丽红, 薛蕴菁, 段青, 等. CT能谱成像定量评估胃癌分化程度. 中国医学影像技术, 2013, 29(2): 225-229.
[17] 雷立昌, 陈建宇. 能谱CT的临床应用与研究进展. 中国医学影像技术, 2013, 29(1): 146-149.
[18] 邵伟光, 周茂义, 刘典美, 等. 宝石能谱CT测定成人甲状腺碘浓度. 中国医学影像技术, 2011, 27(12): 2389-2392.
[19] Lin XZ, Miao F, Li JY, et al. High-Definition CT gemstone spectral imaging of the brain: initial results of selecting optimal monochromatic image for Beam-Hardening artifacts and image noise reduction. J Comput Assist Tomogr, 2011, 35(2): 294-297.
[20] 任庆国, 滑炎卿, 李剑颖. CT能谱成像的基本原理及临床应用. 国际医学放射学杂志, 2011, 34(6): 559-563.
[21] 刘金刚, 刘亚, 李丽新, 等. CT能谱成像在诊断肿瘤淋巴结转移性和肿瘤性质中的作用. 中华放射学杂志, 2011, 45(8): 731-735.
[22] Matsumoto K, Jinzaki M, Tanami Y, et al. Virtual monochromatic spectral imaging with fast kilovoltage switching: improved image quality as compared with that obtained with conventional 120-kVp CT. Radiology, 2011, 259(1): 257-262.
(本文编辑 闻 浩)
Clinical Value of Spectral CT Imaging in the Differential Diagnosis of Small Bowel Adenocarcinoma and Small Intestinal Lymphom
Department of Radiology,PLA General Hospital, Beijing 100853, China
Address Correspondence to:WANG HaiyiE-mail: wanghaiyi301@126.com
PurposeTo investigate the value of gemstone spectral CT imaging in the differential diagnosis of small bowel adenocarcinoma (SBA) from primary small intestinal lymphoma (PSIL).Materials and MethodsWe retrospectively analyzed the images of 17 cases of SBA and 11 cases of PSIL both confirmed surgically at the Affiliated Hospital of Shaanxi University of Chinese Medicine from January 2013 to October 2015. These patients underwent spectral CT imaging at arterial phase and venous phase. CT attenuation numbers of cancers at different energy levels were measured to generate spectral attenuation curve and to calculate its slope (λHU). Iodine concentration (IC) in cancers at arterial phase and venous phase was measured and normalized to that of aorta as normalized iodine concentration (NIC). Receiver operating characteristic (ROC) curves were generated to evaluate the diagnostic efficacy of each index.ResultsThere were significant differences between SBA and PSIL in IC, NIC and λHUat arterial phase and the same trend appeared at venous phase (P<0.05). For the CT number measurement, there were significant differences between SBA andPSIL in the 40-60 keV energy range (P<0.05), but not in the 70-140 keV range (P>0.05). Using 1.38 mg/ml as threshold value for iodine concentration at arterial phase, one could obtain the area under curve (AUC) for ROC study of 0.93 and sensitivity of 94% and specificity of 85% for differentiating small bowel adenocarcinoma from primary small intestinal lymphoma. These values were significantly higher than the respective values of 0.63, 62% and 60% with conventional CT numbers at 70 keV.ConclusionQuantitative parameters obtained in spectral CT, especially iodine concentration at arterial phase, can provide high accuracy for differentiating small bowel adenocarcinoma from primary small intestinal lymphoma.
Intestinal neoplasms; Adenocarcinoma; Intestine, small; Lymphoma; Tomography, X-ray computed; Diagnosis, differential
10.3969/j.issn.1005-5185.2016.11.008
王海屹
2016-09-04
2016-10-30
R445.3;R735.3
