肝细胞癌微观结构的X线相衬CT成像研究
2016-12-27简建波
简建波
杨 浩YANG Hao
秦莉莉QIN Lili
胡春红HU Chunhong
作者单位
天津医科大学生物医学工程与技术学院天津 300070
肝细胞癌微观结构的X线相衬CT成像研究
简建波JIAN Jianbo
杨 浩YANG Hao
秦莉莉QIN Lili
胡春红HU Chunhong
作者单位
天津医科大学生物医学工程与技术学院天津 300070
中国医学影像学杂志
2016年 第24卷 第11期:869-872
Chinese Journal of Medical Imaging 2016 Volume 24 (11): 869-872
目的肝细胞癌(HCC)是最常见的恶性肿瘤之一,本文探讨X线相衬CT(PCCT)在HCC微观结构成像中的应用价值,有助于进一步了解该疾病的发展机制。资料与方法采集HCC组织8例,按病理表现分为中分化组(4例)和低分化组(4例)。在上海同步辐射装置的BL13W1线站进行相衬成像。重建HCC组织中的微观结构,与病理切片对比分析,并应用三维纹理分析方法评估两组中肝细胞排列结构的变化。结果相衬CT成像清晰地显示了HCC组织中的纤维胶原、肿瘤边缘微血管、窦样毛细血管等特征结构的二维和三维特征,与病理切片表现一致。三维纹理分析结果显示低分化组肝细胞的排列结构较中分化组发生了显著变化(P<0.05)。结论相衬CT成像可清晰地显示HCC微观结构的二维和三维图像特征,并为其结构的定量分析提供了参考,在HCC的研究中具有潜在的应用和推广价值。
癌,肝细胞;X射线相位衬度成像;病理学,外科;微观结构;体外研究
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,其5年生存率仅为20%~40%[1-2]HCC发展的过程中伴随着肿瘤血管新生、肝窦毛细血管化等微观结构的改变,研究这些改变有助于了解该疾病的发展机制。病理切片是观察HCC中微观结构最常用的方法,但存在有创性、可重复性差及仅限于二维分析等缺点[3-4]。而常用的影像技术(如传统的X线超声、MRI等)受其成像原理的限制,在衬度分辨率和空间分辨率等多个指标方面无法满足HCC微观结构成像的技术要求。X线相位衬度CT(phase contrast computed tomography,PCCT)是基于X线穿过样品后携带的相位信息对样品内部的微观结构进行成像,以一种全新的成像机制,解决了生物软组织微观成像的问题[5]。目前,关于HCC组织的相衬成像研究较少,本研究旨在利用PCCT高衬度和高分辨率的优势揭示HCC组织的微观结构,分析HCC在相衬成像中的影像学特点。
1 材料与方法
1.1 实验材料及处理 选取2012年12月-2013年2月天津市肿瘤医院切除的人体HCC组织8例。其中,病理结果显示中分化4例,低分化4例。术前未注射任何造影剂,术后离体HCC组织立即使用磷酸缓冲溶液进行冲洗,随后放入10%的福尔马林溶液中固定。成像前将组织切成块状,大小约6 mm×4 mm,厚度2~4 mm,然后充分干燥,行PCCT成像。所有样品取材均经患者及其家属同意,并经道德伦理委员会审核批准。
1.2 实验装置与方法 于上海同步辐射装置的BL13W1线站进行。实验装置示意图见图1。实验采用类同轴相位成像方法,成像能量为20 keV,探测器分辨率为3.7 μm,样品与探测器之间的距离为1 m。CT扫描时,HCC组织置于锥形管内固定在旋转台上,以0.15°/s的速度旋转180°,总投影数1200张,每幅投影图像曝光时间为2 s。每隔60张投影采集1张背景图像,总共采集20张背景图像,完成之后,关闭光源采集10张暗电流图像。HCC组织再次放入福尔马林溶液中。

图1 实验装置示意图
1.3 数据处理 所获得的PCCT图像包含相位和吸收,因此,在对不同角度的投影图像进行背景图像、暗电流图像校正后,还需运用相位恢复的方法提取投影图中的相位信息[6]。相位恢复后,采用滤波反投影算法进行CT重建,然后将所有断层图像按顺序导入三维可视化软件Amira 5.2(美国,Visage Imaging Inc),获得HCC组织的三维结构。
1.4 病理学分析 将成像后的组织从福尔马林溶液中取出,经常规脱水、石蜡包埋、4 μm厚度连续切片,行HE染色。
1.5 图像分析 本研究基于高分辨率的PCCT图像,采用灰度共生矩阵法,探讨中低分化HCC中肝细胞排列的三维纹理特征,提取两组间具有显著性差异的纹理参数,进而对肝细胞排列结构的复杂程度进行科学量化[7]。具体的纹理分析方法为:在某一断层中随机选取100 pixel×100 pixel正方形,然后连续采样100层,最终获取一个100 pixel×100 pixel×100 pixel的三维灰度矩阵,如图2所示,并以此作为纹理分析区域。每例组织随机选取10组上述的三维灰度矩阵,并通过灰度共生矩阵对其纹理进行分析。随后分别提取0°、45°、90°、135°和z轴方向的三维纹理参数,计算每个样品在5个方向上的平均纹理参数值。在对纹理分析的过程中,为了避免血管及胶原纤维对分析结果造成影响,排除断层中存在血管及胶原纤维的地方。

图2 三维纹理分析采样示意图。A为某样品的连续断层。B为在A中(方框)选取的三维灰度矩阵
1.6 统计学方法 采用SAS 9.1.3软件,符合正态分布的计量资料组间比较行t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 PCCT图像和病理切片的对照 PCCT图像(图3A)与相应的病理切片(图3B)非常相似。血管、纤维组织等特征结构基本吻合,这证明了PCCT对HCC组织中微观结构的显示具有较高的敏感度和准确度。

图3 HCC组织的PCCT断层图像(A)和相应的病理切片(B)。箭示纤维组织,箭头示内充血细胞的微血管
2.2 HCC组织微观结构的三维可视化 PCCT显示肿瘤边缘及边缘微血管和窦样毛细血管等微观结构(图4)。结合三维可视化技术,其微观结构可显示为三维形式,可清楚地观察到微血管的三维结构及其分支情况,最小血管直径约为20 μm。HCC组织的血管树状结构破坏,主要沿肿瘤边缘分布,深入肿瘤组织的分支较少,分支级数一般不超过3级。血窦腔不规则、空间结构紊乱(图4)。
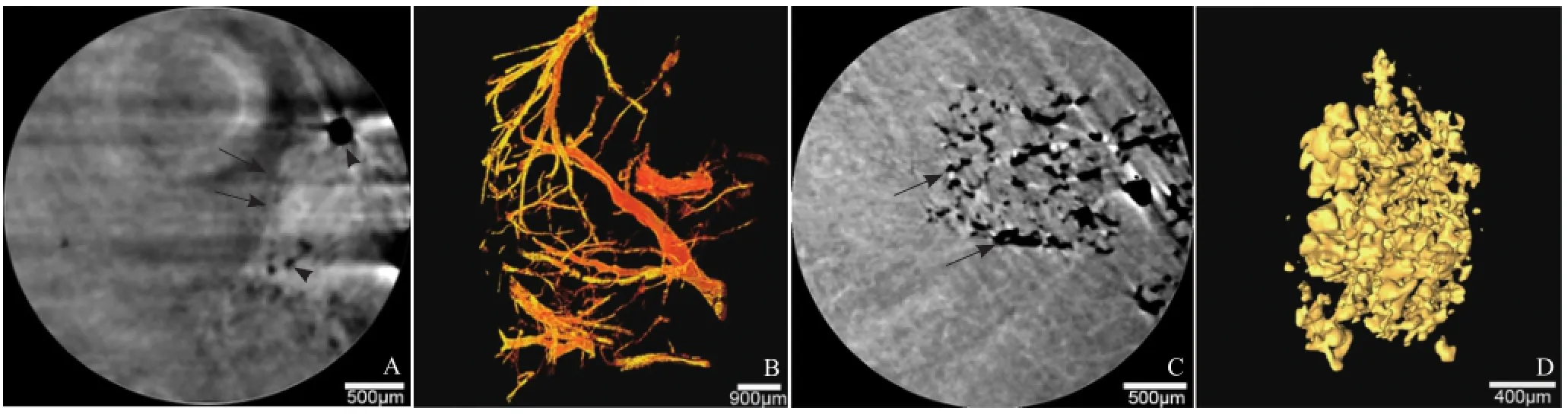
图4 HCC中微观结构的PCCT图像及三维可视化。A和C为断层图像,箭示肿瘤边缘(A)和窦样毛细血管(C),箭头示肿瘤边缘的微血管(A);B、D:微血管和窦样毛细血管的三维结构
2.3 微观结构改变的定量分析 本研究利用能量、惯量、和的均值以及和的熵4个不同的纹理参数来量化HCC发展过程中微小的改变。选取的纹理参数在两组间差异有统计学意义(P<0.05),见表1。

表1 HCC三维纹理分析结果
3 讨论
HCC是典型的多血管肿瘤,肿瘤新生血管形成是该疾病和发展过程中的一个标志性事件,这些新生血管是肿瘤细胞无节制性地生长和远处转移的基础[8]。因此,微血管改变的早期显示对HCC的早期诊断和治疗有重要的临床意义。本研究中,PCCT可以清晰地显示肿瘤组织的边缘和分布在边缘的微血管。利用三维可视化技术,微血管的三维形态得以显现。本研究测得最小血管直径约为20 μm,且血管沿肿瘤边缘杂乱分布。HCC微血管的可视化为该疾病的早期检测提供了可能。此外,增生的纤维组织和窦样毛细血管都是HCC的特征结构[9]。本研究清晰地显示了其结构,并从三维角度分析其形态,这为研究HCC的发展机制提供了新的思路。肝细胞形态和排列方式在HCC发展的过程中也发生了很大的变化,但这些改变引起的密度变化不如纤维或者血管明显,所以其在PCCT图像上的灰度变化并不是非常显著。本研究采用三维纹理分析的方法来捕捉这种轻微的改变,结果显示肝细胞形态和排列方式在HCC发展过程中有明显的改变,进一步验证了PCCT成像对微观结构变化的敏感性。
目前临床上常用的影像学技术还不能观察小于200 μm的微观结构[10-11],限制了这些技术在HCC微观结构成像上的应用。PCCT作为一种全新的X线成像技术,可以分辨密度变化为0.0003~0.002 g/cm3的不同组织边界,空间分辨率可以达到1 μm,在软组织成像领域得到了广泛的应用[12-13]。李蓓蕾等[14]利用PCCT成像对HCC中的新生血管投影图像进行了研究,显示了肿瘤边缘及内部分布杂乱无章、形态无规则的微小血管,测量得到的血管最小直径约为25 μm。但该研究基于投影图像进行研究,未与病理切片进行对比分析,所以研究中显示的树枝状结构及细小的网状结构未能确定是否为血管结构。本研究采用PCCT技术对投影图像进行了断层重建,可观察HCC组织内部的结构信息,结合三维可视化技术,可以从三维角度观察HCC的微观结构,因此除了微血管,本研究还观察到纤维组织、窦样毛细血管等结构。此外,本研究还引入了“金标准”病理切片和断层图像进行对比分析,证实PCCT成像的准确性。
本研究初步探讨了PCCT技术在HCC组织微观结构成像上的应用,但由于样本量较少,对于微血管和窦样毛细血管等微观结构的定量分析还需加大样本量研究加以证实。此外,由于同步辐射光源光斑视野的限制,本研究的成像视野较小,使得该技术目前还不能应用于临床成像,但是基于传统X线的大视野相衬成像研究已经在开展中[15-16]。同时,基于相衬成像的活体实验研究也在进行中[17],随着技术的发展,相衬成像将给医学影像学带来深刻变革,并推动临床医学的发展。
总之,本研究基于相衬CT清晰地展示了HCC组织中纤维组织、肿瘤边缘微血管和窦样毛细血管等微观结构的二维和三维特征,并定量地分析了肝细胞排列结构在HCC发展过程的微小改变。后期将引入更多样本评估微血管和窦样毛细血管等结构在HCC发展过程中的变化。PCCT具有高衬度和高分辨率的特性,在HCC的研究中具有很高的应用价值及前景。
[1] Tang ZY, Ye SL, Liu YK, et al. A decade's studies on metastasis of hepatocellular carcinoma. J Cancer Res Clin Oncol, 2004, 130(4): 187-196.
[2] 杨军妍. 肝细胞癌螺旋CT增强征象与其VEGF、PLGF和MVD表达的关系. 中国医学影像学杂志, 2011, 19(4): 272-278.
[3] Zhang X, Yang XR, Chen Y, et al. Visualising liver fibrosis by phase-contrast X-ray imaging in common bile duct ligated mice. Eur Radiol, 2013, 23(2): 417-423.
[4] Hu DD, Chen Y, Bihi A, et al. A new conversation between radiology and pathology-identifying microvascular architecture in stages of cirrhosis via diffraction enhanced imaging in vitro. PLoS One, 2014, 9(2): e87957.
[5] Momose A, Takeda T, Itai Y, et al. Phase-contrast X-ray computed tomography for observing biological soft tissues. Nat Med, 1996, 2(4): 473-475.
[6] Chen RC, Rigon L, Longo R. Quantitative 3D refractive index decrement reconstruction using single-distance phase-contrast tomography data. J Phys D Appl Phys, 2011, 44(49): 495401-495409.
[7] Tao Q, Li D, Zhang L, et al. Using X-ray in-line phase-contrast imaging for the investigation of nude mouse hepatic tumors. PLoS One, 2012, 7(6): e39936.
[8] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell, 2011, 144(5): 646-674.
[9] Gutiérrez-Ruız MC, Robles-Dıaz G, Kershenobich D. Emerging concepts in inflammation and fibrosis. Arch Med Res, 2002, 33(6): 595-599.
[10] Cao Y, Wu T, Yuan Z, et al. Three-dimensional imaging of microvasculature in the rat spinal cord following injury. Sci Rep, 2015, 5: 12643.
[11] Xuan R, Zhao X, Hu D, et al. Three-dimensional visualization of the microvasculature of bile duct ligation-induced liver fibrosis in rats by X-ray phase-contrast imaging computed tomography. Sci Rep, 2015, 5: 11500.
[12] 姜庆军, 肖湘生, 刘士远, 等. 相干X线相衬成像的初步研究:离体大白鼠肝脏、肺脏成像实验. 中国医学影像技术, 2003, 19(9): 1116-1117.
[13] 刘骏桢, 林江, 严福华. 同步辐射X线相衬技术在肝血管成像中的研究进展. 中国医学影像学杂志, 2011, 19(12): 935-937.
[14] 李蓓蕾, 张一秋, 蔡良, 等. 同步辐射衍射增强成像(DEI)技术检测离体人肝细胞癌(HCC)新生血管. 复旦学报(医学版), 2015, 42(2): 279-282.
[15] Zhao Y, Brun E, Coan P, et al. High-resolution, low-dose phase contrast X-ray tomography for 3D diagnosis of human breast cancers. Proc Natl Acad Sci U S A, 2012, 109(45): 18290-18294.
[16] Hetterich H, Willner M, Fill S, et al. Phase-contrast CT: qualitative and quantitative evaluation of atherosclerotic carotid artery plaque. Radiology, 2014, 271(3): 870-878.
[17] Bech M, Tapfer A, Velroyen A, et al. In-vivo dark-field and phase-contrast X-ray imaging. Sci Rep, 2013, 3(3): 17161-17175.
(本文编辑 张晓舟)
Microstructural Imaging of Hepatocellular Carcinoma Based on X-ray Phase-contrast Computed Tomography
College of Biomedical Engineering, Tianjin Medical University, Tianjin 300070, China
Address Correspondence to:HU ChunhongE-mail: chunhong_hu@hotmail.com
PurposeHepatocellular carcinoma (HCC) is one of the most common malignant tumors. This study aimed to explore the application value of X-ray phasecontrast computed tomography (PCCT) in microstructure imaging of HCC tissues, which might allow for an improved understanding of the development of HCC.Materials and MethodsEight human resected HCC tissues (moderately-differentiated, four cases; poorly-differentiated, four cases) were imaged at beamline BL13W1 at the Shanghai Synchrotron Radiation Facility (SSRF). The microstructures in HCC were revealed via PCCT and the reconstructed CT images were confirmed by pathological sections. Threedimensional (3D) texture analysis was applied to assess distortion of hepatic cell arrangement in different differentiated HCC.ResultsThe microstructures such as fibrosis tissues, microvasculature, capillarized sinusoids were clearly revealed in two-dimensional (2D) and 3D images by PCCT. Moreover, the results of the 3D texture analysis showed that the hepatic cell arrangement had a significant change (P<0.05) between the moderatelydifferentiated and poorly-differentiated HCC.ConclusionThe results of this study indicate that PCCT has the potential to be used for microstructure imaging of HCC tissues and quantitative evaluation of those fine structures in the development of HCC. Thus, PCCT has good value of application and popularity in the study of HCC.
Carcinoma, hepatocellular; X-ray phase-contrast computed tomography; Pathology, surgical; Microstructure; In vitro
10.3969/j.issn.1005-5185.2016.11.018
胡春红
国家自然科学基金(81371549,30900333)天津市自然科学基金(16JCYBJC28600)中国肝炎防治基金会-王宝恩肝纤维化研究基金资助课题(CFHPC20131033)。
2016-07-15
2016-10-25
R735.7;R445.3
