MR体素内不相干运动成像监测子宫肌瘤高能聚焦超声术后消融灶灌注信息的研究
2016-12-27张俊成
张俊成
卢瑞沾1LU Ruizhan
杨振华2YANG Zhenhua
黄飞文1HUANG Feiwen
黎芳莲1LI Fanglian
作者单位
1. 暨南大学附属江门中医院医学影像科广东江门 529031
2. 暨南大学附属江门中医院肿瘤介入科广东江门 529031
MR体素内不相干运动成像监测子宫肌瘤高能聚焦超声术后消融灶灌注信息的研究
张俊成1ZHANG Juncheng
卢瑞沾1LU Ruizhan
杨振华2YANG Zhenhua
黄飞文1HUANG Feiwen
黎芳莲1LI Fanglian
作者单位
1. 暨南大学附属江门中医院医学影像科广东江门 529031
2. 暨南大学附属江门中医院肿瘤介入科广东江门 529031
中国医学影像学杂志
2016年 第24卷 第11期:830-833
Chinese Journal of Medical Imaging 2016 Volume 24 (11): 830-833
目的本研究探讨体素内不相干运动(IVIM)成像方法监测子宫肌瘤高能聚焦超声(HIFU)术后微循环灌注的情况,旨在为判断消融疗效提供新的安全途径。资料与方法前瞻性行HIFU治疗的子宫肌瘤患者26例(32枚肌瘤),治疗前、后均行常规MRI、DCE-MRI及IVIM成像检查。比较术后消融灶与术前肌瘤、残留未消融灶的D值、D*值、f值;评定消融灶的各参数伪彩图与DCE-MRI的吻合度。结果术后消融灶D*值和f值较术前及残留未消融灶明显降低(P<0.01);而D值差异无统计学意义(P>0.05)。f值鉴别消融灶与残留未消融灶间诊断效能较高,其曲线下面积为0.952,最佳诊断界值为19.50%,敏感度为84.5%,特异度为93.6%。消融灶的D*值及f值伪彩图与DCE-MRI的NPV有较的高视觉吻合。结论IVIMDWI成像可以在一定程度上反映子宫肌瘤HIFU后微循环灌注改变情况,从而提供一种无需对比剂的成像方法。
子宫肿瘤;平滑肌瘤;超声疗法;磁共振成像;扩散加权成像;体素内不相干运动;微循环
MRI增强扫描可以显示子宫肌瘤高能聚焦超声(high intensity focused ultrasound,HIFU)术后无对比剂灌注(non perfused volume,NPV)的凝固性坏死范围[1],但围术期对比剂在HIFU热能作用下是否使钆游离而产生毒性副作用尚未明确。扩散加权成像(DWI)在评价疗效上具备无创性、量化分析、快捷和可重复进行等优点。单指数信号衰减模型DWI对消融疗效评价的研究忽略了肌瘤组织微循环灌注效应对表观扩散系数(ADC)值的影响[2-4]。基于体素内不相干运动(intravoxel incoherent motion,IVIM)理论双指数模型计算的扩散系数D值、灌注相关假性扩散系数D*值和灌注分数f值可以反映组织内水分子的真实扩散运动和微循环血液灌注效应。本研究分析子宫肌瘤HIFU前后消融灶和残留未消融灶的IVIM各参数变化情况,探讨该成像方法评价子宫肌瘤HIFU治疗的有效性。
1 资料与方法
1.1 研究对象 收集2015年11月-2016年5月于暨南大学附属江门中医院经临床确诊为子宫肌瘤的患者26例,年龄29~52岁,中位年龄36岁。根据子宫肌瘤的位置、大小、信号等因素进行筛选[5]。纳入标准:①子宫肌瘤影像清晰可见并在聚焦可视范围内;②瘤体直径为3~7 cm。排除标准:①容易造成骶丛神经损伤的后位肌瘤;②瘤体直径<3 cm,或肌瘤过大;③T2WI上高信号,或彩色多普勒超声提示血流4级。最终32枚肌壁间肌瘤纳入研究。
1.2 仪器与方法 采用GE Discovery MR 750、3.0T MR和8通道腹部相控阵列线圈对患者HIFU术前、术后12~18 h进行盆腔检查,扫描序列包括T1WI、T2WI、增强序列及轴位IVIM-DWI序列。扫描参数:TR 6000 ms,TE 62 ms,层厚5 mm,间隔1 mm。取16个b值:0、20、30、50、80、100、120、150、200、300、500、600、800、900、1000、1200 s/mm2,相应激励次数:1、1、1、1、1、1、1、1、2、2、2、2、4、4、4、4。采用JC200型聚焦超声肿瘤治疗系统,功率最高为400 W,术中超声显示靶区团块状灰度增强时立即更换靶点,由点及面逐步完成整个肌瘤治疗。
1.3 图像分析 应用AW 4.6后处理工作站Functool-MADC模型生成IVIM各参数图,测量D值、D*值、f值。消融灶取最大层面,增强扫描图像拟合至参数图中,取NPV中心部、外周距外缘0.5 cm区域、中心与外围两点连线的中点,避开囊变及坏死区,面积16~22 mm2。残留未消融灶为手动绘制轮廓,选取5~9个感兴趣区(ROI)求平均值。由2名影像学副主任医师对各参数图的消融灶与动态增强MRI(DCE-MRI)的NPV吻合度进行分级[6],I级:消融灶轮廓清晰,吻合良好;II级:消融灶轮廓线断续,基本吻合;III级:消融灶分界不清,吻合性差。
1.4 统计学方法 采用SPSS 16.0软件,先进行正态分布检验,术后消融灶与术前肌瘤、残留未消融灶各参数比较采用配对样本t检验;各参数图的消融灶与DCE-MRI的NPV分级采用χ2检验比较。P<0.05表示差异有统计学意义。
2 结果
2.1 HIFU术前、术后与IVIM-DWI各参数值比较 术后消融灶比术前肌瘤D*值、f值明显降低,差异有统计学意义(t=7.875、9.592,P<0.01);而组间D值差异均无统计学意义(t=-0.336,P>0.05);术后消融灶的D*值、f值明显低于残留未消融灶(t=-13.15、-7.202,P<0.01),而组间D值差异无统计学意义(t=0.315,P>0.05)。见表1。
2.2 ROC曲线分析 对术后消融灶与残留未消融灶组间有统计学意义的D*值及f值进行ROC曲线分析,AUC分别为0.901、0.952;f值≤19.5%时,敏感度为84.5%,特异度为93.6%。见图1。
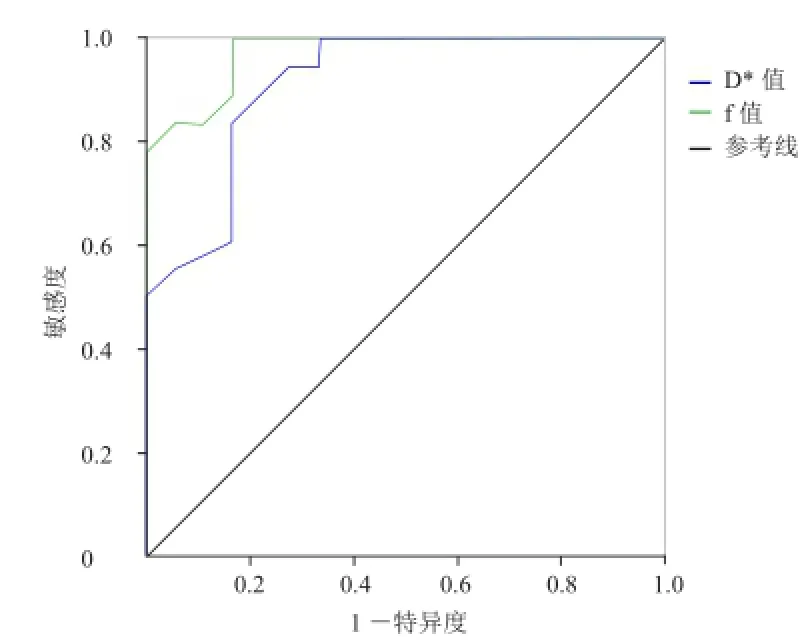
图1 子宫肌瘤HIFU后D*值和f值鉴别消融灶与残留未消融灶的ROC曲线
2.3 消融灶的不同IVIM-DWI参数图与NPV吻合度分级结果 各参数值差异有统计学意义(χ2=20.29,P<0.05),D*值及f值图消融灶与NPV相吻合。14例消融灶外围有不连续环形带,D值消融灶与肌层组织基本吻合。D*值及f值图与NPV吻合度优于D值图,差异有统计学意义(χ2=14.64、12.83,P<0.05);D*值及f值的吻合度比较,差异无统计学意义(χ2=1.40,P>0.05)。见表2、图2。
3 讨论
3.1 IVIM理论与b值设定 IVIM-DWI随b值升高呈双指数信号衰减特征。当b值<200 s/mm2时流动血液中的水质子具有相对大的移动距离,水分子运动来自血液流动的灌注作用;当b值≥200 s/mm2时灌注效应信号明显衰减,灌注对信号衰减作用影响较少,水分子扩散效应增加[7]。IVIM-DWI中的D值、D*值及f值与b值设定有关,如何选取b值目前仍未达成共识。与盆腔病变研究的多b值选取方法不同[8],本研究的IVIM设定16个b值,以b值200为分界点,低b值组和高b值组均采用相同的b值数目,大大提高各参数值的准确性。
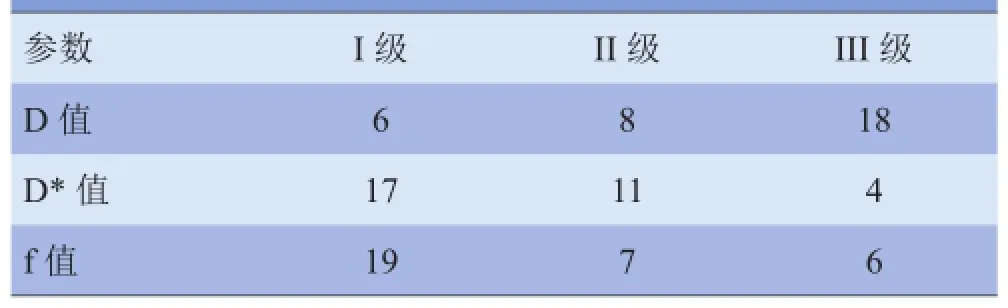
表2 IVIM-DWI参数图消融灶与NPV吻合度的分级(例)

图2 女,40岁,子宫肌瘤。增强扫描示术前肌壁间瘤灶实质明显强化(箭,A);肌瘤HIFU术后无血流灌注区域NPV(ROI 1)及残留未消融灶(ROI 2)(B);消融灶(ROI 1)及残留未消融灶(ROI 2)的双指数函数形式信号衰减图,横坐标为b值由小到大顺序排列,纵坐标为信号强度,b<200 s/mm2时两感兴趣区有信号强度差异,当b>200 s/mm2两曲线趋向重叠,无信号强度差异(C);D值伪彩图显示消融灶轮廓不清楚,消融灶与残留未消融灶间无信号强度对比差异,周边可见充血带(箭,D);D*值、f值图显示消融灶与残留未消融灶分界清,消融灶范围与NPV吻合(E、F)
3.2 各参数值量化评价子宫肌瘤HIFU后消融效果本研究显示术后CE-MRI无强化的消融灶D*值及f值低于术前肌瘤(P<0.05)。子宫肌瘤是含有血管的实体肿瘤,新生血管的形成在实体肿瘤生长过程中具有非常重要的作用,HIFU后损毁肿瘤直径200 μm以内的微血管[9],代表毛细血管密度及血流量指标的D*值及f值明显下降。可见D*值及f值参数值量化改变与DCE-MRI具有相关性,有助于判断肌瘤HIFU后微循环血流灌注分析。与Ikink等[10]对多个b值组合单指数衰减模型的DWI评价肌瘤HIFU后的结果一致,研究发现b值为0、200 s/mm2时,术后ADC值较术前下降,当b值为400、600、800 s/mm2时ADC值无统计学意义。肌瘤HIFU后采用b值为1000 s/mm2的ADC值术后变化无法预测,但发现术后ADC值随时间推移有动态升高趋势[2-3]。上述研究与本研究均认为无法通过水分子的扩散效应来反映子宫肌瘤的消融效果,不同的是D值剔除了灌注作用的影响,反映水分子的真实扩散效应或细胞密度的信息,所有研究都是以DCE-MRI为基准,DCE-MRI只是反映血流灌注情况,不能作为HIFU后水分子扩散效应或细胞密度发生变化的依据。
3.3 D*值及f值评价子宫肌瘤消融效能分析 本研究对消融灶与残留未消融灶间ROC曲线分析显示f值的AUC高于D*值,表明评价肌瘤HIFU疗效f值诊断效能比D*值更有价值,当f值≤19.5%时,敏感度为84.5%,特异度为93.6%。周延等[11]报道肿瘤微循环功能状态以f值较为准确,可能与两者在反映组织灌注方面代表的具体含义以及算法不同有关:f值指灌注相关体积分数,它反映了组织内毛细血管丰富程度,与微血管密度呈高度正相关。数值越大,微血管分布越密集[12-13]。f值与血容量有关,D*值与毛细血管平均长度及血管内血液流速有关。另外,D*值受信噪比影响较大,测量的重复性差可能也是造成其诊断效能低于f值的原因。但肿瘤组织血流动力学变异较大,f值是否可以作为评价肿瘤消融效果的独立指标尚需要加大样本量进一步研究。
3.4 消融灶IVIM-DWI各参数图与NPV吻合度评定比较 本研究中显示术后消融灶D值与残留未消融灶间差异无统计学意义(P>0.05),其伪彩图的消融灶与周围组织无信号强度对比。病理上凝固性坏死消融灶外围出现的充血区[3],部分患者的D值图显示为“环形带”。尽管“环形带”可以作为消融灶的边界,但由于断续不完整,故难以准确勾画消融灶轮廓,显示消融灶体积与NPV吻合性差。另一方面,术后消融灶D*值及f值低于残留未消融灶,两者的视觉信号强度对比明显,两参数图消融灶与NPV吻合性较高。
本研究的不足:①尽管D*值和f值可以评价子宫肌瘤HIFU后的疗效,但D*值的测量稳定性较差,呼吸、肠道蠕动及各种伪影等诸多因素均会影响D*值和f值的精确度。推测在IVIM序列设置上适当增加小b值的数目,降低高b值和激励次数的次数,既能提高D*值和f值的准确性,又能缩短扫描时间;②缺乏明确的病理和免疫组织化学指标与IVIM参数之间关系,今后的研究中可以对肌瘤消融灶进行超声引导下穿刺,寻找各参数反映的意义与病理之间的关系。
总之,HIFU在治疗子宫肌瘤的过程中对血管具有破坏作用,通过IVIM-DWI的D*值及f值能监测子宫肌瘤HIFU后组织的微循环灌注改变,是一种新的评价HIFU疗效的影像学方法,可以为指导治疗方案的实施提供参考。
[1] 韦超, 董江宁, 方昕, 等. DCE-MRI定量参数预测高强度超声消融术治疗症状性子宫肌瘤首次体积消融率价值. 临床放射学杂志, 2016, 35(4): 545-550.
[2] Pilatou MC, Stewart EA, Maier SE, et al. MRI-based thermal dosimetry and diffusion-weighted imaging of MRI-guided focused ultrasound thermal ablation of uterine fibroids. J Magn Reson Imaging, 2009, 29(2): 404-411.
[3] 张俊成, 杨振华, 赵相胜, 等. MR弥散成像在子宫肌瘤HIFU术后早期疗效评价中的价值. 放射学实践, 2012, 27(12): 1356-1360.
[4] Liu C, Liang C, Liu Z, et al. Intravoxel incoherent motion (IVIM) in evaluation of breast lesions: comparison with conventional DWI. Eur J Radiol, 2013, 82(12): e782-e789.
[5] 邵莹, 王蓉, 孙亲利, 等. 磁共振引导下聚焦超声治疗子宫肌瘤的临床应用. 实用放射学杂志, 2014, 30(3): 488-491, 505.
[6] Jacobs MA, Gultekin DH, Kim HS. Comparison between diffusion-weighted imaging, T2-weighted, and postcontrast T1-weighted imaging after MR-guided, high intensity, focused ultrasound treatment of uterine leiomyomata: preliminary results. Med Phys, 2010, 37(9): 4768-4776.
[7] Takahara T, Kwee TC. Low b-value diffusion-weighted imaging: emerging applications in the body. J Magn Reson Imaging, 2012, 35(6): 1266-1273.
[8] 乔敏霞, 时惠平, 秦丹, 等. 3.0T MRI多b值扩散加权成像对女性盆腔良、恶性病变的鉴别诊断价值. 中国医学影像学杂志, 2013, 21(12): 951-954.
[9] Voogt MJ, Van Stralen M, Ikink ME, et al. Targeted vessel ablation for more efficient magnetic resonance-guided highintensity focused ultrasound ablation of uterine fibroids. Cardiovasc Intervent Radiol, 2012, 35(5): 1205-1210.
[10] Ikink ME, Voogt MJ, Van den Bosch MA, et al. Diffusionweighted magnetic resonance imaging using different b-value combinations for the evaluation of treatment results after volumetric MR-guided high-intensity focused ultrasound ablation of uterine fibroids. Eur Radiol, 2014, 24(9): 2118-2127.
[11] 周延, 刘剑羽, 刘从容, 等. MR体素内不相干运动成像用于评价宫颈癌恶性程度和组织血供的价值. 中华放射学杂志, 2015, 49(5): 354-359.
[12] 贾慧茹, 张翼, 刘乐, 等. 扩散加权成像单指数和双指数模型评估单侧输尿管梗阻大鼠肾脏扩散及微灌注变化. 中国医学影像学杂志, 2014, 22(5): 325-328.
[13] Lee HJ, Rha SY, Chung YE, et al. Tumor perfusion-related parameter of diffusion-weighted magnetic resonance imaging: correlation with histological microvessel density. Magn Reson Med, 2014, 71(4): 1554-1558.
(本文编辑 张晓舟)
Study of MR Intravoxel Incoherent Motion in Monitoring Focal Perfusion Status of Uterine Fibroids after High-intensity Focused Ultrasonic
Department of Radiology, the Affiliated
Jiangmen TCM Hospital of Jinan University, Jiangmen 529031,China
Address Correspondence to:LU RuizhanE-mail: wyzhyy@sina.com
PurposeTo assess the value of intravoxel incoherent motion (IVIM) diffusionweightedimaging in monitoring themicrocirculation information duringHighintensity Focused Ultrasonic (HIFU) treatment, in order to provideanew safe technique.Materials and MethodsProspectively analyze 26 patients with 32 uterine fibroids, who were treated with HIFU. Routine MRI, DCE-MRI and IVIM-DWI were performed before and after the treatment. Diffusion coefficient value (D), pseudodiffusion coefficient value (D*), perfusion fraction value (f) of the ablated tissue pre-treatment, post-treatment and non-ablated tissuewere compared. The anastomosisofall parameters' artificial color mapin ablation areaand non-perfused volume (NPV) on DCE-MRI were finally evaluated and classified.ResultsAfter the treatment the mean D* value and f value of the ablated tissue reduced significantly compared with the corresponding areain pre-treatmentand the nonablated tissuegroups (P<0.01). However, there was no significant difference among the three groups in D value of ablation area (P>0.05). The ROC curve analysis showed that f value was the better parameter for distinguishing the ablation area from non-ablationareas. Area under curves (AUC) was 0.952. Diagnostic cut off point was 19.50% with 84.5% sensitivity and 93.6%. specificity. It was proved that D* value and f value's artificial color maps had the best visual anastomosis with NPV detected on DCE-MRI.ConclusionIVIM-DWI may provide microcirculation information in assessment of NPVof uterine fibroidsafter HIFU, since it is anon-invasive techniquewithout the use of an intravenous contrast agent.
Uterine neoplasms; Leiomyoma; Ultrasonic therapy; Magnetic resonance imaging; Diffusion-weighted imaging; IntravoxelIncoherent motion; Microcirculation
10.3969/j.issn.1005-5185.2016.11.007
卢瑞沾
2016-06-17
2016-07-20
江门市医疗卫生领域科技计划项目(20157519)。
R445.2;R737.33
