茜草精油抗氧化及抗癌活性研究
2016-12-26权美平郑翠平马婷婷田呈瑞
权美平 郑翠平 马婷婷 田呈瑞
(陕西师范大学生命科学学院1 ,西安 710119)(陕西省多河流湿地生态与环境重点实验室2 ,渭南 714000)(渭南师范学院化学与环境学院3 ,渭南 714000)
茜草精油抗氧化及抗癌活性研究
权美平1,2,3郑翠平1马婷婷1田呈瑞1
(陕西师范大学生命科学学院1,西安 710119)(陕西省多河流湿地生态与环境重点实验室2,渭南 714000)(渭南师范学院化学与环境学院3,渭南 714000)
以水蒸气蒸馏法提取茜草精油,以天然和合成的抗氧化剂为对照,用4种不同的抗氧化体系(ABTS+·,过氧化氢,FRAP和还原力)检测法估价精油的抗氧化活性。精油呈现出在不同体系中剂量依赖式不同程度的功效。抗癌活性的检测使用人体乳腺癌MCF-7和宫颈癌Hela细胞株,结果发现精油对于2种肿瘤细胞均有较强活性,IC50分别为(1.052±0.396) mg/mL和(0.275±0.026) mg/mL,MTT和LDH检测均表明精油抗癌活性对Hela细胞明显更强;1 g精油中总酚含量为0.220 mg/mL没食子酸当量。研究结果表明茜草精油可作为重要的天然抗氧化剂。
茜草精油 抗氧化 抗肿瘤 Hela细胞
近些年,由于合成化合物的安全性衍生的一系列问题促使人们加快对于植物资源的研究。许多天然植物和中草药的有效成分具有抗氧化和清除自由基的作用,在医学应用上具有很大的潜力。植物精油是从芳香植物中提取出来的具有一定香气和挥发性的油状物质;是一类天然植物性添加剂,能够矫正食品的异味,赋予香气,具有着色、抗菌消炎、防腐、抗氧化、抗肿瘤等作用。因此,植物精油常被开发成天然防腐剂和杀菌剂,广泛应用于食品、医药及化妆品等领域[1-2]。
茜草为茜草科多年生攀援草本植物茜草(RubiacordifoliaL.)的干燥根及根茎。由于茜草干根及茎自古代就作为天然染料、食品的着色剂和药用植物使用[3],它的化学成分、药理和临床作用被深入系统研究。其主治吐血、衄血、崩漏、外伤出血、经闭瘀阻、关节痹痛、跌扑肿痛等[4];亦具抗菌、抗癌、增强免疫、护肝、抑制人体表皮细胞增殖等生物活性。作为一种民族药材,它有着悠久的应用历史,但到目前为止还鲜见茜草精油的研究报道。本研究以水蒸气蒸馏法提取的精油进行抗氧化活性研究,并对茜草精油抗癌活性进行评价,为茜草的开发利用提供参考。
1 材料与方法
1.1 主要材料和试剂
细胞株:Hela和MCF-7细胞株,第四军医大学提供;茜草干根:西北中药材市场;DMEM培养基:Gibco公司;新生牛血清:杭州四季青生物工程材料有限公司;二甲基四氮唑盐(MTT)、二甲基亚砜(DMSO)、DPPH、ABTS、TPTZ:Sigma公司;LDH试剂盒:南京建成生物工程研究所。其余所用试剂均为分析纯。
1.2 主要仪器与设备
722型可见分光光度计:上海光谱仪器有限公司;倒置显微镜:Nikon公司;CO2细胞培养箱及全自动酶联免疫检测仪:美国Thermo Fotma公司;TY-80脱色摇床:常州市国立试验设备研究所。
1.3 试验方法
1.3.1 茜草精油的提取
采用挥发油提取器用常规水蒸气蒸馏法提取挥发油。具体操作:粉碎至40目的茜草干粉40 g,浸泡4 h后,置于1 000 mL圆底烧瓶中,加水500 mL,加热回流提取挥发油,回流至挥发油量不再增加,停止加热;正己烷萃取收集合并挥发油,以无水硫酸钠干燥,得黄色片状固态精油,-40 ℃保存以备用分析。
1.3.2 抗氧化试验
精油的稀释与准备:精确称取20 mg的挥发油,加入10 mL DMSO,配制成初始浓度2.000 mg/mL,然后用倍半法稀释为系列浓度,精油的浓度范围0.016~2.000 mg /mL。
1.3.2.1 清除ABTS+·活力测定
参照Xu等[5]的方法。移取50 μL适当稀释的样品溶液(阳性对照VC和BHT,下同),加入1.9 mL用甲醇稀释至734 nm处吸光度为(0.700±0.050)的ABTS+·应用液,混合,室温下避光反应6 min,测定其在734 nm处的吸光度。ABTS+·自由基清除率=(1-A1/A2)×100%,式中:A1为样品管的吸光值;A2为对照管的吸光值。
1.3.2.2 过氧化氢清除力的测定
参考N. Ozsoy等[6]方法并稍作修改。将0.3 mL不同浓度样液和0.9 mL磷酸缓冲液(50 mmol/L, pH 7.4)混合,再加入1.8 mL过氧化氢溶液后,震荡混匀,10 min后在A230 nm测定吸光值,并用磷酸缓冲液代替过氧化氢做空白对照,H2O2清除率=(1-A1/A2)×100%,式中:A1为样品管的吸光值;A2为对照管的吸光值。
1.3.2.3 还原力的测定
样品提取液还原力的测定依照稍作修改的 Vaquero 等[7]的方法进行。取2.5 mL不同稀释度的样品提取液加入到装有2.5 mL 0.2 mol/L pH 6.6的磷酸缓冲液的试管中,再加入2.5 mL 1%的铁氰化钾溶液混合均匀。50 ℃反应20 min后,加入2.5 mL 10%的三氯乙酸在3 000 r/min 的转速下离心10 min,取上清液5 mL与4mL的蒸馏水和0.5 mL 0.1%的三氯化铁溶液混合。反应10 min后,在700 nm 处测其吸光度。混合液的吸光度越高表示样品提取液的还原能力越强。
1.3.2.4 总抗氧化能力测定(FRAP体系)
参照Benzie等[8]方法进行。以FeSO4为标液绘制标准曲线,根据反应后的吸光值,在标准曲线上求出相当于FeSO4的浓度(mg/mL)定义为FRAP值。FRAP值越大抗氧化活性越强。其具体步骤为:加入0.1 mL 不同浓度的FeSO4,加入3.1 mL蒸馏水和新鲜配制的预热至37 ℃的1.8 mL 三吡啶三吖嗪(TPTZ)工作液。混匀后,在37 ℃条件下水浴反应30 min,在593 nm波长处测定其吸光度。绘制标准曲线,其回归方程为y=0.365 7x+0.055 5(R2=0.999 1)。精油的总抗氧化能力以样品相当于FeSO4的浓度(mg/mL)表示。
1.3.3 抗肿瘤试验
1.3.3.1 细胞培养及药物处理
细胞采用含10%新生牛血清的1640培养基(100 U/mL青霉素、100 μg/mL 链霉素),置于37 ℃含5% CO2饱和湿度培养箱中培养。细胞贴壁生长,用0.25%的胰酶与0.02%的 EDTA(体积比1∶1) 消化传代,取对数增殖期的细胞用于试验。给予药物时、精油以DMSO溶解且溶剂的终浓度在培养体系中保持在0.500 mg/mL以避免溶剂毒性。取细胞生长至对数期或密度达到90%以上的5×103细胞/孔细胞悬液接种于96孔细胞培养板中,分别给予不同浓度的待测样品溶液各10 μL (0、0.031、0.063、0.125、0.250、0.500、1.000、2.000 mg/mL),在相同的培养条件下培养24 h,每浓度设3个复孔,并设空白(不加药物)和溶剂对照。
1.3.3.2 MTT 法测定细胞活力
药物处理结束,避光加入10 μL MTT(5 mg/mL), 置于细胞培养箱4 h后,吸弃培养基,每孔加150 μL DMSO,避光振荡10min,至结晶完全溶解。酶标仪A490 nm测吸光值,计算平均值和标准差,按下公式计算癌细胞的存活率。存活率=A试验孔/A对照孔×100%。
1.3.3.3 乳酸脱氢酶(LDH)检测
细胞给药处理同3.3.3.1,不同之处在于药物处理 24 h后,直接离心,取上清(用24孔板操作),然后按照LDH检测试剂盒的说明进行操作,在酶标分析仪450 nm处检测其OD值,然后按照公式计算细胞上清液中LDH的活性,LDH(U/L)=(A试验孔- A对照孔)/(A标准孔-A空白孔) ×标准浓度×样品稀释倍数×1 000。
1.3.3.4 倒置显微镜观察细胞形态变化
MTT试验前,倒置显微镜观察精油处理孔的细胞形态变化并拍照。
1.4 总酚含量测定
精油总酚含量的测定以福临酚法进行且精油总酚含量以标准品没食子酸当量(mg/mL)表示。
1.5 统计学处理
数据以平均值±标准差表示,数据处理,显著性检验及IC50的计算应用SPSS 18.0软件进行,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 茜草精油的得率与形态
以水蒸气蒸馏法可得茜草精油的提取率0.12%,密度测定为0.896 g/mL。室温条件下茜草精油的颜色为黄色状态为薄片状结晶状固态精油,具有特殊的刺激性芳香气味。茜草精油是精油中为数不多的固态精油种类, Chen等[9]从健康的沉香木中所提取的精油即为固体精油,但目前大多数的研究报告证明芳香植物精油以液体精油占绝大多数。据Mitsuo等[10]报道可知,茜草精油的主要成分为mollugin(大叶茜草素占19.6%)和furomollugin (呋喃大叶茜草素占17.4%)。
2.2 茜草精油的抗氧化活性
2.2.1 清除ABTS+·活力测定结果
不同浓度的精油和阳性对照清除ABTS+·能力如图1所示。精油、VC和BHT清除ABTS+·能力与所试浓度呈剂量依赖效应,在低浓度范围内量效关系增加明显;精油在低浓度范围(<0.063)内,对ABTS+·清除力明显低于VC和BHT,以BHT的清除活力最强;但精油在高浓度范围内(>0.063)对ABTS+·清除基本与VC和BHT相当,表现出超强的抗氧化性,0.063 mg/mL时其清除率高达(98.380±0.820)%,稍高于VC (96.930±0.500%)和BHT(97.580±1.350%);1.000 mg/mL和2.000 mg/mL精油与同浓度的阳性对照VC和BHT对ABTS+·的清除都基本完全,达100%。可见,精油具有较强的ABTS+·清除活力。

图1 茜草精油、VC和BHT 对ABTS自由基的清除效果
2.2.2清除过氧化氢活力测定结果
不同浓度的精油和阳性对照清除过氧化氢能力如图2所示。精油、VC和BHT清除过氧化氢能力与所试浓度呈剂量依赖效应;精油相对于阳性对照(VC和BHT)表现出明显高的过氧化氢清除活力,在所试浓度范围(0.063~2.000 mg/mL),精油随浓度增加清除活力的增加不明显,清除率从(75.600±0.530)%~(97.310±0.500)%[VC从(15.580±0.420)%~(62.230±2.010)%,BHT从(20.260±0.680)%~(88.380±1.010)%]。三者对于过氧化氢清除的活力顺序为精油>BHT>VC。

图2 茜草精油、VC和BHT 对过氧化氢的清除效果
2.2.3 还原力的测定结果
不同浓度的精油和阳性对照的还原能力如图3所示。精油、VC和BHT的还原能力与所试浓度呈剂量依赖效应,但精油的剂量效应性关系不明显,其在所试浓度范围内吸光值仅从0.277升高至0.369,而VC(0.299~0.603)和BHT(0.198~0.705)的变化要更明显。同浓度范围下(<1),还原能力的大小顺序为VC>BHT>精油。

图3 茜草精油、VC和BHT 的还原能力
2.2.4 总抗氧化能力测定结果(FRAP体系)
测定FeSO4的标准曲线曲线方程:y=0.365 7x+0.055 5(R2=0.999 1)。不同浓度的精油和阳性对照的总抗氧化能力(FRAP体系)如图4所示。不同浓度的精油和阳性对照的总抗氧化能力如图4所示。精油、VC和BHT总抗氧化能力与所试浓度呈剂量依赖效应;精油相对于阳性对照(VC和BHT)表现出较低的总抗氧化活力,阳性对照VC则比BHT活力更高;精油的FRAP值其在所试浓度范围的变化范围为(0.676±0.01)~(3.673±0.03),VC的FRAP值的变化范围为[(2.055±0.00)~(4.423±0.15)],BHT的FRAP值的变化范围为(0.944±0.01)~(4.387±0.16)。三者总抗氧化活力顺序为VC>BHT>精油。
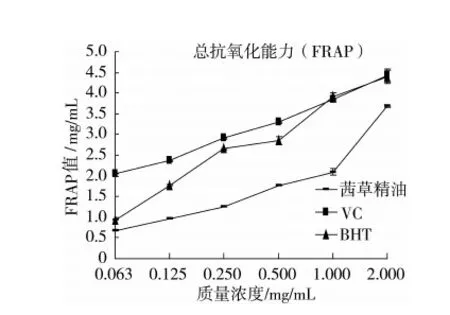
图4 茜草精油、VC和BHT 的总抗氧化能力
2.3 茜草精油的抗肿瘤活性
2.3.1 MTT法测定细胞存活率结果
茜草精油对2种癌细胞增殖效果的影响见图6。精油质量浓度范围内(0.031~2.000 mg/mL)明显地以剂量依赖方式抑制了2种癌细胞的生长,且对于Hela细胞更为敏感,对其的抑制效果明显比MCF-7强,Hela细胞存活率变化范围[(30.500±1.500)%~(83.900±6.000)%)],MCF-7细胞存活率变化范围[(39.600±8.200)%~(86.200±3.700)%];精油对于2种癌细胞的IC50分析表明:Hela细胞的IC50值(0.275±0.026) mg/mL,MCF-7细胞的IC50值1.052±0.396 mg/mL;显著性分析表明,精油的各受试质量浓度条件下,细胞存活率与对照组相比都有显著性差异(P<0.05)。可知,茜草精油对于Hela和MCF-7细胞均具较强的抗癌活性。

图5 茜草精油对Hela和MCF-7细胞增殖的影响
2.3.2 LDH法检测结果
LDH是从细胞内释放出来检测细胞凋亡的指示器。因此,可测定细胞培养液中LDH的活性来判断样品对细胞的损伤程度[11]。由图6可知,细胞培养液中LDH活力与药物呈现明显呈剂量依赖效应,如:随药物浓度(0~2.000 mg/mL),Hela细胞LDH的释放量从(89.300±2.900)U/L增加到(264.300±4.600)U/L,MCF-7细胞LDH的释放量从(81.700±2.600)U/L增加到(232.700±3.400)U/L,Hela细胞LDH的释放量较大。此结果与茜草精油对Hela细胞的活性更强的MTT结果相吻合;显著性分析表明:受试2种细胞在所试浓度下释放出的LDH与对照组相比都有显著性差异(P<0.05)。
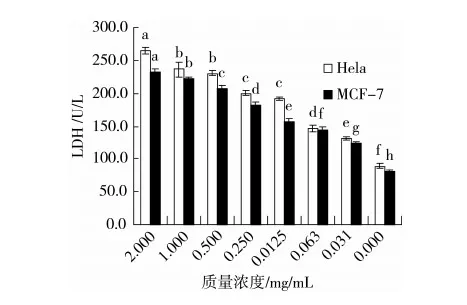
图6 茜草精油对Hela和 MCF-7细胞LDH的影响
2.3.3 细胞形态变化
从图7的药物处理组可知,给药细胞明显发生形态改变,细胞变形,发生皱缩,有些甚至发生大面积的调亡,形成许多的凋亡小体,由此可见精油对Hela和MCF-7细胞有着明显的促凋亡作用。

图7 茜草精油对MCF-7细胞形态的影响
2.4 精油总酚含量的测定结果
福林酚法测定所得没食子酸的标准曲线方程为:y=8.481 7x+0.088 2(R2=0.996 7);试验所测定的精油总酚含量为1 g精油与0.220 mg/mL没食子酸当量研究。研究表明[6,12]:总酚含量是主要地天然抗氧化活性成分;总酚含量与生物活性间有很强的呈正相关性关系。
3 讨论与结论
大量研究分析表明,精油中化合物多为抗氧化剂[13]。Fatouma等[14]研究的茉莉精油强的抗氧化活性足以解释此植物能治疗多种疾病的原因,即精油的天然抗氧化剂与药用植物的有益属性密切相关。本研究以不同体系评价精油的抗氧化活性结果证明茜草精油具有较好的清除ABTS+·和过氧化氢的生物活性,总抗氧化能力和还原能力相对阳性对照较弱。
本研究以Hela和MCF-7为受试细胞株,精油处理后其存活率的IC50值分别为(0.275±0.026)mg/mL和(1.052±0.396) mg/mL,Hela细胞比MCF-7细胞的LDH检测的结果值高都说明茜草精油具有抗癌活性,且茜草精油对于Hela细胞更敏感。
植物界的酚类化合物是植物发挥抗氧化潜力的主要源泉,是发挥抗氧化活性的主要贡献和参与者[6],抗氧化活性的强弱与酚类含量紧密相关;Wu等[15]和Bakkali等[14]研究表明精油中多酚类物质可以有效地导致肿瘤细胞凋亡或者细胞坏死。本研究测定出茜草精油的多酚含量为1 g精油与0.220 mg/mL没食子酸当量相等,精油中的多酚含量可以解释和支撑茜草精油的抗氧化和抗癌活性效果。
[1]Tian Jun, Ban Xiaoquan, Zeng Hong, et al. Chemical composition and antifungal activity of essential oil fromCicutavirosaL.var.latisectaCelak[J]. International Journal of Food Microbiology,2011,145(2/3):464-470
[2]Mohamed Hajji,Ons Masmoudi,Nabil Souissi,et al. Chemical composition, angiotensin I-converting enzyme (ACE) inhibitory, antioxidant and antimicrobial activities of the essential oil fromPeriplocalaevigataroot barks[J]. Food Chemistry, 2010, 121(3): 724-731
[3]Cai Yizhong,Sun Mei,Xing Jie,et al. Antioxidant phenolic constituents in roots ofRheumofficinaleandRubiacordifolia: structure radical scavenging activity relationships[J].Agricultral Food Chemistry,2004,52:7884-7890
[4]国家药典委员会.中华人民共和国药典:一部[S].北京:化学工业出版社,2005:162
[5]Xu JG,Hu QP,Liu Y, et al. Antioxidant and DNA-protective activities of chlorogenic acid isomers. Journal of Agricultural and Food Chemistry,2012,60:11625-11630
[6]Ozsoy N,Can A,Yanardag R. Antioxidant activity ofSmilaxexcelsaL. leaf extracts[J]. Food Chemistry, 2008,(110):571-583
[7]Vaquero M J R,Serravvalie L R T,de Nadra M C M,et al. Antioxidant capacity and antibacterial activity of phenolic compounds from argentinean herbs infusions[J].Food Control,2010,21(5):779-785
[8]Benzie,Iris FF, J J Strain.The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay [J].Analytical Biochemistry,1996,23(9):70-76
[9]Chen Huaiqiong,Yang Yun,Xue Jian, et al. Comparison of compositions and antimicrobial activities of essential oils from chemically stimulated agarwood,wild agarwood and healthyaquilariasinensis(Lour.) Gilg Trees[J]. Molecules, 2011,(16):4884-4896
[10]Mitsuo Miyazawa, Jyunichi Kawata. Identification of key aroma compounds in dried roots of Rubia cordifolia[J]. Journal of Oleo Science,2006,55(1):37-39
[11]Cui Guoting, Zhang Wuxia, Zhang Amin,et al. Variation in antioxidant activities of polysaccharides fromFructusJujubaein South Xinjiang area [J]. International Journal of Biological Macromolecules,2013,57:278-284
[12]Lee YuLing,Huang GiWei, Liang ZengChin, et al. Antioxidant properties of three extracts fromPleurotuscitrinopileatus[J]. LWT-Food Science and Technology,2007(40):823-833
[13]Bakkali F, Averbeck S, Averbeck D,et al. Biological effects of essential oils-A review[J]. Food and Chemical Toxicology,2008,46:446-475
[14]Fatouma Abdoul-Latif, Prosper Edou, François Eba, et al. Antimicrobial and antioxidant activities of essential oil and methanol extract ofJasminumsambacfrom Djibouti[J].African Journal of Plant Science,2010,4(3): 38-43
[15]Wu Xinjiang,Thorsten Stahl,Hu Ying,et al. The production of reactive oxygen species and the mitochondrial membrane potential are modulated during onion oil-induced cell cycle arrest and apoptosis in A549 cells[J].Nutrition,2006,136:608-613.
Antioxidant and Anticancer Activity of Essential Oil from Madder(Rubia cordifolia L.)
Quan Meiping1,2,3Zheng Cuiping1Ma Tingitng1Tian Chengrui1
(College of Life Science, Shaanxi Normal University1, Xi′an 710119)(Key Lab of River Wetland Ecology and Environment in Shaanxi Province2,Weinan 714000)(The College of Chemistry and Environment Science, Weinan Normal University3,Weinan 714000)
The antioxidant and anticancer activity of the essential oil by hydrodistillation from the roots of Rubia cordifolia was examined. 4 different antioxidant tests (evaluated by ABTS radical method, hydrogen peroxide-scavenging activity, the FRAP assay and reducing power assays.) were employed in order to evaluate the antioxidant activities of the essential oil, in addition, the results were compared with natural and synthetic antioxidants. The essential oil exhibited varying degrees of efficacy in each assay in a dose-dependent manner. The anticancer activity of this oil was tested on human breast carcinoma cell line MCF-7 and human cervical carcinoma cell line Hela. The oil was found to be very active against both tumor cell lines, with an IC50of (0.275±0.026) mg/mL for Hela and (1.052±0.396) mg/ml for MCF-7. The anticancer activity of the essential oil against Hela was significantly higher than against MCF-7 through MTT assay and released LDH assay. The levels of total phenolics in the oil were also determined as 0.220 mg/mL in 1 g essential oil. Our findings demonstrate that the essential oil from madder could be considered as a significant natural antioxidant source and be a good candidate for further investigations of new bioactive substances.
rubiacordifoliaL., essential oil, antioxidation, anticancer, Hela cell
Q946
A
1003-0174(2016)04-0089-06
2014年渭南师范学院特色学科建设(14TSXK04)
2014-07-28
权美平,女,1978年出生,副教授,植物资源开发与利用
田呈瑞,男,1955年出生,博士生导师,教授,植物资源开发与利用
