酶促酯交换椰子油制备富含MCT油脂工艺研究与优化
2016-12-26孟鹏程梁少华杨青坪吕新新李茹洋
孟鹏程 梁少华 杨青坪 吕新新 李茹洋
(河南工业大学粮油食品学院,郑州 450001)
酶促酯交换椰子油制备富含MCT油脂工艺研究与优化
孟鹏程 梁少华 杨青坪 吕新新 李茹洋
(河南工业大学粮油食品学院,郑州 450001)
对脂肪酶Lipozyme RM IM催化癸酸与椰子油酯交换制备富含MCT油脂的工艺条件进行研究。结果表明:在反应温度46 ℃,底物摩尔比8:1,加酶量6%,加水量15%,反应时间8 h的优化工艺条件下进行多次平行试验,酯交换产物甘三酯中癸酸和MCT质量分数分别达42.31%和50.85%,与原料油相比分别增长37.57%和35.87%。产物甘三酯脂肪酸组成和甘三酯结构分析结果表明,酯交换产物甘三酯中共含有9种MCT成分,主要成分及其在产物甘三酯中的质量分数分别为DLaD(23.57%)、DLaLa(16.88%)和DDD(4.83%)等。
椰子油 脂肪酶 酯交换 癸酸 MCT
椰子油一般由椰子干压榨而得[1-2],饱和酸大于90%[2],以中碳链脂肪酸(Medium-chain Fatty Acid, MCFA)为主,其中含月桂酸41%~56%[2-4],是主要以MCFA组成的植物油脂,在医药[5]、减肥美容[6]、调节人体代谢和血浆血脂[7-8]等方面具有较高价值。中碳链甘三酯(Medium-Chain Triglycerides,MCT)能直接进入线粒体供能,吸收快,不易引起肥胖[9-11],主要制备方法有水解酯化法、酰氯醇解法和酶法等。目前,富含MCT油脂及MCT产品主要是以椰子油、棕榈仁油等含有MCFA较多的油脂为原料,经水解纯化得到MCFA,然后再进行酯化而得,工艺较复杂[1-2]。此外,我国对利用椰子油制备富含MCT油脂的研究还相对较少,因此,研究对椰子油的深加工与利用和MCT制备具有重要意义。
本研究以酶促酯交换为手段,利用椰子油脂肪酸组成特性和脂肪酶位置专一性使癸酸接入椰子油甘三酯sn-1,3位而高效制备富含MCT产品,提高了椰子油市场价值,也适宜我国加快木本油料产业发展的规划[12]。
1 材料与方法
1.1 材料与试剂
椰子油:印度尼西亚米南伽奧甘农业公司;脂肪酶Lipozyme RM IM(Rhizomucormiehei):丹麦诺维信公司;猪胰脂酶:自制;正癸酸(AR,99%):阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
Agilent 7890A气相色谱仪:Agilent Technologies;80-2离心机:金坛市华锋仪器有限公司;DF-101K集热式恒温磁力搅拌器:郑州长城科工贸有限公司。
1.3 试验方法
1.3.1 原料椰子油品质分析
酸值测定:参照GB/T 5530—2005方法;皂化值测定:参照GB/T 5534—2008;过氧化值测定:参照GB/T 5538—2005;水分与挥发物含量:参照GB/T 5528—2008;磷脂含量:参照GB/T 5537—2008;色泽:参照GB/T 22460—2008。
1.3.2 脂肪酶催化酯交换椰子油
依预设底物摩尔比(油/酸)称取一定量椰子油和癸酸于烧瓶中,预热至反应温度后加入一定量脂肪酶(以总底物质量计)和去离子水(以酶的质量计),密闭反应装置,开始计时。到达预定时间后停止反应,离心去除酶,干燥,以备分析。
1.3.3 脂肪酸组成、癸酸含量与MCT含量分析
采用气相色谱法,结合面积归一化法和sn-1,3-随机-sn-2随机理论对原料油和产物甘三酯进行分析并得到癸酸和MCT在产物甘三酯中的相对百分含量[13]。产物甘三酯中癸酸含量和MCT含量指酯交换反应混合物经薄层分离后得到的甘三酯混合物中的相对百分含量。
原料和产物经薄层色谱分离得中性油后再进行全样和sn-2位脂肪酸组成分析。sn-2位组成分析采用猪胰脂酶水解法(薄层色谱分离得到甘一酯)。脂肪酸甲酯依GB/T 17376—2008制备;脂肪酸甲酯气相色谱分析参考GB/T 17377—2008。
气相色谱条件:BPX-70毛细管柱(30.0 m×250 μm,0.25 μm),进样口温度230 ℃,柱温190 ℃,氢火焰离子化检测器(FID),检测器温度300 ℃,氮气、氢气和空气流速分别为1.2、40、450 mL/min。
2 结果与分析
2.1 原料油脂品质分析
由表1可知,原料油品质较好。未检出磷脂,磷脂大于0.5%会影响酶促反应进行[14-15]。

表1 椰子油理化指标
2.2 脂肪酶催化椰子油酯交换单因素试验
2.2.1 温度和底物摩尔比对癸酸含量和MCT含量的影响
加酶量4%、加水量10%、反应8 h时,控制底物摩尔比或温度,癸酸和MCT含量的变化如图1所示。55 ℃之前,产物含量呈上升趋势。此时,癸酸质量分数为30.35%,MCT质量分数37.05%,分别增长25.61%和22.12%。55 ℃后,曲线趋于平缓。温度影响脂肪酶活性位点暴露和体系黏度,从而影响酶与底物碰撞几率[16-17]。故温度选择55 ℃。
底物摩尔比小于6∶1,增速较快。之后,癸酸和MCT的质量分数分别由6∶1时的37.34%和46.28%增长为42.25%和53.21%,增长缓慢。底物摩尔比增加会增加酶与底物分子碰撞几率,但较高的游离脂肪酸含量也会影响脂肪酶活力[18]。Lee等[19]的研究也证实了这一点。故底物摩尔比选择6∶1。
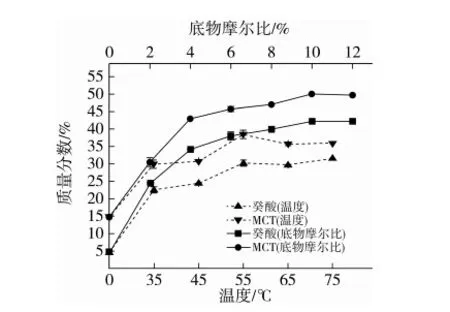
图1 温度和底物摩尔比对癸酸含量和MCT含量的影响
2.2.2 加酶量、加水量和反应时间对癸酸含量和MCT含量的影响
反应温度55 ℃、底物摩尔比6∶1时,控制加酶量、加水量和时间,癸酸和MCT含量的变化如图2所示。两者都随加酶量的增加而增加,加酶量大于4%,基本不再增加。此时,癸酸和MCT的质量分数分别为37.98%和44.67%。酸解反应是复杂的可逆反应,酶量增加使合成反应加快,但水解副反应也加速[20-21]。所以加酶量选择4%。
随着加水量增加,两者呈先增加再趋于平衡后降低的趋势。小于10%时,均有明显增加。10%时,癸酸和MCT的质量分数为37.54%和44.10%,增长32.80%和30.07%。酶促反应主要在油水界面进行,故合适的水分含量会促进反应进行[22],加水量选择10%。
反应6 h时,合成速率开始减缓,癸酸和MCT的质量分数分别达到35.25%和43.46%。6 h后的低速增长主要受底物浓度降低的影响。故反应时间为6 h较适宜。

图2 加酶量、加水量和反应时间对癸酸含量和MCT含量的影响
2.3 脂肪酶催化癸酸与椰子油酯交换反应工艺优化
响应面优化试验分析方案及结果见表2。
利用Design-Expert 8.0.5.0软件对癸酸含量和MCT含量试验结果进行回归分析,得到对应的多项回归方程和方差分析如表3所示。
癸酸质量分数=34.29+2.92A+2.44B+7.36C+1.36D+2.67E-2.61AC-0.89CD-1.47CE-0.66B2-3.84C2
MCT质量分数=41.75+2.45A+2.93B+6.73C+0.81D+2.88E-4.46AC+2.79BC-1.72CE-1.08B2-4.44C2
结果显示,失拟项均不显著(P>0.05),模型P<0.000 1,模型高度显著。癸酸和MCT含量回归方程的复相关系数为0.989 9和0.978 8,校正相关系数为0.981 7和0.961 8,模型拟合程度较好。变异系数均较低,说明试验可靠性较高,模型可用于预测癸酸和MCT含量的变化。
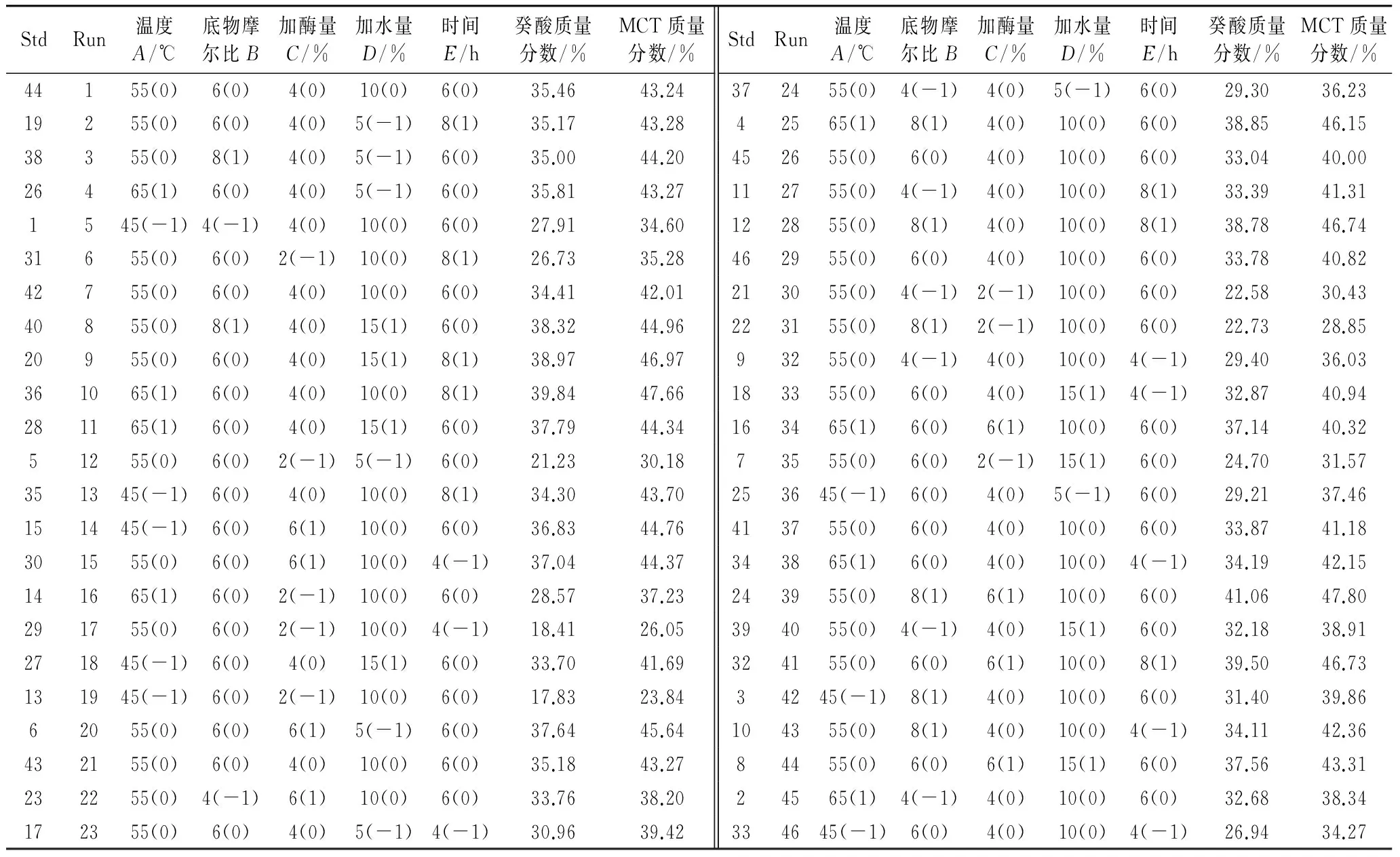
表2 酶催化椰子油酯交换中心组合试验设计方案与结果
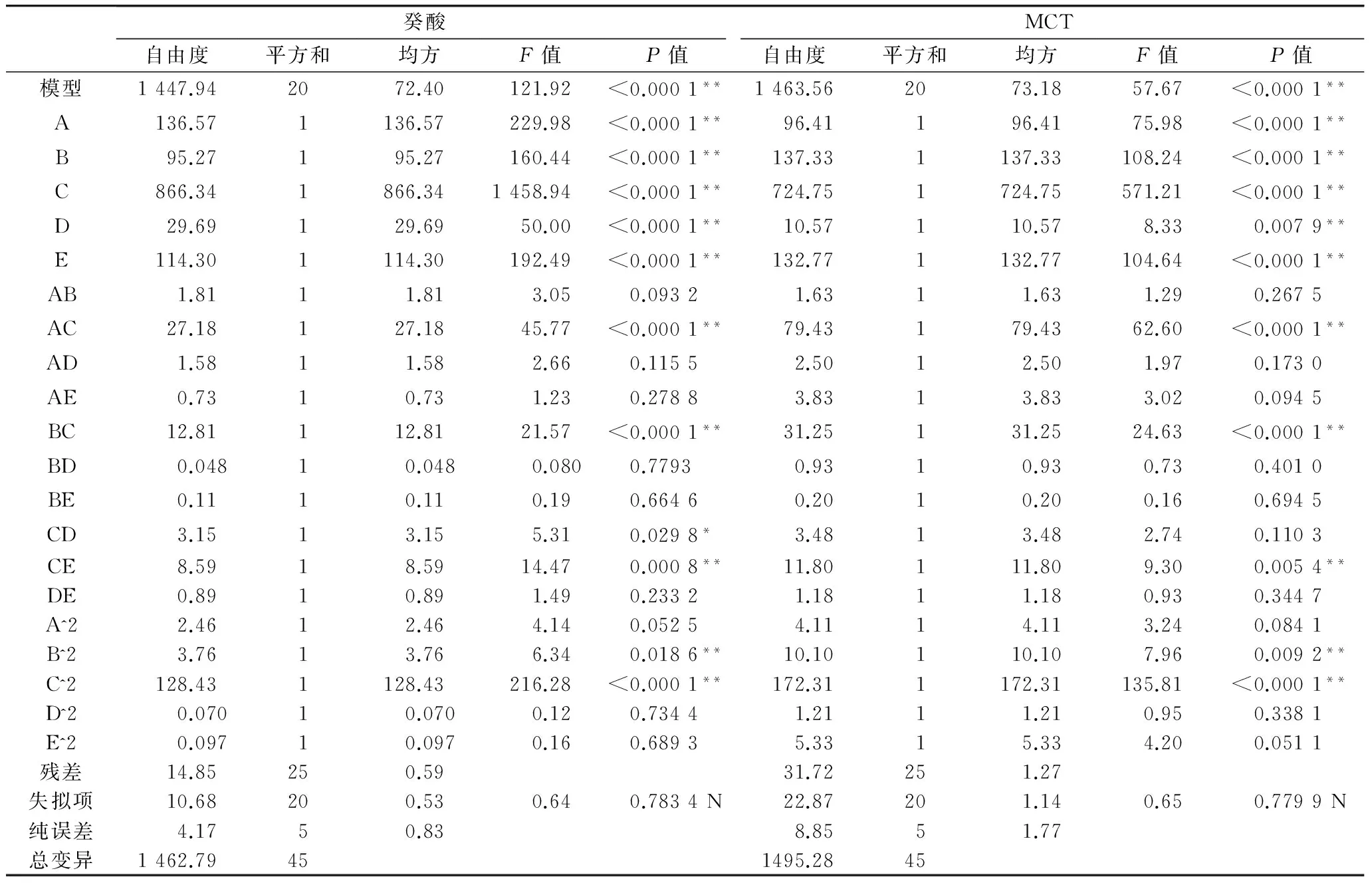
表3 RSM立体模型对癸酸和MCT含量影响的方差分析
注:**表示P<0.01,极显著;*表示P<0.05,显著;N表示P>0.05,不显著。
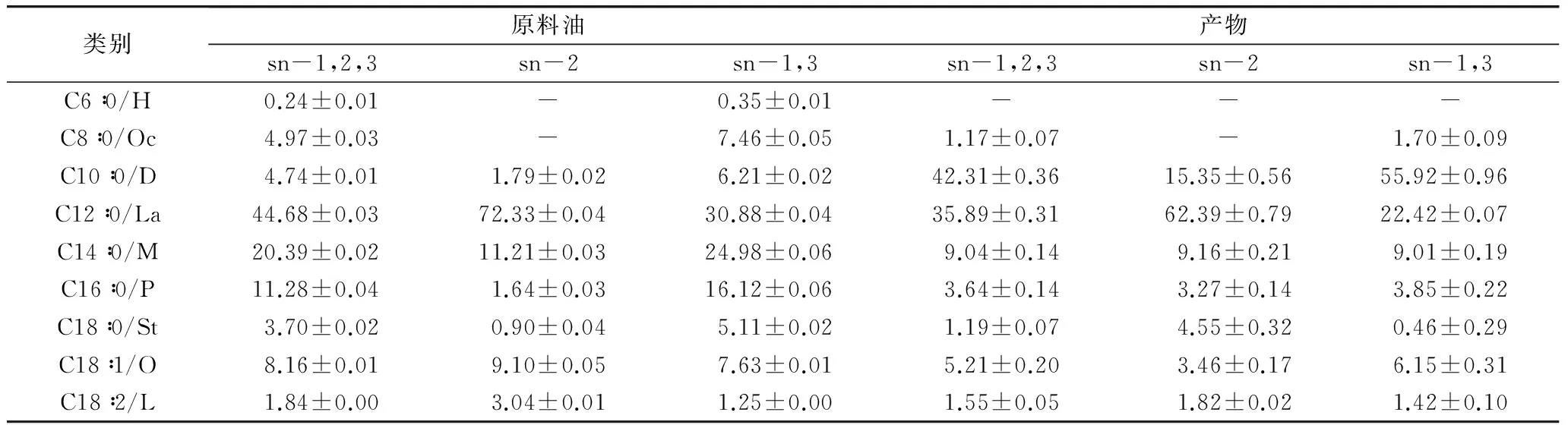
表4 酶促酯交换产品脂肪酸组成与立体专一分布/%
各因素交互作用对癸酸和MCT含量的影响经响应曲面分析,结合方差分析可知,加酶量与温度、加酶量与底物浓度、加酶量与时间对响应值影响极显著。
2.4 酶促酯交换最佳工艺条件确定与验证
结合上述结果,最优条件为温度46 ℃,底物摩尔比8∶1,加酶量6%,加水量15%,反应时间8 h,癸酸的质量分数为42.31%,MCT的质量分数为50.85%,与理论预测值较接近。
2.5 产物甘三酯脂肪酸组成与成分分析
最优条件下产物甘三酯脂肪酸组成及立体专一分布如表4所示,MCT组成如表5所示。
由表4可知,原料油中己酸、豆蔻酸、软脂酸、硬脂酸和油酸主要分布在sn-1,3位,因此它们在产物中的质量分数均呈不同程度下降,各降低0.24%、11.35%、7.64%、2.51%和2.95%。产物中MCFA质量分数为79.34%,增长24.72%,在sn-2位占比33.14%(依公式sn-2位脂肪酸相对含量=sn-2位脂肪酸含量/(3×sn-1,2,3位脂肪酸含量)),sn-1,2,3位分布较均匀。其中,辛酸质量分数为1.17%,降低3.80%;癸酸质量分数42.31%,增长37.57%;月桂酸质量分数35.89%,降低8.79%。
如表5所示,原料油MCT质量分数为14.98%,酯交换产品含50.85%,增长35.87%。产品中MCT成分主要为DLaD(23.57%)、DLaLa(16.88%)、DDD(4.83%)和LaLaLa(3.30%)。原有的HLaLa、HLaOc和HLaD酯交换后未检出,该结果与表4中所得的己酸主要分布在sn-1,3位的结论相互验证。产物中MCT在种类和含量上与原料油差别较大,说明该方法制备富含MCT油脂效果较好。
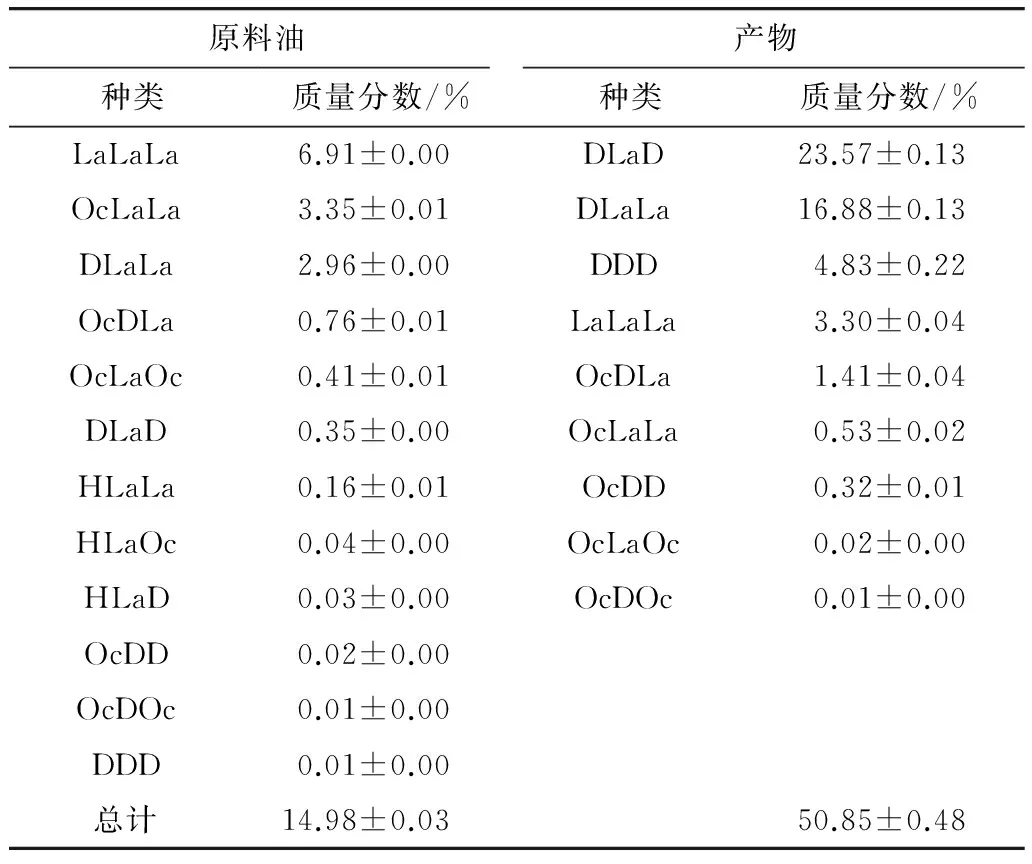
表5 原料油和产物甘三酯中MCT组成与含量
3 结论
脂肪酶Lipozyme RM IM催化酯交换反应最优条件为温度46 ℃,底物摩尔比8∶1,加酶量6%,加水量15%,反应时间8 h。
最优条件下产物甘三酯癸酸和MCT质量分数为42.31%和50.85%,较原料油分别增长37.57%和35.87%。利用sn-1,3特异性脂肪酶催化MCFA与椰子油酯交换制备富含MCT油脂可行且得率较高。
产品中共含9种MCT成分,主要为DLaD(23.57%)、DLaLa(16.88%)、DDD(4.83%)和LaLaLa(3.30%)。
[1]周瑞宝.特种植物油料加工工艺学[M]. 北京:化学工业出版社, 2010: 173-216
Zhou Ruibao. Special plant oil processing technology[M]. Beijing: Chemical Industry Press, 2010: 173-216
[2]毕艳兰.油脂化学[M].北京:化学工业出版社,2011:234-236
Bi Yanlan. Oilchemistry[M]. Beijing: Chemical Industry Press, 2011: 234-236
[3]王金平. 气相色谱法分析椰子油的脂肪酸[J]. 化学世界, 1993, 34(11): 550-553
Wang Jinping. Determination of fatty acid in coconut oil by gas chromatography[J]. Chemical World, 1993, 34 (11): 550-553
[4]林良牧. 油脂和肥皂中脂肪酸组份的气相色谱分析[J]. 厦门大学学报(自然科学版), 1992, 31(1): 103-105
Lin Liangmu. Determination of fatty acid in fats and soaps by gas chromatography[J]. Journal of Xiamen University (Natural Science), 1992, 31 (1): 103-105
[5]邓福明, 王挥, 赵松林, 等. 椰子油的生理活性(Ⅰ): 药用功能[J].热带作物学报, 2013, 33(9): 60-64
Deng Fuming, Wang Hui, Zhao Songlin, et al. Biological activity of coconut oil: Medicinal functions[J]. Chinese Journal of Tropical Agriculture, 2013, 33 (9): 60-64
[6]李晓煜, 邓福明, 赵松林, 等.椰子油的生理活性(Ⅳ): 减肥与美容[J]. 热带作物学报, 2013, 33(9): 84-89
Li Xiaoyu, Deng Fuming, Zhao Songlin, et al. Biological activity of coconut oil: Weight reducing and beautification[J]. Chinese Journal of Tropical Agriculture, 2013, 33 (9):84-89
[7]颜巧丽, 邓福明, 赵松林, 等.椰子油的生理活性(Ⅴ): 代谢与平衡[J]. 热带作物学报, 2013, 33(9): 79-83
Yan Qiaoli, Deng Fuming, Zhao Songlin, et al. Biological activity of coconut oil: Metabolism and balance[J]. Chinese Journal of Tropical Agriculture, 2013, 33 (9): 79-83
[8]禤小凤, 邓福明, 赵松林, 等.椰子油的生理活性(Ⅱ):调节血浆血脂[J].热带作物学报,2013,33(9):65-70
Xuan Xiaofeng, Deng Fuming, Zhao Songlin, et al. Biological activity of coconut oil: Regulating the plasma lipid[J]. Chinese Journal of Tropical Agriculture, 2013, 33 (9):65-70
[9]刘燕萍, 李宁, 张思源, 等.中链甘油三酯的代谢特点及临床应用研究进展[J]. 肠外与肠内营养, 2001, 8(1): 54-56
Liu Yanping, Li Ning, Zhang Siyuan, et al. Metabolic features of medium-chain triglycerides and the progress in clinical application[J]. Parenteral & Enteral Nutrition, 2001, 8 (1): 54-56
[10]Harry U, Stephen M P, David P K. parenteral use of medium-chain triglycerides[J], A Reappraisal Nutrition, 1996, 12(4): 231-237
[11]Auclair E, Satabin P, Servan E, et al. Metabolic effects of glucose, medium chain triglyceride and long chain triglyceride feeding before prolonged exercise in rats[J]. European Journal of Applied Physiology, 1988, 57(1): 126-131
[12]王瑞元. 2013年我国食用油市场供需分析和国家加快木本油料产业发展的意见[J]. 中国油脂, 2014, 39(6): 1-5
Wang Ruiyuan.Supply and demand analysis of Chinese edible oil market and national opinion on accelerating the development of woody oil industry in 2013[J]. China Oils and Fats, 2014, 39 (6): 1-5
[13]梁少华, 彭乐, 王亚东, 等.白芝麻油脂理化特性及组成分析[J]. 农业机械学报, 2012, 43(11): 174-179
Liang Shaohua, Peng Le, Wang Yadong, et al. Physical and chemical characteristics and composition analysis for white sesame oil[J]. Transactions of the Chinese Society for Agricultural Machinery, 2012, 43 (11): 174-179
[14]李扬, 杜伟, 刘德华. 磷脂对脂肪酶催化性能的影响[J]. 催化学报, 2012, 33(3): 389-395
Li Yang, Du Wei, Liu Dehua, et al. Effect of phospholipids on the catalytic performance of lipase[J]. Chinese Journal of Catalysis, 2012, 33 (3): 389-395
[15]李泽波, 杜伟, 刘德华. 生物柴油制备过程中磷脂及水分含量对脂肪酶的影响[J]. 化工学报, 2007, 58(1): 233-237
Li Zebo, Du Wei, Liu Dehua, et al. Effect of phospholipids and water contents on production of bio-diesel fuel catalyzed by lipases in a solvent system[J]. Journal of Chemical Industry and Engineering, 2007, 58 (1):233-237
[16]Xu X, Skands A R H, Høy C E, et al. Production of specific-structured lipids by enzymatic interesterification: Elucidation of acyl migration by response surface design[J]. Journal of the American Oil Chemists’ Society, 1998, 75 (9): 1179-1186
[17]Mu H, Xu X, Høy C E. Production of specific-structured triacylglycerols by lipase-catalyzed interesterification in a laboratory-scale continuous reactor[J]. Journal of the American Oil Chemists’ Society, 1998, 75 (12): 1187-1193
[18]Willis W M, Marangoni A G. Enzymatic Interesterification [M]. In: Akoh CC and Min DB (eds) Food Lipids: Chemistry, Nutrition and Biotechnology, 1998, 665-698
[19]Lee K T, Akoh C C. Solvent-free enzymatic synthesis of structured lipids from peanut oil and caprylic acid in a stirred tank batch reactor[J]. Journal of the American Oil Chemists’ Society, 1998, 75 (11): 1533-1537
[20]陈翔, 王瑛瑶, 栾霞, 等.无溶剂体系中酶催化合成结构脂质条件初探[J]. 中国油脂, 2010, 35(3): 35-38
Chen Xiang, Wang Yingyao, Luan Xia, et al.Enzymatic synthesis of structured lipids in a solvent-free system [J]. China Oils and Fats, 2010, 35 (3): 35-38
[21]赵海珍, 陆兆新, 别小妹, 等.无溶剂体系中脂肪酶改造猪油制备功能性脂的研究[J]. 生物工程学报, 2005, 21(3): 493-496
Zhao Haizhen, Lu Zhaoxin, Bie Xiaomei, et al. Production of functional lipids by lipase-catalyzed acidolysis of lard in solvent free system[J]. Chinese Journal of Biotechnology, 2005, 21 (3): 493-496
[22]Cerdán L E, Medina A R, Giménez A G, et al. Synthesis of polyunsaturated fatty acid-enriched triglycerides by lipase-catalyzed esterification [J]. Journal of the American Oil Chemists' Society, 1998, 75 (10): 1329-1337.
Lipase-Catalyzed Transesterification of Coconut Oil for MCT-Rich Oil: optimized by the Response Surface Methodology
Meng Pengcheng Liang Shaohua Yang Qingping Lü Xinxin Li Ruyang
(Department of Agriculture and Food, Henan University of Technology, Zhengzhou 450001)
This paper focused on the enzymatic-catalyzed transesterification of capric acid and coconut oil using immobilized R.mieheilipase (Lipozyme RMIM) for the preparation of MCT. Optimum reaction conditions for temperature, substrate molar ratio, enzyme load, water load and time were 46 ℃, 8∶1, 6%, 15% and 8 h, respectively. 42.31% and 50.85% of capric acid content and MCT content were obtained under optimized conditions, increased by 37.57% and 35.87% compared with raw material oil. The fatty acid and triglycerides composition of product were analyzed, and DLaD (23.57%), DLaLa (16.88%) and DDD (4.83%) were the 3 species of higher content in 9 species of product.
coconut oil, lipase, transesterification, capric acid, MCT
TS225.1;TS201.2
A
1003-0174(2016)12-0084-06
河南省超级产粮大省农业科研资助(ZX2011-2)
2015-04-10
孟鹏程,男,1989年出生,硕士,脂质化学与品质
梁少华,男,1964年出生,教授,植物油料资源综合利用、脂质化学与品质
