菜籽源锌螯合肽的制备、纯化和结构解析
2016-12-26黄晶晶谢宁宁程江华王灼琛殷俊峰闫晓明
黄晶晶 谢宁宁 李 博 程江华 王灼琛 殷俊峰 闫晓明
(安徽省农业科学院农产品加工研究所1,合肥 230031)(中国农业大学食品科学与营养工程学院2,北京 100083)
菜籽源锌螯合肽的制备、纯化和结构解析
黄晶晶1谢宁宁1李 博2程江华1王灼琛1殷俊峰1闫晓明1
(安徽省农业科学院农产品加工研究所1,合肥 230031)(中国农业大学食品科学与营养工程学院2,北京 100083)
采用碱性蛋白酶水解菜籽蛋白制备水解物,运用固定金属亲和层析(IMAC-Zn2+)和葡聚糖凝胶G25(Sephadex G25)层析分离纯化;利用反相高效液相色谱(RP-HPLC)和电喷雾电离质谱(ESI-MS)鉴定序列;采用EDTA络合滴定法(ECT)、双硫腙比色法(DCM)、原子吸收光谱(AAS)和电感耦合等离子体原子发射光谱法(ICP-AES)检测锌螯合率。试验表明:菜籽蛋白的4 h水解物锌螯合潜力最佳;分离该水解物获得3个肽组分(I,Ⅱ和Ⅲ),其中Ⅱ和Ⅲ具有锌螯合能力;进一步分离后分别获得3个(Ⅱ-1,Ⅱ-2,Ⅱ-3)和2个肽组分(Ⅲ-1和Ⅲ-2),组分Ⅱ-3的锌螯合率最高,高于同浓度的谷胱甘肽(GSH)(P<0.05);鉴定Ⅱ-3序列获得4条肽,即Ala-Arg(AR),Asn-Ser-Met (NSM),Gly-Lys-Arg(GKR)和Glu-Pro-Ser-His(EPSH)。其中NSM的锌螯合率最高,来源于菜籽蛋白NADH-enoyl-ACP reductase Chain A 序列中的296-298氨基酸残基。因此,菜籽蛋白可以作为微量元素螯合肽的优良来源。
锌 菜籽蛋白水解物 螯合肽 固定金属亲和层析 碱性蛋白酶
锌(Zn)是人体必需的微量元素,影响300余种代谢酶的活性,可以作为慢性血管疾病、癌症、免疫紊乱等病理状态下的抗氧化因子和抗炎症因子[1-2]。金属螯合肽(Metal chelating peptide, MCP)通常以蛋白质为底物经过蛋白酶水解制备,多种食源蛋白质(鱼皮[3]、大豆[4]、芝麻[5]、向日葵[6]、核桃[7]都是其优良来源。同时,研究证实MCP具有多种金属离子(铁(Ⅲ)[9]、铜(Ⅱ)[6]、钙[10]、锌[5])螯合能力,可以提高微量元素的稳定性、吸收率和生物利用率[8]。国内外学者已鉴定出具有金属螯合活性的肽序列,如Ser-Cys-His[3]和Asn-Cys-Ser[5]。
菜籽是我国重要的油料作物之一,产量仅次于大豆[12]。菜籽蛋白质量分数达37%~50%,已用于制备抗氧化肽、抗肿瘤肽和抗高血压肽等多种活性肽[13]。但是,以菜籽蛋白制备锌螯合肽的研究鲜见报道。此外,对螯合肽的序列鉴定和结构表征有助于揭示其结构与活性之间的关系。因此,本研究采用碱性蛋白酶水解菜籽蛋白,利用固定金属亲和层析(Immobilized metal-chelated affinity chromatography-Zinc, IMAC-Zn2+)、葡聚糖凝胶(Sephadex G25)层析、反相高效液相色谱(Reverse pphase high performance liquid chromatography, RP-HPLC)纯化水解物,采用EDTA络合滴定法(EDTA complexometric titration, ECT)、双硫腙比色法(Dithizone colorimetric method, DCM)、原子吸收光谱法(Atomic absorption spectrometry, AAS)和电感耦合等离子体原子发射光谱法(Inductively coupled plasma atomic emission spectrometry, ICP-AES)检测锌螯合能力,电喷雾电离质谱(ESI-MS)鉴定序列。
1 材料与方法
1.1 试剂与仪器
菜籽(Brassicanapus):安徽省农业科学院作物科学研究所;碱性蛋白酶(P4860,≥2.4 U/g)、谷胱甘肽(GSH,G4251):Sigma-Aldrich公司;固定金属亲和层析填料(Sepharose 6 Fast Flow):GE Healthcare公司;ZnCl2、EDTA、双硫腙等:国药集团化学试剂。
Analyst 800型原子吸收光谱仪:美国Perkin-Elmer公司;Optima 7300DV型电感耦合等离子体原子发射光谱仪:美国Perkin Elmer公司;AKTA Explorer 100型蛋白纯化仪:美国通用电气公司;waters 1525型高效液相色谱:美国Waters公司;Proteome X-LTQ 型LC-ESI-MS仪:美国Thermo Fisher Scientific公司;Apex 396型平行合成仪:美国Nature Gene 公司;Voyager DE PRO型基质辅助激光解吸电离飞行时间质谱:美国JBI Scientific公司;WF-250型万能粉碎机:上海蓝深制药机械有限公司。
1.2 肽-锌(Ⅱ)螯合物的制备
改进Wu等[14]的方法制备菜籽蛋白。称取10 g菜籽粉,添加100 mL石油醚脱脂30 min,重复3~5次,过滤取残渣。在100 mL 70%的乙醇溶液中浸泡脱脂菜籽12 h后,过滤取残渣用蒸馏水清洗。通过考马斯亮蓝染色鉴定沉淀物为蛋白质,将其冷冻干燥保存。
参照He等[15]的方法水解菜籽蛋白。向菜籽蛋白溶液(4%,pH 8.0)中添加2%碱性蛋白酶。55 ℃水浴水解0.5、1.0、2.0、4.0、6.0 h,8 000×g离心15 min取上清液后浓缩于-80 ℃冷冻备用。TNBS法测定水解度(Degree of hydrolysis, DH)[16]。
改进Wang等[5]的方法制备肽-锌(Ⅱ)螯合物。向5 mL肽溶液(20 mg/mL)中添加1.0 mL ZnCl2溶液(50 mg/mL),调节pH 6.0。30 ℃下培养45 min后在底部形成白色沉淀物(螯合物)。8 000×g离心15 min取沉淀物。空白组以蒸馏水代替ZnCl2溶液。
1.3 锌(Ⅱ)螯合能力的测定
采用4种方法测定锌(Ⅱ)螯合能力,GSH(20 mg/mL)和EDTA(5 mg/mL)作为阳性对照组。(1)改进Novick[17]的EDTA络合滴定法。测定螯合态锌(Ⅱ)含量时,用蒸馏水溶解1.2所得沉淀物并定容至50 mL。测定总锌(Ⅱ)时,用蒸馏水将ZnCl2和水解物的混合溶液定容至50 mL。取20 mL定容溶液,滴定。扣除空白组的锌(Ⅱ)含量。(2)《食品中锌的测定》(GB/T 5009.14—2003)双硫腙比色法。(3)肽-锌(Ⅱ)螯合物用酸消化后用25 mL的1 mol/L HCl稀释。根据Hedberg等[18]的方法用原子吸收光谱分析。(4)参考Chope等[19]采用电感耦合等离子体原子发射光谱仪测量锌(Ⅱ)含量。含有ZnCl2和菜籽蛋白水解物的溶液作为空白组。
锌(Ⅱ)螯合率通过公式计算:
锌(Ⅱ)螯合率=(c样品-c空白)/(c总-c空白)×100%
式中:c样品,c空白和c总分别为肽-锌(Ⅱ)螯合物、菜籽蛋白水解物、ZnCl2和菜籽蛋白水解物混合溶液的锌含量。
1.4 锌(Ⅱ)螯合肽的分离纯化
1.4.1 IMAC-Zn2+
IMAC填料与ZnCl2溶液(50 mg/mL)混合后在30 ℃下摇动螯合12 h,得到IMAC-Zn2+。用3倍柱体积含0.1 mol/L NaCl的20 mmol/L PBS(pH 7.4)冲洗去除非特异性结合锌并平衡色谱柱。上样(1 mL 5 mg/mL蛋白水解物)后用PBS(pH 7.4)冲洗去除未螯合肽,再用含NaCl的 PBS(pH 3.5)洗脱,获得螯合肽浓缩冷冻备用。洗脱流速为2.0mL/min,检测波长220 nm。
1.4.2 凝胶过滤层析
将肽组分(1.5 mL,约20 mg/mL)注入Sephadex G25层析柱(1.6 cm×50 cm)分离,柱温条件4 ℃,蒸馏水洗脱,流速2.0 mL/min,检测波长220 nm,所得肽组分于-20 ℃冷冻。
1.4.3 反相高效液相色谱
流速1 mL/min,检测波长220 nm。首先进行阶段I分离。流动相A:超纯水,流动相B:甲醇;洗脱条件为0~30 min,流动相B从5%线性变为90%;31~33 min,线性变为100%;34~40 min,线性变为5%。进样量10 μL(10 mg/mL)。将阶段I所获峰组分进行阶段Ⅱ分离。流动相A:0.1%(V/V) TFA水溶液,流动相B:0.1%(V/V) TFA乙腈溶液;洗脱条件为0~5 min,流动相B保持5%;6~15 min,线性变为65%;16~20 min,线性变为100%。进样量20 μL(10 mg/mL) 。
1.5 氨基酸序列测定
采用液相色谱-电喷雾离子化-质谱联用技术(LC-ESI-MS)获得质谱数据,手动解谱,获得氨基酸序列。
1.6 肽合成
合肥赛曼诺生物科技有限公司采用固相合成法合成4条多肽:AR,NSM,GKR,EPSH,纯度大于95%。
1.7 肽的立体结构分析
利用RasMol (http://www.openrasmol.org/software/rasmol/软件,定位肽段在母体蛋白质三维结构中的位置(蛋白数据库:http://www.rcsb.org/pdb/)。
1.8 数据分析
每个处理组进行3次独立试验,结果以“平均值±标准差”表示。数据显著性采用SPSS 13.0软件评定。
2 结果与讨论
2.1 菜籽蛋白水解物的制备
研究表明多种蛋白酶的水解产物均具有金属螯合能力,如碱性蛋白酶和风味蛋白酶(葵花籽蛋白)[6],胰蛋白酶和风味蛋白酶(狭鳕鱼皮)[3],protease M(大豆蛋白)[10],碱性蛋白酶/Viscozyme酶/Protex 51FP酶(酵母)[9],胃蛋白酶和胰酶(鹰嘴豆蛋白)[11],胃蛋白酶/胰蛋白酶/碱性蛋白酶(芝麻蛋白)[5]。本研究采用70%乙醇-水溶液处理菜籽后蛋白得率约22%。多种酶水解该蛋白发现碱性蛋白酶产物的水解度(DH值)最高,锌螯合潜力优异。
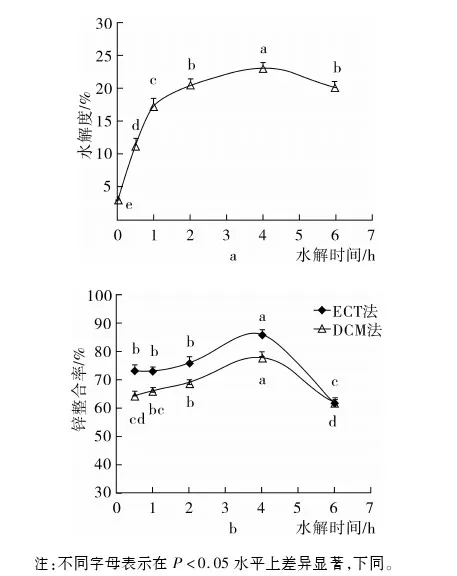
注:不同字母表示在P<0.05水平上差异显著,下同。
图1 水解时间对水解度和锌螯合率的影响
图1a显示碱性蛋白酶水解6 h过程中菜籽蛋白水解度的变化规律。可见,最初1 h内DH值迅速增至17.26%。随后2~4 h内增速放缓,升至23.26%(增幅是0~1 h内的41.67%)。然而,水解6 h比4 h的DH值更低(P<0.05)。图1b为ECT法和DCM法测量水解物锌螯合率在前4 h内逐渐上升达到最高值,而在水解6 h时显著降低(P<0.05)。水解物的DH值与锌螯合率的变化规律相似,可能因为不同的水解度下所生成肽的组成不同,一定程度上影响水解物的螯合活性[5]。另外,水解6 h时检测指标下降,可能因为蛋白酶催化的类蛋白反应导致肽分子聚集,产生具有不同特征的新型肽[20]。因此,选择水解4 h的菜籽蛋白水解物进行后续试验。
2.2 锌螯合肽的分离纯化
以2.1所得水解物为底物,采用IMAC-Zn2+、Sephadex G25、RP-HPLC等分离纯化锌螯合肽。IMAC层析技术相对成熟。该技术利用多肽对基质上所固定金属离子的亲和能力不同进行分离[21]。固定金属通常是具有d层空价电子轨道的过渡金属[22],如Cu2+、Ni2+、Co2+、Zn2+、Fe3+等。
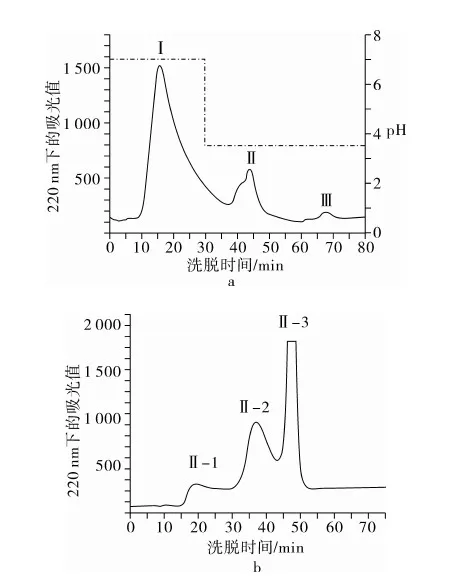
图2 从菜籽蛋白4 h水解物中分离锌螯合肽
图2a显示水解物经过IMAC-Zn2+在pH 7.0的洗脱中收集的未螯合组分(I)和在pH 3.5时收集的锌螯合组分(Ⅱ和Ⅲ)。降低洗脱液pH值是获得金属螯合肽的重要方法之一。已有研究采用该方法在pH 3.6或4.5获得铜(Ⅱ)螯合肽[9, 23],或获得铁(Ⅱ)螯合肽。Sephadex G25柱层析属于分子量排阻层析技术,洗脱时间精确,分离效果良好,操作简单,样品流失少[23-24],广泛用于从蛋白质水解液中分离活性肽[25-26]。图2b为Sephadex G25分离组分Ⅱ获得3个组分(Ⅱ-1,Ⅱ-2,Ⅱ-3),而分离组分Ⅲ获得2个组分(Ⅲ-1和Ⅲ-2,数据未给出)。
表1所列为IMAC-Zn2+和Sephadex G25分离所得各组分的锌螯合率,测量方法包括ECT、DCM、AAS和ICP-AES。EDTA络合滴定法是测量金属离子含量的传统方法之一。Zn2+,Fe3+,Cu2+等金属离子在酸性pH值下与EDTA络合[17]。而双硫腙分光光度法是测定锌的国家标准分析方法之一。AAS和ICP-AES是食品科学,生命科学和环境科学中常用的重金属和微量元素检测手段[27],de la Hoz等[9]曾采用ICP-AES分析铁(Ⅱ)肽混合物中的铁含量以评估酵母肽的铁螯合能力。
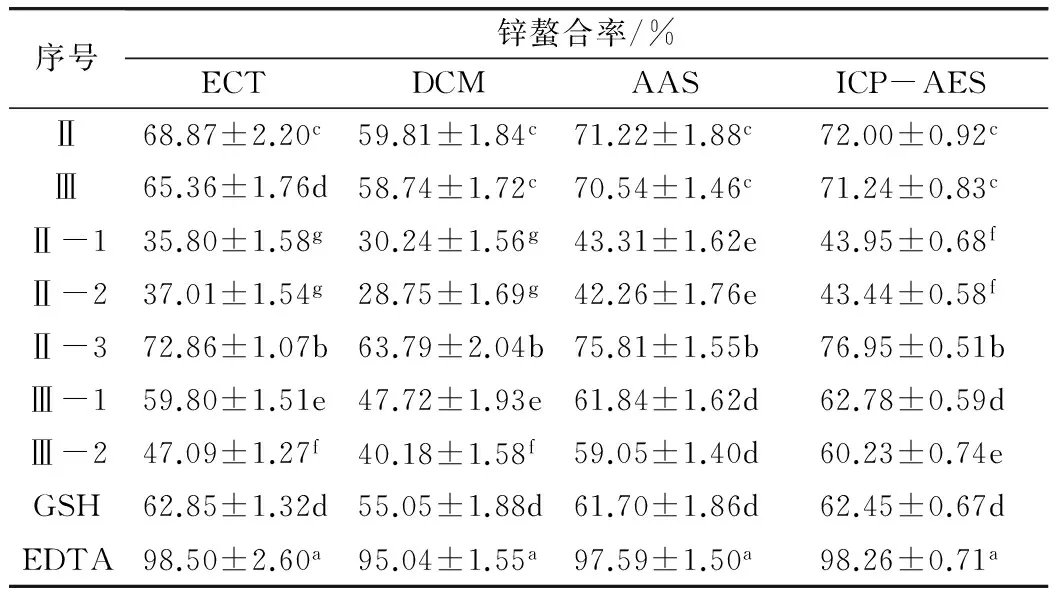
表1 固定金属亲和层析和葡聚糖凝胶G25分离所得肽组分的锌螯合率
注:肽组分,GSH和EDTA的浓度分别为20,20和5 mg/mL。ECT,DCM,AAS和ICP-AES分别代表EDTA络合滴定法,双硫腙比色法,原子吸收光谱法,电感耦合等离子体原子发射光谱法。同列中不同字母表示在P<0.05水平上差异显著,下同。
ECT、DCM测得组分Ⅱ和Ⅲ的螯合率明显低于未分离水解物(图1b和图1c)(P<0.05)。同时,DCM,AAS和ICP-AES表明组分Ⅱ和Ⅲ的锌螯合率间没有显著性差异(P>0.05),但ECT显示组分Ⅱ的锌螯合率较高(P<0.05)。此外,4种方法都表明组分Ⅱ-3的锌螯合率明显高于Ⅱ-1和Ⅱ-2(P<0.05),但后二者间无显著差异(P>0.05)。ECT,DCM和ICP-AES表明组分Ⅲ-1的锌螯合率明显高于Ⅲ-2(P<0.05),而AAS表明组分Ⅲ-1和Ⅲ-2之间无显著差异(P>0.05)。因此,Sephadex G25收集的组分中Ⅱ-3的锌螯合率最高,高于GSH,但低于EDTA。另外,ECT表明组分Ⅱ-3的锌螯合率低于未分离的菜籽蛋白水解物(RPH)(图1b),可能因为RPH中含有具有螯合活性的游离氨基酸,这符合已有研究结果[28]。
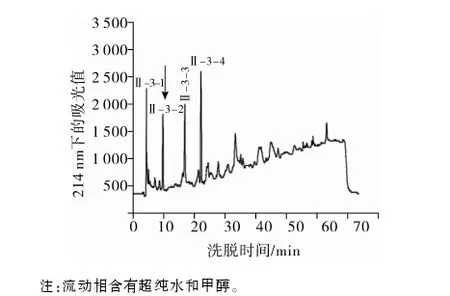
注:流动相含有超纯水和甲醇。
图3 RP-HPLC分离纯化组分Ⅱ-3
根据表1,选择组分Ⅱ-3进行RP-HPLC分离。图3a为组分Ⅱ-3经过阶段I甲醇-水体系后所得组分(Ⅱ-3-1、Ⅱ-3-2、Ⅱ-3-3、Ⅱ-3-4,保留时间依次为:2.263 min、5.232 min、9.139 min、11.893 min)。随后进行阶段Ⅱ的0.1%TFA乙腈体系纯化,所得四种组分(Ⅱ-3-1,Ⅱ-3-2,Ⅱ-3-3和Ⅱ-3-4)色谱鉴定为单一肽。各组分再次分别经过色谱纯化(流动相含有0.1% TFA水溶液和0.1% TFA乙腈溶液,图谱未列出)。
2.3 锌螯合肽的序列鉴定
采用电喷雾电离质谱法(ESI-MS)获得2.2所得组分的系列质谱图。图4为组分Ⅱ-3-2的ESI-MS及其二级质谱(MS/MS)图谱。通过MS/MS检测该活性肽的a-离子,b-离子,c-离子,x-离子,y-离子和z-离子等质谱碎片后解析数据,获得肽结构序列。a-离子,b-离子,c-离子,x-离子,y-离子和z-离子碎片质量标准如下[5]:a-离子,氨基酸的分子质量加27;b-离子,加1;c-离子,加18;x-离子,加45;y-离子,加19;z-离子,加2。经过人工计算,质谱片段b3(331.13),y2 (237.14),b2(202.03)和a2(174.15),分别为114+87+131+1,131+87+19,114+97+1,114+87-27。其中,114,87和131分别为N,S和M的分子质量。最终,确定组分Ⅱ-3-2(350.90)为Asn-Ser-Met(NSM)。此外,组分Ⅱ-3-1,Ⅱ-3-3和Ⅱ-3-4分别为Ala-Arg,Gly-Lys-Arg(或Gly-Gln-Arg)和Glu-Pro-Ser-His。Lys和Gln相对分子质量相同,分析Ⅱ-3-3的氨基酸组成,未检出Gln(数据未列),因此确定其序列为Gly-Lys-Arg。
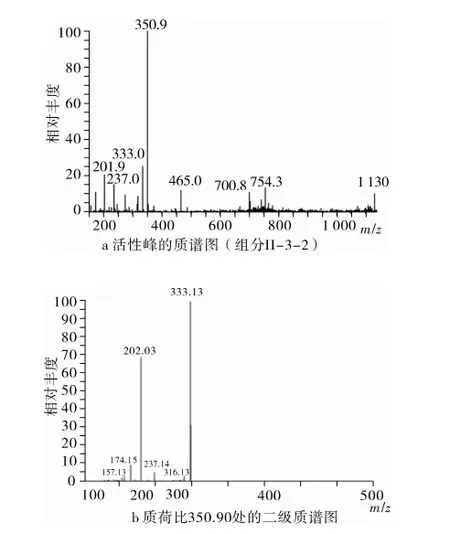
图4 锌螯合肽的序列鉴定
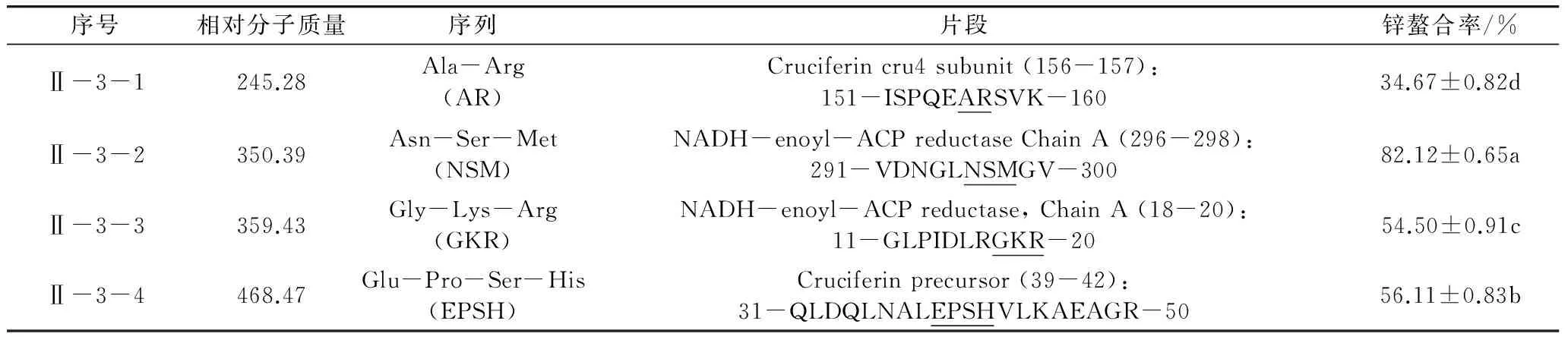
序号相对分子质量序列片段锌螯合率/%Ⅱ-3-1245.28Ala-Arg(AR)Cruciferincru4subunit(156-157):151-ISPQEARSVK-16034.67±0.82dⅡ-3-2350.39Asn-Ser-Met(NSM)NADH-enoyl-ACPreductaseChainA(296-298):291-VDNGLNSMGV-30082.12±0.65aⅡ-3-3359.43Gly-Lys-Arg(GKR)NADH-enoyl-ACPreductase,ChainA(18-20):11-GLPIDLRGKR-2054.50±0.91cⅡ-3-4468.47Glu-Pro-Ser-His(EPSH)Cruciferinprecursor(39-42):31-QLDQLNALEPSHVLKAEAGR-5056.11±0.83b
注:*表示菜籽蛋白的氨基酸序列来自于NCBI (http://www.ncbi.nlm.nih.gov/);**表示ICP-AES法测得GSH的锌螯合率是(62.45±0.67)%。
采用固相肽合成法人工合成所得的4条肽并验证其锌螯合能力。表2显示4种合成肽的结构特征和ICP-AES法测得的锌螯合率。这4条肽含2~4个氨基酸残基,吻合NCBI蛋白数据库中的Brassicanapus油菜蛋白,来源于cruciferin cru4 subunit,NADH-enoyl-ACP reductase Chain A 和cruciferin precursor的蛋白序列。Ala-Arg(AR),Gly-Lys-Arg(GKR),和Glu-Pro-Ser-His(EPSH)经ICP-AES检测的锌螯合率分别是(34.67±0.82)%,(54.50±0.91)%和(56.11±0.83)%,明显低于Asn-Ser-Met(NSM)(82.12±0.65)%(P<0.05)。而GSH的螯合率是(62.45±0.67)% ,同样低于NSM。因此,NSM有作为新型锌补充剂螯合前体的应用潜力。
酸性和碱性氨基酸残基可能对活性肽的铁(Ⅱ)和铜(Ⅱ)螯合能力具有重要作用[29]。Lv等[10]鉴定的五种钙(Ⅱ)/铁(Ⅲ)螯合肽都在N端有酸性氨基酸残基。本研究中EPSH在N端含有1个酸性氨基酸残基(E),而AR和GKR在C端分别含有1个碱性氨基酸残基(R)和2个碱性氨基酸残基(K和R)。Torres-Fuentes等[11]研究表明鹰嘴豆螯合肽的铜(Ⅱ)螯合能力与His含量有良好的线性关系,而Guo等[3]获得了序列为Ser-Cys-His的铁(Ⅱ)螯合肽。本研究中EPSH有1个His残基。
最后,利用分子结构可视化软件(RasMol)定位目标肽段的空间位置,如图5所示。NADH-enoyl-ACP reductase Chain A标为绿色带状,目标肽NSM标为红色的ball-and-stick模式。目标肽段NSM位于NADH-enoyl-ACP reductase Chain A蛋白的C-端无规则卷曲区域。
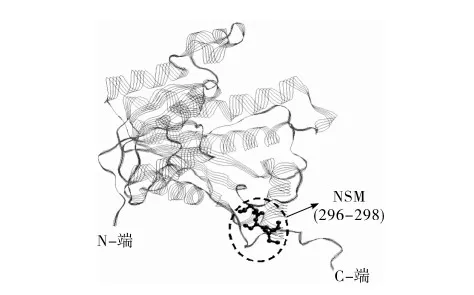
图5 锌螯合肽NSM在ADH-enoyl-ACP reductase Chain A中的模拟三维结构(PDB代码:1ENO)
3 结论
本研究采用碱性蛋白酶制备菜籽蛋白水解物,通过EDTA络合滴定法、双硫腙比色法、原子吸收光谱和电感耦合等离子体原子发射光谱法检测水解物的锌螯合率。另采用色谱层析及反相高效液相色谱纯化获得四条具有锌螯合能力的肽,借助电喷雾电离质谱鉴定肽的序列,为开发安全高效的锌补充剂提供了思路。
[1]Prasad A S.Discovery of human zinc deficiency: 50 years later [J]. Journal of Trace Elements in Medicine and Biology,2012, 26(2) : 66-69
[2]Hambidge M. Zinc and health: current status and future directions [J]. The Journal of Nutrition,2000, 130 : 1344-1349
[3]Guo L, Hou H, Li B, et al. Preparation, isolation and identification of iron-chelating peptides derived from Alaska pollock skin [J]. Process Biochemistry, 2013, 48(5) : 988-993
[4]Carrasco-Castilla J, Hernández-lvarez A J, Jiménez-Martínez C, et al. Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysates [J]. Food Chemistry, 2012,135(3) : 1789-1795
[5]Wang C, Li B, Ao J.Separation and identification of zinc-chelating peptides from sesame protein hydrolysate using IMAC-Zn2+and LC-MS/MS [J]. Food Chemistry,2012, 134(2) : 1231-1238
[6]Megías C, Pedroche J, Yust M M, et al.Affinity purification of copper-chelating peptides from sunflower protein hydrolysates [J]. Journal of Agricultural and Food Chemistry, 2007a,55(16): 6509-6514
[7]吕莹,刘静,陈湘宁. 铁离子螯合亲和层析分离抗氧化活性核桃肽[J]. 中国粮油学报,2013,28(1):65-69
[8]Miquel E, Farré R. Effects and future trends of casein phosphopeptides on zinc bioavailability [J]. Trends in Food Science & Technology,2007, 18(3) : 139-143
[9]de la Hoz L, Ponezi A N, Milani R F, et al. Iron-binding properties of sugar cane yeast peptides [J]. Food Chemistry,2014, 142:166-169
[10]Lü Y, Bao X, Liu H, et al. Purification and characterization of caclium-binding soybean protein hydrolysates by Ca2+/Fe3+immobilized metal affinity chromatography (IMAC) [J]. Food Chemistry, 2013, 141(3) : 1645-1650
[11]Torres-Fuentes C, Alaiz M, Vioque J. Affinity purification and characterisation of chelating peptides from chickpea protein hydrolysates [J]. Food Chemistry,2011, 129(2) : 485-490
[12]Fleddermann M, Fechner A, Rößler A, et al. Nutritional evaluation of rapeseed protein compared to soy protein for quality, plasma amino acids, and nitrogen balance-a randomized cross-over intervention study in humans [J]. Clinical Nutrition (Edinburgh, Scotland), 2013, 32(4) : 519-526
[13]Wu J, Aluko R E, Muir A D. Purification of angiotensin I-converting enzyme-inhibitory peptides from the enzymatic hydrolysate of defatted canola meal [J].Food Chemistry, 2008, 111(4) : 942-950
[14]Wu J, Aluko R E, Muir A D. Production of angiotensin I-converting enzyme inhibitory peptides from defatted canola meal [J]. Bioresource Technology,2009, 100(21):5283-5287
[15]He R, Malomo S A, Alashi A, et al. Purification and hypotensive activity of rapeseed protein-derived renin and angiotensin converting enzyme inhibitory peptides [J]. Journal of Functional Foods,2013, 5(2) : 781-789
[16]Xie N, Wang C, Ao J, et al. Non-gastrointestinal-hydrolysis enhances bioavailability and antioxidant efficacy of casein as compared with its in vitro gastrointestinal digest [J]. Food Research International,2013, 51(1) : 114-122
[17]Novick S G. Complexometric titration of zinc: an analytical chemistry laboratory experiment [J]. Journal of Chemical Education,1997, 74(12) : 1463
[18]Hedberg Y, Herting G, Wallinder I O. Risks of using membrane filtration for trace metal analysis and assessing the dissolved metal fraction of aqueous media-A study on zinc, copper and nickel [J]. Environmental Pollution,2011, 159(5) : 1144-1150
[19]Chope G A, Terry L A.Use of canonical variate analysis to differentiate onion cultivars by mineral content as measured by ICP-AES [J]. Food Chemistry,2009, 115(3) : 1108-1113
[20]Li Y Y, Li T J, Zhao X H.Preparation of alcalase-catalyzed casein plasteins in the presence of proline addition and the ACE-inhibitory activity of the plasteins in vitro [J]. European Food Research and Technology, 2010, 231(2) : 97-207
[21]Wong J W, Albright R L, Wang N H L. Immobilized metal ion affinity chromatography (IMAC) chemistry and bioseparation applications [J]. Separation & Purification Reviews, 1991, 20 (1) : 49-106
[22]李蓉,陈国亮,赵文明. 固定金属离子亲和色谱-蛋白质分离方法、原理和应用[J]. 化学通报,2005,68(5):352-360
[23]Megías C, Pedroche J, Yust M M, et al.Affinity purification of copper chelating peptides from chickpea protein hydrolysates [J]. Journal of Agricultural and Food Chemistry, 2007b, 55(10) : 3949-3954
[24]Li Y, Jiang B, Zhang T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH) [J]. Food Chemistry, 2008, 106(2): 444-450
[25]刘军,徐志宏,魏振承,等. 棉籽蛋白源 ACE 抑制肽的制备过程中脱盐技术的研究[J]. 中国粮油学报,2013,28(7):36-40
[26]王华,林喆,刘强,等. 鹿茸寡肽的制备及其促成骨细胞的增殖作用[J]. 高等学校化学学报,2008,2(9):1791-1796
[27]Dalman Ö, Demirak A, BalcA. Determination of heavy metals (Cd, Pb) and trace elements (Cu, Zn) in sediments and fish of the Southeastern Aegean Sea (Turkey) by atomic absorption spectrometry [J]. Food Chemistry, 2006, 95(1) : 157-162
[28]Ramirez D C, Gomez-Mejiba S E, Mason R P. Copper-catalyzed protein oxidation and its modulation by carbon dioxid:enhancement of protein radicals in cells [J]. The Journal of Biological Chemistry, 2005, 280: 27402-27411
[29]Saiga A, Tanabe S, Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment [J]. Journal of Agricultural and Food Chemistry,2003, 51(12) : 3661-3667.
Preparation, Purification and Structure Analysis of Rapeseed Source Zinc Chelating Peptide
Huang Jingjing1Xie Ningning1Li Bo2Cheng Jianghua1Wang Zhuochen1Yin Junfeng1Yan Xiaoming1
(Institute of Agro-products Processing, Anhui Academy of Agricultural Sciences1, Hefei 230031)(College of Food Science and Nutritional Engineering, China Agricultural University2, Beijing 100083)
In this study, rapeseed protein hydrolysates (RPH) obtained from rapeseed meal was hydrolyzed by alcalase and sequentially separated using IMAC-zinc2+, Sephadex G25 gel filtration and RP-HPLC. The sequences of chelating peptides were then characterized through ESI-MS. Meanwhile, the zinc-chelating rates were validated by EDTA complexion titration, dithizone chromometer method, atomic absorption spectrometry, and inductively coupled plasma atomic emission spectrometry. RPH at 4 h with the highest degree of hydrolysis and zinc-chelating ability was separated into three peptide fractions (Ⅰ, Ⅱ, and Ⅲ) after IMAC-zinc2+. What's more, the two fractions with zinc chelating abilities (II and III) were further separated into three fractions (Ⅱ-1, Ⅱ-2, and Ⅱ-3) and two fractions (Ⅲ-1 and Ⅲ-2), respectively. Among the five fractions, Ⅱ-3 showed the highest zinc-chelating ability. Moreover, four small peptides, namely, Ala-Arg (AR), Asn-Ser-Met (NSM), Gly-Lys-Arg (GKR), and Glu-Pro-Ser-His (EPSH), were obtained and identified from fraction Ⅱ-3. NSM, which exhibited the highest zinc-chelating rate, came from the cruciferin cru4 subunit, NADH-enoyl-ACP reductase chain A, and cruciferin precursor of Brassica napus protein. In conclusion, we speculated that utilizing small peptides from rapeseed protein as novel carriers for zinc supplement was feasible.
zinc, rapeseed protein hydrolysates, chelating peptides, immobilized metal affinity chromatography, alcalase
TS229
A
1003-0174(2016)06-0068-07
国家科技支撑计划(2012BAD14B13),安徽省农业科学院院长杰出青年基金(14B1211),安徽省农业科学院院长青年创新基金面上项目(14B1253)
2014-10-11
黄晶晶,女,1988年出生,助理研究员,功能食品
谢宁宁,男,1984年出生,副研究员,生物活性肽
