中国成人血脂异常防治指南(2016年修订版)
2016-12-26中国成人血脂异常防治指南修订联合委员会
中国成人血脂异常防治指南修订联合委员会
指南与共识
中国成人血脂异常防治指南(2016年修订版)
中国成人血脂异常防治指南修订联合委员会
前言
近30年来,中国人群的血脂水平逐步升高,血脂异常患病率明显增加。2012年全国调查结果显示[1],成人血清总胆固醇(total cholesterol, TC)平均为4.50 mmol/L,高胆固醇血症的患病率4.9%;甘油三酯(triglyceride,TG)平均为1.38 mmol/L,高TG血症的患病率13.1%;高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)平均为1.19 mmol/L,低HDL-C血症的患病率33.9%。中国成人血脂异常总体患病率高达40.40%,较2002年呈大幅度上升。人群血清胆固醇水平的升高将导致2010年-2030年期间我国心血管病事件约增加920万[2]。我国儿童青少年高胆固醇血症患病率也有明显升高[3],预示未来中国成人血脂异常患病及相关疾病负担将继续加重。
以低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)或TC升高为特点的血脂异常是动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease, ASCVD)重要的危险因素;降低LDL-C水平,可显著减少ASCVD的发病及死亡危险[4]。其他类型的血脂异常,如TG增高或HDL-C降低与ASCVD发病危险的升高也存在一定的关联[5-7]。
有效控制血脂异常,对我国ASCVD防控具有重要意义。鼓励民众采取健康的生活方式,是防治血脂异常和ASCVD的基本策略;对血脂异常患者,防治工作重点是提高血脂异常的知晓率、治疗率和控制率。近年来我国成人血脂异常患者的知晓率和治疗率虽有提高[8],但仍处于较低水平,血脂异常的防治工作亟待加强。
2007年,由多学科专家组成的联合委员会共同制订了《中国成人血脂异常防治指南》。该指南在充分采用中国人群流行病学和临床研究证据、结合国外研究结果及指南建议的基础上,提出了更适合中国人群的血脂异常防治建议,对我国血脂异常的防治工作起到了重要的指导作用[9]。
2007年以来,更多的临床研究证据进一步验证了降胆固醇治疗对ASCVD一级预防和二级预防的有效性和安全性,国际上许多学术机构相继更新或制订了新的血脂异常防治指南。此间我国临床血脂领域的研究有了很大进展。我国人群的前瞻性队列研究,在长期随访的基础上,获得了20年随访的新数据。在2007年指南推荐的10年总体危险评估方案基础上,提出了余生危险评估方案[10]。
2013年11月,在国家卫生和计划生育委员会疾病预防控制局的支持下,由国家心血管病中心、中华医学会心血管病学分会、中华医学会糖尿病学分会、中华医学会内分泌学分会以及中华医学会检验医学分会组成血脂指南修订联合委员会,在委员会成员中广泛征集新指南拟回答的核心问题,经讨论后最终确定了4个方面(指南修订的总体原则、心血管总体风险评估、调脂治疗的目标和特殊人群调脂治疗)共17个核心问题;指南工作组针对这些核心问题制定了具体的文献检索和评价策略,综合评价筛选出相关文献。检索文献库分别为中国生物医学文献数据库(CBM),万方数据知识服务平台,中国知识资源总库(CNKI),美国生物医学文献数据库(PubMed)和荷兰医学文摘检索系统(EMBASE)。同时利用国内长期队列研究的新数据开展了有针对性的分析。指南修订版提出的推荐建议是在系统评价基础上由多学科专家反复讨论形成,当专家意见出现分歧时,在充分考虑不同意见的基础上接受多数专家的共识。
指南修订参考了世界卫生组织、中华医学会临床指南制订的标准流程[11]。指南修订过程中,由国家心血管病中心筹集资金,避免与厂家产生利益冲突。
本指南对推荐类别定义借鉴了欧美血脂相关指南[12,13]的定义,具体表述如下:Ⅰ类:指已证实和(或)一致公认有益、有用和有效的操作或治疗,推荐使用。Ⅱ类:指有用和(或)有效的证据尚有矛盾或存在不同观点的操作或治疗。Ⅱa类:有关证据/观点倾向于有用和(或)有效,应用这些操作或治疗是合理的。Ⅱb类:有关证据/观点尚不能被充分证明有用和(或)有效,可考虑应用。Ⅲ类:指已证实和(或)一致公认无用和(或)无效,并对一些病例可能有害的操作或治疗,不推荐使用。
本指南对证据级别水平定义表述如下:证据水平A:证据基于多项随机临床试验或荟萃分析。证据水平B:证据基于单项随机临床试验或多项非随机对照研究。证据水平C:仅为专家共识意见和(或)基于小规模研究、回顾性研究和注册研究结果。
1 血脂与脂蛋白
要点提示:血脂是血清中的胆固醇、TG和类脂(如磷脂)等的总称,与临床密切相关的血脂主要是胆固醇和TG。在人体内胆固醇主要以游离胆固醇及胆固醇酯的形式存在;TG是甘油分子中的3个羟基被脂肪酸酯化而形成。血脂不溶于水,必须与特殊的蛋白质即载脂蛋白结合形成脂蛋白才能溶于血液,被运输至组织进行代谢。
脂蛋白分为: CM、VLDL、IDL、LDL、HDL和Lp(a)。
血脂是血清中的胆固醇、TG和类脂(如磷脂)等的总称,与临床密切相关的血脂主要是胆固醇和TG。在人体内胆固醇主要以游离胆固醇及胆固醇酯的形式存在;TG是甘油分子中的3个羟基被脂肪酸酯化而形成。血脂不溶于水,必须与特殊的蛋白质即载脂蛋白(apolipoprotein, Apo)结合形成脂蛋白才能溶于血液,被运输至组织进行代谢。
脂蛋白分为: 乳糜微粒(chylomicrons, CM)、极低密度脂蛋白(very-low-density lipoprotein, VLDL) 、中间密度脂蛋白(intermediate-density lipoprotein, IDL)、低密度脂蛋白(low-density lipoprotein, LDL)和高密度脂蛋白(high-density lipoprotein,HDL)。此外, 还有一种脂蛋白称为脂蛋白(a) [lipoprotein (a), Lp(a)]。各类脂蛋白的物理特性、主要成分、来源和功能列于表1[14,15]。

表1 脂蛋白的特性和功能
1.1乳糜微粒(CM)
CM是血液中颗粒最大的脂蛋白,主要成分是TG,占近90%,其密度最低。正常人空腹12 h后采血时, 血清中无CM。餐后以及某些病理状态下血液中含有大量CM时,血液外观白色混浊。将血清试管放在4℃静置过夜, CM会漂浮到血清上层凝聚, 状如奶油, 此为检查有无CM存在的简便方法。
1.2极低密度脂蛋白(VLDL)
VLDL由肝脏合成,其TG含量约占55%,与CM一起统称为富含TG的脂蛋白。在没有CM存在的血清中, TG浓度能反映VLDL的多少。由于VLDL分子比CM小, 空腹12 h的血清清亮透明, 当空腹血清TG水平>3.4 mmol/L(300 mg/dl)时,血清才呈乳状光泽直至混浊。
1.3低密度脂蛋白(LDL)
LDL由VLDL和IDL转化而来(其中的TG经酯酶水解后形成LDL),LDL颗粒中含胆固醇约50%,是血液中胆固醇含量最多的脂蛋白, 故称为富含胆固醇的脂蛋白。单纯性高胆固醇血症时, 胆固醇浓度的升高与血清LDL-C水平呈平行关系。由于LDL颗粒小, 即使LDL-C的浓度很高, 血清也不会混浊。LDL中的载脂蛋白95%以上为Apo B100。根据颗粒大小和密度高低不同,可将LDL分为不同的亚组分。LDL将胆固醇运送到外周组织,大多数LDL是由肝细胞和肝外的LDL受体进行分解代谢。
1.4高密度脂蛋白(HDL)
HDL主要由肝脏和小肠合成。HDL是颗粒最小的脂蛋白,其中脂质和蛋白质部分几乎各占一半。HDL中的载脂蛋白以Apo A1为主。HDL是一类异质性脂蛋白,由于HDL颗粒中所含脂质、载脂蛋白、酶和脂质转运蛋白的量和质各不相同,采用不同分离方法,可将HDL分为不同亚组分。这些HDL亚组分在形状、密度、颗粒大小、电荷和抗动脉粥样硬化特性等方面均不相同。HDL将胆固醇从周围组织(包括动脉粥样硬化斑块)转运到肝脏进行再循环或以胆酸的形式排泄,此过程称为胆固醇逆转运。
1.5脂蛋白(a)[Lp(a)]
Lp(a)是利用免疫方法发现的一类特殊脂蛋白。Lp(a) 脂质成分类似于LDL, 但其载脂蛋白部分除含有一分子ApoB100外,还含有一分子Apo (a)。有关Lp(a)合成和分解代谢的确切机制了解尚少。
1.6非高密度脂蛋白胆固醇(非-HDL-C)
非-HDL-C是指除HDL以外其他脂蛋白中含有的胆固醇总和,计算公式如下:非-HDL-C=TC-HDL-C。非-HDL-C作为ASCVD及其高危人群防治时调脂治疗的次要目标,适用于TG水平在2.3~5.6 mmol/L(200~500 mg/dl)时, LDL-C不高或已达治疗目标的个体。国际上有血脂指南建议将非-HDL-C列为ASCVD一级预防和二级预防的首要目标[16]。
2 血脂检测项目
要点提示:临床上血脂检测的基本项目为TC、TG、LDL-C和HDL-C。其他血脂项目如Apo A1、Apo B、Lp(a)的临床应用价值也日益受到关注。
临床上血脂检测的基本项目为TC、TG、LDL-C和HDL-C。其他血脂项目如Apo A1、Apo B和Lp(a) 的临床应用价值也日益受到关注[17]。
2.1总胆固醇(TC)
TC是指血液中各种脂蛋白所含胆固醇之总和。影响TC水平的主要因素有:(1)年龄与性别:TC水平常随年龄而上升,但70岁后不再上升甚或有所下降,中青年女性低于男性,女性绝经后TC水平较同年龄男性高。(2)饮食习惯:长期高胆固醇、高饱和脂肪酸摄入可使TC升高。(3)遗传因素:与脂蛋白代谢相关酶或受体基因发生突变,是引起TC显著升高的主要原因。
TC对动脉粥样硬化性疾病的危险评估和预测价值不及LDL-C精准。利用公式计算非-HDL-C和VLDL-C时,必需检测TC。
2.2甘油三酯(TG)
TG水平受遗传和环境因素的双重影响,与种族、年龄、性别以及生活习惯(如饮食、运动等)有关。与TC不同,TG水平个体内及个体间变异大,同一个体TG水平受饮食和不同时间等因素的影响,所以同一个体在多次测定时,TG值可能有较大差异。人群中血清TG水平呈明显正偏态分布。
TG轻至中度升高常反映VLDL及其残粒(颗粒更小的VLDL)增多,这些残粒脂蛋白由于颗粒变小,可能具有直接致动脉粥样硬化作用。但多数研究提示,TG升高很可能是通过影响LDL或HDL的结构而具有致动脉粥样硬化作用。调查资料表明,血清TG水平轻至中度升高者患冠心病危险性增加[18]。当TG重度升高时,常可伴发急性胰腺炎。
2.3低密度脂蛋白胆固醇(LDL-C)
胆固醇占LDL比重的50%左右,故LDL-C浓度基本能反映血液LDL总量。影响TC的因素均可同样影响LDL-C水平。LDL-C增高是动脉粥样硬化发生、发展的主要危险因素[12,16]。LDL通过血管内皮进入血管壁内,在内皮下层滞留的LDL被修饰成氧化型LDL(oxidized low-density lipoprotein,Ox-LDL),巨噬细胞吞噬Ox-LDL后形成泡沫细胞,后者不断增多、融合,构成动脉粥样硬化斑块的脂质核心。动脉粥样硬化病理虽表现为慢性炎症性反应特征,但LDL很可能是这种慢性炎症始动和维持的基本要素。一般情况下,LDL-C与TC相平行,但TC水平也受HDL-C水平影响,故最好采用LDL-C作为ASCVD危险性的评估指标。
2.4高密度脂蛋白胆固醇(HDL-C)
HDL能将外周组织如血管壁内胆固醇转运至肝脏进行分解代谢,即胆固醇逆转运,可减少胆固醇在血管壁的沉积,起到抗动脉粥样硬化作用。因为HDL中胆固醇含量比较稳定,故目前多通过检测其所含胆固醇的量,间接了解血中HDL水平。
HDL-C高低也明显受遗传因素影响。严重营养不良者,伴随血清TC明显降低,HDL-C也低下。肥胖者HDL-C也多偏低。吸烟可使HDL-C下降。糖尿病、肝炎和肝硬化等疾病状态可伴有低HDL-C。高TG血症患者往往伴有低HDL-C。而运动和少量饮酒会升高HDL-C。大量的流行病学资料表明,血清HDL-C水平与ASCVD发病危险呈负相关[19]。
2.5载脂蛋白A1(Apo A1)
正常人群血清Apo A1水平多在1.2~1.6 g/L范围内,女性略高于男性。HDL颗粒的蛋白质成分即载脂蛋白约占50%,蛋白质中Apo A1约占65%~75%,而其他脂蛋白中Apo A1极少,所以血清Apo A1可以反映HDL水平,与HDL-C水平呈明显正相关,其临床意义也大体相似。
2.6载脂蛋白B(Apo B)
正常人群中血清Apo B多在0.8~1.1 g/L范围内。正常情况下,每一个LDL、IDL、VLDL和Lp(a)颗粒中均含有1分子Apo B,因LDL颗粒占绝大多数,大约90%的Apo B分布在LDL中。Apo B有Apo B48和 Apo B100两种,前者主要存在于CM中,后者主要存在于LDL中。除特殊说明外,临床常规测定的Apo B通常指的是Apo B100。
血清Apo B主要反映LDL水平,与血清LDL-C水平呈明显正相关,两者的临床意义相似。在少数情况下, 可出现高Apo B血症而LDL-C浓度正常的情况,提示血液中存在较多小而密的LDL(small dense low-density lipoprotein,sLDL)。当高TG血症时(VLDL高),sLDL(B型LDL)增高。与大而轻LDL(A型LDL)相比,sLDL颗粒中Apo B含量较多而胆固醇较少,故可出现LDL-C虽然不高,但血清Apo B增高的所谓"高Apo B血症",它反映B型LDL增多。所以,Apo B与LDL-C同时测定有利于临床判断。
2.7脂蛋白(a)[Lp(a)]
血清Lp(a)浓度主要与遗传有关,基本不受性别、年龄、体重和大多数降胆固醇药物的影响。正常人群中Lp(a)水平呈明显偏态分布,虽然个别人可高达1 000 mg/L以上,但80%的正常人在200 mg/L以下。通常以300 mg/L为切点,高于此水平者患冠心病的危险性明显增高,提示Lp(a)可能具有致动脉粥样硬化作用,但尚缺乏临床研究证据[20]。此外, Lp(a)增高还可见于各种急性时相反应、肾病综合征、糖尿病肾病、妊娠和服用生长激素等。在排除各种应激性升高的情况下,Lp(a)被认为是ASCVD的独立危险因素。
各血脂项目测定数值的表达单位按国家标准为mmol/L,国际上有些国家用mg/dl, 其转换系数如下: TC、HDL-C、LDL-C:1 mg/dl=0.0259 mmol/L;TG:1 mg/dl=0.0113 mmol/L。
3 血脂合适水平和异常切点
要点提示:血脂合适水平和异常切点主要适用于ASCVD一级预防目标人群。
血脂异常的主要危害是增加ASCVD的发病危险。本指南对我国人群血脂成分合适水平及异常切点的建议(表2)基于多项对不同血脂水平的中国人群ASCVD发病危险的长期观察性研究结果,包括不同血脂水平对研究人群10年和20年ASCVD累积发病危险的独立影响;也参考了国际范围内多部血脂相关指南对血脂成分合适水平的建议及其依据[12,16,21,22]。需要强调的是,这些血脂合适水平和异常切点主要适用于ASCVD一级预防的目标人群。

表2 中国ASCVD一级预防人群血脂合适水平和异常分层标准[mmol/L(mg/dl)]
4 血脂异常分类
要点提示:血脂异常分类比较复杂,最简单的有病因分类和临床分类二种, 最实用的是临床分类。
血脂异常通常指血清中胆固醇和(或)TG水平升高,俗称高脂血症。实际上血脂异常也泛指包括低HDL-C血症在内的各种血脂异常。分类较繁杂,最简单的有病因分类和临床分类二种, 最实用的是临床分类[16,23,24]。
4.1血脂异常病因分类
4.1.1继发性高脂血症
继发性高脂血症是指由于其他疾病所引起的血脂异常。可引起血脂异常的疾病主要有:肥胖、糖尿病、肾病综合征、甲状腺功能减退症、肾功能衰竭、肝脏疾病、系统性红斑狼疮、糖原累积症、骨髓瘤、脂肪萎缩症、急性卟啉病、多囊卵巢综合征等。此外,某些药物如利尿剂、非心脏选择性β-受体阻滞剂、糖皮质激素等也可能引起继发性血脂异常。
4.1.2原发性高脂血症
除了不良生活方式(如高能量、高脂和高糖饮食、过度饮酒等)与血脂异常有关,大部分原发性高脂血症是由于单一基因或多个基因突变所致。由于基因突变所致的高脂血症多具有家族聚集性,有明显的遗传倾向,特别是单一基因突变者,故临床上通常称为家族性高脂血症。
例如编码LDL受体基因的功能缺失型突变,或编码与LDL受体结合的Apo B基因突变,或分解LDL受体的前蛋白转化酶枯草溶菌素9(proprotein convertases subtilisin/kexin type 9, PCSK9)基因的功能获得型突变,或调整LDL受体到细胞膜血浆表面的LDL受体调整蛋白基因突变可引起家族性高胆固醇血症(familial hypercholesterolemia, FH)。80%以上FH患者是单一基因突变所致,但高胆固醇血症具有多个基因突变的特性。 LDL受体基因的功能缺失型突变是FH的主要病因。纯合子型家族性高胆固醇血症(homozygous familial hypercholesterolemia, HoFH)发病率约1/30万~1/16万, 杂合子型家族性高胆固醇血症(heterozygous familial hypercholesterolemia, HeFH)发病率约1/500~1/200.
家族性高TG血症是单一基因突变所致,通常是参与TG代谢的脂蛋白脂解酶、或Apo C2、或Apo A5基因突变导致,表现为重度高TG血症(TG>10 mmol/L),其发病率为1/100万。轻中度高TG血症通常具有多个基因突变特性[25,26]。
4.2血脂异常临床分类
从实用角度出发,血脂异常可进行简易的临床分类(表3)。

表3 血脂异常的临床分类
5 血脂异常筛查
要点提示:定期检查血脂是血脂异常防治和心血管病防治的重要措施。
早期检出血脂异常个体,监测其血脂水平变化,是有效实施ASCVD防治措施的重要基础。我国绝大部分医疗机构均具有血脂检测条件,血脂异常患者检出和监测工作,主要通过对医疗机构就诊人群进行常规血脂检测来开展。这些人群既包括已经患有ASCVD的人群,也包括尚未患有ASCVD的人群。健康体检也是检出血脂异常患者的重要途径。为了及时发现血脂异常,建议20~40岁成年人至少每5年测量1次血脂(包括TC、LDL-C、 HDL-C和TG);建议40岁以上男性和绝经期后女性每年检测血脂;ASCVD患者及其高危人群,应每3~6个月测定1次血脂。因ASCVD住院患者,应在入院时或入院24 h内检测血脂。
血脂检查的重点对象为:(1)有ASCVD病史者。(2)存在多项ASCVD危险因素(如高血压、糖尿病、肥胖、吸烟)的人群。 (3)有早发性心血管病家族史者(指男性一级直系亲属在55岁前或女性一级直系亲属在65岁前患缺血性心血管病),或有家族性高脂血症患者。(4)皮肤或肌腱黄色瘤及跟腱增厚者。
血脂检测结果受多种因素影响,建议按临床血脂测定建议(附件1) 的要求开展血脂检测工作。
6 总体心血管危险评估
要点提示:依据ASCVD发病危险采取不同强度干预措施是血脂异常防治的核心策略。总体心血管危险评估是血脂异常治疗决策的基础;总体心血管危险评估应按推荐的流程进行;对年龄低于55岁人群应关注心血管病余生危险。
LDL-C或TC水平对个体或群体ASCVD发病危险具有独立的预测作用[27-29],但个体发生ASCVD危险的高低不仅取决于胆固醇水平高低,还取决于同时存在的ASCVD其他危险因素的数目和水平[29-31]。相同LDL-C水平个体,其他危险因素数目和水平不同,ASCVD总体发病危险可存在明显差异。更重要的是,ASCVD总体危险并不是胆固醇水平和其他危险因素独立作用的简单叠加,而是胆固醇水平与多个危险因素复杂交互作用的共同结果。这导致同样的胆固醇水平,可因其他危险因素的存在而具有更大的危害。全面评价ASCVD总体危险是防治血脂异常的必要前提。评价ASCVD总体危险,不仅有助于确定血脂异常患者调脂治疗的决策,也有助于临床医生针对多重危险因素,制定出个体化的综合治疗决策,从而最大程度降低患者ASCVD总体危险。目前,国内外发布的血脂异常防治指南的核心内容均包括ASCVD发病总体危险的评估方法和危险分层的标准[9,12,13,16,22,32-35]。2007年版血脂指南中,提出用"缺血性心血管病"(冠心病和缺血性卒中)发病危险来反映血脂异常及其他心血管病主要危险因素的综合致病危险。对10年ASCVD发病危险为中危且年龄 <55岁的人群,本版血脂指南增加了进行ASCVD余生危险评估的建议[10],以利于早期识别ASCVD余生危险为高危的个体,并进行积极干预。
在进行危险评估时,已诊断ASCVD者直接列为极高危人群;符合如下条件之一者直接列为高危人群:(1)LDL-C ≥4.9 mmol/L (190 mg/dl)。(2)1.8 mmol/L (70 mg/dl)≤LDL-C<4.9 mmol/L(190 mg/dl) 且年龄在40岁及以上的糖尿病患者。符合上述条件的极高危和高危人群不需要按危险因素个数进行ASCVD危险分层。
不具有以上3种情况的个体,在考虑是否需要调脂治疗时,应按照图1的流程进行未来10年间ASCVD总体发病危险的评估。本次指南修订的危险分层按照LDL-C或TC水平、有无高血压及其他ASCVD危险因素个数分成21种组合,并按照不同组合的ASCVD 10年发病平均危险按<5%, 5%~9% 和≥10%分别定义为低危、中危和高危。本次修订延续了2007年血脂指南危险分层方案,将高血压作为危险分层的重要参数(图1)。本版指南提供了更加定量的ASCVD发病危险分层彩图作为危险分层的参考(附件2)。
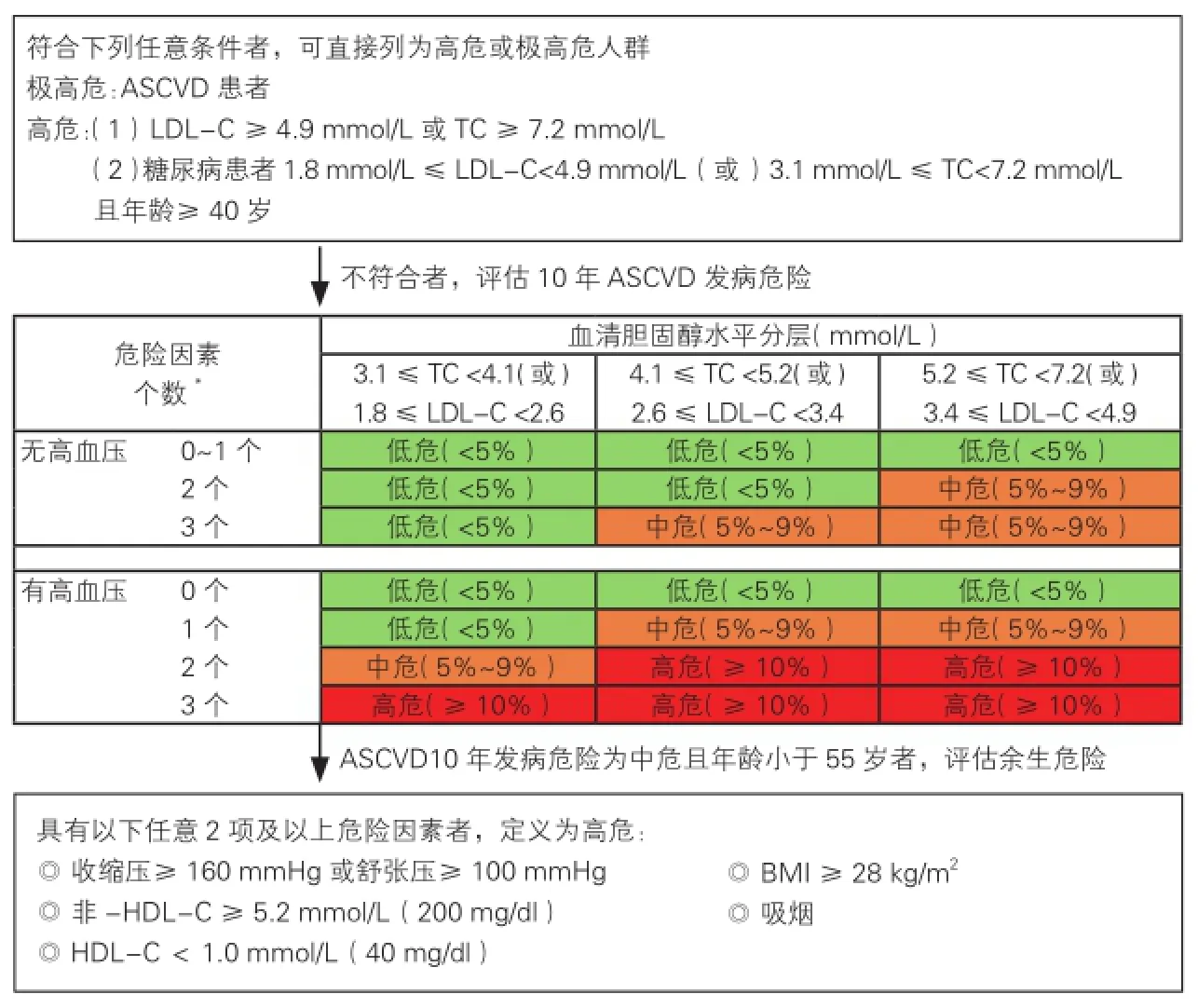
图1 ASCVD危险评估流程图
由于国内外研究已经揭示危险因素水平对年龄低于55岁的人群余生危险的影响[10,31,36,37],本次指南修订建议对ASCVD 10年发病危险为中危的人群进行ASCVD余生危险的评估,以便识别出中青年ASCVD余生危险为高危的个体,对包括血脂在内的危险因素进行早期干预。对于ASCVD 10年发病危险为中危的人群,如果具有以下任意2项及以上危险因素者,其ASCVD余生危险为高危。这些危险因素包括:(1)收缩压≥160 mmHg(1 mmHg=0.133kPa)或舒张压≥100 mmHg。(2) 非-HDL-C ≥5.2 mmol/L (200 mg/dl)。(3)HDL-C<1.0 mmol/L(40 mg/dl)。(4)体重指数(body mass index, BMI) ≥28 kg/m2。(5) 吸烟。
7 血脂异常治疗原则
要点提示:
1. 临床上应根据个体ASCVD危险程度,决定是否启动药物调脂治疗。
2.将降低LDL-C水平作为防控ASCVD危险的首要干预靶点,非-HDL-C可作为次要干预靶点。
3. 调脂治疗需设定目标值:极高危者LDL-C<1.8 mmol/L;高危者LDL-C<2.6 mmol/L;中危和低危者LDL-C<3.4 mmol/L。
4. LDL-C基线值较高不能达目标值者,LDL-C至少降低50%。极高危患者LDL-C基线在目标值以内者, LDL-C仍应降低30%左右。
5.临床调脂达标,首选他汀类调脂药物。起始宜应用中等强度他汀,根据个体调脂疗效和耐受情况,适当调整剂量,若胆固醇水平不能达标,与其他调脂药物联合使用。
血脂异常治疗的宗旨是防控ASCVD,降低心肌梗死、缺血性卒中或冠心病死亡等心血管病临床事件发生危险。由于遗传背景和生活环境不同,个体罹患ASCVD危险程度显著不同,调脂治疗能使ASCVD患者或高危人群获益。临床应根据个体ASCVD危险程度,决定是否启动药物调脂治疗(I类推荐,A级证据)。
7.1调脂治疗靶点
血脂异常尤其是LDL-C升高是导致ASCVD发生、发展的关键因素。大量临床研究反复证实,无论采取何种药物或措施,只要能使血清LDL-C水平下降,就可稳定、延缓或消退动脉粥样硬化病变,并能显著减少ASCVD的发生率、致残率和死亡率。国内外血脂异常防治指南均强调,LDL-C在ASCVD发病中起着核心作用,提倡以降低血清LDL-C水平来防控ASCVD危险[9,12,35,38]。所以,推荐以LDL-C为首要干预靶点(I类推荐,A级证据)。
而非-HDL-C可作为次要干预靶点(Ⅱa类推荐,B级证据)。将非-HDL-C作为次要干预靶点,是考虑到高TG血症患者体内有残粒脂蛋白升高,后者很可能具有致动脉粥样硬化作用。
7.2调脂目标值设定
调脂治疗设定目标值已为临床医生所熟知并习惯应用。然而,有部分国外新发表的血脂异常诊疗指南不推荐设定调脂目标值[12,35]。其理由是:尚无随机对照研究证据支持具体的血脂治疗目标值是多少,也不知道何种血脂目标值能带来ASCVD危险最大幅度的降低。然而,若取消调脂目标值则会严重影响患者服用调脂药的依从性。从调脂治疗获益的角度来说,长期坚持治疗最为重要。只有在设定调脂目标值后,医生才能更加准确地评价治疗方法的有效性,并能与患者有效交流,提高患者服用调脂药的依从性。在我国取消调脂目标值更没有证据和理由[38,39],为此,调脂治疗需要设定目标值(I类推荐,C级证据)。
7.3调脂达标值
应根据ASCVD的不同危险程度,确定调脂治疗需要达到的胆固醇基本目标值。推荐将LDL-C降至某一切点(目标值)主要是基于危险-获益程度来考虑:未来发生心血管事件危险度越高者,获益越大;尽管将LDL-C降至更低,心血管临床获益会更多些,但药物相关不良反应会明显增多。此外,卫生经济学也是影响治疗决策的一个重要因素,必须加以考量。
凡临床上诊断为ASCVD[包括急性冠状动脉综合征(acute coronary syndrome, ACS)、稳定性冠心病、血运重建术后、缺血性心肌病、缺血性卒中、短暂性脑缺血发作、外周动脉粥样硬化病等]患者均属极高危人群[13,35]。而在非ASCVD人群中,则需根据胆固醇水平和危险因素的严重程度及其数目多少,进行危险评估,将其分为高危、中危或低危,由个体心血管病发病危险程度决定需要降低LDL-C的目标值。不同危险人群需要达到的LDL-C/非-HDL-C目标值有很大不同(表4, I类推荐,B级证据)。

表4 不同ASCVD危险人群降LDL-C/非-HDL-C治疗达标值
所有强化他汀治疗的临床研究结果均显示,数倍增量他汀确实可使ASCVD事件发生危险有所降低,但获益的绝对值小,且全因死亡并未下降[40]。在他汀联合依折麦布治疗的研究中也得到相似的结果[41],将LDL-C从1.8 mmol/L降至1.4 mmol/L,能够使心血管事件的绝对危险进一步降低2.0%,相对危险降低6.4%,但心血管死亡或全因死亡危险未降低。提示将LDL-C降至更低,虽然存在临床获益空间,但绝对获益幅度已趋缩小。
如果LDL-C基线值较高,若现有调脂药物标准治疗3个月后,难以使LDL-C降至基本目标值,则可考虑将LDL-C至少降低50%作为替代目标(Ⅱa类推荐,B级证据)。临床上也有部分极高危患者LDL-C基线值已在基本目标值以内,这时可将其LDL-C从基线值降低30%左右(I类推荐,A级证据)。
非-HDL-C目标值比LDL-C目标值约高0.8 mmol/L (30 mg/dl)。不同危险人群非-HDL-C治疗目标值见表4(I类推荐,B级证据)。
7.4调脂达标策略
近20年来,多项大规模临床试验结果一致显示,他汀类药物在ASCVD一级和二级预防中均能显著降低心血管事件(包括心肌梗死、冠心病死亡和缺血性卒中等)危险。他汀类已成为防治这类疾病最为重要的药物。所以,为了调脂达标,临床上应首选他汀类调脂药物(I类推荐,A级证据)。
然而,如何合理有效使用他汀类药物存有争议。新近国外有指南推荐临床上起始就使用高强度(相当于最大允许使用剂量)他汀,但在中国人群中,最大允许使用剂量他汀的获益递增及安全性尚未能确定[42]。HPS2-THRIVE[43]研究表明,釆用完全相同的他汀药物和剂量,中国人群比欧洲人群可以达到更低的LDL-C水平。DYSIS-CHINA[44]研究显示,增大他汀剂量并未使LDL-C达标率增加。CHILLAS[45]研究结果未显示高强度他汀在中国ACS患者中能更多获益。在中国人群中,安全性是使用高强度他汀需要关注的问题。越来越多的研究表明,高强度他汀治疗伴随着更高的肌病以及肝酶上升风险,而这在中国人群中更为突出。HPS2-THRIVE研究表明使用中等强度他汀治疗时,中国患者肝脏不良反应发生率明显高于欧洲患者,肝酶升高率(>正常值上限3倍)超过欧洲患者10倍,而肌病风险也高于欧洲人群10倍。目前,尚无关于中国人群高强度他汀治疗的安全性数据。
他汀类药物调脂疗效的特点是每种他汀的起始剂量均有良好调脂疗效;而当剂量增倍时,LDL-C进一步降低幅度仅约6%(他汀疗效6%效应)。他汀剂量增倍,药费成比例增加,而降低LDL-C疗效的增加相对较小。因此,建议临床上起始应用中等强度他汀,根据个体调脂疗效和耐受情况,适当调整剂量,若胆固醇水平不达标,与其他调脂药物(如依折麦布)联合应用,可获得安全有效的调脂效果(Ⅰ类推荐,B级证据)。
7.5其他血脂异常的干预
除积极干预胆固醇外,其他血脂异常是否也需要进行处理,尚缺乏相关临床试验获益的证据。血清TG的合适水平为<1.7 mmol/L(150 mg/dl)。当血清TG ≥1.7 mmol/L (150 mg/ dl)时, 首先应用非药物干预措施,包括治疗性饮食、减轻体重、减少饮酒、戒烈性酒等。若TG水平仅轻、中度升高[2.3~5.6 mmol/L(200~500 mg/dl)],为了防控ASCVD危险,虽然以降低LDL-C水平为主要目标,但同时应强调非-HDL-C需达到基本目标值。经他汀治疗后,如非-HDL-C仍不能达到目标值,可在他汀类基础上加用贝特类、高纯度鱼油制剂。对于严重高TG血症患者,即空腹TG≥5.7 mmol/L(500 mg/dl),应首先考虑使用主要降低TG和VLDL-C的药物(如贝特类、高纯度鱼油制剂或烟酸)。
对于HDL-C<1.0 mmol/L(40 mg/dl)者,主张控制饮食和改善生活方式,目前无药物干预的足够证据。7.6生活方式干预
血脂异常明显受饮食及生活方式的影响,饮食治疗和生活方式改善是治疗血脂异常的基础措施。无论是否进行药物调脂治疗,都必须坚持控制饮食和改善生活方式(I类推荐,A级证据)。良好的生活方式包括坚持心脏健康饮食、规律运动、远离烟草和保持理想体重。生活方式干预是一种最佳成本/效益比和风险/获益比的治疗措施。
7.7治疗过程的监测
饮食与非药物治疗者,开始3~6个月应复查血脂水平,如血脂控制达到建议目标,则继续非药物治疗,但仍须每6个月~1年复查,长期达标者可每年复查1次。服用调脂药物者,需要进行更严密的血脂监测。首次服用调脂药者,应在用药6周内复查血脂及转氨酶和肌酸激酶。如血脂能达到目标值,且无药物不良反应,逐步改为每6~12个月复查1次;如血脂未达标且无药物不良反应者,每3个月监测1次。如治疗3~6个月后,血脂仍未达到目标值,则需调整调脂药剂量或种类,或联合应用不同作用机制的调脂药进行治疗。每当调整调脂药种类或剂量时,都应在治疗6周内复查。治疗性生活方式改变(therapeutic lifestyle change,TLC)和调脂药物治疗必须长期坚持,才能获得良好的临床益处。
8 治疗性生活方式改变
要点提示:在满足每日必需营养需要的基础上控制总能量;合理选择各营养要素的构成比例;控制体重,戒烟,限酒;坚持规律的中等强度代谢运动。
血脂异常与饮食和生活方式有密切关系,饮食治疗和改善生活方式是血脂异常治疗的基础措施[46]。无论是否选择药物调脂治疗,都必须坚持控制饮食和改善生活方式(表5)。在满足每日必需营养和总能量需要的基础上,当摄入饱和脂肪酸和反式脂肪酸的总量超过规定上限时,应该用不饱和脂肪酸来替代。建议每日摄入胆固醇小于300 mg,尤其是ASCVD等高危患者,摄入脂肪不应超过总能量的20%~30%。一般人群摄入饱和脂肪酸应小于总能量的10%;而高胆固醇血症者饱和脂肪酸摄入量应小于总能量的7%,反式脂肪酸摄入量应小于总能量的1%。高TG血症者更应尽可能减少每日摄入脂肪总量,每日烹调油应少于30 g。脂肪摄入应优先选择富含n-3多不饱和脂肪酸的食物(如深海鱼、鱼油、植物油)。

表5 生活方式改变基本要素
建议每日摄入碳水化合物占总能量的50%~65%。选择使用富含膳食纤维和低升糖指数的碳水化合物替代饱和脂肪酸,每日饮食应包含25~40 g膳食纤维(其中7~13 g为水溶性膳食纤维)。碳水化合物摄入以谷类、薯类和全谷物为主,其中添加糖摄入不应超过总能量的10%(对于肥胖和高TG血症者要求比例更低)。食物添加剂如植物固醇/烷醇(2~3 g/d),水溶性/粘性膳食纤维(10~25 g/d)有利于血脂控制,但应长期监测其安全性。
8.1控制体重
肥胖是血脂代谢异常的重要危险因素。血脂代谢紊乱的超重或肥胖者的能量摄入应低于身体能量消耗,以控制体重增长,并争取逐渐减少体重至理想状态。减少每日食物总能量(每日减少300~500 kcal),改善饮食结构,增加身体活动,可使超重和肥胖者体重减少10%以上。维持健康体重(BMI:20.0~23.9 kg/m2),有利于血脂控制。
8.2身体活动
建议每周5~7天、每次30 min中等强度代谢运动。对于ASCVD患者应先进行运动负荷试验,充分评估其安全性后,再进行身体活动。
8.3戒烟
完全戒烟和有效避免吸入二手烟,有利于预防ASCVD,并升高HDL-C水平。可以选择戒烟门诊、戒烟热线咨询以及药物来协助戒烟。
8.4限制饮酒
中等量饮酒(男性每天20~30 g乙醇,女性每天10~20 g乙醇)能升高HDL-C水平。但即使少量饮酒也可使高TG血症患者TG水平进一步升高。饮酒对于心血管事件的影响尚无确切证据,提倡限制饮酒。
9 调脂药物治疗
要点提示:他汀类药物是血脂异常药物治疗的基石;推荐将中等强度的他汀作为中国血脂异常人群的常用药物;他汀不耐受或胆固醇水平不达标者或严重混合型高脂血症者应考虑调脂药物的联合应用;注意观察调脂药物的不良反应。
人体血脂代谢途径复杂,有诸多酶、受体和转运蛋白参与。临床上可供选用的调脂药物有许多种类,大体上可分为两大类:(1)主要降低胆固醇的药物。(2)主要降低TG的药物。其中部分调脂药物既能降低胆固醇,又能降低TG。对于严重的高脂血症,常需多种调脂药联合应用,才能获得良好疗效。
9.1主要降低胆固醇的药物
这类药物的主要作用机制是抑制肝细胞内胆固醇的合成,加速LDL分解代谢或减少肠道内胆固醇的吸收,包括他汀类、胆固醇吸收抑制剂、普罗布考、胆酸螯合剂及其他调脂药(脂必泰、多廿烷醇)等。
9.1.1他汀类
他汀类(statins)亦称3-羟基3-甲基戊二酰辅酶A (3-hydroxy-3-methylglutaryl-coenzyme A, HMG-CoA)还原酶抑制剂,能够抑制胆固醇合成限速酶HMG-CoA还原酶,减少胆固醇合成,继而上调细胞表面LDL受体,加速血清LDL分解代谢。此外,还可抑制VLDL合成。因此他汀类能显著降低血清TC、LDL-C和Apo B水平,也能降低血清TG水平和轻度升高HDL-C水平。
他汀类药物问世在人类ASCVD防治史上具有里程碑式的意义。4S[47]临床试验首次证实他汀类可降低冠心病死亡率和患者的总死亡率,此后的CARE[48]、LIPID[49]、LIPS[50]等研究也证实这类药物在冠心病二级预防中的重要作用。HPS[51]研究表明,在基线胆固醇不高的高危人群中,他汀类治疗能获益。强化他汀治疗的临床试验主要有PROVE-IT[52]、A to Z[53]、TNT[54]、MIRACL[55]和IDEAL[56]等,与常规剂量他汀类相比,冠心病患者强化他汀治疗可进一步降低心血管事件[52,54],但降低幅度不大[53,56],且不降低总死亡率[57]。ASTEROID[58]研究证实他汀类药物治疗可逆转冠状动脉粥样硬化斑块。WOSCOPS[59]、AFCAPS/TexCAPS[60]、CARDS[61]、JUPITER[62]、HPS[51]等研究将他汀类应用从ASCVD患者扩展到一级预防和更广泛的人群。目前他汀类在心血管病高危人群一级预防中的作用已得到肯定,但在心血管病低危人群中的应用效果有待于进一步研究。多项研究针对特殊人群进行了探索,SPARCL[63]、PROSPER[64]、CARDS[61]、ALLHAT-LLT[65]和ASCOT-LLA[66]研究分别显示出他汀在卒中、老年人、糖尿病及高血压患者中有临床获益。此外,中国的临床研究证据不支持ACS患者经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)术前短期强化他汀治疗的心血管获益,最新国外指南也未对PCI围术期短期强化他汀干预策略予以推荐。
他汀类药物适用于高胆固醇血症、混合性高脂血症和ASCVD患者。目前国内临床上有洛伐他汀、辛伐他汀、普伐他汀、氟伐他汀、阿托伐他汀、瑞舒伐他汀和匹伐他汀。不同种类与剂量的他汀降胆固醇幅度有较大差别,但任何一种他汀剂量倍增时,LDL-C进一步降低幅度仅约6%,即所谓"他汀疗效6%效应"。他汀类可使TG水平降低7%~30%,HDL-C水平升高5%~15%。
他汀可在任何时间段每天服用1次,但在晚上服用时LDL-C降低幅度可稍有增多。他汀应用取得预期疗效后应继续长期应用,如能耐受应避免停用。有研究提示,停用他汀有可能增加心血管事件的发生[67]。如果应用他汀类后发生不良反应,可采用换用另一种他汀、减少剂量、隔日服用[68]或换用非他汀类调脂药等方法处理。
胆固醇治疗研究者协作组(CTT)分析结果表明,在心血管危险分层不同的人群中,他汀治疗后,LDL-C每降低1 mmol/L,主要心血管事件相对危险减少20%,全因死亡率降低10%,而非心血管原因引起的死亡未见增加[57,69]。现有研究反复证明,他汀降低ASCVD事件的临床获益大小与其降低LDL-C幅度呈线性正相关,他汀治疗产生的临床获益来自LDL-C降低效应。不同种类与剂量的他汀降低LDL-C幅度见表6[35]。

表6 他汀类药物降胆固醇强度
血脂康胶囊虽被归入调脂中药,但其调脂机制与他汀类似,系通过现代GMP标准工艺,由特制红曲加入稻米生物发酵精制而成,主要成份为13种天然复合他汀,系无晶型结构的洛伐他汀及其同类物。常用剂量为0.6 g, 2次/d。中国冠心病二级预防研究(CCSPS)及其他临床研究[70-73]证实,血脂康胶囊能够降低胆固醇,并显著降低冠心病患者总死亡率、冠心病死亡率以及心血管事件发生率,不良反应少。
绝大多数人对他汀的耐受性良好,其不良反应多见于接受大剂量他汀治疗者, 常见表现如下:
肝功能异常[74,75]:主要表现为转氨酶升高,发生率约0.5%~3.0%,呈剂量依赖性。血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和(或)天(门)冬氨酸氨基转移酶(aspartate aminotransferase,AST)升高达正常值上限3倍以上及合并总胆红素升高患者,应减量或停药。对于转氨酶升高在正常值上限3倍以内者,可在原剂量或减量的基础上进行观察,部分患者经此处理后转氨酶可恢复正常。失代偿性肝硬化及急性肝功能衰竭是他汀类药物应用禁忌证。
他汀类药物相关肌肉不良反应包括肌痛、肌炎和横纹肌溶解[76,77]。患者有肌肉不适和(或)无力,且连续检测肌酸激酶呈进行性升高时,应减少他汀类剂量或停药。
长期服用他汀有增加新发糖尿病的危险[78],发生率约10%~12%,属他汀类效应。他汀类对心血管疾病的总体益处远大于新增糖尿病危险,无论是糖尿病高危人群还是糖尿病患者,有他汀类治疗适应证者都应坚持服用此类药物。
他汀治疗可引起认知功能异常[79],但多为一过性,发生概率不高。荟萃分析结果显示他汀对肾功能无不良影响[80]。他汀类药物的其他不良反应还包括头痛、失眠、抑郁以及消化不良、腹泻、腹痛、恶心等消化道症状。
9.1.2胆固醇吸收抑制剂
依折麦布能有效抑制肠道内胆固醇的吸收。IMPROVEIT[41]研究表明ACS患者在辛伐他汀基础上加用依折麦布能够进一步降低心血管事件。SHARP[81]研究显示依折麦布和辛伐他汀联合治疗对改善慢性肾脏疾病(chronic kidney disease, CKD)患者的心血管疾病预后具有良好作用。依折麦布推荐剂量为10 mg/d。依折麦布的安全性和耐受性良好,其不良反应轻微且多为一过性, 主要表现为头疼和消化道症状, 与他汀联用也可发生转氨酶增高和肌痛等副作用,禁用于妊娠期和哺乳期。
9.1.3普罗布考
普罗布考通过掺入LDL颗粒核心中,影响脂蛋白代谢,使LDL易通过非受体途径被清除。普罗布考常用剂量为每次0.5g,2次/d。主要适用于高胆固醇血症,尤其是HoFH及黄色瘤患者,有减轻皮肤黄色瘤的作用[82,83]。常见不良反应为胃肠道反应;也可引起头晕、头痛、失眠、皮疹等;极为少见的严重不良反应为QT间期延长。室性心律失常、QT间期延长、血钾过低者禁用。
9.1.4胆酸螯合剂
胆酸螯合剂为碱性阴离子交换树脂,可阻断肠道内胆汁酸中胆固醇的重吸收[84]。临床用法:考来烯胺每次5 g,3次/d;考来替泊每次5 g,3次/d;考来维仑每次1.875 g,2次/d。与他汀类联用,可明显提高调脂疗效。常见不良反应有胃肠道不适、便秘和影响某些药物的吸收。此类药物的绝对禁忌证为异常β脂蛋白血症和血清TG>4.5 mmol/L(400 mg/dl)。
9.1.5其他调脂药
脂必泰是一种红曲与中药(山渣、泽泻、白术)的复合制剂。常用剂量为每次0.24~0.48 g,2次/d,具有轻中度降低胆固醇作用[85,86]。该药的不良反应少见。
多廿烷醇是从甘蔗蜡中提纯的一种含有8种高级脂肪伯醇的混合物,常用剂量为10~20 mg/d,调脂作用起效慢,不良反应少见[87,88]。
9.2主要降低TG的药物
有3种主要降低TG的药物:贝特类、烟酸类和高纯度鱼油制剂。
9.2.1贝特类
贝特类通过激活过氧化物酶体增殖物激活受体α (peroxisome proliferator activated receptor -α, PPARα)和激活脂蛋白脂酶(lipoprotein lipase,LPL)而降低血清TG水平和升高HDL-C水平[89-93]。常用的贝特类药物有:非诺贝特片每次0.1 g,3次/d;微粒化非诺贝特每次0.2 g/次,l次/d;吉非贝齐每次0.6 g,2次/d;苯扎贝特每次0.2 g,3次/d。常见不良反应与他汀类药物类似,包括肝脏、肌肉和肾毒性等,血清肌酸激酶和ALT水平升高的发生率均<1%。临床试验结果荟萃分析提示贝特类药物能使高TG伴低HDL-C人群心血管事件危险降低10%左右,以降低非致死性心肌梗死和冠状动脉血运重建术为主,对心血管死亡、致死性心肌梗死或卒中无明显影响[90-92]。
9.2.2烟酸类
烟酸也称作维生素B3,属人体必需维生素。大剂量时具有降低TC、LDL-C和TG以及升高HDL-C的作用。调脂作用与抑制脂肪组织中激素敏感脂酶活性、减少游离脂肪酸进入肝脏和降低VLDL分泌有关。烟酸有普通和缓释2种剂型,以缓释剂型更为常用。缓释片常用量为每次1~2 g,1次/d。建议从小剂量(0.375~0.5 g/d)开始,睡前服用;4周后逐渐加量至最大常用剂量。最常见的不良反应是颜面潮红,其他有肝脏损害、高尿酸血症、高血糖、棘皮症和消化道不适等,慢性活动性肝病、活动性消化性溃疡和严重痛风者禁用。早期临床试验结果荟萃分析发现,烟酸无论是单用还是与其他调脂药物合用均可改善心血管预后,心血管事件减少34%,冠状动脉事件减少25%[94]。由于在他汀基础上联合烟酸的临床研究提示与单用他汀相比无心血管保护作用[95,96],欧美多国已将烟酸类药物淡出调脂药物市场。
9.2.3高纯度鱼油制剂
鱼油主要成份为n-3脂肪酸即ω-3脂肪酸。常用剂量为每次0.5~1.0 g,3次/d,主要用于治疗高TG血症[97-99]。不良反应少见,发生率约2%~3%,包括消化道症状,少数病例出现转氨酶或肌酸激酶轻度升高,偶见出血倾向。早期有临床研究[100]显示高纯度鱼油制剂可降低心血管事件,但未被随后的临床试验[101,102]证实。
9.3新型调脂药物
近年来在国外已有3种新型调脂药被批准临床应用。
9.3.1微粒体TG转移蛋白抑制剂
洛美他派(lomitapide,商品名为Juxtapid) 于2012年由美国食品药品监督管理局(Food and Drug Administration, FDA)批准上市,主要用于治疗HoFh.可使LDL-C降低约40%。该药不良反应发生率较高,主要表现为转氨酶升高或脂肪肝[103,104]。
9.3.2载脂蛋白B100合成抑制剂
米泊美生( mipomersen) 是第2代反义寡核苷酸,2013年FDA批准可单独或与其他调脂药联合用于治疗HoFh.作用机制是针对Apo B信使核糖核酸(messenger ribonucleic acid, mRNA)转录的反义寡核苷酸,减少VLDL的生成和分泌,降低LDL-C水平,可使LDL-C降低25%。该药最常见的不良反应为注射部位反应,包括局部红疹、肿胀、瘙痒、疼痛,绝大多数不良反应属于轻中度[105]。
9.3.3前蛋白转化酶枯草溶菌素9kexin9型(PCSK9) 抑制剂
PCSK9是肝脏合成的分泌型丝氨酸蛋白酶,可与LDL受体结合并使其降解,从而减少LDL受体对血清LDL-C的清除。通过抑制PCSK9,可阻止LDL受体降解,促进LDL-C的清除。PCSK9抑制剂以PCSK9单克隆抗体发展最为迅速,其中alirocumab、evolocumab和bococizumab研究较多。研究结果显示PCSK9抑制剂无论单独应用或与他汀类药物联合应用均明显降低血清LDL-C水平,同时可改善其他血脂指标,包括HDL-C, Lp(a)等。欧盟医管局和美国FDA已批准evolocumab与alirocumab两种注射型PCSK9抑制剂上市。初步临床研究结果表明,该药可使LDL-C降低40%~70%[106],并可减少心血管事件[106,107]。至今尚无严重或危及生命的不良反应报道[108]。国内尚处于临床试验阶段。
9.4调脂药物的联合应用
调脂药物联合应用可能是血脂异常干预措施的趋势,优势在于提高血脂控制达标率,同时降低不良反应发生率。由于他汀类药物作用肯定、不良反应少、可降低总死亡率,联合调脂方案多由他汀类与另一种作用机制不同的调脂药组成。针对调脂药物的不同作用机制,有不同的药物联合应用方案。
9.4.1他汀与依折麦布联合应用
两种药物分别影响胆固醇的合成和吸收,可产生良好协同作用。联合治疗可使血清LDL-C在他汀治疗的基础上再下降18%左右,且不增加他汀类的不良反应[109-111]。多项临床试验观察到依折麦布与不同种类他汀联用有良好的调脂效果[110,112,113]。IMPROVE-IT和SHARP研究分别显示ASCVD极高危患者及CKD患者采用他汀与依折麦布联用可降低心血管事件[41,81]。对于中等强度他汀治疗胆固醇水平不达标或不耐受者,可考虑中/低强度他汀与依折麦布联合治疗(Ⅰ类推荐,B级证据)。
9.4.2他汀与贝特联合应用
两者联用能更有效降低LDL-C和TG水平及升高HDL-C水平,降低sLDL-C。贝特类药物包括非诺贝特、吉非贝齐、苯扎贝特等,以非诺贝特研究最多,证据最充分[114]。既往研究提示,他汀与非诺贝特联用可使高TG伴低HDL-C水平患者心血管获益[115]。非诺贝特适用于严重高TG血症伴或不伴低HDL-C水平的混合型高脂血症患者,尤其是糖尿病和代谢综合征时伴有的血脂异常, 高危心血管疾病患者他汀类治疗后仍存在TG或HDL-C水平控制不佳者。由于他汀类和贝特类药物代谢途径相似,均有潜在损伤肝功能的可能,并有发生肌炎和肌病的危险,合用时发生不良反应的机会增多,因此,他汀类和贝特类药物联合用药的安全性应高度重视。吉非贝齐与他汀类药物合用发生肌病的危险性相对较多,开始合用时宜用小剂量,采取晨服贝特类药物、晚服他汀类药物的方式,避免血药浓度的显著升高,并密切监测肌酶和肝酶,如无不良反应,可逐步增加他汀剂量。
9.4.3他汀与PCSK9抑制剂联合应用
尽管PCSK9抑制剂尚未在中国上市,他汀与PCSK9抑制剂联合应用已成为欧美国家治疗严重血脂异常尤其是FH患者的联合方式,可较任何单一的药物治疗带来更大程度的LDL-C水平下降,提高达标率。FH尤其是HoFH患者,经生活方式加最大剂量调脂药物(如他汀+依折麦布)治疗, LDL-C水平仍>2.6 mmol/L 的ASCVD患者,加用PCSK9抑制剂,组成不同作用机制调脂药物的三联合用。
9.4.4他汀与n-3脂肪酸联合应用
他汀与鱼油制剂n-3脂肪酸联合应用可用于治疗混合型高脂血症,且不增加各自的不良反应。由于服用较大剂量n-3多不饱和脂肪酸有增加出血的危险,并增加糖尿病和肥胖患者热卡摄入,不宜长期应用。此种联合是否能够减少心血管事件尚在探索中。
10 血脂异常治疗的其他措施
要点提示:脂蛋白血浆置换、肝移植、部分回肠旁路手术和门腔静脉分流术,作为辅助治疗措施用于FH患者。脂蛋白血浆置换效果肯定。
10.1脂蛋白血浆置换
脂蛋白血浆置换是FH[116],尤其是HoFH患者重要的辅助治疗措施,可使LDL-C水平降低55%~70%。长期治疗可使皮肤黄色瘤消退。最佳的治疗频率是每周1次,但现多采用每2周进行1次。怀孕期间脂蛋白血浆置换可以持续进行。该治疗措施价格昂贵,耗时及存在感染风险,副作用包括低血压、腹痛、恶心、低钙血症、缺铁性贫血和过敏性反应,但随着科技与材料的发展,相关副作用发生率已降低。
10.2肝移植和其他手术治疗
肝移植可使LDL-C水平明显改善。单纯肝移植或与心脏移植联合,虽然是一种成功的治疗策略,但有多种弊端,包括移植术后并发症多和死亡率高、供体缺乏、终生服用免疫抑制剂等,因此,临床上极少应用。虽然部分回肠旁路手术和门腔静脉分流术并不推荐,但极严重纯合子FH患者在缺乏更有效的治疗时,可考虑采用[116]。
11 特殊人群血脂异常的管理
要点提示:高血压、糖尿病等人群的血脂管理,同样遵循在ASCVD发病危险评估基础上,结合伴随疾病特点开展血脂个性化管理。
11.1糖尿病
糖尿病合并血脂异常主要表现为TG升高,HDL-C降低, LDL-C升高或正常[117]。调脂治疗可以显著降低糖尿病患者发生心血管事件的危险[61]。应根据心血管疾病危险程度确定LDL-C目标水平[118]。40岁及以上糖尿病患者血清LDL-C水平应控制在2.6 mmol/L (100 mg/dl)以下,保持HDL-C目标值在1.0 mmol/L (40 mg/dl)以上。糖尿病患者血脂异常的处理原则按照ASCVD危险评估流程图(图1)进行危险分层干预管理。根据血脂异常特点,首选他汀类药物治疗,如合并高TG伴或不伴低HDL-C者,可采用他汀类与贝特类药物联合应用。
11.2高血压
高血压合并血脂异常者,调脂治疗应根据不同危险程度确定调脂目标值(图1)。调脂治疗能够使多数高血压患者获得很好的效益,特别是在减少冠心病事件方面可能更为突出[66]。因此,高血压指南建议,中等危险的高血压患者均应启动他汀治疗。新近公布的HOPE-3[119,120]研究结果提示,对于中等危险者,他汀类治疗显著降低总体人群的心血管事件;对于收缩压>143.5 mmHg的亚组人群,他汀与降压药联合应用,使心血管危险下降更为显著。
11.3代谢综合征
代谢综合征是一组以肥胖、高血糖(糖调节受损或糖尿病)、高血压以及血脂异常[高TG血症和(或)低HDL-C血症]集结发病的临床征候群,特点是机体代谢上相互关联的危险因素在同一个体的组合。这些因素直接促进ASCVD的发生,也增加2型糖尿病的发病危险。有证据表明代谢综合征患者是发生心血管疾病的高危人群。与非代谢综合征人群相比,其罹患心血管病和2型糖尿病的危险均显著增加[121]。
目前,国际上有关代谢综合征组分中的高血糖、高血压及血脂异常的判断切点已基本达成共识。但是,作为代谢综合征的核心指标-肥胖,尤其是中心型肥胖的诊断标准各不相同。基于我国人群的研究证据所制定的代谢综合征诊断标准为具备以下3项或更多项:(1)中心型肥胖和(或)腹型肥胖:腰围男性≥90 cm,女性≥85 cm;(2)高血糖:空腹血糖≥6.10 mmol/L (110 mg/dl)或糖负荷后2 h血糖≥7.80 mmol/L (140 mg/dl)及(或)已确诊为糖尿病并治疗者;(3)高血压:血压≥130/85 mmHg及(或)已确诊为高血压并治疗者;(4)空腹TG≥1.7 mmol/L (150 mg/dl);(5)空腹HDL-C<1.0 mmol/L (40 mg/dl)。
代谢综合征的主要防治目标是预防ASCVD以及2型糖尿病,对已有ASCVD者要预防心血管事件再发。积极持久的生活方式干预是达到治疗目标的重要措施。原则上应先启动生活方式治疗,如果不能达到目标,则应针对各个组份采取相应药物治疗。代谢综合征血脂代谢紊乱方面的治疗目标是LDL-C<2.6 mmol/L (100 mg/dl)、TG<1.7 mmol/L (150 mg/ dl)、HDL-C≥1.0 mmol/L (40 mg/dl)。
11.4慢性肾脏疾病(CKD)
CKD常伴随血脂代谢异常并促进ASCVD的发生。尚无临床研究对CKD患者LDL-C治疗目标进行探索。在可耐受的前提下,推荐CKD患者应接受他汀类治疗。治疗目标:轻、中度CKD者 LDL-C<2.6 mmol/L,非-HDL-C<3.4 mmol/L;重度CKD、CKD合并高血压或糖尿病者LDL-C <1.8 mmol/L,非-HDL-C<2.6 mmol/L。推荐中等强度他汀类治疗,必要时联合胆固醇吸收抑制剂。终末期肾病(end stage renal disease,ESRD)和血透患者,需仔细评估降胆固醇治疗的风险和获益,建议药物选择和LDL-C目标个体化。
CKD患者是他汀类引起肌病的高危人群,尤其是在肾功能进行性减退或肾小球滤过率(GFR)<30 ml/(min.1.732)时,并且发病风险与他汀剂量密切相关,故应避免大剂量应用。中等强度他汀治疗LDL-C不能达标时,推荐联合应用依折麦布[81]。贝特类可升高肌酐水平,中重度CKD患者与他汀联用时,可能增加肌病风险。
11.5家族性高胆固醇血症(FH)
FH属常染色体显性遗传性胆固醇代谢障碍,发生机制主要系LDL受体的功能性遗传突变,少数是由于Apo B或PCSK9的功能突变产生,新近发现LDL受体调整蛋白基因突变也是其发生的原因之一。其突出的临床特征是血清LDL-C水平明显升高和早发冠心病(心肌梗死或心绞痛)。根据显性遗传特点,FH的临床表型分为纯合子型(HoFH)和杂合子型(HeFH),按胆固醇水平甄别,HeFH的血清TC水平常>8.5 mmol/L(328 mg/dl),而HoFH的血清TC水平常>13.5 mmol/L (521 mg/dl)。如果未经治疗,HeFH患者常常在年过40岁(男)或50岁(女)罹患心血管疾病,而HoFH则多于幼童时期就发生严重心血管疾病,其青年时期心血管疾病死亡率较非FH患者增高100倍以上。
FH治疗的最终目的是降低ASCVD危险,减少致死性和致残性心血管疾病发生[116]。治疗要点首先是所有FH患者包括HoFH和HeFH患者均须采取全面的治疗性生活方式改变:饮食(减少脂肪和胆固醇摄入,全面均衡膳食)、运动和行为习惯(戒烟,减轻体重)。同时强调防治其他危险因素,如高血压和糖尿病。其次,FH患者从青少年起即应开始长期坚持他汀类治疗,可显著降低ASCVD危险。调脂治疗的目标水平与心血管疾病高危者相同。LDL受体低下的患者接受他汀类治疗后LDL-C降低25%,而无LDL受体的患者仅降低15%。事实上,FH患者常需要两种或更多种调脂药物的联合治疗。心血管疾病极高危患者,经联合调脂药物治疗,胆固醇水平仍未达到目标水平,尤其是疾病处于进展中的患者,可考虑接受脂蛋白血浆置换作为辅助治疗。
11.6卒中
对于非心原性缺血性卒中或短暂性脑缺血发作(transient ischemic attack, TIA)患者,无论是否伴有其他动脉粥样硬化证据,均推荐给予他汀类药物长期治疗,以减少卒中和心血管事件危险(I类推荐,A级证据)[63]。若患者基线LDL-C≥2.6 mmol/L(100 mg/dl),他汀类药物治疗效果证据明确;而基线LDL-C<2.6 mmol/L(100 mg/dl)时,目前尚缺乏临床证据。颅内大动脉粥样硬化性狭窄(狭窄率70%~99%)导致的缺血性卒中或TIA患者,推荐目标值为LDL-C<1.8 mmol/L(70 mg/dl) (Ⅰ类推荐,B级证据)。长期使用他汀类药物治疗总体上是安全的。有脑出血病史的非心原性缺血性卒中或TIA患者应权衡风险和获益合理使用他汀类药物。
11.7高龄老年人
≥80岁高龄老年人常患有多种慢性疾病需服用多种药物,要注意药物间的相互作用和不良反应;高龄患者大多有不同程度的肝肾功能减退,调脂药物剂量的选择需要个体化,起始剂量不宜太大,应根据治疗效果调整调脂药物剂量并严密监测肝肾功能和肌酸激酶。因尚无高龄老年患者他汀类药物治疗靶目标的随机对照研究,对高龄老年人他汀类药物治疗的靶目标不做特别推荐。现有研究表明,高龄老年高胆固醇血症合并心血管疾病或糖尿病患者可从调脂治疗中获益。
指南修订联合委员会:
国家心血管病中心国家心血管病专家委员会
中华医学会心血管病学分会
中华医学会糖尿病学分会
中华医学会内分泌学分会
中华医学会检验医学分会
指南修订工作组:
组长:诸骏仁 高润霖
主要执笔人:
赵水平 陆国平 赵 冬 李建军
成员(按拼音顺序):
陈 红 陈伟伟 陈文祥 董吁钢 高润霖
高 炜 高 妍 葛均波 韩雅玲 胡大一
霍 勇 纪立农 贾国良 贾伟平 李光伟
李建军 李向平 李小鹰 李 莹 李 勇
廖玉华 刘 静 刘梅林 陆国平 陆菊明
陆宗良 马冠生 马 虹 宁 光 宁田海
潘柏申 潘长玉 彭道泉 沈卫峰 王拥军
王增武 吴学思 武阳丰 徐成斌 鄢盛恺
严晓伟 杨晓光 叶 平 游 凯 曾定尹
曾正陪 詹思延 张 运 赵 冬 赵水平
诸骏仁 邹大进
学术秘书:陈伟伟 马丽媛
[1] 国家卫生和计划生育委员会疾病预防控制局。 中国居民营养与慢性病状况报告。 (2015年)。 北京: 人民卫生出版社, 2015.
[2] Moran A, Gu D, Zhao D, et al。 Future cardiovascular disease in china: markov model and risk factor scenario projections from the coronary heart disease policy model-china。 Circ Cardiovasc Qual Outcomes, 2010, 3: 243-252.
[3] 丁文清, 董虹孛, 米杰。 中国儿童青少年血脂异常流行现状meta分析。 中华流行病学杂志, 2015, 36: 71-77.
[4] Baigent C, Keech A, Kearney PM, et al。 Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90, 056 participants in 14 randomised trials of statins。 Lancet, 2005, 366: 1267-1278.
[5] Ren J, Grundy SM, Liu J, et al。 Long-term coronary heart disease risk associated with very-low-density lipoprotein cholesterol in Chinese: the results of a 15-Year Chinese Multi-Provincial Cohort Study (CMCS)。 Atherosclerosis, 2010, 211: 327-332.
[6] 王淼, 赵冬, 王薇, 等。 中国35~64岁人群血清甘油三酯与心血管病发病危险的关系。 中华心血管病杂志, 2008, 36: 940-943.
[7] 李莹, 陈志红, 周北凡, 等。 血脂和脂蛋白水平对我国中年人群缺血性心血管病事件的预测作用。 中华心血管病杂志, 2004, 32: 643-646.
[8] 李剑虹, 王丽敏, 米生权, 等。 2010年我国成年人血脂异常知晓率和治疗率及控制率调查。 中华预防医学杂志, 2012, 46: 687-691.
[9] 中国成人血脂异常防治指南制订联合委员会。 中国成人血脂异常防治指南。 中华心血管病杂志, 2007, 35: 1-30.
[10] Wang Y, Liu J, Wang W, et al。 Lifetime risk for cardiovascular disease in a Chinese population: the Chinese Multi-Provincial Cohort Study。 Eur J Prev Cardiol, 2015, 22: 380-388.
[11] 蒋朱明, 詹思延, 贾晓巍, 等。 制订/修订《临床诊疗指南》的基本方法及程序。 中华医学杂志, 2016, 96: 250-253.
[12] Stone NJ, Robinson JG, Lichtenstein AH, et al。 American College of Cardiology/American Heart Association Task Force on Practice G。 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines。 J Am Coll Cardiol, 2014, 63: 2889-2934.
[13] Reiner Z, Catapano AL,De Backer G, et al。 ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the Management of Dyslipedemias of the Europe Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS)。 Eur Heart J, 2011, 32: 1769-1818.
[14] 赵水平。 血脂基础。 赵水平主编 。 血脂学研修全集。 长沙: 中南大学出版社, 2014. 2-107.
[15] Ballantyne CM。 Clinical Lipidology: A Companion to Braunwald's Heart Disease。 2nd Ed。 Philadelplia: Saunders,2014.
[16] Jacobson TA, Ito MK, Maki KC, et al。 National lipid association recommendations for patient-centered management of dyslipidemia: part 1--full report。 J Clin Lipidol, 2015, 9: 129-169.
[17] 鄢盛恺。 应进一步加强血脂检验与临床的联系。 临床检验杂志, 2008, 26: 243-245.
[18] Miller M, Stone NJ, Ballantyne C, et al。 Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association. Circulation, 2011, 123: 2292-2333.
[19] Gotto AM Jr, Brinton EA。 Assessing low levels of high-density lipoprotein cholesterol as a risk factor in coronary heart disease: a working group report and update。 J Am Coll Cardiol, 2004, 43: 717-724.
[20] Luc G, Bard JM, Arveiler D, et al。 Lipoprotein(a) as a predictor of coronary heart disease: The PRIME study。 Athrosclerosis, 2002, 163: 377-384.
[21] Son JI, Chin SO, Woo JT。 Treatment guidelines for dyslipidemia: summary of the expanded second version. J Lipid Atheroscler, 2012, 1: 45-59.
[22] Teramoto T, Sasaki J, Ishibashi S, et al。 Japan Atherosclerosis Society。 Executive summary of the Japan Atherosclerosis Society (JAS) guidelines for the diagnosis and prevention of atherosclerotic cardiovascular diseases in Japan -2012 version. J Atheroscler Thromb, 2013, 20: 517-523.
[23] 赵水平。 高脂血症的临床表现及分型。 中国临床医生, 2003, 31: 23-25.
[24] Grundy SM。 An International Atherosclerosis Society Position Paper: global recommendations for the management of dyslipidemia。 J ClinLipidol, 2013, 7: 561-565.
[25] Najam O, Ray KK。 Familial hypercholesterolemia: a review of the natural history, diagnosis, and management。 Cardiol Ther, 2015, 4: 25-38.
[26] Hegele RA, Ginsberg HN, Chapman MJ, et al。 The polygenic nature of hypertriglyceridaemia: implications for definition, diagnosis, and management。 Lancet Diabetes Endocrinol, 2014, 2: 655-666.
[27] 武阳丰, 赵冬, 周北凡, 等。 中国成人血脂异常诊断和危险分层方案的研究。 中华心血管病杂志, 2007, 35: 428-433.
[28] Zhao D, Liu J, Xie W, et al。 Cardiovascular risk assessment: a global perspective。 Nature Reviews Cardiology, 2015, 12: 301-311.
[29] 王薇, 赵冬, 刘静, 等。 中国35~64岁人群胆固醇水平与10年心血管病发病危险的前瞻性研究。 中华心血管病杂志, 2006, 34: 169-173.
[30] 刘静, 赵冬, 秦兰萍, 等。 低密度脂蛋白胆固醇与心血管病发病关系的前瞻性研究。 中华心血管病杂志, 2001, 29: 561-565.
[31] Pencina MJ, D'Agostino RB Sr, Larson MG, et al。 Predicting the 30-year risk of cardiovascular disease: the framingham heart study。 Circulation, 2009, 119: 3078-3084.
[32] Grundy SM, Arai H, Barter P, et al。 An International Atherosclerosis Society Position Paper: Global recommendations for the management of dyslipidemia - Full report。 J Clin Lipidol, 2014, 8: 29-60.
[33] Jellinger PS, Smith DA, Mehta AE, et al。 American Association of Clinical Endocrinologists' Guidelines for Management of Dyslipidemia and Prevention of Atherosclerosis。 Endocrine Practice, 2012;18 Suppl 1: 1-78.
[34] Anderson TJ, Grégoire J, Hegele RA, et al。 2012 update of the Canadian Cardiovascular Society guidelines for the diagnosis and treatment of dyslipidemia for the prevention of cardiovascular disease in the adult。 Can J Cardiol, 2013 , 29: 151-167.
[35] Rabar S, Harker M, Flynn N, et al。 On behalf of the Guideline Development Group。 Lipid modification and cardiovascular risk assessment for the primary and secondary prevention of cardiovascular disease: summary of updated NICE guidance。 BMJ, 2014, 349: 1-6.
[36] Lloyd-Jones DM, Leip EP, Larson MG, et al。 Prediction of lifetime risk for cardiovascular disease by risk factor burden at 50 years of age。 Circulation, 2006, 113: 791-798.
[37] Lloyd-Jones DM, Wilson PW, Larson MG, et al。 Framingham risk score and prediction of lifetime risk for coronary heart disease。 Am J Cardiol, 2004, 94: 20-24.
[38] 胡大一。 降低密度脂蛋白胆固醇是硬道理。 中华心血管病杂志, 2015, 43: 3-4.
[39] 赵水平, 黄贤圣, 胡大一。 比较ACC/AHA与ESC/EAS血脂指南。中华心血管病杂志, 2014, 42: 898-899.
[40] 孙艺红, 胡大一。 如何理解强化剂量他汀的证据和获益。 中华心血管病杂志, 2014, 42: 899-901.
[41] Cannon CP, Blazing MA, Giugliano RP, et al。 IMPROVE-IT Investigators。 Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes。 N Engl J Med, 2015, 372: 2387-2397.
[42] Dai W, Huang XS, Zhao SP。 No evidence to support high-intensity statin in Chinese patients with coronary heart disease。 Int J Cardiol, 2016, 204: 57-58.
[43] HPS2-THRIVE Collaborative Group。 HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/ laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment。 Eur Heart J, 2013, 34: 1279-1291.
[44] Zhao SP, Wang Y, Mu Y, et al。 Prevalence of dyslipidaemia in patients treated with lipid-lowering agents in China: results of the DYSlipidemia International Study (DYSIS)。 Atherosclerosis, 2014, 235: 463-469.
[45] Zhao SP, Peng DQ, Yu BL, et al。 。 The effect of moderate-dose versus double-dose statins on patients with acute coronary syndrome in China: results of the CHILLAS trial。 Atherosclerosis, 2014, 233: 707-712.
[46] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会。 正确认识合理使用调脂药物。 中华心血管病杂志, 2001, 29: 705-706.
[47] Scandinavian Simvastatin Survival Study Group。 Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S)。 Lancet, 1994, 344: 1383-1389.
[48] Sacks FM, Pfeffer MA, Moye LA, et al。 The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels。 Cholesterol and Recurrent Events Trial investigators。 N Engl J Med, 1996, 335: 1001-1009.
[49] The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group。 Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels。 N Engl J Med, 1998, 339: 1349-1357.
[50] Serruys PW, de Feyter P, Macaya C, et al。 Fluvastatin for prevention of cardiac events following successful first percutaneous coronary intervention: a randomized controlled trial。 JAMA, 2002, 287: 3215-3222.
[51] Heart Protection Study Collaborative Group。 MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: a randomised placebo-controlled trial。 Lancet, 2002, 360: 7-22.
[52] Cannon CP, Braunwald E, McCabe CH, et al。 Intensive versus moderate lipid lowering with statins after acute coronary syndromes。 N Engl J Med, 2004, 350: 1495-1504.
[53] de Lemos JA, Blazing MA, Wiviott SD, et al。 Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial。 JAMA, 2004, 292: 1307-1316.
[54] LaRosa JC, Grundy SM, Waters DD, et al。 Intensive lipid lowering with atorvastatin in patients with stable coronary disease。 N Engl J Med, 2005, 352: 1425-1435.
[55] Schwartz GG, Olsson AG, Ezekowitz MD, et al。 Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial。 JAMA, 2001, 285: 1711-1718.
[56] Pedersen TR, Faergeman O, Kastelein JJ, et al。 High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial。 JAMA, 2005, 294: 2437-2445.
[57] Cholesterol Treatment Trialists (CTT) Collaboration. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170000 participants in 26 randomised trials。 Lancet, 2010, 376: 1670-1681.
[58] Nissen SE, Nicholls SJ, Sipahi I, et al。 Effect of very high-intensitystatin therapy on regression of coronary atherosclerosis: the ASTEROID trial。 JAMA, 2006, 295: 1556-1565.
[59] Shepherd J, Cobbe SM, Ford I, et al。 Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia。 West of Scotland Coronary Prevention Study Group。 N Engl J Med, 1995, 333: 1301-1307.
[60] Downs JR, Clearfield M, Weis S, et al。 Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS。 Air Force/Texas Coronary Atherosclerosis Prevention Study。 JAMA, 1998, 279: 1615-1622.
[61] Colhoun HM, Betteridge DJ, Durrington PN, et al。 Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo controlled trial。 Lancet, 2004, 364: 685-696.
[62] Ridker PM, Danielson E, Fonseca FA, et al。 Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med, 2008, 359: 2195-2207.
[63] Amarenco P, Bogousslavsky J, Callaham A 3rd, et al。 High-dose atorvastatin after stroke or transient ischemic attack。 N Engl J Med, 2006, 355: 549-559.
[64] Shepherd J, Blauw GJ, Murphy MB, et al。 Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial。 Lancet, 2002, 360: 1623-1630.
[65] The ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group。 Major outcomes in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin vs usual care: the Antihypertensive and Lipd-lowering treatment to prevent heart attack trial (ALLHAT-LLT)。 JAMA, 2002, 288: 2998-3007.
[66] Sever PS, Dahlof B, Poulter NR, et al。 Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial -Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial。 Lancet, 2003, 361: 1149-1158.
[67] 陈红, 任景怡, 武蓓, 等。 停用辛伐他汀对冠心病及冠心病危险因素患者血管内皮功能的影响。 中华心血管病杂志, 2007, 35: 531-535.
[68] Li JJ, Yang P, Liu J, et al。 Impact of 10 mg rosuvastatin daily or alternate-day on lipid profile and inflammatory markers。 Clin Chim Acta, 2012, 413: 139-142.
[69] Mihaylove B, Emberson J, Blackwell L, et al。 The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials。 Lancet, 2012, 380: 581-590.
[70] 血脂康调整血脂对冠心病二级预防研究协作组。 中国冠心病二级预防研究。 中华心血管病杂志, 2005, 33: 109-115.
[71] Lu ZL, Kou WR, Du BM, et al。 Effect of Xuezhikang, an extract from red yeast Chinese rice, on coronary events in a Chinese population with previous myocardial infarction. Am J Cardiol, 2008, 101: 1689-1693.
[72] Li JJ, Lu ZL, Kou WR, et al。 Impact of Xuezhikang on coronary events in hypertensive patients with previous myocardial infarction from the China Coronary Secondary Prevention Study (CCSPS)。 Ann Med, 2010, 42;231-240.
[73] Zhao SP, Liu L, Cheng YC, et al。 Xuezhikang, an extract of cholestin, protects endothelial function through antiinflammatory and lipidlowering mechanisms in patients with coronary heart disease。 Circulation, 2004, 110: 915-920.
[74] McKenney JM, Davidson MH, Jacobson TA, et al。 Final Conclusions and Recommendations of the National Lipid Association Statin Safety Assessment Task Force。 Am J Cardiol, 2006, 97: 89C-94C。
[75] Bays H, Cohen DE, Chalasani N, et al。 An assessment by the Statin Liver Safety Task Force: 2014 update。 J Clin Lipidol, 2014, 8: S47-S57.
[76] Rosenson RS, Baker SK, Jacobson TA, et al。 An assessment by the Statin Muscle Safety Task Force: 2014 update。 J Clin Lipidol, 2014, 8: S58-S71.
[77] Stroes ES, Thompson PD, Corsini A, et al。 Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management。 Eur Heart J, 2015, 36: 1012-1022.
[78] Maki KC, Ridker PM, Brown WV, et al。 An assessment by the Statin Diabetes Safety Task Force: 2014 update。 J Clin Lipidol, 2014, 8: S17-S29.
[79] Rojas-Fernandez CH, Goldstein LB, Levey AI, et al。 An assessment by the Statin Cognitive Safety Task Force: 2014 update。 J Clin Lipidol, 2014, 8: S5-S16.
[80] Geng Q, Ren JY, Song JX, et al。 Meta-analysis of the effect of statins on renal function. Am J Cardiol, 2014, 114: 562-570.
[81] Sharp Collaborative Group。 Study of Heart and Renal Protection (SHARP): randomized trial to assess the effects of lowering lowdensity lipoprotein cholesterol among 9, 438 patients with chronic kidney disease。 Am Heart J, 2010, 160: 785-794.
[82] Yamashita S, Hbujo H, Arai H, et al。 Long-term probucol treatment prevents secondary cardiovascular events: a cohort study of patients with heterozygous familial hypercholesterolemia in Japan. J Atheroscler Thromb, 2008, 15: 292-303.
[83] Yamashitaa S, Matsuzawab Y。 Where are we with probucol: a new life for an old drug。 Atherosclerosis, 2009, 207: 16-23.
[84] Knapp HH, Schrott H, Ma P, et al。 Efficacy and safety of combination simvastatin and colesevelam in patients with primary hypercholesterolemia。 Am J Med, 2001, 110: 352-360.
[85] Xu DY, Shu j. Huang QY, et al。 Evaluation of the lipid lowering ability, anti-inflammatory effects and clinical safety of intensive therapy with Zhibitai, a Chinese traditional medicine。 Atherosclerosis, 2010, 211: 237-241.
[86] 许丹焰, 舒君, 黄全跃, 等。 脂必泰与阿托伐他汀疗效及安全性对比研究。 中华内科杂志, 2010, 49: 392-395.
[87] 刘顺, 谭茗月, 赵水平, 等。 多廿烷醇对高脂血症患者血脂谱和血红素氧合镁1的作用。 中华心血管病杂志, 2012, 40: 840-843.
[88] 多廿烷醇临床应用专家共识组。 新型调脂植物药-多廿烷醇临床应用专家共识。 中华内科杂志, 2008, 47: 961-963.
[89] Rubins HB, Robins SJ, Collins D, et al。 Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of highdensity lipoprotein cholesterol。 N Engl J Med, 1999, 341: 410-418.
[90] Keech A, Simes RJ, Barter P, et al。 Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial。 Lancet, 2005, 366: 1849-1861.
[91] Ginsberg HN, Elam MB, Lovato LC, et al。 Effects of combination lipid therapy in type 2 diabetes mellitus。 N Engl J Med, 2010, 362: 1563-1574.
[92] Jun M, Foote C, Lv J, et al。 Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis。 Lancet, 2010, 375: 1875-1884.
[93] 诸骏仁, 叶平, 寇文镕, 等。 微粒化非诺贝特治疗血脂异常的疗效与耐受性研究。 中华心血管病杂志, 2002, 30: 152-155.
[94] Lavigne PM, Karas Rh. The current state of niacin in cardiovascular disease prevention: a systematic review and meta-regression. J Am Coll Cardiol, 2013, 61: 440-446.
[95] Boden WE, Probstfield JL, Anderson T, et al。 Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy。 N Engl J Med, 2011, 365: 2255-2267.
[96] Landray MJ, Haynes R, Hopewell JC, et al。 Effects of extended-release niacin with laropiprant in high-risk patients。 N Engl J Med, 2014, 371: 203-212.
[97] Leaf A, Weber PC。 Cardiovascular effects of n-3 fatty acids。 N Engl J Med, 1988, 318: 549-557.
[98] Harris WS。 n-3 fatty acids and serum lipoproteins: human studies。 Am J Clin Nurr, 1997, 65: 1645S-1654S。
[99] Harris WS。 n-3 fatty acids and lipoproteins: comparison of results from human and animal studies。 Lipids, 1996, 31: 243-252.
[100] GISSI-Preventione Investigators。 Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevention trial, Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico。 Lancet, 1999, 354: 447-455.
[101] Kromhout D, Giltay EJ, Geleijnse JM, et al。 n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med, 2010, 363: 2015-2026.
[102] Risk and Prevention Study Collaborative Group。 n-3 fatty acids in patients with multiple cardiovascular risk factors。 N Engl J Med, 2013, 368: 1800-1808.
[103] Cuchel M, Meagher EA, du TTH, et al。 Efficacy and safety of a microsomal triglyceride transfer protein inhibitor in patients with homozygous familial hypercholesterolaemia: a single-arm, open-label, phase 3 study。 Lancet, 2013, 381: 40-46.
[104] Rader DJ, Kastelein Jj. Lomitapide and mipomersen: two first-inclass drugs for reducing low-density lipoprotein cholesterol in patients with homozygous familial hypercholesterolemia。 Circulation, 2014, 129: 1022-1032.
[105] Raal FJ, Santos RD, Blom DJ, et al。 Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial。 Lancet, 2010, 375: 998-1006.
[106] Stein EA, Mellis S, Yancopoulos GD, et al。 Effect of a monoclonal antibody to PCSK9 on LDL cholesterol。 N Engl J Med, 2012, 366: 1108-1118.
[107] Sabatine MS, Giugliano RP, Wiviott SD, et al。 Efficacy and safety of evolocumab in reducing lipids and cardiovascular events。 N Engl J Med, 2015, 372: 1500-1509. ,
[108] Robinson JG, Farnier M, Krempf M, et al。 Efficacy and safety of alirocumab in reducing lipids and cardiovascular events。 N Engl J Med, 2015, 372: 1489-1499.
[109] Ballantyne CM, Weiss R, Moccetti T, et al。 Efficacy and safety of rosuvastatin 40 mg alone or in combination with ezetimibe in patients at high risk of cardiovascular disease (results from the EXPLORER study)。 Am J Cardiol, 2007, 99: 673-680.
[110] Mikhailidis DP, Sibbring GC, Ballantyne CM, et al。 Meta-analysis of the cholesterol-lowering effect of ezetimibe added to ongoing statin therapy。 Curt Med Res Opin, 2007, 232009-2026.
[111] Ballantyne CM, Houri J, Notarbartolo A, et al。 Effect of ezetimibe coadministered with atorvastatin in 628 patients with primary hypercholesterolemia: a prospective, randomized, double-blind trial。 Circulation, 2003, 107: 2409-2415.
[112] Davidson MH, McGarry T, Bettis R, et al。 Ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia。 J Am Coll Cardiol, 2002, 40: 2125-2134.
[113] Melani L, Mills R, Hassman D, et al。 Efficacy and safety of ezetimibe coadministered with pravastatin in patients with primary hypercholesterolemia: a prospective, randomized, double-blind trial。 Eur Heart J, 2003, 24: 717-728.
[114] Jones PH, Davidson MH, Goldberg AC, et al。 Efficacy and safety of fenofibric acid in combination with a statin in patients with mixed dyslipidemia: Pooled analysis of three phase 3, 12-week randomized, controlled studies。 J Clin Lipidol, 2009, 3: 125-137.
[115] 任景怡, 陈红, 罗宇。 联合应用辛伐他汀和非诺贝特治疗混合性高脂血症的疗效及安全性观察。 中华心血管病杂志, 2005, 33: 122-126.
[116] Cuchel M, Bruckert E, Ginsberg HN, et al。 Homozygous familial hypercholesterolaemia: new insights and guidance for clinicians to improve detection and clinical management。 A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society。 Eur Heart J, 2014, 35: 2146-2157.
[117] American Diabetes Association. Dyslipidemia management in adults with diabetes。 Position statement & ADA statement。 Diabetes Care, 2004, 27(suppl): S68-71.
[118] 中华医学会糖尿病学分会。 中国2型糖尿病防治指南(2013版)。中华糖尿病杂志, 2014, 6: 447-498.
[119] Yusuf S, Bosch J, Dagenais G, et al。 Cholesterol Lowering in Intermediate-Risk Persons without Cardiovascular Disease。 New Engl J Med, 2016, 374: 2021-2031.
[120] Yusuf S, Lonn E, Pais P, et al。 Blood-Pressure and Cholesterol Lowering in Persons without Cardiovascular Disease。 N Engl J Med, 2016, 374: 2032-2043.
[121] Grundy SM, Cleeman JI, Daniels SR, et al。 Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement。 Circulation, 2005, 112: 2735-2752.
2016-08-03)
(编辑: 宁田海)
诸骏仁 Email:jrzhu@zshospital.com 高润霖 Email:gaorunlin@citmd.com
R54
C
1000-3614(2016)10-0937-17
10.3969/j.issn.1000-3614.2016.10.001
