体外震波对人脐静脉内皮细胞增殖、细胞周期及细胞间黏附因子-1表达的影响
2016-12-26马一铭李丽蔡红雁胡钊郭涛
马一铭,李丽,蔡红雁,胡钊,郭涛
基础与实验研究
体外震波对人脐静脉内皮细胞增殖、细胞周期及细胞间黏附因子-1表达的影响
马一铭,李丽,蔡红雁,胡钊,郭涛
目的:观察体外震波治疗对人脐静脉内皮细胞(HUVECs)增殖、细胞周期及细胞间黏附因子-1(ICAM-1)表达的影响。
方法:将体外培养的人脐静脉内皮细胞分组,实验部分分别给予0.03、0.09、0.18、0.24 mJ/mm2能量震波500击处理(分别设定为0.03、0.09、0.18、0.24 mJ/mm2能量组),对照组不给予震波处理。细胞计数试剂盒(CCK)比色法检测细胞增殖情况,流式细胞术检测细胞周期,实时定量聚合酶链反应(PCR)及蛋白质印迹方法(Westen blot)分别检测低能量震波处理后ICAM-1信使核糖核酸( mRNA) 和蛋白的表达水平。
结果:CCK 比色法检测结果显示:只有0.09 mJ /mm2能量组与对照组比能促进HUVECs增殖,且差异有统计学意义(P<0.05),而其他能量组与对照组比,差异均无统计学意义(P>0.05)。不同能量组与对照组比较,0.09 mJ/mm2能量组G0/G1期细胞比例明显减少(P<0.05),S期和G2/M期细胞比例明显增加(P<0.05),0.03 mJ/mm2能量组仅增加G2/M期细胞比例(P<0.05),而其他能量组与对照组比差异均无统计学意义(P>0.05)。实时定量PCR检测显示:0.09 mJ/mm2能量组ICAM-1 mRNA表达均较对照组明显增高(9.27±0.95 vs 1.02±0.27,P<0.001),0.03 mJ/mm2能量组ICAM-1 mRNA表达均较对照组亦增高(7.08±0.60 vs 1.02±0.27,P<0.01)。Westen blot检测显示:0.09 mJ/mm2能量组ICAM-1蛋白表达较对照组明显增高,差异有统计学意义(P<0.05)。
结论:体外震波治疗,特别是0.09 mJ/mm2能量的体外震波能加速HUVECs细胞周期由G0期/G1期向S期和G2/M期的转换,促进细胞增殖,并且提高ICAM-1的表达,这在体外震波促进血管新生机制中起重要作用。
体外震波治疗;脐静脉;内皮细胞;细胞周期
(Chinese Circulation Journal, 2016,31:1013.)
体外震波作为物理疗法,已成功运用于泌尿系结石、胆道结石、骨骼肌肉系统疾病、肩周炎、糖尿病足等多年,近年来发现体外震波能促进血管新生用于冠心病治疗,改善心肌缺血。目前国内外已在细胞水平、动物实验、临床水平证实了其促血管新生的确切疗效,且有效能量级别为0.09 mJ /mm2(相当于体外震波碎石能量的1/10)[1-4],但其显效机制目前尚不明确。血管内皮细胞是血管形成的基础,在血管形成的过程中起最重要作用[5-7],可以说内皮细胞增殖是血管形成的先决条件,促进血管内皮细胞的增殖能提高血管新生。但血管新生过程复杂,还需要多种细胞因子的参与,细胞间粘附因子-1(ICAM-1)可在增生的内皮细胞高度表达,介导细胞与细胞间或细胞与基质间相互接触和结合从而加速血管新生[8]。体外震波能否促进血管内皮细胞增殖和ICAM-1的表达进而促进血管新生,值得我们进一步研究,故本实验从细胞水平探讨体外震波促进血管新生的有效能量,观察其对人脐静脉内皮细胞(HUVECs)细胞增殖、细胞周期及ICAM-1表达的影响,探讨低能量体外震波促血管新生的可能机制,进一步寻找体外震波促血管新生的理论依据。
1 材料与方法
1.1材料
胎牛血清白蛋白(美国Hyclone公司), HUVECs(中国科学院昆明动物研究所),DMEM培养基(美国Hyclone 公司),0.25% 胰蛋白酶(美国Gibco公司),青链霉素(美国Sigma公司),细胞计数试剂盒(CCK,日本Dojindo公司),细胞周期检测试剂盒(美国Beckmam Coulter公司),二喹林甲酸(BCA)蛋白浓度测定试剂盒(杭州碧云天公司),鼠抗人ICAM-1多克隆抗体(美国Santa Cruz公司),山羊抗鼠HRP标记IgG抗体(美国Santa Cruz公司),核糖核酸(RNA)抽提试剂盒(德国Qiagen公司), cDNA合成试剂(德国Promege公司),聚合酶链反应(PCR)定量反应试剂盒(德国Qiagen公司),引物(上海生物工程公司),10XLoading Buffer(DNA)(日本TaKaRa公司),ELX800酶标仪(美国Chernicon公司),SDS-PAGE凝胶电泳、转膜装置(美国Bio-Rad公司),PCR扩增仪(7300型,美国ABI公司),流式细胞仪(美国Becman Coulter公司)。
1.2细胞培养
将购于中国科学院昆明动物研究所的HUVECs培养于含10%胎牛血清的DMEM培养基中,置于37℃,5%CO2孵箱培养3 d,用磷酸缓冲盐溶液(PBS,浓度0.01 mol/L,pH=7.4,含NaCl、Na2HPO4、KCl、KH2PO4) 洗掉非贴壁细胞,按1:3的比例传代。
1.3HUVECs分组与震波处理
将培养至对数生长期细胞用0.25%的胰蛋白酶消化,用10%胎牛血清的DMEM培养基制成细胞悬液,调节细胞浓度为1X105/ml,分别置于5支2 ml试管中,培养24 h,使细胞同步化并随机分组处理。采用瑞士STORZMEDICAL公司生产的震波仪(MODULITHSLC)进行震波处理,实验部分分别给予0.03、0.09、0.18、0.24 mJ/ mm2能量震波500击处理(分别设定为0.03、0.09、0.18、0.24 mJ/mm2能量组),对照组置于震波仪器中但不进行震波处理,继续培养细胞24 h,进行后续检测。
1.4CCK检测HUVECs增殖情况
各组细胞悬液加入96孔板中( 100 μl/孔),再向每孔加入10 μl的CCK溶液,将培养板在(37℃, 5%CO2) 培养箱内孵育4 h,用酶标仪测定在波长450 nm 处的吸光度值(A450),用吸光度值表示细胞增殖能力[9]。
1.5 流式细胞仪术检测HUVECs细胞周期的分布情况
将各细胞悬液收集于15 ml试管中,以626 g离心5 min,加少量DMEM培养液,计数,各组细胞量约1X105,收集沉淀重悬于200 μl的PBS中,再次离心收集沉淀,75%冰冻乙醇4℃固定细胞,离心弃固定液,再加PBS离心洗涤1次,沉淀重悬于200~500 μl的PBS,加入RnaseA 37℃水浴l h,加入碘化丙啶(PI)染色,终浓度50 ng/ml,4℃避光30 min,过300目筛网流式细胞仪检测细胞周期[10]。
1.6 蛋白质印迹方法(Westen blot)检测
提取震波后各组细胞总蛋白,用BCA法[11]测定总蛋白浓度。取20 μg蛋白样品上样,聚丙稀铣胺凝胶电泳(SDSPAGE),电转移90 min至聚偏二氟乙烯膜(PVDF)上,5%脱脂奶粉封闭2 h后与ICAM-1(1:6 000)一抗4 ℃孵育过夜。与山羊抗鼠辣根过氧化物酶(HRP)标记IgG抗体(1:10 000)二抗室温孵育1 h后,再与化学发光试剂(ECL)室温作用3 min,后曝光、显影和定影。
1.7 实时定量PCR法检测
提取并纯化震波后各组HUVECs细胞RNA,按照MBI公司逆转录试剂盒操作明合成cDNA,利用primer premier 5.0 软件设计引物,引物(上海生物工程公司合成):ICAM-1 (正义链) 5'-tccagacatgaccgctgagt-3',(反义链) 5'-ctcattggccaacctgcctt-3',扩增片段长度为210 bp; GAPDH( 正义链) 5'-caaggtcatccatgacaactttg-3',(反义链) 5'-gtccaccaccctgttgctgtag-3',扩增片段长度为496 bp,设定反应条件进行PCR反应。琼脂糖凝胶电泳,凝胶成像、扫描,紫外灯下观察结果并拍照记录。用GAPDH 基因为内参基因,ICAM-1样品目的基因的相对表达率(RQ) 参照文献[12]方法采用2-ΔΔCt法计算,公式如下:RQ = 2-ΔΔCt;ΔΔCt =待测样本目的基因ΔCt-对照组目的基因ΔCt;ΔCt =目的基因Ct-内参基因Ct。
1.8 统计学处理
应用SPSS 17.0 统计软件进行数据分析。实验数据以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 体外震波治疗对HUMVCs增殖的影响(图1)
不同能量组与对照组比较,0.09 mJ /mm2能量组增殖能力较对照组升高(吸光度值升高),且差异有统计学意义(P<0.05);而0.03、0.18、0.24 mJ /mm2能量组的增殖能力( 0.60 ± 0.06、0.62 ± 0.06、0.58 ±0.04) 与对照组相比差异无统计学意义(P>0.05)。

图1 不同震波能量级别对HUVECs增殖的影响
2.2 体外震波治疗对HUMVCs细胞周期分布的影响(表1)
0.09 mJ/mm2能量组与对照组相比,G0 /G1期细胞比例降低[(53.16±5.89)% vs (71.30±4.95)%, P<0.05],S期及G2/M期细胞比例明显升高[(39.05±5.25)% vs (25.01±5.39)%、(8.21 ±1.44)% vs (4.03±0.73)%],且差异有统计学意义(P<0.05)。0.03 mJ/mm2能量组仅G2/M期细胞比例高于对照组[(5.69±0.93)% vs (4.03±0.73)%, P<0.05]。其余各组细胞周期比例较对照组均无统计学意义(P>0.05)。
表1 各组HUVECs的细胞周期分布比例(n= 6,)

表1 各组HUVECs的细胞周期分布比例(n= 6,)
注: HUVECs:人脐静脉内皮细胞。与对照组相比*P<0.05
?
2.3 实时定量PCR检测ICAM-1 mRNA的表达(图2)
琼脂糖凝胶电泳显示,ICAM-1 PCR反应所得的产物条带均与预期扩增产物的长度一致,无明显杂带,扩增曲线以"S"型为扩增成功。与对 照 组 相 比,0.09 mJ/mm2能 量 组HUVECs ICAM-1mRNA的表达明显增加[(9.27±0.95) vs (1.02±0.27),P<0.001];0.03 mJ/mm2能 量组亦能增加ICAM-1 mRNA的表达(7.08±0.60 vs 1.02±0.27,P<0.01),但不如0.09 mJ/mm2能量组明显。

图2 体外震波对HUVECs ICAM-1 mRNA表达的影响
2.4 Western blot检测ICAM-1蛋白的变化(图3)
与 对 照 组 相 比,0.09 mJ/mm2能 量 组 处理HUVECs时ICAM-1蛋 白 表 达 明 显 增 加[(132.32±14.43) vs (100.00±0.00),P<0.05], 其余能量组与对照组比较差异无统计学意义。
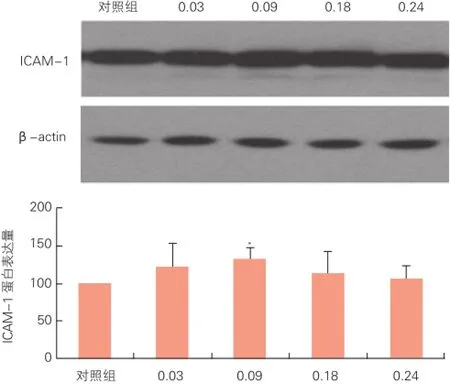
图3 体外震波对HUVECs ICAM-1蛋白表达的影响
3 讨论
目前,冠心病已经成为人类疾病死亡的主要原因,严重危害人类健康,当心肌发生缺血、坏死时,机体可代偿性的促进内皮细胞增殖、迁移,从而促进梗死周围区侧枝循环的建立,但这种微循环的重建代偿不足以满足机体改善心肌供血的需要[13]。寻找新的无创方法通过人为因素来促进缺血区血管新生,从而改善缺血组织的血液供应,已经成为近年来心血管疾病治疗研究的热点方向。近年来发现体外震波作为一种新型的血管再生疗法,通过低能量脉冲波对心肌及血管内皮细胞产生剪切力和空穴效应,能够刺激新生血管形成,提高局部心肌血流和毛细血管密度[1,2]。体外震波能够增加缺血心肌供血,减轻冠心病患者心绞痛症状,减少硝酸酯类用量,改善心功能,期间未发现明显不良反应,初步证实其安全有效[3,14],但其具体机制仍然不清楚,仍需我们不断研究。
本研究采用能够近似反映人类血管内皮细胞真实情况的HUVECs进行实验,结果发现0.09 mJ / mm2500击低能量震波能加速HUVECs细胞周期由G0/G1期向G2/M期和S期的转换,增加S期及G2/ M期细胞数,从而促进细胞增殖。0.09 mJ /mm2能量被认为最佳能量,这与国外报道类似[1,2,14],但对血管内皮细胞增殖、细胞周期的影响至今少见报道。而内皮细胞增殖同迁移、成熟和毛细血管形成一样,是血管新生中极为重要的一环[15],因此认为体外震波可以通过诱导内皮细胞增殖来促进血管新生。
研究发现人为地增加心肌局部细胞生长因子的浓度,对缓解以致解除心肌缺血有潜在的可行性[16]。血管内皮生长因子( VEGF) 是促血管生成的重要调节因子,低能量体外震波能促进受损心肌组织高表达VEGF、内皮型一氧化氮合酶(eNOS)等血管相关细胞因子,参与促进缺血心肌组织新生毛细血管的形成和侧枝循环的建立[1,17,18]。研究还发现体外震波能促进具有分化成血管内皮细胞的间充质细胞(MSCs)的增殖、分化和旁分泌活动,参与血管新生[19-21]。ICAM-1属于黏附因子中免疫球蛋白超家族(IGSF)中的成员,是介导黏附反应重要的一个黏附因子,ICAM-1广泛分布于内皮细胞、单核细胞、中性粒细胞表面,内皮细胞上的细胞间黏附因子介导细胞与细胞间或细胞与基质间相互接触和结合,从而参与细胞的信号转导与活化、细胞组织生长及分化、免疫反应、炎症反应、血管生成及肿瘤转移等生理病理过程。
血管形成是一个复杂的过程,血管生成过程中需要血管内皮细胞与细胞外基质间、血管内皮细胞相互间及血管内皮细胞与其他周围细胞间的相互作用,这种作用是黏附因子完成的,研究证明ICAM-1通过影响机体免疫抑制活性,有助于异位组织逃避机体免疫系统,促进异位组织侵入后的血管生成[22]。亦有研究发现ICAM-1介导白细胞与血管内皮细胞的黏附,促发炎性反应,一方面聚集的白细胞释放大量炎性介质和化学物质,可引起血管内皮损伤,另一方面也可以促进缺血组织炎症血管新生[23],炎症反应对缺血组织的这种双重作用以哪种为主与缺血的程度和时间相关。我们的研究结果显示,体外震波处理HUVECs在0.03~0.09 mJ/mm2能量时促进ICAM-1mRNA的表达,而Western blot检测发现只有0.09 mJ/mm2能量时才表达ICAM-1蛋白,出现这样的结果可能与较低的能量使细胞出现的炎症反应低,只出现基因水平的变化,而适宜的能量不仅出现基因水平的变化,而且出现蛋白质水平的变化,认为体外震波促进ICAM-1的表达在促进血管新生中起到重要作用,此时作为炎性因子正面作用更大。
本实验结果显示,体外震波能够促进血管内皮细胞增殖,提高黏附因子ICAM-1的表达而参与血管新生,且0.09 mJ/mm2为最佳能量。但本实验仅检测了具有代表性的黏附因子ICAM-1,震波作用后与血管新生相关的其他细胞因子、酶、基因等也有待进一步研究。
[1] Nishida T, Shimokawa H, Oi K, et al。 Extracorporeal cardiac shock wave therapy markedly ameliorates ischemia induced-myocardial dysfunction in pigs in vivo。 Circulation, 2004, 110: 3055-3061.
[2] Uwatoku T, Ito K, Abe K, et a1. Extracorporeal cardiac shock wave therapy proves left ventficular remodeling after acute myocardial infarction in pigs。 Coron Artery Dis, 2007, 18: 397-404.
[3] Kikuchi Y, Ito K, Ito Y, et al。 Double-blind and placebo-controlled study of the effectiveness and safety of extracorporeal cardiac shock wave therapy for severe angina pectoris。 Circ J, 2010, 74: 589-591.
[4] 周超, 王静, 庞玺倬, 等。 体外心脏震波治疗冠心病新进展。 中国循环杂志, 2015, 30: 287-289.
[5] Folkman J, Shing Y。 Angiogenesis。 J Biol Chem, 1992, 267: 10931-10934.
[6] Dimmeler S, Zeiher AM。 Endothelial cell apoptosis in angiogenesis and vessel regression. Circulation Res, 2000, 87: 434-439.
[7] Lorier G, Tourino C, Kalil RA。 Coronary angiogenesis as an endogenous response to myocardial ischemia in adults。 Arq Bras Cardiol, 2011, 97: e140-e148.
[8] Hoefer IE, van Royen N, Rectenwald JE, et al。 Arteriogenesis proceeds via ICAM-1/Mac-1- mediated mechanisms。 Circ Res, 2004, 94: 1179-1185.
[9] Lei H, Weihua C, Jichao Y, et al。 Sodium valproate inhibits proliferation in rat neural stem cells through p21 pathway。 J Third Military Medical University, 2013, 6: 487-490.
[10] 魏子寒, 王颖, 杨国杰, 等。 磷酸肌酸钠对血管紧张素Ⅱ诱导的乳鼠心肌成纤维细胞增殖和胶原合成的影响及机制研究。 中国循环杂志, 2014, 29: 738-742.
[11] 曹娜, 葛力萁, 程明月, 等。 阿托伐他汀通过SIRT1/NADPH 氧化酶对抗高糖诱导的人脐静脉内皮细胞的氧化损伤作用。 中国循环杂志, 2014, 29: 1000-1004.
[12] Livak KJ, Schmittgen TD。 Analysis of relative gene expression data using real-time quantitative PCR and the 2( -Delta Delta C( T) ) Method。 Methods, 2001, 25: 402-408.
[13] 史彤彤, 程明月, 张超群, 等。 白藜三醇对人脐静脉内皮细胞血管生成的影响及其可能机制。 中国循环杂志, 2014, 29: 643-646.
[14] Fukumoto Y, Ito A, Uwatoku T, et al。 Extracorporeal cardiac shock wave therapy ameliorates myocardial ischemia in patients with severe coronary artery disease。 Coron Artery Dis, 2006, 17: 63-70.
[15] Carmeliet P, Jain RK。 Angiogenesis in cancer and other diseases。 Nature, 2000, 407: 249-257.
[16] 马洁, 周召锋, 徐晤, 等。 白藜芦醇对兔心肌梗死后血管新生的诱导作用。 中国循环杂志, 2011, 26: 141-144.
[17] Ito K, Fukumoto Y, Shimokawa K。 Extracorporeal shock wave therapy for ischemic cardiovascular disorders。 Am J Cardiovasc Drugs, 2011, 11: 295-302.
[18] Mariotto S, Cavalieri E, Amelio E, et al。 Extracorporeal shock waves: from lithotripsy to anti-inflammatory action by NO production. Nitric Oxide, 2005, 12: 89-96.
[19] Suhr F, Delhasse Y, Bungartz G, et al。 Cell biological effects of mechanical stimulations generated by focused extracorporeal shock wave applications on cultured human bone marrow stromal cells。 Stem Cell Res, 2013, 11: 951-964.
[20] Zhao Y, Wang J, Wang M, et al。 Activation of bone marrow-derived mesenchymal stromal cells-a new mechanism of defocused low-energy shock wave in regenerative medicine。 Cytotherapy, 2013, 15: 1449-1457.
[21] 王静, 周超, 郭涛。 心脏震波联合干细胞治疗在心血管领域的运用展望。 中国循环杂志, 2015, 30: 602-604.
[22] Griffioen AW。 Anti-angiogenesis: making the tumor vulnerable to the immune system。 Cancer Immunol Immunother, 2008, 57: 1553-1558.
[23] 宋宜慧, 黄熙。 细胞间黏附分子-1与血管生成的研究进展。 免疫学杂志, 2012, 23: 530-533.
Effect of Extracorporeal Shock Wave on Proliferation, Cell Cycle and Intercellular Adhesion Molecule-1 Expression in Human Umbilical Vein Endothelial Cells
MA Yi-ming, LI Li, CAI Hong-yan, HU Zhao, GUO Tao。
Department of Cardiology, First Affiliated Hospital of Kunming Medical University, Kunming (650000), Yunnan, China Corresponding Author: CAI Hong-yan, Email: hyflykm@sina.com。
Objective: To observe the effect of extracorporeal shock wave therapy (ESWT) on proliferation, cell cycle and intercellular adhesion molecule-1 (ICAM-1) expression in human umbilical vein endothelial cells (HUVECs)。Methods: HUVECs were cultured in vitro at the concentration of (1X105/ml) and the cells were divided into 2 sets of groups: CSWT group, the cells were treated by different energy of (0.03, 0.09, 0.18, 0.24) mJ/mm2respectively and corresponding Control group, in which the cells had no CSWT。 HUVEC proliferation was detected by CCK colorimetric method, cell cycle was measured by flow cytometry, mRNA and protein expressions of ICAM-1 were examined by RT-PCR and Western blot analysis respectively。Results: Compared with Control group, (0.09 mJ/mm2) CSWT group had promoted HUVECs proliferation, P<0.05 and the other CSWT groups were similar to corresponding Control groups, P>0.05; (0.09 mJ/mm2) CSWT group showed decreasedproportion of G0/G1 stage and increased S and G2/M stages, all P<0.05; while (0.03 mJ/mm2) CSWT group only increased the proportion of G2/M stage, P<0.05 and the other CSWT groups were similar to corresponding Control group, P>0.05. Compared with Control group, (0.09 mJ/mm2) and (0.03mJ/mm2) CSWT groups showed increased mRNA expression of ICAM-1 (9.27±0.95) vs (1.02±0.27), P<0.001 and (7.08±0.60) vs (1.02±0.27), P<0.01; (0.09 mJ /mm2) CSWT group had elevated protein expression of ICAM-1, P<0.05.Conclusion: ESWT especially at (0.09 mJ/mm2) may accelerate cell cycle transition from G0/G1 stage to S and G2/M stages, promote HUVECs proliferation and increase ICAM-1 expression which may play important roles in ESWT facilitated angiogenesis in vitro。
Extracorporeal shock wave therapy; Human umbilical vein; Endothelial cells; Cell cycle;
2016-01-24)
(编辑:王宝茹)
国家自然科学基金项目(81260027);云南省卫生厅科技计划项目(2012WS005);云南省科技计划项目(2014FZ023);云南省科技厅-昆明医科大学联合专项基金(2013FB128)
650000 云南省昆明市,昆明医科大学第一附属医院 心内科
马一铭 硕士研究生 主要从事冠心病介入治疗研究 Email:mymkm@sina.com 通讯作者:蔡红雁 Email:hyflykm@sina.com
R54
A
1000-3614(2016)10-1013-05
10.3969/j.issn.1000-3614.2016.10.016
