黄硝巴布剂中红花与大黄提取工艺研究
2016-12-24曾明辉邱建平余继英居国华
曾明辉,何 林,邱建平,余继英,居国华
(1.四川省邛崃市医疗中心医院药学部,四川 邛崃 611530; 2.四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
黄硝巴布剂中红花与大黄提取工艺研究
曾明辉1,何 林2,邱建平1,余继英2,居国华1
(1.四川省邛崃市医疗中心医院药学部,四川 邛崃 611530; 2.四川省医学科学院·四川省人民医院药学部,四川 成都 610072)
目的 优选黄硝巴布剂中红花与大黄水煎提取的最佳工艺。方法 以红花中羟基红花黄色素A、大黄中总蒽醌在提取液中的含量为考察指标,采用 L9(34)正交试验设计,考察煎煮溶剂的量、提取时间和提取次数3个因素对提取效果的影响。结果 红花、大黄分别加14倍量水,浸泡20min,大黄单独煎煮提取40min,药渣与红花混合,加14倍量水,煎煮2次,每次40min,能最大限度地提取红花与大黄药材中的有效成分。结论 该提取工艺简单可行,可为工业化生产提供依据。
红花;大黄;正交试验;提取工艺;羟基红花黄色素A;总蒽醌
“水晶丹”为医院治疗疮疡的自制制剂,由红花、大黄等组方,在临床应用多年,疗效肯定,无毒副作用[1-2],但存在制备工艺不规范、患者使用不方便等现象。笔者拟对其制剂工艺等进行研究,将其研制成黄硝巴布膏剂。该制剂处方中红花为菊科植物红花的干燥管状花,主要化学成分为黄酮醇及查尔酮类等,其中羟基红花黄色素A(HSYA)为其主要活性成分,有活血化瘀、止痛等功效[3]。大黄有消炎镇痛、收敛止血等作用,其化学成分复杂,其中蒽醌类化合物(TAQN)是重要的活性成分[4]。本研究中基于中药传统方剂的煎煮方式,以提取液中HSYA和TAQN的含量为考察指标,采用正交试验法,优选红花与大黄水煎提取的最佳工艺。现报道如下。
1 仪器与试药
1.1 仪器
美国Waters 2690型高效液相色谱系统,包括自动进样器,996二极管阵列检测器,Empower3色谱工作站(美国Waters公司);UV1800型紫外分光光度计(日本岛津公司);BP211型电子天平(德国赛多利斯公司);Genius3型漩涡混合器(德国IKA公司);320R型低温离心机(德国Hettich公司);H66025T型超声清洗机(无锡超声电子设备厂)。
1.2 试药
HSYA对照品(批号为111637-200905),大黄素对照品(批号为110756-201017),均购自中国食品药品检定研究院;红花(批号为121201,HSYA的标示含量为1.2%)、大黄(批号为 13070,TAQN的标示含量为1.8%),均由四川利民中药材饮片有限责任公司提供。甲醇、乙腈为色谱纯,水为纯净水,其他试剂均为分析纯。
2 方法与结果
2.1 HSYA含量测定(高效液相色谱法)
2.1.1 色谱条件[5]
色谱柱:DiamonsilC18柱(200mm×4.6mm,5μm),柱温:30℃;流动相:甲醇-乙腈-0.7%磷酸溶液(26∶2∶72);流速:0.8mL/min;检测波长:403 nm;进样量:20μL。
2.1.2 溶液制备
称取HSYA对照品适量,精密称定,加25%甲醇制成0.10 g/L的溶液,摇匀,即得HSYA对照品贮备液。精密吸取混合提取液2 m L,用25%甲醇稀释5倍,摇匀,用0.45μm微孔滤膜过滤,即得供试品溶液。
2.1.3 方法学考察
线性关系考察:分别精密吸取HSYA对照品贮备液0.2,0.5,1.0,2.0,5.0 mL,加25%甲醇制成2,5,10,20,50μg/mL系列溶液。分别吸取上述溶液各20μL进样测定,以HSYA峰面积对质量浓度作回归分析,得回归方程 Y=37 640X-3 321.5,r=0.999 2(n=5)。结果表明,HSYA质量浓度在2~50μg/mL范围内与峰面积线性关系良好。
加样回收试验:精密吸取含HSYA(0.224 2 g/L)的提取液0.5m L 6份,分别加入一定量的HSYA对照品溶液。按供试品溶液制备方法处理,进样测定,计算得平均加样回收率为98.01%,RSD为1.28%(n=6)。
2.2 TAQN含量测定(紫外分光光度法)
2.2.1 溶液制备
称取TAQN对照品适量,精密称定,用甲醇溶解并稀释成质量浓度为0.10 g/L的溶液,摇匀,即得TAQN对照品贮备液。精密吸取TAQN提取液5m L,置100m L三角瓶中,加入2.5 mol/L的硫酸溶液50 m L,回流水解2 h;稍冷后用氯仿回流提取4次,用量分别为30,20,10,10mL,每次1 h,合并氯仿液,低温挥干氯仿,残渣用氯仿定容于50 m L容量瓶中;精密吸取氯仿液5mL,置蒸发皿中,低温挥干氯仿,残渣用适量甲醇转溶于25m L容量瓶中,即得供试品溶液[6-7]。
2.2.2 检测波长选择
精密吸取大黄素对照品溶液3~25 mL置容量瓶中,加入1%醋酸镁甲醇溶液10m L,再加甲醇至刻度,摇匀,在200~700 nm波长范围内扫描。结果大黄素在512 nm波长处有最大吸收峰,故以512 nm为检测波长。2.2.3 方法学考察
线性关系考察:分别精密吸取TAQN对照品溶液1,2,3,4,5,6 m L,置25 mL容量瓶中,加1%醋酸镁甲醇溶液10mL,加甲醇至刻度,摇匀,得质量浓度为4,8,12,16,20,24μg/m L的系列标准溶液,以甲醇为空白溶液在512 nm波长处测定吸光度,绘制标准曲线,得回归方程 Y=0.050 17X-0.001 02,r=0.999 8(n=6)。结果表明,TAQN对照品溶液质量浓度在4~24μg/mL范围内与吸光度值线性关系良好。
加样回收试验:精密吸取含TAQN 1.716 g/L的提取液1mL,分别加入一定量的TAQN对照品溶液。按供试品溶液制备方法处理,并测定吸光度值,计算得平均加样回收率为94.87%,RSD为1.58%(n=6)。
2.3 混合提取工艺优化
2.3.1 正交试验设计
在预试验基础上,选择以水为溶剂,考察对象选择影响TAQN及HSYA提取的3个主要因素,即溶剂量(因素A)、煎煮时间(因素B)、煎煮次数(因素C),进行工艺优化,每个因素3个水平,按正交表 L9(34)进行试验,因素水平见表1。

表1 正交试验因素水平表
2.3.2 试验方法与结果
称取大黄50 g,红花10 g,大黄碎断为1 cm左右的小块。药材在第1次煎煮前均浸泡20min,按正交设计进行试验,收集提取液,药渣用适量水洗涤。合并提取液和洗涤液,于高速离心机上离心,去除沉淀,溶液减压浓缩至约300 m L,定容至500 m L,摇匀,测定HSYA及TAQN含量,结果见表2和表3。将以上结果运用正交试验助手Ⅱ软件作方差分析,结果见表4和表5。

表2 以HSYA含量为评价指标的正交试验结果
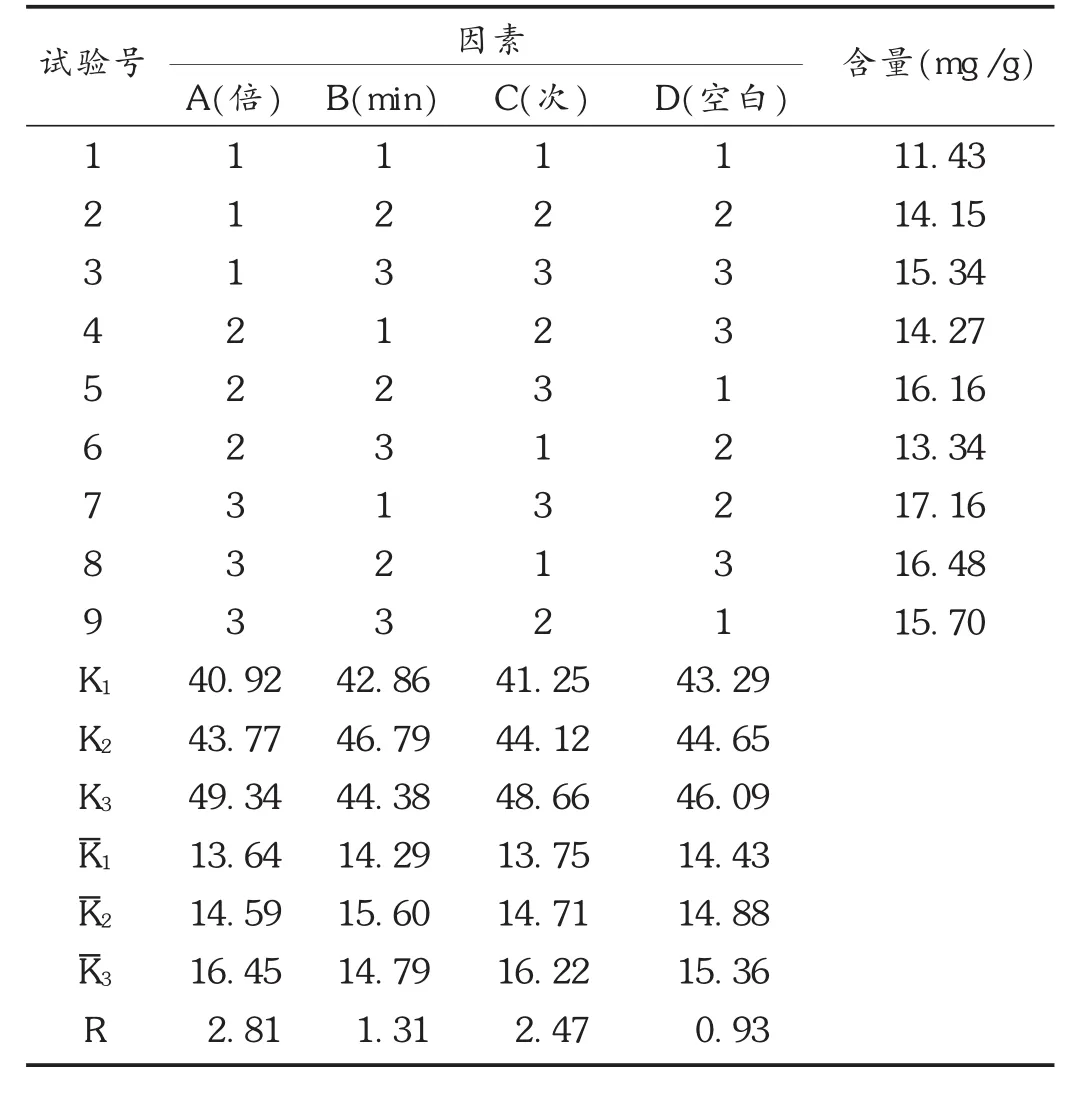
表3 以TAQN含量为评价指标的正交试验结果
2.3.3 结果分析
以HSYA含量为评价指标的正交试验方差分析结果表明,因素重要性 C>B>A,最佳工艺为C2B1A3,即煎煮次数 2次,煎煮时间 40 min,溶剂量 14倍。以TAQN含量为评价指标的正交试验方差分析结果表明,因素重要性A>C>B;最佳工艺为A3C3B1,即溶剂量14倍,煎煮次数3次,煎煮时间40min。

表4 以HSYA含量为评价指标的正交试验方差分析结果
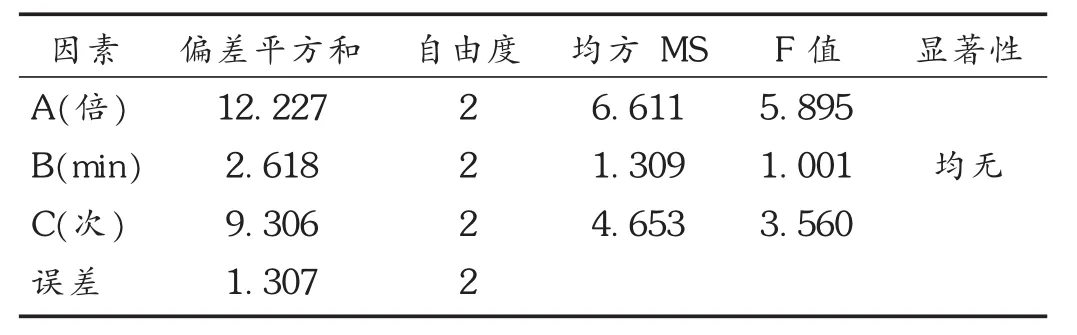
表5 以TAQN含量为评价指标的正交试验方差分析结果
综合TAQN及HSYA 2个指标发现,因素C选择的水平存在矛盾,本研究中拟订的解决方法是将大黄先单独煎煮1次,过滤,药渣再与红花混合煎煮,故最佳提取工艺为红花、大黄分别加14倍量水浸泡20min;大黄单独煎煮提取40min,过滤,药渣与红花混合,加14倍量水煎煮2次,每次40min,合并3次提取液及药渣洗涤液。2.4 验证试验
按正交设计试验得出的最佳工艺进行验证试验,并比较大黄14倍量水分别先单独煎煮0,40,60min,再与红花煎煮2次,每次加14倍量水煎煮40min,分别测定各提取液中TAQN及HSYA含量,结果见表6。可见,大黄先单煎40 min,药渣再与红花混合提取,TAQN提取效果较好,同时不影响HSYA的提取。
表6 验证试验结果(±s,mg/g,n=3)

表6 验证试验结果(±s,mg/g,n=3)
大黄单煎时间(min)0 40 60 HSYA 11.012±0.20 11.176±0.24 11.143±0.23 TAQN 14.625±0.25 17.036±0.35 16.514±0.33
3 讨论
HSYA为红花活血化瘀、止痛等功效的主要有效成分,2010年版《中国药典(一部)》规定红花药材中HSYA的含量不得少于1.0%;TAQN为大黄活血化瘀、止痛等功效的主要有效成分,2010年版《中国药典(一部)》规定大黄药材中TAQN的含量不得少于1.5%。因此,本研究中选用HSYA和TAQN为2种药材的代表物质。
本研究中参照药典方法制备红花药材中HSYA含量测定的供试品溶液,并选用403 nm作为检测波长,具有良好的峰形,与干扰成分分离度大于1.5。同时,在参考文献[6-7]的基础上建立了红花和大黄混合提取液中TAQN的含量测定方法,该方法具有良好的准确性和重复性。
复方制剂是由2味及其以上的药物组成,其所含成分的种类含量及其治疗功效往往并非单味药的简单加和,而中药传统方剂服用时往往是多种药材混合在一起煎煮。本研究中优选了红花与大黄混合提取的工艺,为红花与大黄复方研究提供了一定基础。
红花和大黄为科研课题“黄硝巴布剂”研制处方的主要成分,本研究中以中药传统方剂的煎煮方式为基础,以水为提取溶剂,实现了HSYA及TAQN较高的提取率,成本较低,工艺稳定,易操作,可为工业生产提供依据。
[1]周华君.水晶丹加减治疗疮疡300例的临床观察[J].四川中医,1996,14(9):45.
[2]段 华,母发旭.水晶丹治疗痛风性关节炎急性发作135例临床观察[J].四川医学,2008,29(10):1 347-1 348.
[3]王艺蓉,白咸勇.红花的作用及机制研究进展[J].滨州医学院学报,2009,32(6):451-453.
[4]兰志琼,王 凌.大黄的药理作用与临床应用[J].中国医药指南,2010,13(2):85.
[5]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:141.
[6]张志荣,侯世祥,黄 园,等.大黄及其复方中药制剂中蒽醒衍生物的含量测定[J].华西药学杂志,1994,9(4):225-227.
[7]吕 洁,李晓燕,李向军,等.大黄中结合蒽醌的提取工艺研究[J].河北中医药学报,2009,24(4):34-35.
Extraction Technology of Carthamus Tinctorius L.and Radix et Rhizoma.Rhei in Huangxiao Catap lasm ta
Zeng Minghui1,He Lin2,Qiu Jianping1,Yu Jiying2,Ju Guohua1
(1.Department of Pharmacy,Sichuan Qionglai Medical Center Hospital,Qionglai,Sichuan,China 611530; 2.Sichuan Academy of Medicial Sciences· Department of Pharmacy,Sichuan Provincial People′s Hospital,Chengdu,Sichuan,China 610072)
Objective To explore the optional extraction technology of Carthamus tinctorius L.and Radix et Rhizoma.Rhei in Huangxiao Cataplasm ta.M ethods Based on the orthogonal test L9(34),the contents of hydroxysaffl in yellow A and total anthraquinone were regarded as the index to evaluate the extracting conditions such as the water volume,extracting time and extracting times.Resu lts A fter Carthamus tinctorius L.and Radix et Rhizoma.Rhei being soaked respectively for 20 min with 14 times amount of water,the Radix et Rhizoma.Rhei was decocted alone for 40 min with 14 times amount of water.The gruffs were admixed with the Carthamus tinctorius L.The admixture was extracted 2 times by using 14 times amount of water and 40 min each time.In this way,the hydroxysafflof yellow A and total Anthraquinone were utmostly extracted.Conclusion The extraction technology is simple,practicable and may provide a basis for industrial production.
Carthamus tinctorius L.;Radix et Rhizoma.Rhei;orhogonal test;extraction technology;hydroxysafflof yellow A;total anthraquinone
TQ 461;R284.1;R282.71
A
1006-4931(2016)06-0020-04
曾明辉,大学本科,研究方向为中药新剂型与新工艺及药事管理,(电话)028-88761203(电子信箱)zengyaoshi168@163.com;何林,博士研究生,主任药师,研究方向为药物新制剂及药代动力学,本文通讯作者,(电话)028-87393932(电子信箱)helin514@126.com。
2015-10-14)
四川省中医药管理局科研课题,项目编号:No.2010-G-093。
