质量量度在国内药品生产企业中的应用
2016-12-22包敏芝胡廷熹
包敏芝+胡廷熹
摘 要 本文借鉴FDA质量量度指南草案,结合中国2010版药品生产质量管理规范(GMP)要求以及企业现状,总结以往质量管理的经验,提出了用于衡量国内药品生产企业中药品质量和工艺性能的质量量度指标及其计算方法和考核评估频率建议。
关键词 质量量度 质量管理体系 药品质量 工艺性能
中图分类号:F406.2 文献标识码:C 文章编号:1006-1533(2016)23-0069-04
Application of quality metrics in Chinese pharmaceutical enterprises
BAO Minzhi1*, HU Tingxi2(1. Suzhou Teraypharm Inc., Suzhou 215151, China; 2. School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT The quality metrics items for the measurement of the quality and process performance of drugs produced in Chinese Pharmaceutical enterprises and suggestions on the approaches and frequency for the calculation and evaluation of quality metrics were proposed by referring to Request for Quality Metrics Guidance for Industry (FDA draft) and the requirements of Good Manufacturing Practice (GMP, China, 2010) and based on the current situation of Chinese pharmaceutical enterprises combined with the writers experiences in quality management.
KEY WORDS quality metrics; quality management system; quality of product; process performance
2015年7月27日美国食品药品管理局(FDA)发布了质量量度指南草案[1],希望药品生产企业或相关机构定期递交质量量度数据,通过收集量化指标来评价产品质量和工艺能力、企业的质量承诺和质量体系的健康度,实现基于质量风险的对药品生产企业或相关机构的全面有效监管,从而实现一个愿景:“药品企业能够在不受过分监管的情况下,最大程度地高效、敏捷、灵活地生产出质量可靠的高质量产品”[2]。对于中国的药品生产企业,可以采用质量量度的方法来管理和控制产品生产工艺,提高产品质量,完善质量管理水平,提升质量文化和企业形象,将来可以实现与药品监管要求的衔接。
1 药品生产企业质量量度应用现状
质量量度的定义是对产品质量的综合评估和度量,是所有影响产品质量的因素的总函数。质量量度并不是一个新工具,药品生产企业早已有用到,比如一次性合格率、客户投诉率等。一般都是作为质量目标的形式或绩效考核时以量化的指标出现。也有药品行业借助质量量度作为产品工艺过程控制的工具,推动药品生产的持续改进。但是在大部分企业其使用的广度、深度、力度参差不齐,有的企业甚至还未启用。因此,质量量度目前仍处于初始阶段。
1.1 行业规范或监管部门没有明确要求
《药品生产质量管理规范》(GMP)2010年版[3],在质量管理章节中,第一条就指出:企业应建立并实施符合质量管理体系要求的质量目标。《2010年药品GMP实施指南:质量管理体系》[4]中指出:有关药品安全、有效和质量可控的所有要求是贯穿于药品生产的全过程的,应根据各质量要素建立具体的质量目标和对应的职责范围。行业规范只有质量目标的要求,但是质量目标并不一定要求是量化指标,与质量量度是有区别的。监管部门执行的是各类GMP检查、药品抽检,检查内容没有包括质量量度的要求,检查报告也没有质量量度报告;药品监管平台要求输入的是物料等信息,没有质量量度报告或质量量度数据输入要求[5-6]。
1.2 没有明确基本的质量量度项
制药企业最基本的要求是遵循GMP规范,GMP规范对制药企业的质量管理体系的所有要素[7]、相关的药品或生产质量管理活动提出了基本要求,药品GMP指南作为对GMP规范的补充和技术参考,帮助企业科学地理解GMP并有效地实践。目前国家的GMP认证制度是通过检查员对企业的质量体系及产品生产过程的检查,按照GMP规范条款逐项评估,以考量GMP的执行程度。企业也进行自检,自检的方式基本也是依据GMP规范条款来进行。没有将质量量度指标与质量管理体系的因素以及质量管理活动产品质量属性关联起来,没有用量化的指标进行评估与衡量产品质量和工艺能力以及执行GMP规范的符合程度与水平。
1.3 没有统一计算方法规定限度
目前在部分企业内部是通过一些质量量度指标来进行绩效考核,但是由于行业没有质量量度要求,各企业根据自己要求制定指标和计算方法。这样的量度指标数据在行业中就没有统计学意义,无法用统一的方式来横向评估同类药品的质量、工艺能力和GMP执行程度。
2 质量量度对产品质量的意义
药品是特殊的商品,药品的质量对于用药人来讲要百分百合格。药品的安全性、有效性、质量可控性是药品开发和生产的目的。在药品生命周期的研发阶段,确定了药品的关键质量属性、关键工艺属性、关键原辅料属性,这些药品的属性通过商业化生产阶段来实现。如果在产品质量实现的过程中,采用量化质量量度指标进行统计分析,在企业内部有利于药品质量的稳定,有利于药品质量的持续改进,有利于质量体系的建设;对外有利于行业同品种的质量评估和横向比较,有利于树立品牌效应、提升企业诚信度,便于向药监主管部门提供直观、可衡量的信息。
2.1 有利于日常生产过程监控,保证产品质量实现
药品质量是通过生产全过程遵循GMP规范以及按照批准的生产工艺来实现的。药品的合格不仅仅停留在药品抽检符合质量标准,还要求药品生产的全过程可控,工艺稳定,工艺能力可重复。通过质量量度工具,可以纵向考量工艺遵从性,即使存在操作人员更换、物料批号不同、设备仪表有一定误差等可变因素,还是可以稳定地生产出满足预定用途、符合既定关键质量属性的药品来。即质量量度是证明工艺持续处在受控状态的工具,也就是工艺验证第三阶段“持续工艺确认”的要求。
2.2 有利于药品质量和工艺能力的持续改进
在从小试、中试到商业化生产,药品研发阶段确定的关键质量属性、关键工艺属性、关键原辅料属性由于生产设备、批量等的不同都有可能进行适当的调整。在持续的商业化规模生产中,也有可能运用到一些现代生产技术。通过质量量度工具,可提高企业对工艺的认知,包括工艺放大和商业化生产中所获得的知识以及上市后的学习和经验。通过改进措施以优化工艺,改善既定关键质量属性、关键工艺属性等,提高药品质量、质量稳定性或工艺能力。
2.3 有利于质量体系的建设
药品生产过程及药品质量的监控通过质量管理体系实现,从人员培训、设备管理、工艺验证、设备确认、环境监控、物料管理,以及偏差、纠正预防措施(corrective action and preventive action,CAPA)、年度产品回顾(annual product review,APR)或产品质量回顾(product quality review,PQR)、GMP自检、客户投诉等方面来把控药品生产流程,质量量度可以帮助评估这些方面的数据来判别为实现药品质量的一系列活动是否符合GMP要求、如有不符合应如何改进,以确保药品质量和工艺稳定。
2.4 有利于同品种的质量评估和横向比较
制药行业引入此概念的原因之一是想把药品的质量好坏变得透明,直接并有效地呈现给用户(患者、医生、购买方等)和监管部门,让药品的使用者有知情权和选择权,创造一个良性的市场竞争机制,鼓励创优及持续改进。通过质量量度指标,用同一杆标尺来度量药品质量,同时体现企业的管理水平和工艺水平。
2.5 有利于树立品牌效应、提升企业诚信度
通过质量量度数据的业内横向比较,各项指标能够位居前位的企业,将提高客户对产品的信任度,树立品牌形象。同时,提高企业高层管理者对产品质量和质量体系的关注度,支持和参与质量活动。企业高管的质量承诺,将影响产品质量和工艺能力的整体状况。我们之所以对名牌或进口产品更加信赖,原因之一也是基于认可产品质量和公司质量文化。质量量度可以对这种关系进行系统的、合理的量化和测量。
2.6 便于向药监主管部门提供直观、可衡量的信息
FDA已经开始要求部分企业定期提供质量量度数据,而国内药监部门也在通过网络要求企业提供药品生产相关信息(质量量度数据还未要求)。通过电子化数据管理,将大大提高监管的时效性、真实性、系统性。通过量化的质量量度指标,衡量产品质量,评估企业对产品质量的重视程度,有助于监管部门要求的企业诚信系统建设。
3 质量量度的应用
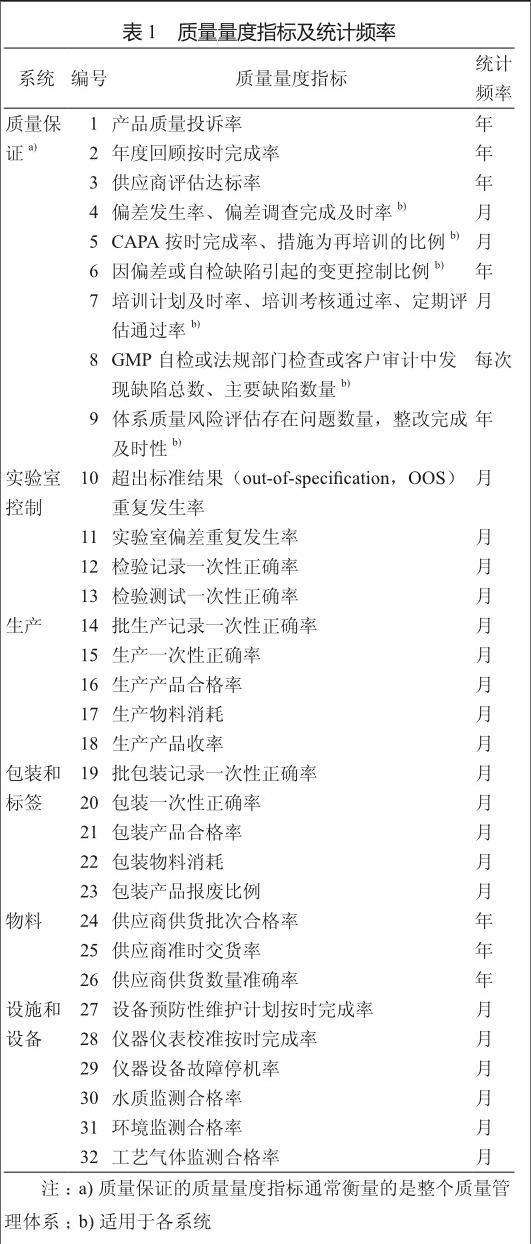
GMP要求药品生产企业应建立药品质量管理体系。它是确保药品质量符合预定用途所需的有组织、有计划的全部活动总和,包括了影响药品质量的所有因素。GMP是药品质量管理体系的一部分,是药品质量管理体系的基础,通过药品质量管理体系的建设从而加强了GMP。FDA将药品质量管理体系分为六大系统:质量保证系统、生产系统、物料系统、实验室控制系统、包装和标签系统、设施和设备系统(表1)。
建立质量管理体系有效监控工艺性能和产品质量,允许在适当的范围内波动,为工艺持续适宜性和产品稳定性提供保证,并有助于产品质量和工艺的持续改进。质量量度是可以体现工艺性能和产品质量的有效手段,直观、可量化、可实现横向和纵向的比较。设定合适的质量量度指标,以实现产品质量和工艺的有效监控和持续改进。
质量量度指标如何科学合理地计算和考核,以对药品质量和工艺能力控制、以及GMP管理起到积极的作用,值得探讨。推荐的计算方法如下:
1) 产品质量投诉率 工厂接到的总的产品质量投诉量(相同产品的重复投诉不重复计算)占总生产批次的比例。
2) 产品年度审核及时率 APR或PQR在每年度截止日后30 d内完成并批准的报告数量占计划完成总数的比例。
3) 供应商评估达标率 通过对供应商供货批次合格率、使用在线报废率、准时交货率、订单变化接受率、价格指数、服务指数等综合考评的结果来衡量供应商后计算达标率。
4) 偏差重复发生率、偏差调查按时完成率 偏差重复发生率为偏差调查后根本原因相同的总数占偏差总数的比例;偏差调查完成及时率为偏差调查按规定时间完成数量占总报告偏差数量的比例。
5) CAPA按时完成率、措施为再培训的比例CAPA按时完成率为CAPA按规定时间完成数量占CAPA总数的比例;措施为再培训的比例为由涉及再培训措施的次数占CAPA总数的比例。
6) 因偏差或自检缺陷引起的变更控制比例 因偏差或自检缺陷引起的变更控制数量占总变更控制数量的比例。
7) 培训计划按时完成率、培训考核通过率、定期评估通过率 培训计划按时完成率为培训完成数量占培训计划数量的比例;培训考核通过率为培训考核通过人数占该项培训总人数的比例;定期评估通过率为定期评估通过人数占应定期评估总人数的比例。
8) GMP自检或法规部门检查或客户审计中发现缺陷总数、主要缺陷数量 GMP自检发现缺陷总数为在一次GMP自检或法规部门检查或客户审计中发现本部门缺陷数量的总和;主要缺陷数量是指在上述GMP自检或法规部门检查或客户审计中发现缺陷为主要缺陷项数量。
9) 体系质量风险评估存在问题数量 在质量管理体系风险评估中发现本部门存在问题数量的总和。
10) OOS重复发生率 OOS调查后根本原因相同的OOS数量占OOS总数的比例。
11) 实验室偏差重复发生率、实验室偏差调查按时完成率 实验室偏差重复发生率为实验室偏差调查后根本原因相同的实验室偏差数量占总数的比例;实验室偏差调查完成及时率为实验室偏差调查按规定时间完成数量占总报告偏差数量的比例。
12) 检验记录一次性正确率 批检验记录审核后没有一次差错的批数占总检验批数的比例。
13) 检验测试一次性正确率 批检验测试审核后没有一次无效测试或没有一个偏差的批数占总检验批数的比例。
14) 批生产记录一次性正确率 批生产记录审核后没有一次差错的批数占总生产批数的比例。
15) 生产一次性正确率 生产过程没有发生一次偏差的批次数占总生产批数的比例。
16) 生产产品合格率 生产产品经审核放行(除去判不合格)的批次数占总生产批数的比例。
17) 生产物料消耗 每批产品生产用各物料实际领用量(如有返回应扣除)与计划用量之比。
18) 生产产品收率 按批计算实际生产产量与理论产量之比。
19) 批包装记录一次性正确率 批包装记录审核后没有一次差错的批数占总包装批数的比例。
20) 包装一次性正确率 包装过程没有发生一次偏差的批次数占总包装批数的比例。
21) 包装产品合格率 包装产品经审核放行(除去判不合格)的批次数占总包装批数的比例。
22) 包装物料消耗 每批产品包装用各物料实际领用量(如有返回应扣除)与计划用量之比。
23) 包装产品收率 按批计算实际包装产量与理论产量之比。
24) 供应商供货批次合格率 供应商供货通过验收放行的批次数占其总供货批次的比例。
25) 供应商准时交货率 供应商在合同要求时限前将货物送达(不能通过验收放行的批次除外)的物料批次数占其总供货批次的比例。
26) 供应商供货数量准确性 各物料每个包装使用完后统计净重量(必要时可加上合理损耗)与包装标示重量之比。
27) 设备预防性维护计划按时完成率 设备预防性维护计划按时完成的台次数与计划规定的总台次数之比。
28) 仪器仪表校准按时完成率 仪器仪表在其校准有效期内完成校准并合格的数量与计划应校准仪器仪表总数之比。
29) 仪器设备故障停机率 仪器设备因故障停机时间与应运行时间之比。
30) 水质监测合格率 各工艺用水监测合格的点次数与规定需监测的总点次数之比。
31) 环境监测合格率 各洁净区域环境监测合格的点次数与规定的环境监测总点次数之比。
32) 工艺气体监测合格率 各工艺气体监测合格的点次数与规定的监控点的监测总点次数之比。
4 结语
质量量度的概念一经提出,已引起业内人士的广泛关注。质量量度按如上定义应该和产品质量有直接并唯一的关系:质量量度好即产品质量好。但是,要充分全面地衡量产品质量,不能仅仅孤立地采用某项质量量度指标,需要一些列的质量量度指标的组合,构成一个合理有用的质量量度模型。 是否能够开发一个合理有用的模型,还有待时间的验证。相信通过药监部门和企业的共同努力下,质量量度将成为衡量药品质量和质量管理体系的有利工具。
参考文献
[1] U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), et al. Quality metrics technical conformance guide[EB/OL]. (2015-07-28)[2016-08-01]. http://www.fda.gov/downloads/drugs/ developmentapprovalprocess/manufacturing/ucm508464.pdf.
[2] U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), et al. Request for quality metrics: guidance for industry[EB/OL]. (2015-07-28)[2016-08-01]. http://www. fda.gov/downloads/drugs/guidancecomplianceregulatoryinfor mation/guidances/ucm455957.pdf.
[3] 中华人民共和国卫生部. 药品生产质量管理规范(2010年修订)(卫生部令第79号)[EB/OL]. (2011-01-17)[2016- 08-01]. http://www.sda.gov.cn/WS01/CL0053/58500.html.
[4] 国家食品药品监督管理局药品认证管理中心. 药品GMP指南·质量管理体系[M]. 北京: 中国医药科技出版社, 2011: 9.
[5] 杨依晗, 赵燕君, 高惠君. 国食品和药物管理局质量量度的简介及启示[J]. 中国新药与临床杂志, 2016, 35(4): 260-263.
[6] 张景辰. 加强事中监管,促进药品产业的供给侧改善——FDA质量量度计划的启示[J]. 中国食品药品监管, 2016(4): 56-58.
[7] ICH. ICH harmonized tripartite guideline: pharmaceutical quality system Q10[EB/OL]. (2008-06-04)[2016-1-10]. http:// www.ich.org/fileadmin/Public_Web_Site/ICH_Products/ Guidelines/Quality/Q10/Step4/Q10_Guideline.pdf.
