Fn14-shRNA慢病毒载体的制备
2016-12-22杨云峰张明珠赵有光俞光荣
于 涛,杨云峰,李 兵,陈 凯,朱 辉,张明珠,赵有光,俞光荣
同济大学附属同济医院骨科,上海 200065
Fn14-shRNA慢病毒载体的制备
于 涛,杨云峰,李 兵,陈 凯,朱 辉,张明珠,赵有光,俞光荣
同济大学附属同济医院骨科,上海 200065
目的 构建Fn14-shRNA慢病毒载体,以进一步进行动物实验,研究Fn14在骨肉瘤中的表达和作用。方法 使用RNA干扰技术,构建Fn14干扰载体、病毒包装、感染细胞,并进行鉴定。结果 Fn14-shRNA干扰质粒单酶切验证阳性,测序结果与设计完全一致,干扰组Fn14在稳转细胞株中表达下调。结论 成功构建了Fn14-shRNA慢病毒载体,为进一步从分子水平探讨Fn14在骨肉瘤中的生物学作用奠定了基础。
骨肉瘤;细胞表面受体成纤维细胞生长因子诱导14;RNA干扰;慢病毒
细胞表面受体成纤维细胞生长因子诱导14 (Fn14)是一种Ⅰ型跨膜蛋白,最初以肿瘤坏死因子样细胞凋亡弱诱导剂(TWEAK)受体的身份被人们发现。经证实,TWEAK与Fn14结合后可激活下游通路,进而诱导某些肿瘤细胞凋亡[1],促进肿瘤细胞生存和增殖[2],提高肿瘤细胞侵袭力[3],诱导肿瘤血管的形成[4],促炎性反应并藉此通过炎性递质的调控促进肿瘤播散和转移[5-6]。Fn14在乳腺癌、神经胶质瘤、肠腺癌和肝癌等多种恶性肿瘤中异常表达[7-10],且在其配体TWEAK表达量很低甚至不表达的情况下亦可激活下游通路[11],发挥其生物学作用,故Fn14是一个与很多恶性肿瘤发生相关的关键分子。因此它可能也在骨肉瘤的发生、发展中发挥重要作用,是一种潜在的治疗骨肉瘤的新型分子靶向。然而,Fn14在骨肉瘤中是否表达异常、具有何种生物学作用等却未见报道。
本研究主要通过Fn14-shRNA干扰重组慢病毒载体的制备和慢病毒包装,用慢病毒介导的基因转移方法建立Fn14基因下调的稳转U-2OS细胞株,以对其进行下一步骨肉瘤细胞生物学行为的检测。
1 材料与方法
1.1材料
①质粒为慢病毒主质粒pLKO.1-TRC;慢病毒载体系统,该病毒包装系统为三质粒系统,由pLKO.1-TRC、psPAX2和pMD2.G组成,其中,pLKO.1-TRC具有PURO抗性,用于稳转筛选,psPAX 2和pMD2.G含有病毒包装所必须的元件;②菌株:大肠杆菌DH5a;③细胞系:293T为美国ATCC来源人胚肾细胞系,用含10%胎牛血清的DMEM于37℃、CO2体积分数为5%的条件下培养;④试剂和试剂盒:DMEM培养基[High glucose,4 500mg/LGlucose,4.0mmol/LL-Glutam ine,110mg/ L Sodium Pyruvate;1/100(v/v)Penicillin/strepen (Gibco 15140-122)]、10%胎牛血清均购于美国Gibco公司,质粒DNA提取试剂盒、胶回收试剂盒均购自天根生化科技有限公司,1st strand cDNA Synthesis Kit、限制性内切酶BamHI、EcoRI和1kb plus DNAMarker均购自TAKARA公司,DNA聚合酶PFU酶、T4 DNA连接酶均购自天根生化科技有限公司,转染试剂 Lipofectam ineTM2000购自Invitrogen公司;⑤ 实验仪器:荧光定量PCR仪(ABI 7500型),RNA/DNA calculator(Pharmacia公司),高速冷冻离心机(BECKMAN公司),Mastercycler 96孔 PCR仪(Eppendorf公司),DYY-6C型稳流稳压电泳仪(北京六一仪器厂),Gel Doc 1000凝胶成像系统(BIO RAD),CO2恒温培养箱(Nuaire)。
1.2方法
1.2.1 Fn14干扰载体的构建
根据Genebank报道的FN14的mRNA序列和相关文献报道,从基因起始密码子下游寻找符合设计特征的靶序列。其美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)号为NM_016639.2。经BLAST Search检索确认与其他的人类已知基因序列无同源性。然后针对靶点序列,将转录出shRNA的DNA双链从茎环处设计为两段。根据siRNA序列,设计成针对其编码区核苷酸碱基序列的1对寡核苷酸链。其顺序依次为21nt的正义序列、9nt的loop插入序列、21nt的反义序列和转录终止信号。FN14-shRNA片段1:ACCGGTCGGACCTGGACAAGTGCATTTCAAGAGAATGCACTTGTCCAGGTCCGTTTTTTGAAT TC;FN14-shRNA片段2:AATTCAAAAAACGGACCTGGACAAGTGCATTTCAAGAGAATGCACT TGTCCAGGTCCGA;NC-shRNA片段1:CCGGAGCGACTGTGCCAATTCCATTCTC GAGAATGGAATTGGCACAGTCGCTTTTTTG;NC-shRNA片段2:AATTCAAAAAAAGCGACTGTGCCAATTCCATTCTCGAGAATGGAATTGGCACAGTCGC。
shRNA双链的制备。合成单链DNA oligo,把片段1、片段2干粉溶解于退火缓冲液中,90℃水浴15 m in,然后自然冷却至室温,使其复性成双链。plko.1-TRC载体双酶切及回收、连接转化、质粒抽提,步骤如上。单酶切鉴定:利用该内切酶EcoRI对重组质粒进行单酶切反应。酶切产物进行琼脂糖电泳,如果电泳条带单一,且大小适当,表明该质粒克隆为阳性,否则为阴性。测序鉴定:此抽提质粒测序由上海博尚生物技术有限公司进行。测序引物为:CACGCTGTTTTGACCTCCATAGAA。
1.2.2 Fn14干扰病毒包装
慢病毒包装细胞转染用胰蛋白酶消化对数生长期的293T细胞,重新接种于10m L的10 cm2细胞培养皿,在37℃、CO2体积分数为5%的培养箱内培养;当细胞融合度达90%~95%时转染。先吸去培养基,然后用无菌的PBS洗1次,然后加入5m L无血清培养基。制备慢病毒包装系统中三种质粒DNA溶液:加入DMEM至500μL,室温放置5m in;另外取一无菌EP管,加入450μL的DMEM,然后加入50μL脂质体Lipofectam ineTM2000,室温放置5 m in。然后将脂质体缓慢的加入质粒DNA中,混匀,室温放置20m in。将DNA和脂质体混合液转移至含单层细胞的培养液中,混匀,培养6 h后弃去含有转染混和物的培养液,加入10m L的PBS,轻摇后弃去,重复该步骤3次;每瓶细胞中加入含10%胎牛血清的细胞培养液10m L,继续培养;当细胞培养基变黄时,收集转染的293T细胞上清液;重新加入新鲜含10%胎牛血清的细胞培养液,继续收集病毒。在48和72 h时收集2次。将收集的上清液于4℃,4 000×g离心10m in,收集上清液;将上清液以0.45μm滤器过滤上清液于40m L超速离心管中。50 000×g超离心1.5 h。收集离心所得沉淀即为慢病毒粒子,用1m L的PBS液稀释慢病毒备用。使用实 时 定 量 PCR(quantitative real-time PCR,qRT-PCR)法测定滴度。
感染细胞:接种目的细胞于6 cm培养皿中,当细胞融合度达到30%~45%左右时,加入2m L的病毒上清,同时加入3m L含10%胎牛血清的细胞培养液,加入polybrene至终浓度6μg/m L,24 h后更换为正常培养基。若48 h能长到80%~90%视为稳定生长,荧光显微镜观察慢病毒感染效率。3 d后观测GFP表达情况,然后做流式筛选GFP阳性细胞为稳转株,将细胞移至96孔板进行培养,然后进行放大培养,依次为96孔板、24孔板、6孔板,6 cm细胞培养皿,10 cm细胞培养皿,冻存细胞。制备不携带干扰基因的空载组细胞,未进行任何处理的骨肉瘤细胞为对照组。
稳转细胞株的鉴定:使用Western blot和qRT-PCR技术对稳转细胞株、空载组和对照组中Fn14的表达含量进行检测,具体方法同前。
2 结果
2.1测序结果
Fn14-shRNA干扰质粒单酶切验证阳性,测序结果与设计完全一致,质粒构建成功(图1、2)。

图1 Fn14-shRNA单酶切验证结果Fig.1 Resu ltsof single restriction enzym e verification
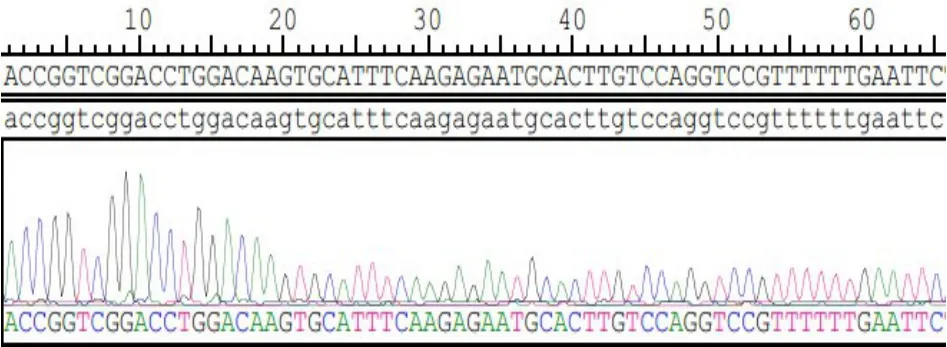
图2 Fn14-shRNA测序结果Fig.2 Fn14-shRNA sequencing resu lts
2.2无关对照慢病毒载体NC-shRNA插入序列
无关对照慢病毒载体NC-shRNA插入序列为CCGGAGCGACTGTGCCAATTCCATTCTCGAGA ATGGAATTGGCACAGTCGCTTTTTTGAATTC,NC-shRNA测序结果与设计完全一致,表明对照干扰载体已经构建成功(图3)。

图3 NC-shRNA对照载体测序结果Fig.3 NC-shRNA sequencing results
2.3滴度检测结果
加入不同病毒量的细胞样品,通过提取总RNA后反转录为cDNA,然后进行定量PCR检测,通过比较对照组和试验组的Ct值差异判断滴度值(表1)。绘制的Puro的溶解曲线如下(图4)。绘制的Actin的溶解曲线如下(图5)。
图4 抗生素抗性基因Puro溶解曲线Fig.4 Solubility curve of antibiotic resistance gene Puro
图5 内参Actin熔解曲线Fig.5 Solubility curve of internal reference Action

表1 抗生素抗性基因Puro及内参检测的Ct值Tab.1 Ctvaluesof antibiotic resistance gene Puro and internal reference
2.4稳转细胞株的鉴定结果
通过Western blot技术对干扰组、空载组和对照组三组细胞株中Fn14的含量进行检测,比较三组间的数值差异,使用SPSS 17.0,经方差分析(三组间方差检验齐性),三组间差别有统计学意义(F=69.48,P<0.000 1)两两比较发现干扰组与对照组和空载组均差异均有统计学意义(P<0.05),而空载组和对照组间差别无统计学意义(P>0.05)。干扰组Fn14表达量较其他两组低(图6、7,表2)。

图6 Western blot电泳结果Fig.6 ResultsofWestern blot
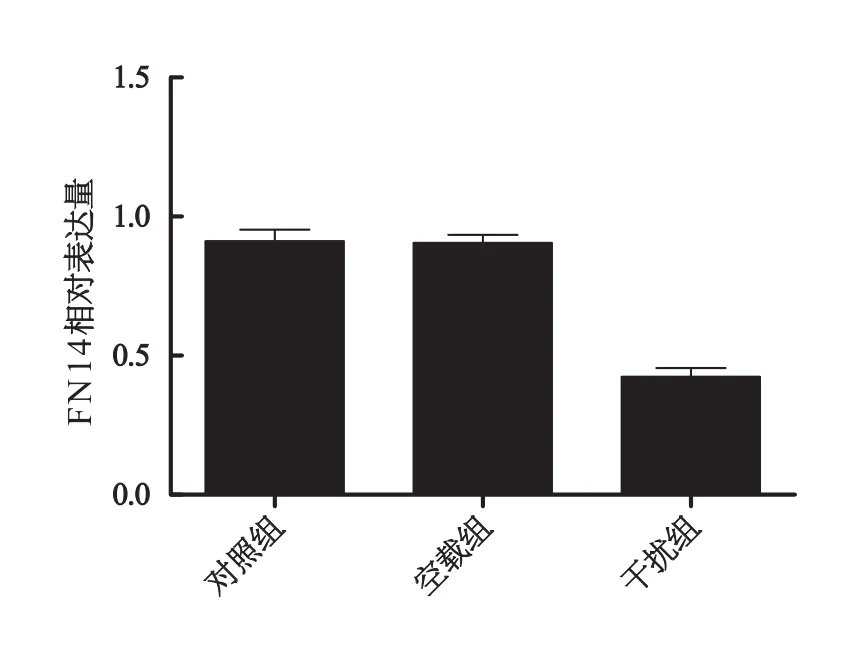
图7 根据W estern b lot统计数据绘制的Fn14相对表达量统计图Fig.7 The relative expression of Fn14 according to Western blot results

表2 对照组、空载组及干扰组的化学发光与内参的灰度系数比Tab.2 Gamm a ratio of controlgroup,no-load group and interference group com pared w ith internal reference
通过Realtime qPCR技术对干扰组、空载组和对照组三组细胞株中Fn14的含量进行检测,比较三组间的数值差异,使用SPSS 17.0,经方差分析(三组间方差检验齐性),三组间差别有统计学意义(F= 27.22,P=0.001)两两比较发现干扰组与对照组和空载组均差异均有统计学意义(P<0.05),而空载组和对照组间差别无统计学意义(P>0.05)。干扰组Fn14表达量较其他两组低(表3、图8)。

表3 标准化后的CT值Tab.3 Standardized CT values
3 讨论
RNA干扰(RNA interference,RNAi)指在进化过程中高度保守的、双链RNA诱发的同源mRNA特异性降解,诱使细胞表现出特定基因缺失的表型[12]。此技术可以此阻碍特定基因的翻译或转录,高效特异地抑制某特定基因表达,达到基因敲除的效果,故被广泛应用于基因功能和恶性肿瘤治疗研究,具有高效、特异等特点。
RNAi是通过一些稳定的中间递质来实现的,首先双链RNA降解为较小的RNA分子,尔后他们序列互补与mRNA结合,从而使得mRNA降解。长度21~23 nt的小RNA分子正是引起RNA干扰的直接原因,被称为小干扰RNA(siRNA)[13-14]。siRNA的制备有多种方法,包括体外制备和体内表达两大类。体外制备需要专门的RNA转染试剂将siRNA转到细胞内,而体内表达则是转染的细胞的DNA模板在体内转录得到siRNA。体外制备方法主要包括化学合成、体外转录和长片段dsRNAs经RNaseⅢ类降解。体内表达主要有siRNA表达载体或病毒载体在细胞中表达siRNA和PCR制备的siRNA表达框在细胞中表达。其中除长片段dsRNAs经RNaseⅢ类降解法外,均需要单独设计siRNA序列。化学合成方法相对价格较为昂贵,对细胞和动物都存在一定毒性,定制周期长,无法长期产生基因沉默的效果,故本实验未采用。体外转录以DNA Oligo为模板,通过体外转录合成siRNA,其成本相对于化学合成较低,而且获得siRNA更快,但是反应的规模和量受到限制,最适合用于筛选siRNA,特别是需要制备多种siRNA时,故本实验也没用使用此方法。用RNaseⅢ消化长片段双链RNA制备siRNA,无需设计和检验多个siRNA序列以找到有效的siRNA,但是本方法有可能引发非特异性的基因沉默,特别是同源或者是密切相关的基因,本方法不适用于需要一个特定siRNA进行的研究,在本研究中也没有采纳。siRNA表达框架由PCR得到siRNA表达模板,能够直接导入细胞进行表达而无需事前克隆到载体中,但是PCR产物很难转染到细胞中,转染效率有待于进一步提高,更适合于筛选siRNA序列,所以本研究也未使用此方法。而siRNA表达载体可以在哺乳动物细胞中表达更多的siRNA,适合已知一个有效的siRNA序列,需要维持较长时间基因沉默的研究,故本实验采纳此方法。
慢病毒载体是以人类免疫缺陷病毒-1为来源的一类病毒载体,属于反转录病毒科,其包含了包装、转染和稳定整合所需的遗传信息。携带有外源性基因的慢病毒载体在包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。慢病毒载体可以感染非分裂期的细胞,在非有丝分裂细胞中复制,且能够稳定长期表达,已经广泛应用于RNA干扰中。
Fn14是TWEAK的受体,是一种Ⅰ型跨膜蛋白,TWEAK与其结合后会激活下游通路,从而引发一系列的生物学效应。Fn14已被证实在多种恶性肿瘤中表达异常,且被激活后有可能刺激肿瘤细胞增殖、分化和迁移[1-3],调节肿瘤细胞凋亡,促进肿瘤血管生成的作用[4],是多种恶性肿瘤发生发展中的一个重要调节因子[5-6]。而对于恶性程度较高且发病机制尚不清楚的骨肉瘤中,Fn14的表达情况和生物学意义未有报道。在Pubmed公开的基因芯片数据中显示,Fn14在骨肉瘤中表达较正常骨组织显著增高,这说明Fn14有可能在骨肉瘤的发生发展中发挥一定作用。本研究我们使用RNA干扰技术下调Fn14基因在骨肉瘤细胞中的表达,并经鉴定病毒包装和稳转细胞株构建成功。这为进一步通过侵袭实验、增殖实验或凋亡实验等研究Fn14在骨肉瘤细胞中发挥的具体作用奠定了基础。
本实验首先根据既往文献报道的mRNA序列,从基因起始密码子下游寻找合适的符合设计特征的靶序列,合成shRNA双链,并进行单酶切鉴定和测序鉴定。Fn14-shRNA干扰质粒单酶切电泳验证为阳性,测序结果与设计一致,质粒构建成功;而NC-shRNA测序结果也与设计完全一致,说明对照的干扰载体也已经构建成功。
进而下一步加入不同病毒量的细胞样品,提取总RNA后反转录,得到cDNA,再进行定量PCR检测,得出滴度值>3.00×109TU/m L。本研究中的溶解曲线做图没有出现杂峰,也未出现主峰的异常增宽,表明实验中未出现污染、引物二聚体和非特异性扩增。
在对稳转细胞株构建的鉴定中,我们使用qRT-PCR和Western blot技术,经检测Fn14在稳转细胞株中表达下调,结果有统计学意义,Fn14-shRNA稳转细胞株构建成功。
本研究成功构建了Fn14-shRNA慢病毒载体,携带的干扰序列可以通过病毒感染整合到细胞基因组中,可以使用该方法得到的稳转细胞株进行Fn14的功能研究,对进一步开展增殖、凋亡、侵袭及动物实验有重要意义。
[1]Nakayama M,Ishidoh K,Kayagaki N,et al.M ultiple pathways of TWEAK-induced cell death[J].J Immunol,2002,168(2):734-743.
[2]JakubowskiA,Ambrose C,ParrM,etal.TWEAK induces liver progenitor cell proliferation[J].JClin Invest,2005,115(9):2330-2240.
[3]Burkly LC,M ichaelson JS,Zheng TS.TWEAK/Fn14 pathway:an immunological sw itch for shaping tissue responses[J]. ImmunolRev,2011,244(1):99-114.
[4]Ho DH,Vu H,Brown SA,et al.Soluble tumor necrosis factor-likeweakinducer of apoptosisoverexpressionin HEK293 cells promotes tumor grow th and angiogenesis in athym ic nudem ice[J].Cancer Res,2004,64(24):8968-8972.
[5]Campbell S,Burkly LC,Gao HX,et al.Proinflammatory effects of TWEAK/Fn14 interactions in glomerular mesangial cells[J].JImmunol,2006,176(3):1889-1898.
[6]Munoz-Garcia B,M artin-Ventura JL,M artinez E,et al.Fn14 is upregulated in cytokine-stimulated vascular smooth muscle cells and is expressed in human carotid atherosclerotic plaques:modulation by atorvastatin[J].Stroke,2006,37(8):2044-2053.
[7]M ichaelson JS,Cho S,Browning B,et al.Tweak induces mammary epithelial branching morphogenesis[J].Oncogene,2005,24(16):2613-2624.
[8]Tran NL,M cDonough WS,Savitch BA,et al.Increased fibroblast grow th factor-inducible 14 expression levels promote glioma cell invasion via Rac1 and nuclear factor-kappaB and correlate w ith poor patient outcome[J].Cancer Res,2006,66 (19):9535-9542.
[9]Kawakita T,Shiraki K,Yamanaka Y,et al.Functional expression of TWEAK in human colonic adenocarcinoma cells [J].Int JOncol,2005,26(1):87-93.
[10]Kawakita T,Shiraki K,Yamanaka Y,et al.Functional expression of TWEAK in human hepatocellular carcinoma:possibleimplicationincellproliferationandtumor angiogenesis[J].Biochem Biophys Res Commun,2004,318(3):726-733.
[11]Zou H,Wang D,Gan X,et al.Low TWEAK expression is correlated to the progression of squamous cervical carcinoma [J].GynecolOncol,2011,123(1):123-128.
[12]Ham ilton AJ,Baulcombe DC.A species of small antisense RNA in posttranscriptionalgene silencing in plants[J].Science,1999,286(5441):950-952.
[13]Hammond SM,Bernstein E,Beach D,et al.An RNA-directed nucleasemediatespost-transcriptionalgenesilencingin Drosophila cells[J].Nature,2000,404(6775):293-296.
[14]Zamore PD,Tuschl T,Sharp PA,et al.RNAi:double-stranded RNA directs the ATP-dependent cleavage ofmRNA at 21 to 23 nucleotide intervals[J].Cell,2000,101(1):25-33.
Construction and identification of Fn14-shRNA lentiviralvector
YU Tao,YANG Yunfeng,LIBing,CHEN Kai,ZHU Hui,ZHANGM ingzhu,ZHAO Youguang,YU Guangrong
DepartmentofOrthopaedics,TongjiHospital,TongjiUniversity School ofMedicine,Shanghai 200065,China
ObjectiveTo construct Fn14-shRNA lentiviral vector to further investigate the expression and biological significance of Fn14 in osteosarcomaw ith animal experiment.M ethods Fn14-shRNA vectorwas constructed by RNA interference technique,and viral packaging,cell co-transfection,and indentification were conducted.Results The single enzyme detection was positive,and the sequencing result was consistent w ith design.Fn14 was downregulated in stably transfected cell lines.Conclusion Fn14-sh RNA lentivirus recombinant vectors are successfully constructed,which lays the foundation for further study of the biologicalsignificance of Fn14 in osteosarcoma.
Osteosarcoma;Fibroblastgrow th factor-inducible14;RNA interference;Lentiviral
R681
A
2095-378X(2016)02-0096-06
10.3969/j.issn.2095-378X.2016.02.008
于涛(1985—),男,住院医师,博士,研究足踝外科、骨科创伤、骨肿瘤
俞光荣,电子信箱:yuguangrong@hotmail.com
(2016-01-18)
