夹脊电针联合甲强龙对急性脊髓损伤大鼠肢体运动功能及尼氏小体影响的实验研究*
2016-12-22李晓宁梅继林单筱淳梁雪松
李晓宁,吴 磊,梅继林,李 诺,单筱淳,梁雪松
1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
实验研究
夹脊电针联合甲强龙对急性脊髓损伤大鼠肢体运动功能及尼氏小体影响的实验研究*
李晓宁1,吴 磊2,梅继林2,李 诺2,单筱淳2,梁雪松2
1.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:观察夹脊电针联合甲强龙治疗对急性脊髓损伤大鼠肢体运动功能和神经细胞尼氏小体的影响。方法:将72只雌性Wistar大鼠随机分为假手术组、模型组和夹脊电针联合甲强龙组,每组分1天、3天、7天和14天4个亚组,每个亚组6只。NYU打击器制备急性脊髓损伤模型。假手术组仅暴露脊髓,不进行打击,常规饲养至相应时间点;模型组暴露脊髓并进行打击,造成ASCI模型后常规饲养;夹脊电针联合甲强龙组造模后给予夹脊电针治疗,每次30 min每日1次,并于术后30 min给予实验大鼠一次性注射甲基强的松龙30 mg/kg。用BBB评分观察急性脊髓损伤大鼠肢体运动功能,Nissl染色观察各组大鼠脊髓组织神经细胞尼氏小体的变化。结果:BBB评分结果显示,模型组大鼠BBB评分较假手术组显著降低(P<0.05);经治疗后,夹脊电针联合甲强龙组3天、7天、14天组BBB评分显著升高(P<0.05),且14天评分高于3天组(P<0.05)。Nissl染色结果可见,模型组大鼠1天时神经细胞胞体肿胀变形,尼氏小体肿胀破碎,神经细胞数量减少;3天时神经细胞胞体破坏明显,核仁消失,受损神经细胞明显增多;7天时神经细胞紧缩,尼氏小体溶解破碎,数量减少;14天时神经细胞紧缩更加明显,胞浆深染。夹脊电针联合甲强龙组尼氏小体破碎溶解减轻,尼氏小体数量较模型组增多,神经细胞形态较好。结论:夹脊电针联合甲强龙治疗可以通过增加尼氏小体数量,从而改善脊髓神经细胞形态,保护受损神经细胞,改善ASCI大鼠肢体运动功能。
急性脊髓损伤;夹脊穴;电针;甲强龙;Nissl染色
急性脊髓损伤(ASCI)年发病率约为(20~40)/100万[1],由脊髓受损所致的永久性神经功能障碍一直是世界医学的难题[2-3]。由于其高致残率和死亡率,给患者家庭和社会造成了沉重的经济负担,因此积极寻求有效的治疗手段具有重要的临床意义。目前,对于ASCI的治疗主要包括手术干预、药物治疗、细胞移植治疗等[4],药物治疗中甲强龙是临床运用较广的一种类固醇激素类药物,但目前对其临床获益、使用剂量及时间等问题仍存在较大争议[5],这也限制了其临床应用。
夹脊穴是祖国医学治疗督脉损伤的常用穴,随着对夹脊电针治疗急性脊髓损伤的机制研究逐渐深入[6-7],运用夹脊电针治疗急性脊髓损伤越来越引起人们的重视,并被运用于临床实践[8]。急性脊髓损伤后挽救受损神经细胞是恢复脊髓功能的结构基础,而尼氏小体的数量和形态能够反应急性脊髓损伤后神经细胞的功能状态。本研究运用夹脊电针联合甲强龙治疗急性脊髓损伤大鼠,观察两者联合运用对急性脊髓损伤大鼠肢体运动功能及尼氏小体的影响,为夹脊电针更好的应用临床提供实验依据。
1 材料与方法
1.1 动物与分组
清洁级雌性Wistar大鼠72只,体质量(200±10)g,由辽宁长生生物技术有限公司(许可证号2015-0001)提供,保持实验动物水与粮食充足。大鼠在实验室常规饲养适应1周后,按照随机数字表法分为3组4个时间点,分别为假手术组(24只)、模型组(24只)、夹脊电针组(24只),治疗时间点为1天、3天、7天和14天。选取BBB评分为1~3分的ASCI大鼠入组,手术大鼠单笼饲养,苦味酸染色标记编号。实验过程中严格按照《关于善待实验动物的指导性意见》[9]对动物进行处置。
1.2 主要试剂及仪器设备
二甲苯(X112051,国药集团化学试剂有限公司);甲酚紫(71044080,国药集团化学试剂有限公司);冰醋酸(FX11610,天津科密欧化学试剂有限公司); NYU打击器(Impactor Model-Ⅲ 029,USA);石蜡切片机(RM2235,德国 Leica);电热恒温鼓风干燥箱(QH01-9030A,上海精宏实验设备);电热恒温培养箱(DH36001B,天津泰斯特);显微镜(DP73,日本 Olympus);电针仪(KWD-808-Ⅱ,中国英迪); 针灸针(0.35 mm×13 mm,苏州医疗用品有限公司)。
1.3 模型制备
1.3.1 造模方法[10]采用美国Impactor Model-Ⅲ spinal cord contusion system 打击器,计算机程控下精确打击制作大鼠 ASCI 模型(T10,中度损伤)。用10%水合氯醛腹腔麻醉(3.5 ml/kg),俯卧固定,背部去毛,皮肤常规消毒,铺巾。以肋弓下缘作为第8肋的标记,沿肋骨定位其椎骨,选取后背正中切口,在第10胸椎上1.5 cm下1.5 cm切长约3 cm的纵行切口,纵行切开皮下肌筋膜,暴露T9~11棘突,钝性分离肌肉至关节突,充分暴露棘突和椎板,在T10部位行椎板摘除术,暴露脊髓但不破坏硬脊膜。将大鼠固定于打击器基座上,设置打击参数,调整脊髓与打击棒位置,释放脊髓棒,设置零点等,打击脊髓。打击棒以10 g×50 mm势能撞击以T10为中心段脊髓,造成该段的急性脊髓中度损伤,生理盐水冲洗伤口及清除残留血液,伤口部位常规分层缝合。
1.3.2 NYU打击器撞击成功标志 当打击棒接触到脊髓与探针形成回路后会发出警报声;撞击完成后电脑描记撞击曲线,撞击高度和速度在正常误差范围内;大鼠可有身体痉挛性颤动及硬脊膜内充血或血肿。满足以上条件即为撞击成功。
1.3.3 模型成功标志 待大鼠清醒后,分别进行BBB评分,选择BBB评分在1~3分入组,造模未成功按照随机方法选择大鼠进行补充,造模后大鼠单笼饲养。
1.3.4 术后动物护理 术后腹腔注射生理盐水0.5 ml补充体液,于次日给予大鼠前肢青霉素20万U肌肉注射(体重为200 g),1次/天,连续3天。次日开始按摩大鼠腹部,协助排尿、排便,每日早晚各1次,持续至大鼠能自主排尿排便。观察手术切口有无异常、腹部皮肤有无压疮或感染、下肢有无溃烂等,注意鼠笼清洁卫生,隔日换1次垫料。每次抓取大鼠动作要轻柔,避免牵拉损伤脊髓。
1.4 各组处理方法
假手术组:仅暴露脊髓,不进行打击,手术后常规饲养,不予任何处置。
模型组:暴露脊髓并打击,造成ASCI大鼠模型,模型制备成功后单笼饲养,不予任何处置。
夹脊电针联合甲强龙组[11]:夹脊电针治疗:于模型制备成功后3 h进行夹脊电针早期干预治疗,此后每日1次,直至疗程结束。针刺穴位选取T9、T11节段夹脊穴。操作方法:将0.35 mm×13 mm毫针直刺入所选穴位下4~5 mm,接通电针仪正负两极,正极在上、负极在下,然后打开电流输出旋钮,电流输出强度以大鼠耐受、不出现强烈挣扎、背部肌肉轻微抽动为度(强度约0.4~0.6 mA)。电针仪脉冲波型:连续波,脉冲宽度:(0.5±0.15)ms,脉冲重复频率:100 Hz,由电位器FREQ连续可调,脉冲峰值:Vp1≥(40±10)V(在500负载下),刺激时长为30 min/次/日。甲强龙治疗:术后30 min时,给予实验大鼠一次性注射甲强龙,按30 mg/kg与9/L生理盐水配置成0.5 ml注射液,给予大鼠腹腔注射。
1.5 实验大鼠BBB评分
大鼠脊髓损伤后,对后肢运动情况的观察和评价采用Basso、Beattie和Bresnahan(BBB)分级法[12]进行。BBB分级法被认为是评价大鼠脊髓损伤后肢体功能十分有效的一种方法。在实验过程中,笔者采用3位熟悉该评分、但不熟悉实验设计的其他实验人员按BBB评分标准,通过观察大鼠的髋、膝、踝关节行走、躯干运动及协调情况,判断损伤大鼠分数。1分:1或两个关节轻微运动,通常为髋和/或膝关节;2分:1个关节广泛活动或1个关节广泛活动且有另一关节轻微活动;3分:两个关节广泛活动。
1.6 动物取材及指标检测
大鼠在实验治疗结束后,于相应时间点用10%水合氯醛腹腔麻醉(3.5 ml/kg),然后断头处死,于冰盒上快速取出损伤处脊髓,长度约4 cm,从损伤中心处迅速切开,置入4%多聚甲醛缓冲液中固定后4℃冰箱备用。经脱水、透明、透蜡、包埋、切片及烘干等步骤制备石蜡切片,层厚5 μm。常规切片脱蜡至水,切片用吸水纸擦干,免疫组化笔在组织周围画圈,防止滴加液体外溢。将切片置于湿盒内,每张切片滴加0.5%的甲酚紫溶液直至覆盖整个组织,室温下染色10 min。取出切片,蒸馏水快速冲洗,然后置于0.25%冰醋酸乙醇溶液中,分化数秒。常规脱水、透明、封片,显微镜下观察染色效果,并于200倍镜下拍照。
1.7 统计学分析
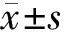
2 实验结果
2.1 大鼠BBB运动功能评分
BBB评分结果显示,术后各时间点,模型组大鼠运动功能评分显著降低,与假手术组比较差异有统计学意义(P<0.05)。治疗3天、7天、14天时间点,夹脊电针联合甲强龙组大鼠肢体运动功能评分升高,与模型组比较差异显著(P<0.05)。并且治疗14天组大鼠肢体运动功能评分与3天组比较差异显著(P<0.05)。以上结果表明,夹脊电针联合甲强龙组能改善大鼠脊髓损伤后肢体运动功能,治疗14天后疗效更加显著。见图1。
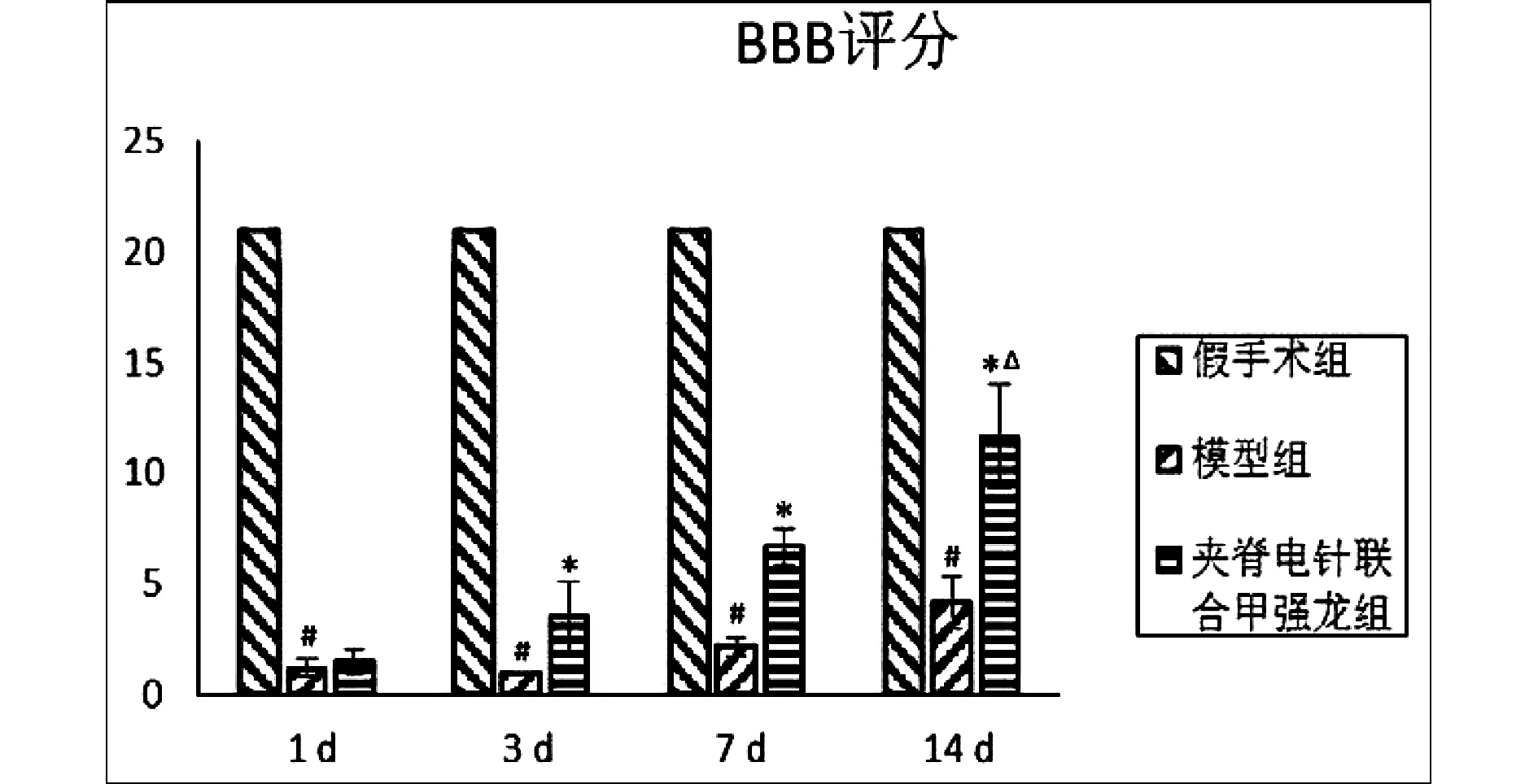
图1 各组大鼠运动功能评分比较只鼠/组) 注:与假手术组比较,#P<0.05;与模型组比较,*P<0.05;与3 d亚组比较,△P<0.05
2.2Nissl染色观察各组大鼠脊髓组织神经细胞变化结果
尼氏小体主要分布在胞浆中,染色后可呈蓝紫色,是神经细胞功能活性的形态指标,尼氏小体数量多,表明神经细胞合成蛋白质功能较强。染色结果显示:假手术组细胞结构正常,尼氏体数量较多,分布清晰,排列整齐,胞体呈斑驳的蓝紫色染色。1天的模型组细胞结构破坏,胞体肿胀变形或萎缩,细胞核周边尼氏小体肿胀破碎,大量集聚,神经细胞数量减少;夹脊电针联合甲强龙组损伤略轻,损伤神经细胞数量减少,保留的神经细胞形态较好。3天的模型组神经细胞结构破坏明显,胞体中央因尼氏小体从核周逐渐消失呈泥沙样,甚至染色已不明显,损伤神经细胞明显增多;夹脊电针联合甲强龙组细胞形态略好于模型组,尼氏小体相对模型组略有增加,染色加深,损伤神经细胞数量减少。7天的模型组神经细胞紧缩,尼氏小体数量减少,胞浆染色变浅;夹脊电针联合甲强龙组神经细胞形态较好,可见尼氏小体数量明显增加、集聚,胞浆深染。14天的模型组神经细胞胞体紧缩,尼氏小体有所增加,胞浆深染;夹脊电针联合甲强龙组存活神经细胞数量增加,形态较正常,尼氏小体数量明显增多呈斑块状,胞浆浓染,胞核可见。可见,ASCI后给予夹脊电针联合甲强龙治疗,能降低神经细胞损伤程度,改善神经细胞形态,防止尼氏小体破碎溶解,增加其数量,提高神经细胞功能活性。见封三彩图2。
3 讨论
急性脊髓损伤的发病机制主要包括原发性损伤和继发性损伤两大类,脊髓损伤后多种不利因素均通过促进神经细胞坏死和凋亡或者抑制神经细胞功能而导致严重的肢体运动功能障碍。由此可见,受损脊髓组织中神经细胞结构和功能完整是ASCI肢体运动功能恢复的基础。尼氏小体广泛存在于神经细胞胞体和轴突内,是神经细胞的特殊结构之一,尼氏小体的功能主要是合成蛋白质。在生理情况下,尼氏小体体积较大,而且数量多,说明神经细胞合成蛋白质的功能较强;相反,在神经细胞受到损伤时,尼氏小体的数量会减少甚至消失。因此,尼氏小体的数量和形态能够反应急性脊髓损伤后神经细胞的功能状态。前期研究表明[11],ASCI后1h即可有神经细胞形态的改变,因此积极寻求临床有效干预手段、增加ASCI后神经细胞尼氏小体数量、恢复受损神经细胞功能,对后期肢体运动功能恢复具有重要意义。
甲强龙是目前临床应用广泛的ASCI治疗药物之一,其作用机制主要包括减轻水肿、调节炎症反应、抑制脂质过氧化、保护神经细胞等。尽管NASCS通过3项大规模的临床研究制定了甲强龙在治疗ASCI患者时的应用标准,有学者研究结果显示在ASCI后48h以内使用NASCSIII推荐的剂量治疗后对患者神经功能的康复疗效甚微,然而却增加了伤口感染以及重症肺炎等并发症的风险[13],因此,这一临床治疗方案亟待优化。祖国传统医学认为急性脊髓损伤导致的截瘫是由于督脉受损导致经脉不通、阴阳失调、气血不达四末、筋脉肌肉失于气血濡养而致痿废不用。夹脊穴位于督脉两侧,内夹督脉,外循膀胱,督脉为人体“阳脉之海”,具有总督一身之阳经、调节阳经经气的作用;而膀胱经为多血之经,并行于督脉调节人体后部之阳气。夹脊电针可以疏通督脉及膀胱经之经气,起到振奋阳气使阴阳调和的作用,经气上下贯通,阳气得以通达四末,则痿病可愈。临床研究发现[14],夹脊电针能改善脊髓损伤患者下肢肢体运动功能,治疗前后ASIA运动评分、改良的Bathel指数均有明显升高,而改良的Ashworth指数明显下降。尹洪娜等[15]研究发现,夹脊电针治疗能够抑制脊髓损伤大鼠CHOP的表达,从而改善线粒体功能,保护受损神经细胞。
本研究结果显示:模型组大鼠BBB评分较假手术组显著降低(P<0.05);经治疗后,夹脊电针联合甲强龙组3天、7天、14天亚组BBB评分显著升高(P<0.05)。Nissl染色结果可见,模型组大鼠1天时神经细胞胞体肿胀变形,尼氏小体肿胀破碎,神经细胞数量减少;3天时神经细胞胞体破坏明显,核仁消失,受损神经细胞明显增多;7天时神经细胞紧缩,尼氏小体溶解破碎,数量减少;14天时神经细胞紧缩更加明显,胞浆深染。而夹脊电针联合甲强龙组尼氏小体破碎溶解减轻,尼氏小体数量较模型组增多,神经细胞形态较好。宋良玉[16]研究也发现,电针干预能够修复脊髓损伤大鼠脊髓前角神经细胞,增加神经细胞中尼氏小体的数量,与本研究结果一致。
综上所述,ASCI后运用夹脊电针联合甲强龙治疗可以显著改善肢体运动功能,其作用机制可能与增加尼氏小体数量有关,从而改善脊髓神经细胞形态、保护受损神经细胞。
[1] 徐秀梅,徐彦龙.康复训练结合针灸治疗脊髓损伤神经源性膀胱患者临床疗效观察[J].中国针灸,2015,35(7):670-673
[2]JainNB,AyersGD,PetersonEN.TraumaticspinalcordinjuryintheUnitedStates,1993-2012[J].JAMA,2015,313(22):2236-2243
[3] 王永杰,洪毅,陈学明,等.周围神经电刺激对脊髓损伤大鼠轴突再生的影响[J].中国康复理论与实践,2016,22(8):884-891
[4] 杨杰,丁明甫.脊髓损伤治疗的进展与策略[J].检验医学与临床,2016,13(8):1134-1136
[5]BrackenMB.Steroidsforacutespinalcordinjury[J].CochraneDatabaseSystRev,2012,1:CD001046
[6] 李波霖,周宾宾,金昕.电针刺激不同穴位治疗脊髓损伤机制实验研究进展[J].针灸临床杂志,2015,31(5):75-78
[7] 张林,孙忠人,陈晨,等.近10年电针治疗脊髓损伤机制的实验进展[J].针灸临床杂志,2012,28(1):62-65
[8] 李晓宁,迟蕾.夹脊配合督脉电针治疗脊髓损伤后功能障碍临床观察[J].上海针灸杂志,2015,34(10):972-975
[9] 科学技术部.关于发布《关于善待实验动物的指导性意见》的通知[J].畜牧兽医科技信息,2007,12(4):35-36
[10]Alvarez-MejiaL,MoralesJ.Functionalrecoveryinspinalcordinjuredratsusingpolypyrrole/iodineimplantsandtreadmilltraining[J].JMaterSciMaterMed,2015,26(7):209
[11] 綦雪巍.夹脊电针联合MP调控NMDAR/Calpain通路相关蛋白抑制ASCI大鼠微环境神经细胞凋亡作用机制研究[D].哈尔滨:黑龙江中医药大学,2016
[12]BassoDM,BeattieMS,BresnahanJC.GradedhistologicalandlocomotoroutcomesafterspinalcordcontusionusingtheNYUweightdropdeviceversustransection[J].ExpNeurol,1996,139(2):244-56
[13]ColemanWP,BenzelD,CahillDW,etal.Acriticalappraisalofthereportingofthenationalacutespinalcordinjurystudies(IIandIII)ofmethylprednisoloneinacutespinalcordinjury[J].JSpinalDisord,2000,13(3):185-199
[14] 霍会霞.头电针配合夹脊电针治疗脊髓损伤后下肢运动功能障碍的临床观察[D].哈尔滨:黑龙江中医药大学,2014
[15] 尹洪娜,孙忠人,李全.电针夹脊穴对脊髓损伤大鼠内质网应激相关因子CHOP影响的实验研究[J].中医药信息,2016,33(4):35-38
[16] 宋良玉.不同电针对脊髓损伤14天后大鼠再生修复的机理研究[D].北京:北京中医药大学,2016
国家自然科学基金项目,编号:81373715;哈尔滨市科技创新人才项目,编号:2016RAXYJ090。
李晓宁(1969-),女,教授,博士研究生导师,研究方向:针灸治疗神经系统疾病。
R246.6
A
1005-0779(2016)12-0061-04
2016-07-25
