小叶章组培快繁体系的研究
2016-12-21倪红伟徐明怡冷海楠
张 玉, 倪红伟, 隋 心,2, 徐明怡, 冷海楠
(1.黑龙江省科学院 自然与生态研究所,黑龙江 哈尔滨 150040;2.东北林业大学,黑龙江 哈尔滨 150040)
小叶章组培快繁体系的研究
张 玉1, 倪红伟1, 隋 心1,2, 徐明怡1, 冷海楠1
(1.黑龙江省科学院 自然与生态研究所,黑龙江 哈尔滨 150040;2.东北林业大学,黑龙江 哈尔滨 150040)

以野生小叶章幼嫩茎段为外植体,研究MS对外植体生长的影响。通过正交试验设计,研究不同种类及浓度配比激素对丛生芽增殖和生根的影响。表明小叶章茎段用75%酒精消毒30 s,再经0.01 L汞溶液浸泡4 min的灭菌效果较好;茎段直接诱导不定芽的最适宜培养基为MS+0.05 mg/L KT+1.0 mg/L 6-BA+0.1 mg/L+TDZ 0.1 mg/L NAA,诱导率可达87.44%;最佳继代增殖培养基为MS+0.1 mg/L KT+0.5 mg/L 6-BA+0.05 mg/L TDZ+0.1 mg/L NAA,增殖系数可达5.76;生根最适宜培养基为0.5MS+2.0 mg/L NAA,生根率为93.33%。
小叶章; 茎段; 组织培养; 快速繁殖
0 引 言
小叶章(CalamagrostisangustifoliaKom.)是禾本科拂子茅属多年生根茎型草本植物,我国主要分布于东北、华北、内蒙古等地的平原低洼湿地,是三江平原典型草甸、沼泽化草甸的建群植物和优势植物[1-4]。小叶章具有重要的经济价值和生态价值,例如在东北草地地区其饲用价值仅次于羊草,同时它也是很好的水土保持植物和造纸等轻工业的良好原料[5]。近年来,由于三江平原大量湿地开垦成农田,使得湿地生态系统遭到严重破坏,湿地生物多样性降低,小叶章的种群受到严重的破坏,生态功能下降。因此,对小叶章的人工繁殖可以减少对野生资源的破坏,对于研究小叶章生理学、分子生物学具有重要的意义。
目前,对于小叶章的研究主要集中在种群特征[6-7]、生长动态[8]、温室气体排放[9]及土壤物质循环等方面[10],而关于小叶章的离体培养研究目前为止还没有,仅有同属的拂子茅是以茎尖为外植体材料,诱导获得愈伤组织,然后愈伤组织再分化成芽的方式进行的[11]。而利用植物离体器官直接再生不定芽具有培养时间短,不容易发生变异等优点[12-13]。鉴于此,本研究以小叶章幼嫩茎段为外植体,按正交试验设计筛选组织培养条件,通过直接诱导不定芽、继代增殖、生根和炼苗移栽等过程,从而建立小叶章的组织培养和快速繁殖体系,为小叶章的资源保护、基因工程研究提供可靠的理论基础。
1 材料与方法
1.1 试验材料
小叶章采自黑龙江省科学院自然与生态研究所三江平原湿地生态定位研究站——洪河国家级自然保护区内(47°49′N, 133°40′E,年均气温1.9 ℃,年均降水量500~650 mm)。选取当年新生无病虫害、生长健壮的幼嫩茎段作为外植体。本试验室内研究部分在黑龙江省科学院自然与生态研究所分子生物学实验室的组织培养实验室进行,扩繁部分在本所温室进行。
1.2 试验方法
1.2.1 培养基条件
以MS为基本培养基,添加蔗糖30 g/L和琼脂6 g/L,调整pH 5.5~5.8,配制分装后于121 ℃灭菌20 min。培养温度(25±2)℃,光照强度3 000 lx,光照16 h/d。
1.2.2 外植体处理
将采集的茎段去除叶片后,剪成4~6 cm长的茎段,用自来水冲洗10 min左右,再用适量的洗洁精水冲洗2遍,自来水冲洗干净后置于超净工作台中,用75%酒精浸泡30 s,无菌水冲洗2次;用0.1%HgCl2溶液消毒2、4、6、8、10、15 min,期间不断摇晃,无菌水冲洗5次,用无菌滤纸吸干表面水分,于消毒过的滤纸上切除上下切口处的褐化部分,将材料切成1.5~2.0 cm、带1或2个叶腋的茎段并吸干茎段上的水分,接种于初代培养基上。比较0.1%HgCl2不同消毒时间的灭菌效果,7 d后观察污染情况,14 d后统计污染率、成活率。
污染率(%)=(污染数/接种数)×100%
成活率(%)=(芽诱导直接成苗率/接种未污染芽数)×100%
1.2.3 初代培养
将消毒好的小叶章带腋芽茎段接种在初代诱导培养基MS,同时添加不同种类和浓度的激素。按照表1设计正交实验的因素和水平,采用L16(45)正交表设计初代诱导培养基(见表2)。每瓶一个茎段,每个处理接种30瓶,重复3次。4周后,腋芽萌发并伸长生长形成绿梢,获得的这些无菌苗用于进一步进行增殖实验的材料。
腋芽诱导率(%)=(萌芽的外植体数/接种外植体总数)×100%

表1 正交试验的因素和水平 mg/L

表2 按正交表设计的培养基配方 mg/L
1.2.4 继代增殖
采用L16(45)正交实验设计,以MS为基本培养基,设置KT(0.05,0.1 mg/L)、6-BA(0.1,0.5 mg/L)、TDZ(0.05,0.1 mg/L)、NAA(0.1,0.2 mg/L)四因素二水平共8个处理。每处理10瓶,每瓶接种1个芽丛,重复3次。培养30 d后统计增殖系数=培养30 d后的总芽数/接种时的芽数,并记录增殖芽生长情况。
1.2.5 生根培养
以0.5MS作为生根培养基,当继代苗长到约2 cm高、具2~4片小叶时,将植株从基部剪下,转接至添加不同浓度(0,0.1,0.5,1.0,2.0 mg/L)的NAA生根培养基中,每瓶接种1个茎段,每个处理10瓶,重复3次,并计算生根率和平均每株根数。
1.2.6 数据分析
实验结果采用Microsoft Excel 2003和DPS 7.5分析软件对试验数据进行处理与统计分析。
2 结果与分析
2.1 外植体的消毒处理
从表3可以看出,随着0.1% HgCl2消毒时间的增加,外植体污染率下降,而成活率先升后降,4 min时达到最高,71.6%,当消毒15 min时,外植体全部死亡,所以升汞溶液消毒的适宜时间为4 min。

表3 消毒时间对小叶章茎段灭菌效果的影响
2.2 初代培养
从表4可以看出,小叶章茎段在不添加植物生长调节剂的MS培养基中,茎段腋芽不萌发。在添加不同植物生长调节剂培养基上的诱导率为5.56%~87.44%。其中8号培养基上芽诱导率最高,为87.44%,培养效果较好(图1(b));其次是7号培养基,诱导率为59.89%。从各因素水平均值k的大小,比较四因素各水平求得最优水平组合仍为8号培养基;由R值大小可知,各因素不同水平对小叶章茎段腋芽诱导率的影响大小为:KT>TDZ>6-BA >NAA。对诱导率反正弦转换值方差分析(见表5),结果表明,KT、TDZ、6-BA和NAA浓度对小叶章茎段腋芽诱导率都有显著影响(P<0.05),且8号培养基与其他培养基的差异显著(见表4)。
2.3 继代增殖
将初代培养的腋芽切下接到继代增殖培养基中,由表6可以看出,影响增殖系数的主要因素是6-BA>KT>NAA>TDZ。由方差分析表7可知,除了TDZ对小叶章的增殖影响不显著(P>0.05)外,KT、6-BA、NAA对增殖系数的影响均达到显著水平。综合以上因素,7号培养基为最佳。
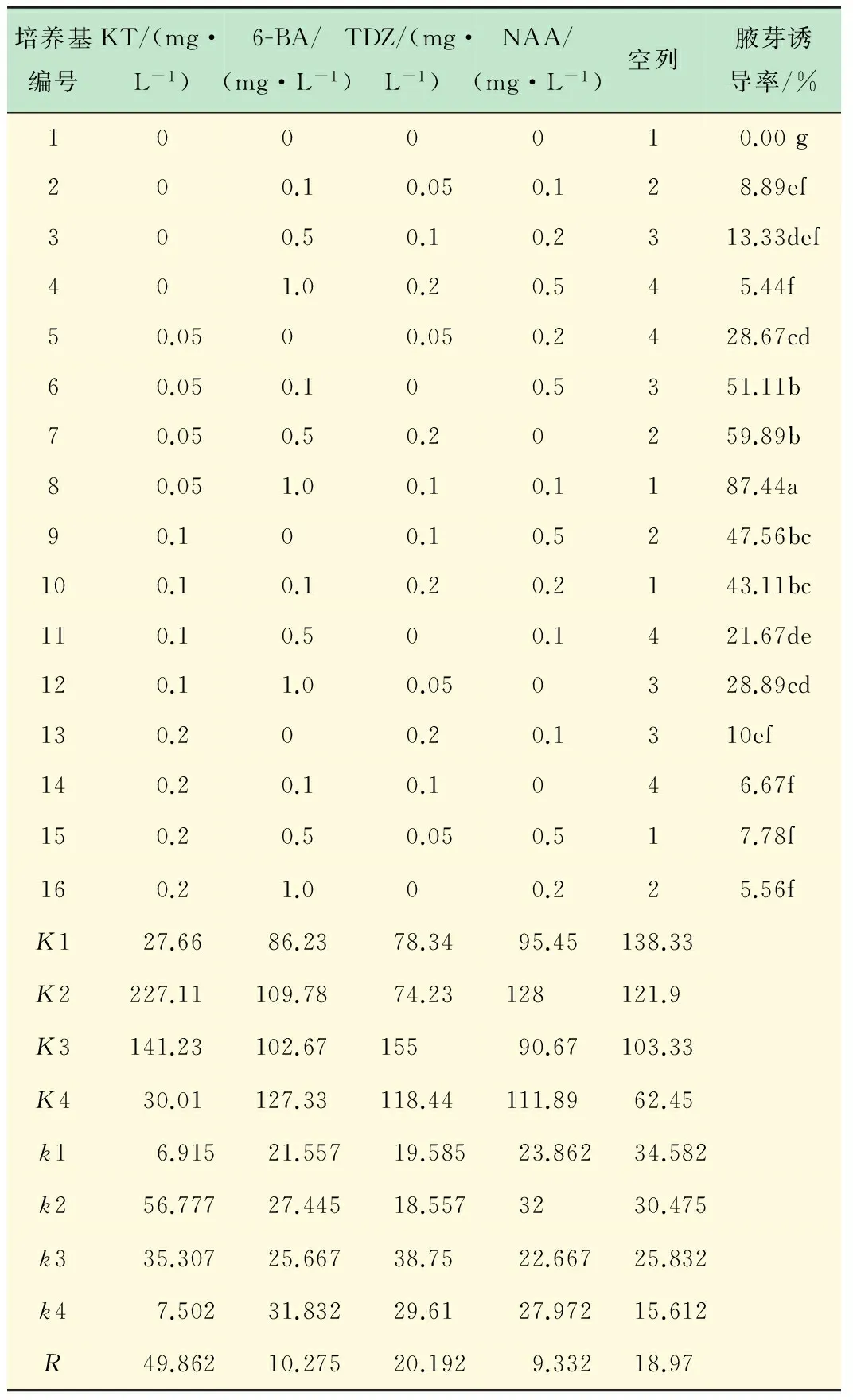
表4 不同植物生长调节剂对小叶章茎段初代培养的影响
注:K1、K2、K3、K4分别代表不同水平 4次诱导率之和;kl、k2、k3、k4分别代表不同水平均值诱导率;R代表平均极差(R=最大均值-最小均值), 同一列中不同字母表示数据差异显著(P<0.05)

表5 正交设计方差分析表(完全随机模型)
2.4 生根培养
由表8可见,不同浓度NAA对小叶章组织培养苗生根率的影响显著,其中,0.5MS+2.0 mg/L NAA培养基上培养30 d后,生根率最高,达到93.33%,根多且粗壮,植株生长健壮(图1(g))。

表6 正交试验不同培养基小叶章的增殖系数


(a) 刚接种的无菌外植体,(b) 茎段腋芽萌发,(c)、(d) 增殖培养,(e)、(f) 芽苗生根,(g)、(h) 生根苗移栽

表8 不同NAA浓度对小叶章生根培养的影响
3 讨 论
在植物组织培养中,外植体无菌体系的建立是很关键的一步。其中,适当的消毒时间和合适的消毒剂是非常重要的。本试验选取当年生长健壮的小叶章幼嫩茎段为外植体,在预试验中发现,使用2%的次氯酸钠消毒效果较差,污染率极高。而使用0.1%的升汞,污染率大幅降低,成活率较高,这与张娟等[11]在拂子茅茎尖作为外植体中的研究基本相似。所以,本试验中筛选出最佳的消毒处理方案为75%酒精30 s+0.1% HgCl24 min,该条件下植株成活率最高。
在植株分化过程中,通过调节生长素和细胞分裂素的比值,能调控植物细胞的生长和定向分化[14]。对大多数植物来说,为了达到腋芽萌发或者芽增殖的目的,采用一定浓度的单一细胞分裂素和生长素,就可以得到较好的效果。孙清荣等[15]在欧洲李的组织培养与快速繁殖中发现MS+BA 0.5 mg/L+IBA 0.1 mg/L增殖效果较好,红歌等[16]在单头亚菊组培快繁技术研究中提出MS+0.75 mg/L 6-BA+0.01 mg/L NAA,的组合就能得到较高的增殖率,但在小叶章组培试验中,用单一的细胞分裂素,分化率低,笔者猜测只有用一定浓度两种或两种以上的细胞分裂素结合较低浓度的生长素,才有可能找到最佳分化配方。因此,本试验采用6-BA、KT、TDZ及NAA组合试验,结果表明,MS+KT0.05 mg/L+6-BA 1.0 mg/L+TDZ 0.1 mg/L+NAA0.1 mg/L为最适外植体诱导培养基,诱导率达87.44%。
在生根培养过程中发现,生根培养基中适量降低无机盐的浓度能有效促进生根,因此,采用1/2MS作为基本培养基,小叶章的生根效果更好,这与王雪芳[17],赵智燕[18]在小花碱茅和高羊茅生根试验中的结果相一致。预试验中发现,单独使用IBA不能使小叶章组培苗生根,在培养基中加入2.0 mg/L的NAA后,生根效果最好,生根率明显提高,这与吴玲利等[19]在白木通生根过程中的研究相一致,说明NAA对小叶章的生根有明显的促进作用。
4 结 语
本研究通过小叶章组培快繁各个阶段最佳培养基的筛选,建立稳定而高效的小叶章组织培养与快速繁殖体系,为小叶章的遗传改良提供技术支持,有利于促进小叶章基因工程的深度开发。
[1] 倪红伟. 三江平原典型草甸小叶章种群地上器官生物量及其分层结构[J]. 植物研究,1996,16(3):356-362.
[2] 倪红伟,臧淑英,高亦珂.三江平原沼泽化草甸小叶章种群地上生物量及其生长速率季节动态的研究[J]. 植物研究,1996,16(4):122-128.
[3] 倪红伟,张 兴,贾 利. 三江平原典型草甸小叶章种群地上生物量动态[J]. 植物研究,1998,18(3):72-79.
[4] 王建波,倪红伟,付小玲.大气CO2浓度升高对小叶章光合色素含量和光合参数的影响[J]. 国土与自然资源研究,2013(1):82-83.
[5] 钟章成, 曾 波. 植物种群生态研究进展[J]. 西南师范大学学报(自然科学版), 2001(2): 230-236.
[6] 高福元,石福习. 基于不同零模型的三江平原沼泽湿地主要物种小尺度点格局分析[J].生态学报, 2015,35(7):2029-2037.
[7] 倪红伟,郭亚胜,吴海一. 小叶章种群分布格局的分形特征Ⅱ信息维数与关联维数[J]. 植物研究,2000,20(3):351-354.
[8] 孙志高,刘景双,杨继松. 三江平原小叶章湿地种群生物量结构动态与生长速率分析[J]. 草业学报,2006,15(2): 21-29.
[9] Zhang L,Song C,Zheng X,etal. Effects of nitrogen on the ecosystem respiration,CH4and N2O emissions to the atmosphere from the freshwater marshes in northeast China[J]. Environmental Geology. 2007,52(3):529-539.
[10] Wang J,Zhu T,Ni H,etal. Effects of elevated CO2and nitrogen deposition on ecosystem carbon fluxes on the Sanjiang plain wetland in Northeast China[J]. PLo S One, 2013, 8(6): e66563.
[11] 张 娟,韩 蕾,巨关升.拂子茅组培再生体系的建立[J]. 广东农业科学,2010(11):123-125.
[12] 陈怡佳,崔媛媛,张晓明. 美国红叶紫薇的组织培养与快速繁殖[J]. 植物生理学报, 2015,51(6): 882-886.
[13] 林 青,吴玲利,张 琳,等. 油桐叶柄高效直接再生体系的建立[J]. 植物生理学报,2014,50(10):1608-1612.
[14] 李伟玲,刘 君,于景金,等.海滨雀稗再生体系的建立[J]. 中国草地学报,2013,35(4):19-24.
[15] 孙清荣,王金政,薛晓敏,等. 欧洲李‘红艳1号’的组织培养与快速繁殖[J]. 植物生理学报,2015, 51(7): 1024-1028.
[16] 红 歌,吴潇波,谢 菲,等. 单头亚菊的组织培养与快速繁殖[J]. 植物生理学报,2013,49(12):1359-1362.
[17] 王雪芳,王春梅,张金林,等.小花碱茅组织培养植株再生体系的建立[J]. 草业学报, 2014,23(6): 355-360.
[18] 赵智燕,潘俊松,何亚丽,等.两个高羊茅无性系的营养器官组织培养及再生体系的建立[J]. 草业学报,2009,18(5):168-175.
[19] 吴玲利,柯镔峰,龚 春,等.白木通组织培养及快速繁殖[J].植物生理学报,2015,51(6): 903-908.
Tissue Culture and Rapid Propagation of Calamagrostis Angustifolia
ZHANGYu1,NIHong-wei1,SUIXin1,2,XUMing-yi1,LENGHai-nan1
(1. Institute of Natural Resources and Ecology, HAS, Harbin 150040, China; 2. Northeast Forestry University, Harbin 150040, China)
In order to provide experimental and technological basis for Calamagrostis Angustifolia community propagation, protection and sustainable development, this study explored the techniques of in vitro propagation of Calamagrostis Angustifolia using stem segments, and MS(as basal medium) to find the most suitable time for surface sterilization of explants. The effects of different plant growth regulators on buds multiplication and root formation were studied by orthogonal design method. It found that the best sterilization method for Calamagrostis Angustifolia was to soak explants into 75% alcohol for 30s and 0.1% HgCl2 for 4 min after pretreatment. The best medium for the buds induction was MS+KT0.05 mg/L+6-BA 1.0 mg/L+TDZ 0.1 mg/L+NAA0.1 mg/L, by which the induction rate was 87.44%; the optimal medium for subculture was MS+0.1 mg/L KT+0.5 mg/L 6-BA+0.05 mg/L TDZ+0.1 mg/L NAA, by which the multiplication coefficient was 5.76; the best rooting medium was 1/2MS+2.0 mg/L NAA, by which the rooting rate was 93.33%.
Calamagrostisangustifolia; stems; tissue culture; rapid propagation
2015-11-23
国家自然科学基金项目(No.31470019);黑龙江省财政应用技术专项(STJB16-01);黑龙江省科学院创新基金资助项目
张 玉(1983-),女,黑龙江东宁人,硕士, 助理研究员,主要从事分子生态方向研究。
Tel.:15124502196;E-mail:lengning1029@126.com
倪红伟(1964-),男,黑龙江双城人,博士,研究员,主要从事湿地生态学研究。E-mail: nihongwei2000@163.com
Q 938
A
1006-7167(2016)08-0047-05
