种植菠菜和生菜对土壤可培养细菌多样性的影响
2016-12-21刘一倩马挺军郎丹丹巩翰颖易欣欣
刘一倩, 常 青, 马挺军, 郎丹丹, 巩翰颖, 易欣欣
北京农学院食品科学与工程学院, 北京 102206
种植菠菜和生菜对土壤可培养细菌多样性的影响
刘一倩, 常 青, 马挺军, 郎丹丹, 巩翰颖, 易欣欣*
北京农学院食品科学与工程学院, 北京 102206
为了研究种植生菜和菠菜对土壤可培养细菌多样性的影响,了解这两种蔬菜种植对土壤可培养细菌的改变情况,利用R2A培养基,分离细菌菌株,基于16S rRNA基因比对的系统发育分析对菌株进行初步鉴定。种植生菜的土样分离到109株细菌,这109株细菌主要分属4个门,19科,23属。种植菠菜的土壤样品共分离得到126株细菌,主要分属3个门,16科,21属。门水平上,种植生菜的土壤中优势菌为厚壁菌门(Firmicutes,39.4%),放线菌门(Actinobacteria,33.9%)和变形菌门(Proteobacteria,24.8%);种植菠菜的土壤样本中优势菌为放线菌门(64.3%),厚壁菌门(27%)和变形菌门(8.7%)。在属水平上,两类土样分离得到的菌株类别和数量的差异更大。
细菌多样性;菠菜;生菜;土壤细菌
随着生活条件的提高,人们对营养健康的饮食方式越来越重视,蔬菜的消费量也快速增长。据统计,我国蔬菜播种面积由1980年的316万hm2增加至2003年的1 800万hm2[1~4]。北京地区京郊种植蔬菜尤其是叶类蔬菜较多,通州区漷县镇徐官屯村、顺义杨镇等地都常年生产叶类蔬菜,有些村镇甚至专门生产某种蔬菜,如生菜、芹菜和油菜等,形成了一些有特色的专业蔬菜生产村。其中京郊生菜的种植面积在最近10年来上升很快,到2013年北京市生菜种植面积达5 666.7 hm2,总产量达20.4万t[5],有些农户甚至一年连续种植几茬生菜,经过近几年的连续高强度种植,生菜的连作障碍已经非常明显。
有研究显示蔬菜生产中的连作障碍因素有很多,包括植物根系分泌及植物残体腐烂形成的化感物质引起的自毒作用、土壤理化性状恶化和土壤微生物群落失衡土传病害病原菌增加[6,7]等。目前尚未发现非常有效的解决连作障碍的方法,大多采取综合治理,从栽培管理如轮作、增加施肥量、增加农药使用量等手段暂时缓解。土壤微生物群落平衡问题目前被认为是连作障碍的一个主要方面,要解决这一问题,寻找能够与生菜土壤微生物互补的蔬菜品种进行轮作,不仅可以及时缓解或恢复因生菜种植导致的土壤微生物改变,进而缓解或解决土壤微生态的失衡程度,降低生菜种植过程中病害发病率,少用或不使用农药,在食品安全的第一关即生产关口保证食品的安全性,合理轮作还可以保持土壤微生物群落平衡,改善土壤质量,实现土壤的可持续发展。
目前还没有文献专门研究生菜的种植对土壤微生物群落多样性的影响[8]。菠菜是第一个与生菜同时试种的蔬菜,选择菠菜与生菜作为研究对象,主要因为它们是京郊种植面积较大的蔬菜,在分类学上的亲缘关系较远,其对土壤微生物群落的影响差异可能更为明显。本文初步研究了种植这两种蔬菜对土壤细菌多样性的影响,以期为今后进一步研究蔬菜合理轮作做准备。
1 材料与方法
1.1 材料
1.1.1 土壤样品 本次实验10个土壤样品,生菜、菠菜各5个,来自2014年12月同一地块采集的表层0~20 cm土壤样品,该地块在2014年3~5月分别于相邻地块同时栽种1次生菜和菠菜,6~8月土地闲置,9~12月在原来位置分别栽种第2次生菜和菠菜。第2次收获后采集土壤样品。种植每一种蔬菜的土壤都采用五点采样法,使用土壤采样器采样,土壤样品装入自封的无菌采样袋封口。在实验室将每种土壤样品分为3份,1份分离可培养细菌的样品于4℃暂存;另1份样品于4℃保存备用;第3份样品于-40℃冻存。分离细菌时将种植每种蔬菜的5点土壤样品混合为1个土壤样品,最终获得2个直接用于分离的土壤样品。
1.1.2 分离培养基 分离培养基为R2A培养基[9]:酵母膏0.50 g,月示蛋白胨0.50 g,酸解酪蛋白0.50 g,葡萄糖0.50 g,可溶性淀粉0.50 g,丙酮酸钠0.30 g,K2HPO40.30 g,MgSO4·7H2O 0.05 g,蒸馏水1 000 mL。
1.1.3 实验试剂及仪器TaqPCR Mastermix和细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司);细菌通用PCR引物由上海生工合成;小型台式高速冷冻离心机(Eppendorf公司);Bio-Rad的PCR仪;德国MMM Incucell系列恒温培养箱。
1.2 方法
1.2.1 生菜与菠菜种植方式 试验地点位于北京市昌平区崔村镇麻峪村,生菜品种为“美国大速生”,菠菜品种为“京菠3号”,试验于2014年3~12月进行。第一茬(春茬)3~5月,第二茬(秋茬)9~12月,夏季闲田。生菜采用128孔穴盘育苗后定植,菠菜直播后间苗。生菜株距25 cm,行距35 cm;菠菜株距20 cm,行距25 cm。生菜与菠菜中间设3 m隔离区,试验期间未使用任何农药和肥料,人工除草。
1.2.2 菌株分离、纯化及保藏 称取10 g土壤样品至90 mL无菌生理盐水中,室温摇匀30 min,取1 mL至装有9 mL无菌生理盐水的试管中,混匀,梯度稀释7次后,每个试管中取100 μL样品稀释液涂布平板28℃培养7~20 d。 挑取单菌落,采用相同的培养基进行划线分离纯化(5~6次),革兰氏染色后采用光学显微镜检查纯度。获得的纯培养制成斜面、平板和甘油管保藏备用。
1.2.3 基于16S rRNA基因序列的多样性分析 采用细菌基因组DNA提取试剂盒提取纯培养物的基因组DNA,进行PCR扩增,扩增产物送交博迈德公司测序。采用细菌通用引物为正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R:5′-GGTTACCTTGTTACGACTT-3′[10]。采用正向引物测一个反应进行细菌多样性分析。采用ClustalX进行序列比对,RDP-Classifer(http:// rdp.cme.msu.edu)进行同源性分析,Mega构建系统发育树。用Excel计算Simpson指数和Shannon-Wiener指数[11]。
2 结果与分析
2.1 种植生菜的土样细菌多样性结果
种植生菜的土样分离到109株细菌,16S rDNA测序结果比对分析发现,这109株细菌主要分属4个门,19科,23属。这些可培养细菌菌株大多分布在厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)4大类群,见图1。Simpson

图1 生菜土样分离菌株在门水平的分布Fig.1 Strain number distributed in phyla of lettuce planting soil.
指数为0.848,Shannon-Wiener指数为2.49。系统发育树见图2。
2.1.1 厚壁菌门(Firmicutes) 分离得到的菌株中有43株属于该类群,主要分布在3个属,见表1,占该土样所有分离获得纯培养菌株的39.4%,是本研究中发现的优势类群。其中,分离获得的芽孢杆菌属(Bacillus)菌株不仅是厚壁菌门中最大的一个类群,还是生菜土样中第一位的优势种群,共有39株,占该类群的90.6%;占该土样所有分离菌株的35.8%。
2.1.2 放线菌门(Actinobacteria) 此类群包含37株纯培养细菌,主要分属9个属,见表2,占该土样所有获得纯培养的33.9%。 其中链霉菌属(Streptomyces)、节杆菌属(Arthrobacter)和微杆菌属(Microbacterium)获得菌株最多,分别为11株、8株和7株。链霉菌属可以分解木质素,在土壤矿化中起重要作用,亦是抗生素的主要来源类群[12]。
2.1.3 变形菌门(Proteobacteria) 该类群中共分离获得27株纯培养,主要分布在10个属,见表3。占该土样所有分离获得菌株的24.8%。这些菌株属于3个亚纲:α-Proteobacteria、β-Proteobacteria和γ-Proteobacteria,分离纯培养数量分别为11、4、11,占该类群的比例为40.7%、14.8%、40.7%。其中,α-Proteobacteria和γ-Proteobacteria是优势种群。
2.1.4 拟杆菌门(Bacteroidetes) 该类群只分离到1株纯培养,属于鞘氨醇杆菌属(Sphingobacterium)。
2.2 种植菠菜土样的细菌多样性结果
种植菠菜的土壤样品共分离得到126株细菌,经16S rRNA基因序列比对分析,这126株细菌主要分属3个门,16科,21属。这些细菌菌株分布在放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)3大类群,见图3。 Simpson指数为0.812,Shannon-Wiener指数为2.16。系统发育树见图4。

图2 种植生菜土壤细菌菌株16S rDNA序列的系统发育树Fig.2 Neighbour-Joining phylogenetic tree based on 16S rDNA of lettuce planting soil isolates.
2.2.1 厚壁菌门(Firmicutes) 分离得到的菌株中有34株属于该类群,见表1,占该土样所有分离获得纯培养的27%,这34株纯培养主要分布在5个属,是种植菠菜土壤样品中发现的第二大优势类群。其中,亦是芽孢杆菌属(Bacillus)为该类群中菌株数最多的一个属,共有24株菌株,占该类群的70.6%。
表1 厚壁菌门类群中菠菜生菜土样菌株在属水平的分布
Table 1 Genera distributed in Firmicutes of spinach and lettuce planting soil.

属名生菜土样菌株数量菠菜土样菌株数量游动微菌属(Planomicrobium)21微小杆菌属(Exiguobacterium)1-芽孢杆菌属(Bacillus)3924类芽孢杆菌属(Paenibacillus)-5土地芽孢杆菌属(Terribacillus)-1厌氧芽孢杆菌属(Anaerobacillus)-1未确定菌株12共计4334
注:-:表示没有。
2.2.2 放线菌门(Actinobacteria) 此类群包含81株纯培养,主要分属9个属,见表2。占该土样所有获得纯培养的64.3%。 其中链霉菌属(Streptomyces)和节杆菌属(Arthrobacter)获得菌株最多,分别为45株和19株,分别占该类群的55.5%和23.4%。其中链霉菌属还是菠菜土样中第一位的优势种群,占该土样所有纯培养的35.7%。

图3 菠菜土样分离菌株在门水平的分布Fig.3 Strain number distributed in phyla of spinach planting soil.
2.2.3 变形菌门(Proteobacteria) 该类群中共分离获得11株纯培养,主要分布在7个属,见表3。占该土样所有分离获得菌株的8.7%。这些纯培养属于3个亚纲,α-Proteobacteria、β-Proteo-bacteria和γ-Proteobacteria,分离的细菌菌株数量分别为2、4、5,占该类群的比例为18.2%、36.4%、45.4%。其中,γ-Proteobacteria是优势种群。
2.3 种植生菜菠菜土壤样品的细菌多样性比较
在门的水平上,种植菠菜和生菜的土壤样本前三位的优势菌群都为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。然而,种植生菜的土壤样本分离得到的纯培养细菌位居第一位的是厚壁菌门(所占比例为39.4%),而后依次为放线菌门(所占比例为33.9%)和变形菌门(所占比例为24.8%);种植菠菜的土壤样本分离得到的纯培养细菌位居第一位的是放线菌门(所占比例为64.3%),而后依次为厚壁菌门(所占比例为27%)和变形菌门(所占比例为8.7%)。本研究发现,种植生菜后土壤细菌中前三大类优势门,虽然相互有所差异,但是基本是各占三分之一;种植菠菜后土壤细菌三大优势门中放线菌门比例超过60%,厚壁菌门大约还是三分之一,而变形菌门数量减少很多,仅占到不足10%。生菜土样还分离到1株拟杆菌门的纯培养,而菠菜土样并未分离到该类菌株。在门的水平上,生菜土样的多样性和类群之间的均衡程度都高于菠菜土样。
表2 放线菌门类群中菠菜生菜土样菌株在属水平的分布
Table 2 Genera distribution of Actinobacteria in spinach and lettuce planting soil.

属名生菜土样菌株数量菠菜土样菌株数量伦茨氏菌属(Lentzea)21链霉菌属(Streptomyces)1145原小单孢菌属(Promicromonospora)21亮杆菌属(Leucobacter)11农球菌属(Agrococcus)-1微杆菌属(Microbacterium)78考克氏菌属(Kocuria)11柠檬球菌属(Citricoccus)-3节杆菌属(Arthrobacter)819红球菌属(Rhodococcus)1-迪茨氏菌属(Dietzia)1-未确定菌株31共计3781
注:-:表示没有。
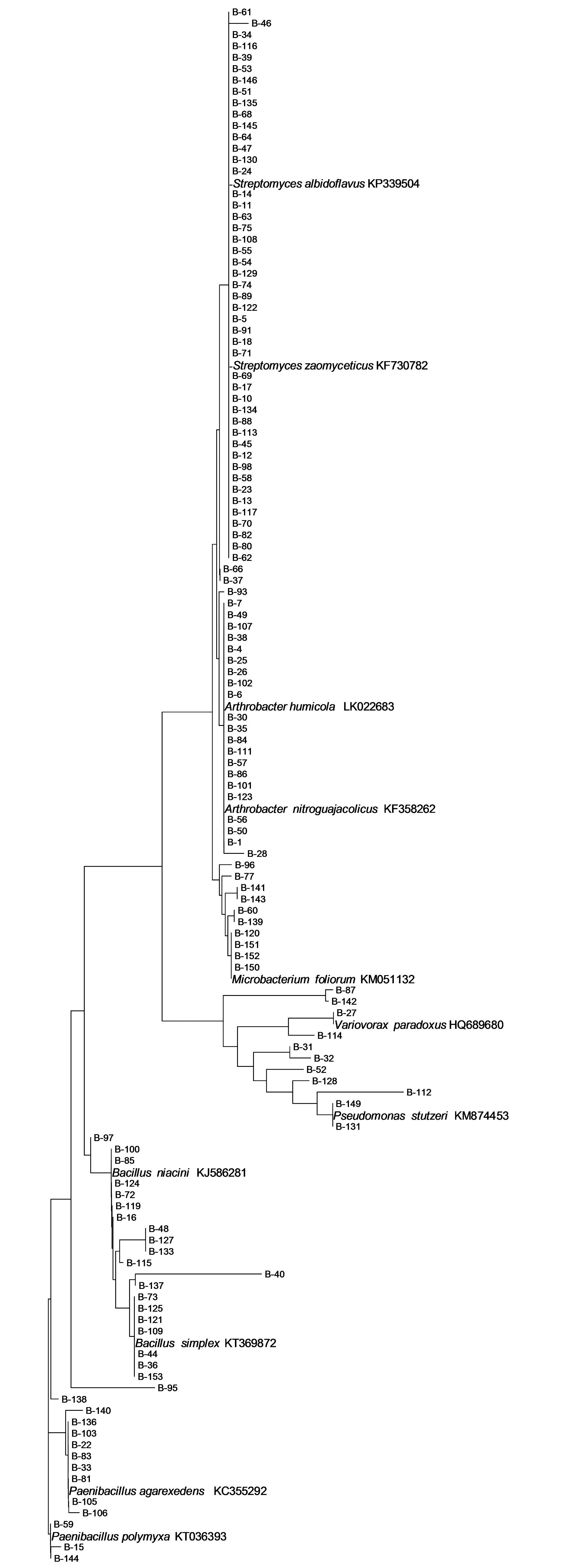
图4 种植菠菜土壤细菌16S rDNA序列的系统发育树Fig.4 Neighbour-Joining phylogenetic tree based on 16S rDNA of lettuce planting soil isolates.
厚壁菌门类群中,菠菜和生菜土样分离到的纯培养中一个极为明显的优势类别为芽孢杆菌属(Bacillus),这一属菌株数量远远高于该类群中其他属的数量。生菜中芽孢杆菌属(Bacillus)所占比例高达90.6%,菠菜土样中略低亦为70.6%。生菜土样中菌株主要分布在3个属,其中微小杆菌属(Exiguobacterium,1株)在菠菜土样中并未分离到;菠菜土样中菌株主要分布在5个属,其中厌氧芽孢杆菌属(Anaerobacillus,1株)、类芽孢杆菌属(Paenibacillus,5株)和土地芽孢杆菌属(Terribacillus,1株)在生菜土样中未分离到(表1)。这一类群中,无论生菜土样还是菠菜土样的菌株类别均衡程度都很差,菠菜土样的多样性略高于生菜土样。
放线菌门类群中,菠菜和生菜土样分离得到的纯培养主要分布在9个属,链霉菌属(Streptomyces)、节杆菌属(Arthrobacter)和微杆菌属(Microbacterium)位于前3位。但是,菠菜土样中,链霉菌和节杆菌两个属的数量远远大于第3位的微球菌属,农球菌属(Agrococcus,1株)和柠檬球菌属(Citricoccus,3株)在生菜土样中没有分离到;生菜土样中前3位链霉菌属、节杆菌属和微杆菌属相互之间的差异不大,红球菌属(Rhodococcus,1株)和迪茨氏菌属(Dietzia,1株)在菠菜土样中并未分离到(表2)。放线菌类群中,就多样性而言,生菜土样和菠菜土样差别不大,但是生菜土样类别之间的均衡程度高于菠菜土样。
变形菌门类群在菠菜土样纯培养中所占比例(8.7%)明显低于生菜土样(24.8%),菠菜土样中该类群的菌株主要分布在7个属,没有优势菌株,分布较为均衡,在纲的水平上,γ-变形菌纲(γ-Proteobacteria)所占比例最大,达到45.4%,埃希氏菌属(Escherichia,1株)和水栖菌属(Enhydrobacter,1株)在生菜土样中并未分离到;生菜土样中,α-变形菌纲和γ-变形菌纲所占比例相同(40.7%),都大于β-变形菌纲(14.8%),分离得到的菌株主要分布在10个属,其中有5个属在菠菜土样中未分离到:食酸菌属(Acidovorax,1株)、黄单胞菌属(Xanthomonas,1株)、肠杆菌属(Enterobacter,1株)、不动杆菌属(Acinetobacter,4株)和副球菌属(Paracoccus,7株)。 生菜土样分离到的α-变形菌纲的副球菌属(Paracoccus)有7株,数量位居该类群第1位,远远超过其他属的菌株数量,除该属外,其他属的菌株数量多在1~2株,较为均衡。这一类群中,无论菠菜土样还是生菜土样,菌株分布的均衡程度和多样性都较好,但是在这一类群中,两种土样分离获得的菌株在属的差别上很大,共同含有的属只有5种(表3)。
表3 变形菌门类群中菠菜生菜土样菌株在属水平的分布
Table 3 Genera distribution of Proteobacteria in spinach and lettuce planting soil.

属名生菜土样菌株数量菠菜土样菌株数量短波单胞菌属(Brevundimonas)42埃希氏菌属(Escherichia)-1水栖菌属(Enhydrobacter)-1假单胞菌属(Pseudomonas)22寡养单胞菌属(Stenotrophomonas)11贪噬菌属(Variovorax)21Massilia/Naxibacter12食酸菌属(Acidovorax)1-黄单胞菌属(Xanthomonas)1-肠杆菌属(Enterobacter)1-不动杆菌属(Acinetobacter)4-副球菌属(Paracoccus)7-未确定菌株41共计2711
注:-:表示没有;Massilia和Naxibacter属已合并为一属[13]。
目前土壤中不同门类菌株对土壤功能及蔬菜生长情况影响方面的研究很少,哪些门类的菌株对菠菜、生菜的生长具体有哪些作用尚需进一步研究。
3 讨论
有研究显示,韭菜和香蕉轮作地的细菌多样性较香蕉连作地更为丰富, 轮作地以变形菌门、拟杆菌门、放线菌门、酸杆菌门和绿湾菌门为主要类群;连作地的优势种群为厚壁菌门、变形菌门、绿湾菌门和放线菌门[14]。与黄瓜连作相比,毛苕子-黄瓜轮作可以显著增加根际细菌种类,减少结瓜后期的真菌种群[15]。张丽红等[16]的研究认为,用菊花—生菜—辣椒轮作处理可以促进有益微生物生长,同时抑制有害微生物的繁殖。吴艳飞等[17]对菠菜—白菜—黄瓜轮作研究表明,这种方式的轮作可以增加土壤微生物数量,抑制镰刀菌增殖。云南省的烤烟—苕子—水稻轮作土壤酶活性、细菌多样性最佳,具有潜在的推广价值[18]。由此可见,选择合适的作物进行轮作,可以有效缓解土壤微生物群落的失衡。
菠菜属藜科菠菜属,生菜属菊科莴苣属,虽然都归于叶菜类蔬菜,但是两者的生长对土壤可培养细菌多样性的影响并不相同。菌株在门水平上前三位的优势菌相同,均为放线菌门、厚壁菌门和变形菌门,这与茶树根际土壤可培养细菌分析结果相似[19]。塔吉克斯坦哈特隆州土壤可培养细菌中厚壁菌门超过80%[20],与菠菜土壤可培养细菌放线菌门占有超过60%的分析结果类似,都显示某一门类细菌有较大优势。而种植香蕉、马铃薯土壤[14,21]和温室黄瓜根际土壤[22]都显示厚壁菌门为主要细菌类群,这与生菜土壤样品分析结果类似。在属水平,生菜土样分离菌株数量最多的属为芽孢杆菌属,菠菜土样分离菌株芽孢杆菌属数量亦较多,但是位居第一位的却是链霉菌属。
土壤微生物数量众多、种类丰富,在维持土壤生态功能,尤其是元素循环中扮演着重要的角色[23],并且对植物健康起着重要的作用[24],同时由于其对环境变化敏感,微生物群落的改变可以从一定程度上反应土壤生态功能的变化[25,26]。菠菜与生菜种植后造成土壤中第一位的优势种出现变化,分析结果显示第一优势种所占比例很大,均超过30%。虽然有研究发现微生物群落存在功能冗余的现象[27],但微生物主要的种系型和类群是维持微生物群落功能的重要因素[28~30],土壤优势种比例占据三分之一强,土壤的生态功能或多或少总会受到影响,进而对生态系统产生影响。
宁夏枸杞根际土壤中细菌群落组成随着种植年限的增加,厚壁菌门(0.6%增至2.5%)和变形细菌门(18%增至26%)增加;放线菌门(5.4%减至3.9%)和拟杆菌门(16%减至13%)降低[31]。种植的植物不同,土壤细菌的优势种群和所占比例会有改变进而出现差别。本研究只是种植了两茬生菜和菠菜,土壤中可培养细菌群落已经有了明显分化,菠菜种植后放线菌门所占比例很大,变形菌门比例很小,后期实验应尽量寻找并选择能降低土壤放线菌门数量增加变形菌门数量的植物与菠菜轮作;生菜种植后土壤厚壁菌门所占比例虽然最大,但并不是远远超出第二位的放线菌门,而是前三位优势菌的比例相差不大,后期应寻找并选择能适当增加变形菌门的数量但又不是大幅改变土壤细菌比例的蔬菜与之轮作。
[1] 王 阳, 王奇赞. 种植年限对大棚蔬菜地土壤微生物群落结构多样性的影响[J].浙江农业学报, 2013, 25(3): 567-576.
[2] 丁宝华. 近10 年来我国蔬菜生产的变化特点和发展趋势[A]. 见:菜园土壤肥力与蔬菜合理施肥论文集[D]. 南京: 河海大学出版社, 1997,17-21.
[3] 张真和, 李建伟. 我国蔬菜设施园艺的现状及可持续发展对策探讨[A]. 见:李晓林. 平衡施肥与可持续优质蔬菜生产[M]. 北京: 中国农业大学出版社, 2000,1-7.
[4] 李天来. 我国日光温室产业发展现状与前景[J]. 沈阳农业大学学报,2005, 36(2): 131-138.
[5] 范双喜.北京市叶类蔬菜产业发展研究[M].北京:中国农业出版社,2014, 29-32.
[6] 黄看生,熊 明. 连作障碍的产生原因及改善途径[J]. 上海蔬菜, 2010,(5): 62-64.
[7] 王 飞,李世贵,徐凤花,等.连作障碍现象研究进展[J].中国土壤与肥料,2013,(5):6-13.
[8] 李文娇,杨殿林,赵建宁,等. 长期连作和轮作对农田土壤生物学特性的影响研究进展[J]. 中国农学通报,2015,31(3):173-178.
[9] Reasoner D J, Geldreich E E.A new medium for the enumeration and subculture of bacteria from potable water[J]. Appl. Environ. Microbiol., 1985, 49: 1-7.
[10] Abdulmawjood A, Lammler C. Amplification of 16S ribosomal RNA gene sequences for the identification of streptococci of Lancefield group B[J]. Res. Veter. Sci., 1999. 67: 159-162.
[11] 高玉葆,石福臣.植物生物学与生态学试验[M]. 北京:科学出版社,2008,136-137.
[12] 刘玉娟,田新朋, 黄小芳, 等. 中国南海沉积环境可培养细菌多样性研究[J]. 微生物学通报, 2014, 41(4): 661-673.
[13] Kampfer P, Lodders N, Martin K,etal.. Revision of the genusMassiliaLa Scolaetal. 2000, with an emended description of the genus and inclusion of all species of the genusNaxibacteras new combinations, and proposal ofMassiliaconsociata sp. Nov[J]. Int. J. Syst.Evol. Microbiol., 2011, 61: 1528-1533.
[14] 欧阳娴, 阮小蕾, 吴 超,等. 香蕉轮作和连作土壤细菌主要类群[J]. 应用生态学报,2011,22(6):1573-1578.
[15] 于高波,吴凤芝,周新刚. 小麦、毛苕子与黄瓜轮作对土壤微生态环境及产量的影响[J]. 土壤学报,2011,48(1): 175-184.
[16] 张丽红,符建平,高丽红,等. 不同蔬菜轮作对日光温室土壤微生物的影响[J]. 中国农学通报,2010,26(1):140-144.
[17] 吴艳飞,张雪艳,李 元,等. 轮作对黄瓜连作土壤环境和产量的影响[J]. 园艺学报, 2008,35(3):357-362.
[18] 陈丹梅, 陈晓明, 梁永江, 等. 轮作对土壤养分、微生物活性及细菌群落结构的影响[J]. 草业学报,2015,24(12):56-65.
[19] 卢开阳,张云峰,贾 鳗, 等. 基于16S rRNA序列分析南糯山不同生境茶树根际土壤细菌群落分布多样性[J]. 昆明理工大学学报:自然科学版, 2016,41(2):89-95.
[20] 谢汶芝, 罗 明, 韩 剑,等. 塔吉克斯坦哈特隆州土壤可培养细菌多样性分析[J]. 干旱区地理, 2016, 39(1): 144-153.
[21] 秦 越, 马 琨, 刘 萍. 马铃薯连作栽培对土壤微生物多样性的影响[J]. 中国生态农业学报, 2015, 23(2): 225-232.
[22] 赵志祥,罗 坤, 陈国华, 等.结合宏基因组末端随机测序和16S rDNA技术分析温室黄瓜根围土壤细菌多样性[J].生态学报, 2010, 30(14):3849-3857.
[23] Nannipieri P, Ascher J, Ceccherini M T,etal.. Microbial diversity and soil functions[J]. Eur. J. Soil Sci., 2003,54(4): 655-670.
[24] Berg G. Plant-microbe interactions promoting plant growth and health: Perspectives for controlled use of microorganisms in agriculture[J]. Appl. Microbiol. Biotechnol., 2009, 84(1): 11-18.
[25] Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant Soil, 1995, 1(170): 75-86.
[26] 孙瑞波,郭熙盛,王道中,等.长期施用化肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 微生物学通报, 2015, 42(10): 2049-2057.
[27] Allison S D, Martiny J B. Colloquium paper: resistance, resilience, and redundancy in microbial communities[J]. Proc. Natl. Acad. Sci. USA, 2008, 105(1): 11512-11519.
[28] Yuan H, Ge T, Zhou P,etal.. Soil microbial biomass and bacterial and fungal community structures responses to long-term fertilization in paddy soils[J]. J. Soils Sed., 2013, 13(5): 877-886.
[29] Fierer N, Leff J W, Adams B J,etal.. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proc. Natl. Acad. Sci. USA, 2012, 109(52): 21390-21395.
[30] Monard C, Vandenkoornhuyse P, Le B B,etal.. Relationship between bacterial diversity and function under biotic control: the soil pesticide degraders as a case study[J]. ISME J., 2011, 5(6): 1048-1056.
[31] 纳小凡, 郑国琦, 彭 励, 等.不同种植年限宁夏枸杞根际微生物多样性变化[J]. 土壤学报, 2016,53(1):241-252.
[32] van Elsas J D, Garbeva P, Salles J. Effects of agronomical measures on the microbial diversity of soils as related to the suppression of soil-borne plant pathogens[J]. Biodegradation,2002,(13):29-40.
Effect of Spinach and Lettuce Planting on Soil Cultivable Bacteria Diversity
LIU Yi-qian, CHANG Qing, MA Ting-jun, LANG Dan-dan, GONG Han-ying, YI Xin-xin*
FacultyofFoodScienceandEngineering,BeijingUniversityofAgriculture,Beijing102206,China
To study the effect of lettuce and spinach planting on soil cultivable bacteria diversity, and in order to understand the changes of soil bacteria after planting of these two kinds of vegetables, using R2A media, we isolated bacterial strains, and phylogeneticly analized comparison system and preliminary identification of these strains based on 16S rRNA gene sequence. Soil samples grown lettuce were isolated 109 strains of bacteria, mainly belonged to 4 phyla, 19 families, 23 genera. Soil samples grown spinach were isolated 126 strains of bacteria, mainly belonged to 3 phyla, 21 genera and 16 families. In phyla, the dominant bacteria in the soil of planting lettuce were Firmicutes (39.4%), Actinobacteria (33.9%) and Proteobacteria (24.8%); the dominant bacteria in the soil sample of planting spinach were Actinobacteria (64.3%), Firmicutes (27%), and Proteobacteria (8.7%). At the genus level, the difference between the two types of soil samples was greater.
bacterial diversity; spinach; lettuce; soil bacteria
2016-05-09; 接受日期:2016-06-24
现代农业产业技术体系北京市叶菜创新团队(blvt-16);北京市教委面上项目(KM201410020012)资助。
刘一倩,讲师,研究方向为微生物生态学。E-mail:liuyi143@163.com。*通信作者:易欣欣,副教授,研究方向为致病微生物与蔬菜产品安全。E-mail:yixinxin2008@163.com
10.3969/j.issn.2095-2341.2016.05.11
