生物膜定量分析方法研究进展
2016-12-21赵智颖李良秋马连营游雪娇
赵智颖, 李良秋, 马连营, 游雪娇
广东省微生物研究所, 省部共建华南应用微生物国家重点实验室; 广东省菌种保藏与应用重点实验室, 广州 510070
生物膜定量分析方法研究进展
赵智颖, 李良秋*, 马连营, 游雪娇
广东省微生物研究所, 省部共建华南应用微生物国家重点实验室; 广东省菌种保藏与应用重点实验室, 广州 510070
生物膜因具有强致病性、耐药性和抗逆性,已成为全球关注的重大难题。介绍了生物膜生物量、细胞总数、活细胞数、大分子物质和结构的定量分析方法,以期为深入研究生物膜提供更丰富的手段,推动生物膜定量分析方法的改进与提高,从而更好地预防、控制及开发生物膜。
生物膜; 定量; 检测
生物膜是指微生物粘附于接触表面,分泌多糖基质、纤维蛋白和脂质蛋白等,将其自身包绕其中而形成的大量菌体聚集膜样物,是微生物在自然界的普遍存在方式之一[1]。生物膜广泛存在于工业管道、通风设备、食品生产设备、自来水管道、医疗器械甚至病理状态下的人体组织器官中,绝大多数微生物在一定的条件下都可以形成生物膜[2]。生物膜在形态结构、生理生化特征、对环境因子的敏感性等方面都与浮游状态存在显著的差异,造成其致病性、耐药性、抗逆性大大增强[3]。从而导致了生物膜在医疗、食品、工业、养殖业等诸多领域给人类社会带来了严重危害,造成了巨大的经济损失,同时也严重威胁着人类健康。目前,生物膜已成为全球关注的重大难题之一,越来越受到各国学者的重视,在近30年的研究中也取得了很大的进展。对生物膜的研究,首先要依赖于快速、灵敏、特异的分析检测方法。目前针对生物膜的检测方法不再局限于单纯定性的层面,大量针对生物膜定量检测的方法被报道。而生物膜生物量、细胞总数、活细胞数、大分子物质和结构是生物膜研究中的重要指标,常应用于生物膜活性、耐药性、抗性、成膜能力等研究中。本文就生物膜生物量、细胞总数、活细胞数、大分子物质和结构的定量分析方法作一综述,以期为更加深入研究生物膜提供更丰富的手段。
1 生物膜生物量的定量分析方法
生物膜生物量包含了菌体和细胞外多聚物(EPS),通过结晶紫染色法、称量生物膜干重/生物膜挥发性干重、测定生物膜总有机碳含量等方法,均可对生物膜生物量进行检测。
1.1 结晶紫(crystal violet,CV)染色法
结晶紫是一种碱性三苯甲烷染料,广泛应用于细胞学、组织学和细菌学等方面,是一种优良的染色剂。其苯环上带有发色基团和助色基团,发色基团使化合物在紫外及可见光区域内有吸收,助色基团在溶液中可发生电离,其分子的染色部分为带正电荷的阳离子,因而很容易与通常带负电荷的细菌结合使细菌着色[4]。生物膜内细菌和胞外多聚物可与结晶紫结合[5],因此可通过结晶紫染色对生物膜进行半定量检测。该方法由Christensen等[6]首次提出,研究者们在此基础上进行了修改,以期提高其精确度与扩大其应用范围[7]。Monteiro等[8]研究了纳米银对白色念珠菌(Candidaalbicans)和光滑念珠菌(Candidaglabrata)生物膜形成的影响,结晶紫染色结果表明念珠菌生物膜经纳米银作用5 h后,生长过程中(24 h)和成熟(48 h)的生物膜生物量均显著降低,而不同阶段生物膜的生物量无显著差异。另外,番红染色、刚果红染色也可用于生物膜的半定量检测[9, 10],其检测方法与结晶紫染色类似。
1.2 干重(dry mass,DM)/挥发性干重(ash-free dry mass,AFDM)
采用机械、超声等物理方法将生物膜剥落后,经0.4 μm滤膜过滤,将滤膜置于105℃烘箱内干燥至恒重,干燥前后的重量差为生物膜干重。生物膜干重是生物膜研究中较为常用的定量分析指标[11]。
生物膜干重反映的是生物膜总量,而生物膜挥发性干重可以反应生物膜中有机组分的含量。在测量生物膜干重后,将样品550℃灼烧至恒重,重量的差值为挥发性生物膜干重。在生物膜研究中,为获得更准确的生物量信息,常常选用生物膜挥发性干重作为测量指标[12]。
1.3 总有机碳含量(total organic carbon,TOC)
细胞骨架主要由有机碳组成,测定生物膜总有机碳含量(TOC)可间接反映生物膜量的变化。特别是对于硝化生物膜等增长缓慢、生物膜量较少、不便用干重法进行测量的微生物,生物膜TOC分析更具准确性。TOC测定的基本原理是先将总有机碳氧化成二氧化碳,然后由检测器测定氧化生成的二氧化碳含量,再由数据处理把二氧化碳气体含量换算成TOC值。目前,TOC的分析已经仪器化,按工作原理不同,可分为湿法氧化(过硫酸盐)-非色散红外探测(NDIR)、高温催化燃烧氧化-非色散红外探测(NDIR)、紫外氧化(UV)-湿法(过硫酸盐)氧化-非色散红外探测(NDIR)、电阻法、紫外法、电导法、臭氧氧化法、超声空化声致发光法等[13]。生物膜会导致纳滤膜(NF)和反渗透膜(RO)性能的下降,Dreszer等[14]通过测定生物膜TOC值发现高水流流速和原水导流网可导致生物膜生物量的增加。
2 生物膜细胞总数的定量分析方法
2.1 SYTO9染色法
SYTO9染料是可穿透原核细胞和真核细胞的细胞膜,与DNA或RNA结合的核酸荧光染料。它对死细胞和活细胞均可进行染色[15],因而结合激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)可对细菌和酵母生物膜菌体总数进行定量检测。其最大激发波长为483 nm,最大发射波长为503 nm,激发后发绿色荧光。SYTO9染色法操作简单,检测时间短,且不受细菌类群的影响。Goncalves等[16]利用SYTO9对添加不同碳源进行培养的白色念珠菌生物膜进行染色,发现碳源对生物膜生物量有显著影响,添加蔗糖或葡萄糖作为碳源后,白色念珠菌菌体总量显著增加。
2.2 吖啶橙(acridine orange)染色法
吖啶橙是一种三环芳香类阳离子型碱性荧光染料,它可嵌入双链DNA的双链碱基对,也可与单链核酸发生静电吸引而堆积在其磷酸根上[17]。吖啶橙最大激发波长为492 nm,当其与DNA或RNA结合时,最大发射波长分别为530 nm(绿色)和640 nm(红色)。细菌经吖啶橙染色后,在荧光显微镜或CLSM下观察,处于静止期或不活跃状态的细菌,由于其核酸主要为双链DNA,因而产生绿色荧光;死菌核酸被破坏为单链DNA,因而发出橙红色荧光;而处于高速生长期的活菌的核酸主要为RNA,也呈现出红色荧光[18]。因此,吖啶橙不能准确区分死活细菌,但可用于细菌总数的定量测定。Stiefel等[19]比较了6种清洁剂对绿脓假单胞菌(Pseudomonasaeruginosa)和金黄色葡萄球菌生物膜的清除作用,通过吖啶橙染色对其细胞总数进行测定,其中一种新型清洁剂X对生物膜的清除作用最为显著。
2.3 实时荧光定量PCR技术(Real-time quantitative PCR, RT-qPCR)
RT-qPCR技术是指在PCR反应中加入荧光基团,根据荧光信号的累积,对PCR扩增反应中每一个循环扩增产物量的变化进行实时检测,通过循环阈值(cycle threshold,Ct值)和标准曲线对起始模板进行定量分析的方法[20]。RT-qPCR技术克服了结晶紫染色法、XTT减低法等传统方法不能区分复合生物膜中不同种细菌的缺点,其可对生物膜进行种特异性的定量分析,并且可以用于生物膜变化过程中相关基因的研究,具有灵敏度高、精确性高、重复性好等特点。Karched等[21]对6种牙周细菌分别进行了单一菌株生物膜、复合生物膜和浮游状态的培养。RT-qPCR结果表明:6种牙周细菌培养8 d后均可在缺乏先锋细菌的情况下形成生物膜;大部分菌株的单一菌株生物膜和混合生物膜的生物量比浮游状态下的生物量少;而在混合生物膜中,牙龈卟啉单胞菌的生物量比其他牙周细菌的生物量高。
3 生物膜活细胞数的定量分析方法
3.1 平板菌落计数法
平板菌落计数法是将生物膜经超声或震荡,使其充分分散成单个细胞,将细胞悬浮液稀释到合适浓度,取一定量的稀释液接种到平板上,经培养,每个单细胞均可生长繁殖形成肉眼可见的菌落,即一个单菌落应代表样品中的一个单细胞。统计菌落数,根据其稀释倍数和接种量即可换算出样品中的活菌数。Hyun等[22]研究了不同大气状态对阪崎肠杆菌(Cronobactersakazakii)生物膜细胞活性的影响,平板菌落计数法结果表明,在N2、CO2环境下阪崎肠杆菌生物膜活细胞数显著减少。
值得注意的是,自然界中大部分微生物都处于有活性但不可培养状态(viable but non-cultural, VBNC),只有很少种类和数量的细菌可被培养,而且具有一定选择性的人工培养实际上已经不同于微生物的自然生活环境,不适合人工培养的细菌在与优势菌种竞争时会处于劣势;而且生物膜往往不易完全分散成单个细胞,因此平板菌落计数的结果往往偏低,只具有相对意义。
3.2 三磷酸腺苷(ATP)生物发光法
ATP是一种高能磷酸化合物,广泛存在于细胞中,通过与ADP相互转化实现能量的贮存和释放,在细胞各项生命活动中起到能量传递的作用。James等[23]在1983年提出细胞内源性ATP 的含量可以反映细胞活性和活细胞数量。研究表明,活体微生物在一定生长时期内的ATP含量基本恒定,使得ATP含量与活细胞生物量存在较好的线性关系。当微生物死亡后,其体内的ATP迅速降解,不会影响活细胞的检测。ATP在生物体内的广泛性、与活细胞生物量之间的线性关系和易降解性,使其成为较好的活细胞检测指标。萤火虫荧光素酶(firefly luciferase)在Mg2+的存在下,以D-荧光素(D-luciferin)、ATP和O2作为反应底物,将化学能转化为光能,发出光量子,其发光强度和ATP含量成线性关系,根据发光强度可对ATP的含量进行定量分析[24]。ATP生物发光法的优点主要是反应快速、操作简便、重现性好。
大肠杆菌DH5α生物膜可作为混凝土表面的保护层抵抗微生物造成的混凝土劣化。Soleimani等[25]对大肠杆菌DH5α生物膜在灰浆表面的生长情况和结构进行了研究,其利用ATP生物发光法对灰浆样品上分别培养了3 d、5 d、8 d的生物膜活菌数进行测定,结果表明活菌数随时间的增加呈现渐进式增长的趋势,该结果与滤膜法测定结果一致。
3.3 四唑鎓盐(tetrazolium, XTT)减低法
XTT[2,3-bis-(2-methoxy-4-nitro-5-sulphenyl)-(2H)-tetrazolium-5-carboxanilide]是一种与MTT[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetra-zolium bromide]类似的四唑氮衍生物,活细胞线粒体中脱氢酶可将外源性XTT还原成水溶性的棕黄色甲臜,与电子耦合剂如硫酸酚嗪甲酯(PMS)、甲萘醌(MEN)、辅酶Q(CQ)等共同使用时,甲臜的产生量与活细胞数成正相关,用酶标仪在波长近450 nm处检测其光吸收值,可反映活细胞的相对数量和相对活性[26]。XTT减低法现已广泛应用于细菌和真菌生物膜活性的研究中。Nostro等[27]用XTT减低法对基于乙烯-醋酸乙烯共聚物(ethylene-vinyl acetate copolymer,EVA)薄膜的抗菌精油测定了李斯特菌(Listeriamonocytogenes)、金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌和铜绿假单胞菌(Pseudomonasaeruginosa)的抗菌活性。
3.4 荧光染料染色法
DAPI、SYTO9、Hoechst等荧光染料可对活细胞进行染色,使生物膜的观察具有选择性,结合荧光显微镜或CLSM进行观察及数据分析,可对生物膜中活细胞数进行定量。
DAPI即4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole),是一种能够与DNA强力结合的荧光染料。它可结合到双链DNA小沟的AT碱基对处,荧光强度可提高约20倍。DAPI可穿透完整的细胞膜,因此它可用于活细胞和固定细胞的染色,用荧光显微镜或CLSM进行观测,根据荧光强度可确定DNA量,继而反映活细胞量。单独DAPI的最大激发波长为340 nm,最大发射波长为488 nm;当DAPI与双链DNA结合时,最大吸收波长为364 nm,最大发射波长为454 nm,发散光为蓝色。DAPI也可以和RNA结合,但产生的荧光强度只有与DNA结合的1/5,其发射波长在500 nm左右[28]。Gressler等[29]用DAPI对113株从临床样品和马粪样品中分离的马红球菌(Rhodococcusequi)进行染色,验证形成生物膜的能力,并评价了阿奇霉素、克拉霉素和红霉素对马红球菌生物膜的抑制能力。
碘化丙啶(propidium iodide,PI)是一种溴化乙啶的类似物,在嵌入双链DNA后发出红色荧光,荧光强度和双链DNA的量成正比,最大激发和最大发射波长分别为535 nm和615 nm[30]。尽管PI不能通过活细胞膜,但却能穿过破损的细胞膜对DNA染色。PI与SYTO9一起使用,可同时对活细胞和死细胞进行染色,因此可区分生物膜中的死活细胞,得出生物膜活细胞量及细胞死活比。Park等[31]合成了一种一氧化氮(NO)释放材料,并用SYTO9/PI染色研究其对大肠杆菌、金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureus, MRSA)生物膜的抗菌作用。
Hoechst染料为非嵌入型荧光染料,可与DNA双链中的小沟结合,且更倾向于富含A/T(腺嘌呤/胸腺嘧啶)的DNA链。Hoechst可穿过细胞膜,对活细胞或固定细胞的细胞核进行染色,因此可用于活细胞标记。类似的染料有Hoechst 33258、Hoechst 33342和Hoechst 34580 3种。Hoechsr-DNA的最大激发波长和最大发射波长分别350 nm和460 nm,发蓝色荧光[32]。Peyyala等[33]评价了包括Hoechst 33258在内的多种细胞核酸染料对口腔细菌形成单一生物膜和复合生物膜细胞活性研究的能力。
3.5 磷脂法
磷脂存在于所有活细胞的细胞膜中,是生物膜的主要组分,其在细胞中的含量较稳定;当细胞衰亡时,磷脂会很快被分解[34],所以死细胞中磷脂含量很低。因此,磷脂含量可近似表示生物膜的活性生物量,即通过测定与脂结合的磷的方法来定量表示生物膜的活性生物量。磷脂法已经被证明是一种可以测定生物膜活性生物量的好方法。磷脂法首先要以一系列浓度KH2PO4标准溶液测定吸收值,绘制标准曲线;对生物膜内磷脂进行萃取;然后用消化剂将以上萃取液中有机磷脂中的磷转化为无机磷;按照制作标准曲线的方法测定消解液中的磷酸盐浓度,换算得出生物膜活性生物量。熊正为等[35]采用悬挂链曝气式接触氧化工艺在3个时段内处理城市河道污水,采用磷脂法研究载体表面生物膜特性,验证了装置的水质净化效果。
4 生物膜中大分子物质的定量分析方法
4.1 生物膜中蛋白质的定量分析方法
4.1.1 异硫氰酸荧光素(fluorescein isothiocyanate,FITC)染色法 FITC本身性质稳定,能与蛋白质结合,是检测细胞内蛋白质最常用的荧光探针。当FITC在碱性溶液中与蛋白质反应时,主要是蛋白质上赖氨酸的r氨基与荧光素的硫碳胺键结合,形成FITC-蛋白质复合物。FITC最大吸收光波长为490~495 nm,最大发射光波长为520~530 nm,呈现明亮的黄绿色荧光,通过CLSM进行观察及荧光强度的测定,可对蛋白质含量进行测定。Feldman等[36]结合FITC染色法评价了蔓越莓原花青素抑制白念珠菌生物膜黏附的能力。
4.1.2 考马斯亮蓝显色法(bradford法) 1976年Bradford[37]利用考马斯亮蓝G-250与蛋白质结合的原理,建立了迅速而准确的定量蛋白质的分析方法。考马斯亮蓝G-250与蛋白质结合后,其对可见光的最大吸收峰从465 nm变为595 nm,吸光度与蛋白质含量呈线性关系。蛋白质-染料复合物具有高的消光系数,因此大大提高了蛋白质测定的灵敏度。Jain等[38]探讨了不同碳源和生理条件对铜绿假单胞菌和枯草芽孢杆菌(Bacillussubtilis)生物膜生长的影响,其中对蛋白质含量的分析采用了Brandford法。
4.1.3 Folin-酚试剂法(lowry法) Folin-酚试剂法是Lowry等[39]于1951年提出的,它是在双缩脲法的基础上发展而来的测定蛋白质含量的经典方法。Lowry法所用的试剂由两部分组成,蛋白质中的肽键与试剂A中的碱性硫酸铜反应形成铜-蛋白质复合物。该复合物可与试剂B中磷钼酸-磷钨酸发生氧化还原反应,致使溶液颜色变成蓝色,通过分光光度计在650~750 nm检测吸光值,使用选定的标准蛋白溶液,可估算样品的蛋白含量。此法操作简单、迅速、灵敏度高。Moryl等[40]分析了不同营养状态和胁迫条件(氨噻肟头孢菌素、低pH、营养耗竭)对奇异变形杆菌(Proteusmirabilis)生物膜多糖合成的影响,其中Lowry法被应用于研究蛋白质含量的变化。
4.1.4 二喹啉酸法(BCA法) BCA法是Smith等[41]于1985年发明的,该方法是基于双缩脲反应,即Cu2+在碱性条件下可转换为Cu+,该反应受4个氨基酸(半胱氨酸、胱氨酸、酪氨酸和色氨酸)残基,以及多肽主链的影响。BCA 是Cu+的一种特定显色剂,在反应的第二步,2个BCA分子和1个Cu+离子发生反应。Cu2+被还原的数量是蛋白质浓度的函数,样品溶液的颜色变成紫色,可以通过分光光度计测量在562 nm处的吸光度。吸光度与溶液中蛋白质的量成正比,通过与已知蛋白标准,例如牛血清白蛋白(BSA)相比较,可估算出蛋白含量[42]。何智妍等[43]采用Bradford法、Lowry法和BCA法评价了不同超声条件下超声破碎法提取粪肠球菌生物膜总蛋白含量的效果,确定了最佳超声时间、间隔时间和振幅等参数。
4.2 生物膜中多糖的定量分析方法
4.2.1 苯酚-硫酸法 苯酚-硫酸法是Dubois等[44]在1951年建立的一种用于多糖含量测定的方法,也被称为苯酚-硫酸分光光度法或苯酚-硫酸比色法。其原理是利用多糖在浓硫酸的作用下水解成单糖,并迅速脱水生成糠醛衍生物,然后和苯酚缩合成橙黄色化合物,在490 nm处进行比色测定[45]。该法操作简便,灵敏度高,应用广泛。但其准确性和重现性受实验条件影响较大,因此,许多学者从不同角度对苯酚-硫酸法进行了研究改进[46]。Moryl等[40]采用苯酚-硫酸法分析了不同营养状态和胁迫条件对奇异变形杆菌生物膜多糖合成的影响。
4.2.2 蒽酮法 糖类在较高温度下可被浓硫酸脱水生成糠醛或其衍生物,糠醛或羟甲基糠醛进一步与蒽酮试剂缩合产生蓝绿色物质,其在可见光区波长620~630 nm处有最大吸收,且其光吸收值在一定范围内与糖的含量成正比[47]。蒽酮法可用于单糖、寡糖和多糖含量的测定,因此可用于生物膜多糖含量的测定,该方法具有灵敏度高、简便快捷、适用于微量样品的测定等优点。Zhang等[48]对抗菌牙胶抑制多物种生物膜[变形链球菌(Streptococcusmutans)、戈登链球菌(Streptococcusgordonii)和血链球菌(Streptococcussanguinis)]形成的效果进行了研究,蒽酮法表明加入了抗菌剂(dimethylaminododecyl methacrylate, DMADDM)后牙胶形成的生物膜多糖含量显著降低。
4.2.3 植物细胞壁钙荧光(calcofluor white, CFW)染色法 CFW是一种二苯乙烯类的非特异性的荧光染料,可与纤维素、几丁质或肽聚糖通过β-1,3-或β-1,4-糖苷键非特异性的结合。CFW可与生物膜中β糖苷键连接的多糖结合,最大激发波长为300~440 nm,最大发射波长为355 nm,发亮蓝色荧光[49]。Brackman等[50]发现肉桂醛和肉桂醛衍生物通过降低群体感应反映调节蛋白LuxR的DNA结合能力可减少弧菌毒性,CV染色、CFW染色等结果表明肉桂醛和肉桂醛衍生物可在不影响弧菌生长的情况下,抑制其生物膜的形成,减少其胞外多糖的形成,进而降低其对饥饿条件和抗生素的抗性。
4.2.4 凝集素标记法 凝集素是一种从各种植物或动物中提纯的糖蛋白或结合糖的蛋白,具有一个以上与糖结合的位点。凝集素对某种特异性糖基的结合具有专一性,如刀豆蛋白A(ConA)与α-D-吡喃糖基甘露糖(α-D-Mannopyranosy)结合;麦胚凝集素(WGA)与N-乙酰糖胺(N-acetyl glucosamine)结合;菜豆凝集素(PHA)与N-乙酰乳糖胺(N-acetyl lactosamine)结合[51]。同时,凝集素具有多价结合能力,能被荧光染料标记。结合荧光染料标记的凝集素被越来越广泛地应用于生物膜形成和胞外多糖的研究中。FITC、TRITC、Alexa Fluor、Texas Red、Orange Green等荧光染料特异性标记刀豆蛋白或麦胚凝集素等凝集素,结合CLSM及相关分析软件,可对生物膜多糖含量进行测定。Wang等[52]结合显微镜和光谱方法对肉类加工过程中沙门氏菌生物膜进行原位表征和分析,其中运用了FITC-ConA染色及CLSM对不同基质下生物膜多糖成分进行了分析。
5 生物膜结构的定量分析方法
生物膜在形成过程及成熟后,其结构具有特异性。成熟的生物膜是由大量胞外聚合物包裹菌体的三维立体结构,一般由多个蘑菇样或柱样的亚单位组成。利用荧光染料对生物膜进行标记,结合CLSM,不仅可对生物膜结构直接观察,进一步结合图像分析软件,还可对图像堆数据进行结构定量化分析,使直观的图像转变成可以统计分析的数据,获得生物膜生物量、厚度、基质覆盖率、比表面积等相关信息[53]。常用于结合CLSM对生物膜结构进行分析的软件有:COMSTAT、Image Structure Analyzer(ISA)、PHLIP、Image J、BioImage L等,其中,以COMSTAT和ISA应用最为广泛。
5.1 COMSTAT
COMSTAT分析软件是由丹麦技术大学Arne Heydorn团队[54]于2000年针对生物膜分析自主开发的一款计算机软件。该软件可将由CLSM获得的三维图像堆数据化,进行生物膜空间结构定量分析,从而更加直观的了解不同生物膜的空间构造。COMSTAT可以对生物膜的生物量、平均厚度、基质覆盖率、分形维数、粗糙系数、平均扩散距离、均一性、比表面积等十几个参数进行测定[55,56]。Larimer等[57]对恶臭假单胞菌(Pseudomonasputida)生物膜进行荧光染色,结合CLSM和COMSTAT软件对生物膜进行定量分析,结果表明其精度与传统的细胞计数方法一致,且具有操作简单、快速,同时可原位、实时、无损的分析生物膜空间结构等优点。Yang等[58]将COMSTAT分析软件应用于双环溴代呋喃酮抑制铜绿假单胞菌生物膜形成的研究中,分析了双环溴代呋喃酮作用后铜绿假单胞菌生物膜结构、生物量、平均厚度、基质覆盖率等参数的变化。
5.2 图像结构分析(image structure analyze,ISA)
ISA是美国Montana州立大学生物膜工程中心Hlauk Beyenal团队[59]专门为生物膜空间结构研究开发的图像结构分析软件,通过对生物膜的二维和三维结构参数运算而实现对生物膜的结构定量化分析,为更深入研究生物膜空间结构提供了新的平台,逐渐被研究者们结合应用到生物膜研究中[60]。ISA可分析的参数包括:①结构参数:如结构熵、结构能、均一性;②平面参数:如区域孔率、平均扩散距离、最大扩散距离、分形维数、平均水平/垂直延伸距离、平均X/Y/Z轴延伸距离、周边等指标;③其他参数:如生物量、比表面积、单位面积生物膜体积等[59]。Khajotia等[61]对变异链球菌(Streptococcusmutans)生物膜核酸、蛋白质和胞外多糖同时进行荧光染料的标记,结合CLSM和ISA分析软件评价了漱口水BIO和LTO对生物膜成分及结构的作用。
6 方法比较
目前已形成针对于生物膜生物量、细胞总数、活细胞数、大分子物质和结构的一系列定量分析方法,由于每种方法都是根据一定的对象和条件发展起来的,因此各有其优缺点,现将生物膜多种指标的各种定量分析方法的优缺点及适用范围列于表1。研究者可以根据实验的具体情况选择合适的分析方法。
7 展望
生物膜是地球生态系统的重要组成部分,它与人类健康、食品安全、工业生产甚至环境稳定息息相关。生物膜与浮游状态相比,结构更加复杂、信息交流更加广泛、调控机制更加精细、社会效应更加完善。随着近年来生物膜研究的不断深入,经典的定性分析方法已不能满足生物膜研究的需求,因此生物膜定量分析方法的建立尤为重要。近年来越来越多针对生物膜的定量分析方法被报道,但仍然缺乏被广泛认可的标准方法。有些方法操作复杂,灵敏度低、特异性差,不能满足快速检测的需要。因此,提高生物膜的检测水平,建立简便、快捷、灵敏、精确的定量检测方法,研制出标准、快速、特异的检测商品试剂盒,也是今后生物膜研究的重要内容之一。另外,生物膜定量检测多局限于生物量、活性和形态结构,对起关键作用的细胞间信息传递研究还很有限,报告基因在生物膜研究中的应用有望对细胞间信息传递机制的研究带来突破性的进展。随着仪器的改进和方法的创新,以及多种方法的联合使用,必将推动生物膜定量分析方法的改进与提高。随着相关定量分析方法的不断发展和完善,人们对生物膜的研究将更加深入和透彻,从而更好地预防、控制和开发生物膜。
表1 生物膜多种指标定量分析方法的比较
Table 1 Comparion of quantification analysis methods for multiple index of biofilm.
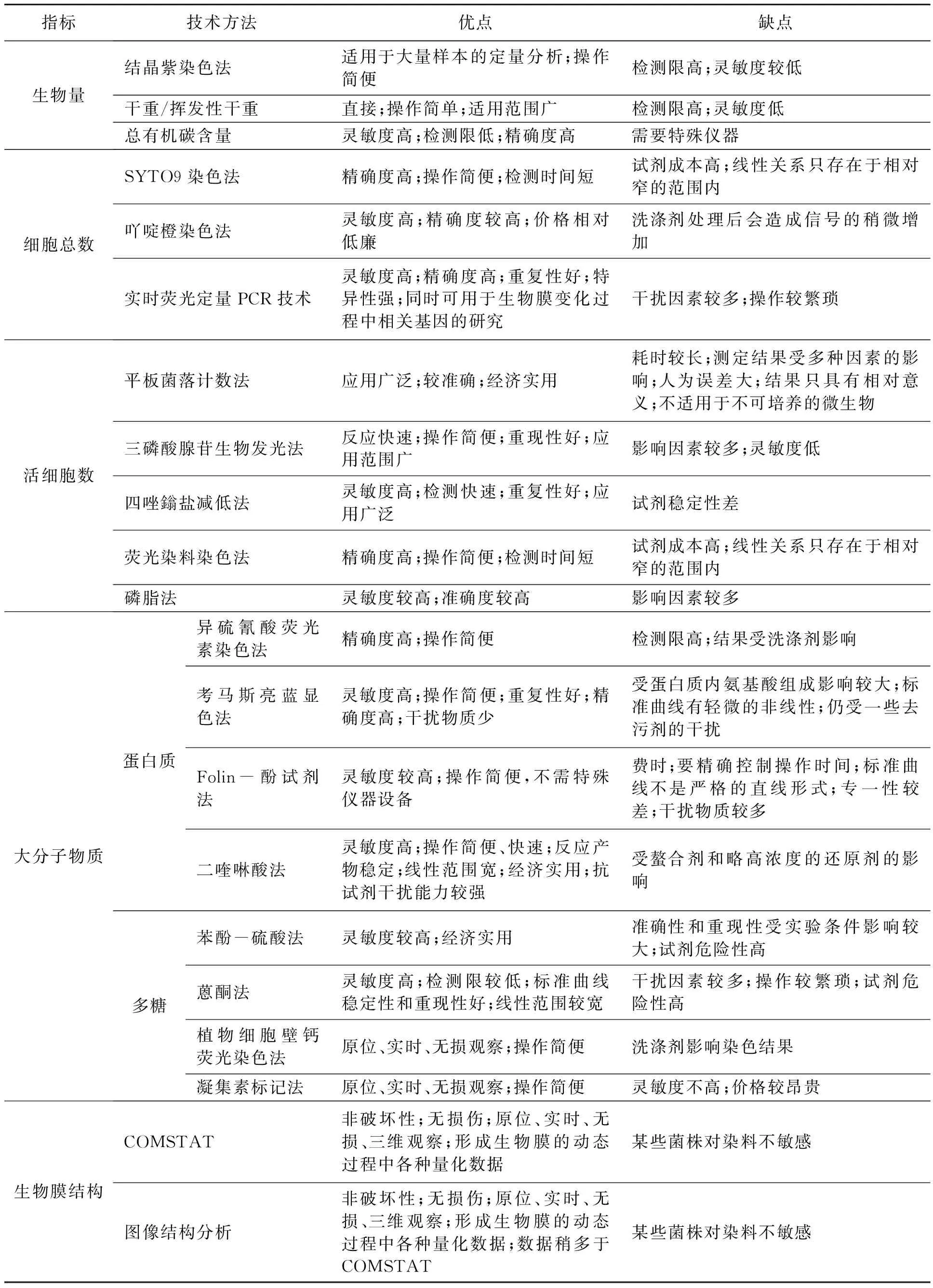
指标技术方法优点缺点生物量结晶紫染色法适用于大量样本的定量分析;操作简便检测限高;灵敏度较低干重/挥发性干重直接;操作简单;适用范围广检测限高;灵敏度低总有机碳含量灵敏度高;检测限低;精确度高需要特殊仪器细胞总数SYTO9染色法精确度高;操作简便;检测时间短试剂成本高;线性关系只存在于相对窄的范围内吖啶橙染色法灵敏度高;精确度较高;价格相对低廉洗涤剂处理后会造成信号的稍微增加实时荧光定量PCR技术灵敏度高;精确度高;重复性好;特异性强;同时可用于生物膜变化过程中相关基因的研究干扰因素较多;操作较繁琐活细胞数平板菌落计数法应用广泛;较准确;经济实用耗时较长;测定结果受多种因素的影响;人为误差大;结果只具有相对意义;不适用于不可培养的微生物三磷酸腺苷生物发光法反应快速;操作简便;重现性好;应用范围广影响因素较多;灵敏度低四唑鎓盐减低法灵敏度高;检测快速;重复性好;应用广泛试剂稳定性差荧光染料染色法精确度高;操作简便;检测时间短试剂成本高;线性关系只存在于相对窄的范围内磷脂法灵敏度较高;准确度较高影响因素较多大分子物质蛋白质多糖异硫氰酸荧光素染色法精确度高;操作简便检测限高;结果受洗涤剂影响考马斯亮蓝显色法灵敏度高;操作简便;重复性好;精确度高;干扰物质少受蛋白质内氨基酸组成影响较大;标准曲线有轻微的非线性;仍受一些去污剂的干扰Folin-酚试剂法灵敏度较高;操作简便,不需特殊仪器设备费时;要精确控制操作时间;标准曲线不是严格的直线形式;专一性较差;干扰物质较多二喹啉酸法灵敏度高;操作简便、快速;反应产物稳定;线性范围宽;经济实用;抗试剂干扰能力较强受螯合剂和略高浓度的还原剂的影响苯酚-硫酸法灵敏度较高;经济实用准确性和重现性受实验条件影响较大;试剂危险性高蒽酮法灵敏度高;检测限较低;标准曲线稳定性和重现性好;线性范围较宽干扰因素较多;操作较繁琐;试剂危险性高植物细胞壁钙荧光染色法原位、实时、无损观察;操作简便洗涤剂影响染色结果凝集素标记法原位、实时、无损观察;操作简便灵敏度不高;价格较昂贵生物膜结构COMSTAT非破坏性;无损伤;原位、实时、无损、三维观察;形成生物膜的动态过程中各种量化数据某些菌株对染料不敏感图像结构分析非破坏性;无损伤;原位、实时、无损、三维观察;形成生物膜的动态过程中各种量化数据;数据稍多于COMSTAT某些菌株对染料不敏感
[1] Costerton J W, Lewandowski Z, Caldwell D E,etal.. Microbial biofilms[J]. Ann. Rev. Microbiol., 1995, 49(2): 711-745.
[2] 李京宝, 韩 峰, 于文功. 细菌生物膜研究技术[J]. 微生物学报, 2007, 47(3): 558-561.
[3] Flemming H C, Wingender J. The biofilm matrix[J]. Nat. Rev. Microbiol., 2010, 8(9): 623-633.
[4] 沈 萍, 陈向东. 微生物学实验(第4版)[M]. 北京:高等教育出版社, 2010.
[5] Li X, Yan Z, Xu J. Quantitative variation of biofilms among strains in natural populations ofCandidaalbicans[J]. Microbiology, 2003, 149: 353-362.
[6] Chrisrensen G D, Simpson W A, Younger J J,etal.. Adherence of coagulase-negative staphylococci to plastic tissue culture plates a quantitative model for the adherence of staphylococci to medical devices.[J]. J. Clin. Microbiol., 1985, 22(6): 996-1006.
[7] Peeters E, Nelis H J, Coenye T. Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J]. J. Microbiol. Meth., 2008, 72(2): 157-165.
[8] Monteiro D R, Takamiya A S, Feresin L P,etal.. Susceptibility ofCandidaalbicansandCandidaglabratabiofilms to silver nanoparticles in intermediate and mature development phases[J]. J. Prosthodont. Res., 2015, 59(1): 42-48.
[9] Patterson J L, Stull-Lane A, Girerd P H,etal.. Analysis of adherence, biofilm formation and cytotoxicity suggests a greater virulence potential ofGardnerellavaginalisrelative to other bacterial-vaginosis-associated anaerobes[J]. Microbiology, 2010, 156:392-399.
[10] Ansari M A, Khan H M, Khan A A,etal.. Anti-biofilm efficacy of silver nanoparticles against MRSA and MRSE isolated from wounds in a tertiary care hospital[J]. Indian. J. Med. Microbi., 2015, 33(1): 101-109.
[11] Graba M, Sauvage S, Moulin F Y,etal.. Interaction between local hydrodynamics and algal community in epilithic biofilm[J]. Water Res., 2013, 47(7): 2153-2163.
[12] Rüegg J, Chaloner D T, Levi P S,etal.. Environmental variability and the ecological effects of spawning Pacific salmon on stream biofilm[J]. Freshwater Biol., 2012, 57(1): 129-142.
[13] Fan S L, Qu F, Zhao L,etal.. Flow-injection analysis for the determination of total inorganic carbon and total organic carbon in water using the H2O2-luminol-uranine chemiluminescent reaction[J]. Anal. Bioanal. Chem., 2006, 386:2175-2182.
[14] Dreszer C, Flemming H C, Zwijnenburg A,etal.. Impact of biofilm accumulation on transmembrane and feed channel pressure drop: Effects of crossflow velocity, feed spacer and biodegradable nutrient[J]. Water Res., 2014, 50(3): 200-211.
[15] Boulos L, Prevost M, Barbeau B,etal.. LIVE_DEAD© BaclightTM: Application of a new rapid staining method for direct enumeration of viable and total bacteria in drinking water[J]. J. Microbiol. Meth., 1999, 37(1): 77-86.
[16] Goncalves L M, Del Bel Cury A A, de Vasconcellos A A,etal.. Confocal analysis of the exopolysaccharide matrix ofCandidaalbicansbiofilms[J]. J. Invest. Clin. Dent., 2015, 6(3): 179-185.
[17] Darzynkiewicz Z. Differential staining of DNA and RNA in intact cells and isolated cell nuclei with acridine orange[J]. Method. Cell Biol., 1990, 33:285-298.
[18] Mah T F C, O’Toole G A. Mechanisms of biofilm resistance to antimicrobial agents[J]. Trends Microbiol., 2001, 9(1): 34-39.
[19] Stiefel P, Rosenberg U, Schneider J,etal.. Is biofilm removal properly assessed? Comparison of different quantification methods in a 96-well plate system[J]. Appl. Microbiol. Biotechnol., 2016, 100:4135-4145.
[20] Kubista M, Andrade J M, Bengtsson M,etal.. The real-time polymerase chain reaction[J]. Mol. Aspects Med., 2006, 27:95-125.
[21] Karched M, Bhardwaj R G, Inbamani A,etal.. Quantitation of biofilm and planktonic life forms of coexisting periodontal species[J]. Anaerobe, 2015, 35:13-20.
[22] Hyun P S, Hyun K D. Fate of biofilm cells ofCronobactersakazakiiunder modified atmosphere conditions[J]. LWT-Food Sci. Technol., 2014, 57(2): 782-784.
[23] James D M, Hendrson J F. Nucleoside triphosphate specificity of firefly luciferase [J]. Anal. Biochem., 1983, 131(1): 187-189.
[24] 唐倩倩, 叶尊忠, 王剑平, 等. ATP生物发光法在微生物检验中的应用 [J]. 食品科学, 2008, 29(6): 460-465.
[25] Soleimani S, Ormeci B, Isgor O B. Growth and characterization ofEscherichiacoliDH5α biofilm on concrete surfaces as a protective layer against microbiologically influenced concrete deterioration(MICD)[J]. Appl. Microbiol. Biotechnol., 2013, 97(3): 1093-1102.
[26] 吴 楠. XTT比色法在细胞活性检测中的应用[J]. 国外医学临床:生物化学与检验学分册, 1998, 19(5): 204-205.
[27] Nostro A, Scaffaro R, D′Arrigo M,etal.. Development and characterization of essential oil component-based polymer films: a potential approach to reduce bacterial biofilm[J]. Appl. Microbiol. Biotechnol., 2013, 97(21): 9515-9523.
[28] Zhao H, Li J, Traganos F,etal.. Cell fixation in zinc salt solution is compatible with DNA damage response detection by phospho-specific antibodies[J]. Cytom. Part A, 2011, 79(6): 470-476.
[29] Gressler L T, Vargas A C, Costa M M,etal.. Biofilm formation byRhodococcusequiand putative association with macrolide resistance[J]. Pesquisa Vet. Brasil., 2015, 35(10): 835-841.
[30] Surhone L M, Tennoe M T, Henssonow S F,etal.. Propidium iodide[J]. Encyc. Syst. Biol., 2010, 70(4): 125-126.
[31] Park J, Kim J, Singha K,etal.. Nitric oxide integrated polyethylenimine-based tri-block copolymer for efficient antibacterial activity[J]. Biomaterials, 2013, 34(34): 8766-8775.
[32] Hubbard K S, Gut I M, Scheeler S M,etal.. Compatibility of SYTO 13 and Hoechst 33342 for longitudinal imaging of neuron viability and cell death[J]. BMC Res. Not.,2012, 5(1): 1-6.
[33] Peyyala R, Kirakodu S S, Ebersole J L,etal.. Novel model for multispecies biofilms that uses rigid gas-permeable lenses[J]. Appl. Environ. Microbiol., 2011, 77(10): 3413-3421.
[34] Arnaiz C, Gutierrez J, Lebrato J. Support material selection for anaerobic fluidized bed reactors by phospholipid analysis[J]. Biochem. Eng. J., 2006, 27(3): 240-245.
[35] 熊正为, 陆 森, 王志勇, 等. 悬挂链生物接触氧化工艺处理河道污水[J]. 环境工程学报, 2014, 8(7): 2748-2752.
[36] Feldman M, Tanabe S, Howell A,etal.. Cranberry proanthocyanidins inhibit the adherence properties ofCandidaalbicansand cytokine secretion by oral epithelial cells[J]. BMC Complem. Altern. M., 2012, 12(6): 1-12.
[37] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal. Biochem., 1976, 72:248-254.
[38] Jain K, Parida S, Mangwani N,etal.. Isolation and characterization of biofilm-forming bacteria and associated extracellular polymeric substances from oral cavity[J]. Ann. Microbiol., 2013, 63(4): 1553-1562.
[39] Lowry O H, Rosebrough N J, Farr A L,etal.. Protein measurement with the Folin phenol reagent[J]. J. Biol. Chem., 1951, 193(1): 265-275.
[40] Moryl M, Kaleta A, Strzelecki K,etal.. Effect of nutrient and stress factors on polysaccharides synthesis inProteusmirabilisbiofilm[J]. Acta Biochim. Pol., 2014, 16(1): 133-139.
[41] Smith P K, Krohn R L, Hermanson G T,etal.. Measurement of protein using bicinchoninic acid[J]. Anal. Biochem., 1985, 150(1): 76-85.
[42] Johnson M. Protein quantitation[J]. Mater. Meth., 2015, 2:115.
[43] 何智妍, 梁景平, 黄正蔚, 等. 不同方法提取和测定粪肠球菌生物膜总蛋白含量的比较[J]. 口腔医学研究, 2013, 29(7): 597-600.
[44] Dubois M, Gilles K, Hamilton J K,etal.. A colorimetric method for the determination of sugars[J]. Siam J. Numer. Anal., 1951, 168(4265): 167.
[45] 王 超, 张曜武. 苯酚-硫酸法的改进发展[J]. 天津化工, 2011, 25(6): 16-18.
[46] 姜 琼, 谢 妤. 苯酚-硫酸法测定多糖方法的改进[J]. 江苏农业科学, 2013, 12: 316-318.
[47] Gaudy A F. Colorimetric determination of protein and carbohydrate[J]. Ind. Water Wastes, 1962, 7:17-22.
[48] Zhang K, Wang S, Zhou X,etal.. Effect of antibacterial dental adhesive on multispecies biofilms formation[J]. J. Dent. Res., 2015, 94(4): 622-629.
[49] 杨 通, 谭亚夏. 活检组织中真菌Calcofluor White荧光染色法的改良[J]. 临床与病理杂志, 2015, 5: 767-771.
[50] Brackman G, Defoirdt T, Miyamoto C,etal.. Cinnamaldehyde and cinnamaldehyde derivatives reduce virulence inVibriospp. by decreasing the DNA-binding activity of the quorum sensing response regulator LuxR[J]. BMC Microbiol., 2008, 8:149.
[51] Goldstein I J, Hayes C E. The lectins: Carbohydrate-binding proteins of plants and animals[J]. Adv. Carbohyd. Chem. Biol., 1978, 35:127-340.
[52] Wang H, Ding S, Wang G,etal.. In situ characterization and analysis of Salmonella biofilm formation under meat processing environments using a combined microscopic and spectroscopic approach[J]. Int. J. Food Microbiol., 2013, 167(3): 293-302.
[53] 游雪娇, 李良秋, 马连营, 等. 激光共聚焦扫描显微镜在抗菌机理研究中的应用[J]. 微生物学通报, 2015, 42(6): 1108-1121.
[54] Heydorn A, Nielsen A T, Hentzer M,etal.. Quantication of biolm structures by the novel computer program COMSTAT[J]. Microbiology, 2000, 146:2395-2407.
[55] 陈 璐, 王 博, 姚蜜蜜, 等. 基于COMSTAT软件对微生物被膜进行定量分析的方法与意义[J]. 现代生物医学进展, 2014, 14(7): 1201-1206.
[56] Heydorn A, Ersboll B K, Hentzer M,etal.. Experimental reproducibility in flow-chamber biofilms[J]. Microbiology, 2000, 146(4): 2409-2415.
[57] Larimer C, Winder E, Jeters R,etal.. A method for rapid quantitative assessment of biofilms with biomolecular staining and image analysis[J]. Anal. Bioanal. Chem., 2016, 408(3): 999-1008.
[58] Yang S, Abdel-Razek O A, Cheng F,etal.. Bicyclic brominated furanones: a new class of quorum sensing modulators that inhibit bacterial biofilm formation[J]. Bioorg. Medicinal Chem., 2014, 22(4): 1313-1317.
[59] Beyenal H, Donovan C, Lewandowski Z,etal.. Three-dimensional biofilm structure quantification[J]. J. Microbiol. Meth., 2004, 59(3): 395-413.
[60] 邹志慧, 余加林, 杨冰岩, 等. 纳米银离子对铜绿假单胞菌生物被膜结构的影响的分析[J]. 中国微生态学杂志, 2014, 26(6): 641-645.
[61] Khajotia S S, Smart K H, Pilula M,etal.. Concurrent quantification of cellular and extracellular components of biofilms[J]. J. Vis. Exp., 2013, 82: 1-7.
Review on the Quantification Analysis Methods of Biofilm
ZHAO Zhi-ying, LI Liang-qiu*, MA Lian-ying, YOU Xue-jiao
StateKeyLaboratoryofAppliedMicrobiologySouthernChina;GuangdongProvincialKeyLaboratoryofMicrobialCultureCollectionandApplication,GuangdongInstituteofMicrobiology,Guangzhou510070,China
Because of strong pathogenicity, drug resistance and stress resistance, biofilm has become a major problem of global concern. In this paper, a review was made on the quantitative analysis methods of biofilm biomass, total cell count, living cell number, macromolecular substance and structure, which was expected to provide abandant methods for biofilm research. We are also looking forward to provide theory reference to promote biofilm quantitative analysis method, thereby we can better prevent, control and exploit biofilm.
biofilm; quantification; detection
2016-06-02; 接受日期:2016-06-30
广东省科学院分析测试基金项目(Sf201502)资助。
赵智颖,助理工程师,研究方向为微生物资源学。 E-mail:crystal23200@163.com。*通信作者:李良秋,教授级高级工程师,研究方向为微生物资源与发酵工程。E-mail: liliangqiu1010@163.com
10.3969/j.issn.2095-2341.2016.05.03
