大蒜素对糖尿病肾病大鼠肾脏保护作用的实验研究
2016-12-21黄虹江缨袁放郑和昕阮园吴天凤
黄虹 江缨 袁放 郑和昕 阮园 吴天凤
大蒜素对糖尿病肾病大鼠肾脏保护作用的实验研究
黄虹 江缨 袁放 郑和昕 阮园 吴天凤
目的 探讨大蒜素对糖尿病肾病大鼠肾脏的保护作用及其机制。方法 将60只雄性SD大鼠采用腹腔注射链脲佐菌素(STZ)的方法建立糖尿病肾病大鼠模型,造模成功的大鼠采用随机数字表法分为低、中、高剂量组[分别采用15、30、45mg/(kg·d)大蒜素混悬液灌胃]、贝那普利组[贝那普利17.5 mg/(kg·d)灌胃]和模型组(0.9%氯化钠溶液灌胃),各12只,另以10只SD大鼠0.9%氯化钠溶液灌胃为正常对照组,分别于用药的0、4、8、12周末检测大鼠空腹血糖(FBG)、血尿素氮(BUN)、血肌酐(Scr)和24h尿白蛋白排泄率(UAE)水平,12周末时检测大鼠体质量、肾质量、肾质量/体质量;采用电镜及Masson染色观察大鼠肾组织病理学变化;采用Western blot法检测肾组织转化生长因子-β1(TGF-β1)、I型胶原(Collagen I)及p-ERK1/2蛋白的表达强度。结果 12周末时,高剂量组大鼠的肾质量/体质量、FBG、Scr、BUN、UAE低于模型组(均P<0.05),且肾小球肥大、系膜细胞增生、肾小球变形病变明显减轻,TGF-β1、Collagen I及p-ERK1/2的蛋白表达均显著下降(P<0.01)。结论 大蒜素可降低糖尿病肾病大鼠肾组织TGF-β1、Collagen I及p-ERK1/2的表达,具有一定的肾保护作用。
大蒜素 糖尿病肾病 TGF-β1 p-ERK1/2
【 Abstract】 Objective To investigate the renal protective effect and mechanism of allicin on rats with diabetic nephropathy. Methods Diabetic nephropathy model were established by intraperitoneal injection of streptozotocin(STZ)in 60 male SD rats,then the animals were randomly divided into 5 groups with 12 in each group.Rats in low,middle and high dose allicin groups were given 15,30,45 mg/kg·d allicin,respectively,rats in benazepril group were given 17.5 mg/kg·d benazepril by gavage and no drug was given to rats in model group.Ten SD male rats were included in experiment as normal control group. Fasting blood glucose(FBG),serum urea nitrogen(BUN),serum creatinine(Scr)and 24-h urine albumin excretion(UAE)were detected at the 4,8,12th weeks.At the end of 12 weeks animals were sacrificed,the body mass,kidney mass,and the ratio of kidney mass/body mass of rats were detected.Histopathological changes of kidney were observed by light microscope,electron microscope,and Masson staining.Expression of collagen I,transforming growth factor-β1(TGF-β1)and phosphorylation of extracellular signal-regulated kinase 1/2(p-ERK1/2)were examined by Western blot. Results Compared with model group,the kidney mass/body mass,FBG,Scr,BUN and 24-h UAE in high dose allicin group were significantly decreased at the end of wk 12(P<0.05),the glomerular hypertrophy,mesangial cell proliferation,glomerular deformation lesions were significantly attenuated, and the expression of TGF-β1,collagen I and p-ERK1/2 protein were decreased significantly(P<0.01). Conclusion Allicin may have a protective role in diabetic nephropathy rats,which is associated with the down-regulation of TGF-β1,collagen I and p-ERK1/2 expression.
【 Key words】 Allicin Diabetic nephropathy Transforming growth factor-β1 Phosphorylation of extracellular signal-regulated kinase 1/2
糖尿病肾病是糖尿病常见、严重的慢性并发症,也是导致终末期肾病的主要原因。我国终末期肾病患者的比例正逐年增加[1],探讨糖尿病肾病的发病机制,寻找有效治疗的新靶点,对防治糖尿病肾病、延缓终末期肾病的进程具有重要意义。转化生长因子β1(TGF-β1)在糖尿病肾病中发挥重要作用,对肾细胞的分化、增生和细胞外基质的合成及降解具有很强的调控作用[2];大蒜素为大蒜的主要有效成分,具有抗肺、肝及心肌纤维化的作用[3-6],但鲜有关于大蒜素对糖尿病肾病干预作用的报道。本研究通过检测大蒜素对糖尿病肾病大鼠模型肾组织TGF-β1及Ⅰ型胶原蛋白表达的影响,探讨大蒜素对糖尿病肾病大鼠肾脏的保护作用及可能机制,现将结果报道如下。
1 材料和方法
1.1 材料 (1)实验大鼠:选择雄性SD大鼠70只,体质量200~220g,由浙江中医药大学实验动物中心提供[动物许可证号:SCXK(浙)2008-0016]。(2)主要药物、试剂和仪器:大蒜素注射液(规格30mg/2ml,生产批号:8239401)购自上海禾丰制药有限公司;链脲佐菌素(STZ)购自美国Sigma公司;枸橼酸缓冲液(0.1mol/L,pH 4.5)由浙江中医药大学实验动物中心配制;贝那普利(10mg/片,生产批号:20110513)购自北京诺华制药有限公司。尿微量白蛋白(UAE)ELISA试剂盒购自美国Exocell公司;Masson染色试剂盒购自南京建成科技有限公司。兔抗鼠TGF-β1、β-actin抗体购自美国Santa Cruz公司,兔抗鼠CollagenⅠ抗体购自Abcam公司;p-ERK1/2抗体、ERK1/2抗体购自Cell Signal Technology公司。日立7170自动生化分析仪由日本日立公司提供,Sigma高速冷冻离心机由德国SIGMA公司提供,血糖仪由美国罗氏公司提供。
1.2 方法
1.2.1 糖尿病肾病大鼠模型制备 参考文献[7],大鼠适应性饲养1周后,除正常对照组(10只)外,其余60只大鼠均行STZ60 mg/kg单次腹腔注射(使用前用枸橼酸缓冲液溶解),注射72h后,尾静脉采血测血糖,连续3d随机血糖≥16.7mmol/L为糖尿病大鼠造模成功。糖尿病大鼠继续喂养1周,以1周后随机血糖≥16.7mmol/L,24h尿量大于造模前50%、24h尿白蛋白大于造模前50%为糖尿病肾病模型制备成功。
1.2.2 实验分组及给药方法 60只糖尿病肾病模型大鼠采用随机数字表法分为5组(每组12只),其中低、中、高剂量组分别予大蒜素15、30、45mg/(kg·d),贝那普利组予贝那普利17.5 mg/(kg·d),均用0.9%氯化钠溶液稀释至3ml,模型组及正常对照组予3ml 0.9%氯化钠溶液灌胃[8-9]。大鼠单笼饲养,每日上午给药1次,连续12周。实验期间大鼠自由饮水、标准饮食,不使用胰岛素及其他降糖药物。
1.2.3 标本的收集 分别于实验的0、4、8、12周末给每组大鼠称重,之后股静脉采血,分离血清测定空腹血糖(FBG)、血尿素氮(BUN)、血肌酐(Scr)等生化指标,用代谢笼留取大鼠24h尿液并记录,取10ml,5 000r/min离心10min,去除沉渣,于-20℃冰箱保存待测。给药12周末时,称重后处死大鼠,以10%水合氯醛300mg/kg腹腔注射麻醉,剪开大鼠腹腔,采用10ml注射器进行心脏取血,室温静置1h后,5 000r/min离心15min,吸取上层血清,于-20℃冰箱保存待测。大鼠处死后迅速取出肾脏,经4℃预冷的0.9%氯化钠溶液灌洗,至整个肾脏颜色变苍白后游离,去除包膜称肾质量,取部分肾皮质置于40g/L多聚甲酚固定,以备组织病理检测。
1.2.4 生化指标测定 采用日立7170全自动生化分析仪测定FBG、Scr、BUN。24h尿微量白蛋白检测采用NephratⅡELISA试剂盒操作说明进行。
1.2.5 肾组织病理检测 将4%多聚甲醛溶液固定的肾组织石蜡包埋,常规组织切片(3μm),行Masson染色,于光镜下观察肾组织病理变化,并采用电镜观察肾组织的病变情况。
1.2.6 Western blot检测 分别采用总蛋白抽提试剂盒、膜蛋白抽提试剂盒提取肾脏组织总蛋白和膜蛋白。蛋白含量采用紫外分光光度法在280nm处进行浓度测定。取总蛋白30g进行SDS-PAGE凝胶电泳后,转印蛋白质至硝酸纤维素膜上,用立春红染色观察转印效果,然后用含5%脱脂牛奶的Tris缓冲液4℃封闭2h,洗膜后分别加入兔抗鼠TGF-β1(1∶500)、CollagenⅠ(1∶5 000)、p-ERK1/2(1∶2 000)、ERK1/2(1∶2 000)、β-actin(1∶2 000)进行杂交过夜。再用1∶2 000HRP标记的羊抗兔IgG进行二抗杂交。加入显色剂显色并曝光成像。扫描图像作计算机信号吸光度分析。
1.3 统计学处理 应用SPSS17.0统计软件,计量资料以表示,组间比较采用单因素方差,进一步行两两比较采用LSD-t检验。
2 结果
2.1 12周末时各组大鼠体质量、肾质量和肾质量/体质量 见表1。
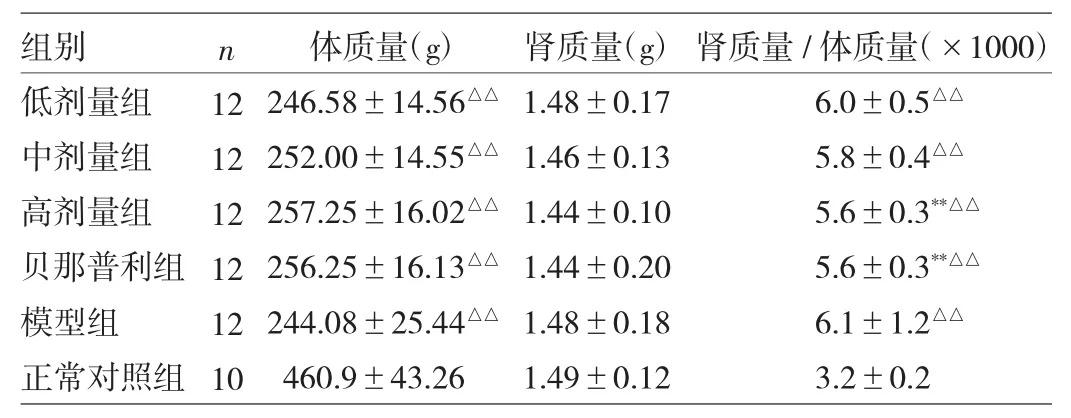
表1 12周末时各组大鼠体质量、肾质量、肾质量/体质量的比较
由表1可见,高剂量组及贝那普利组的肾质量/体质量明显低于模型组(t=2.933、3.067,均P<0.01);低、中、高剂量组、贝那普利组及模型组大鼠体质量均低于正常对照组(t=21.869、21.316、20.781、20.883、22.124,均P<0.01),肾质量/体质量均高于正常对照组(t=-17.063、-15.875、 -14.812、-14.688、-17.563,均P<0.01)。
2.2 各组大鼠肾脏组织形态学改变 光镜下所见如图1,电镜下所见如图2。

图1 各组大鼠肾组织形态变化光镜下所见(a:低剂量组;b:中剂量组;c:高剂量组;d:贝那普利组;e:模型组;f:正常对照组;Masson染色,×200)

图2 各组大鼠肾组织电镜下所见(a:低剂量组;b:中剂量组;c:高剂量组;d:贝那普利组;e:模型组;f:正常对照组,×50 000)
由图1可见,模型组大鼠肾小球肥大、变形,基底膜增厚,系膜基质增生,系膜区明显增宽,肾小管管腔变窄,上皮细胞肿胀、空泡样变性,肾间质明显纤维化,亮绿色纤维组织增生,弥漫性淋巴细胞浸润和成纤维细胞增生及胶原纤维形成。低、中、高剂量组大鼠上述病理改变均有不同程度改善,以高剂量组尤为明显,肾小球有所减小,基底膜增厚减轻,系膜轻度增生,细胞外基质轻度增多,肾小管上皮细胞肿胀、空泡样变性及间质纤维化程度和炎症细胞浸润显著改善。贝那普利组与高剂量组无明显差别。正常对照组大鼠肾组织形态正常,肾小球、肾小管间质未见异常改变。
由图2可见,电镜下模型组大鼠肾脏肾小球显示不规则,基底膜弥漫性均匀增厚,系膜区电子致密物沉积,系膜区基质明显增多,足突广泛融合;低、中剂量组肾小球基底膜稍增厚,系膜区基质稍增多,足突少量融合;高剂量组肾小球基底膜厚度尚均匀,未见明显增厚,足突细胞未见明显融合;贝那普利组与高剂量组无明显差别;正常对照组大鼠肾小球正常,基底膜厚度适中,足突细长整齐,无融合。
2.3 各组大鼠生化指标的比较 见表2。

表2 各组大鼠代谢指标的比较
由表2可见,造模4、8、12周时,中、高剂量组、贝那普利组FBG均低于模型组(t=4.244、4.156、2.404,2.338、2.721、2.976,2.528、2.969、2.328,均P<0.05),模型组的FBG均高于正常对照组(t=-16.671、-14.371、-16.680,均P<0.01)。造模4周时,高剂量组、贝那普利组大鼠的UAE和Scr水平均明显低于模型组(t=5.213、2.356,5.574、2.956,P<0.05或0.01),此外,贝那普利组BUN水平亦低于模型组(t=3.675,P<0.05),低剂量组、中剂量组上述指标较模型组则无明显改善(P>0.05)。模型组的UAE、BUN和Scr水平均高于正常对照组(t=-10.750、-8.669、-3.376,均P<0.01)。造模8周时,高剂量组、贝那普利组的的UAE、BUN和Scr水平均低于模型组(t= 2.602、2.344、2.557,3.796、2.851、2.607,均P<0.05),模型组UAE、BUN和Scr水平均高于正常对照组(t=-6.149、-8.387、-3.232,均P<0.01)。造模12周时,高剂量组、贝那普利组的UAE、BUN和Scr水平均低于模型组(t= 3.360、3.544、4.968,4.809、3.723、5.749,均P<0.05),中、低剂量组的Scr、中剂量组BUN亦低于模型组(t=4.225、2.980、3.185,均P<0.05),模型组大鼠UAE、BUN和Scr水平均明显高于正常对照组(t=-8.054、-10.849、-7.095,均P<0.01)。
2.5 各组大鼠肾脏TGF-β1、CollagenⅠ、p-ERK1/2蛋白表达的比较 见图3-5、表3。

图3 各组大鼠肾脏TGF-β1蛋白的表达(1:正常对照组,2:模型组,3:低剂量组,4:中剂量组,5:高剂量组,6:贝那普利组)
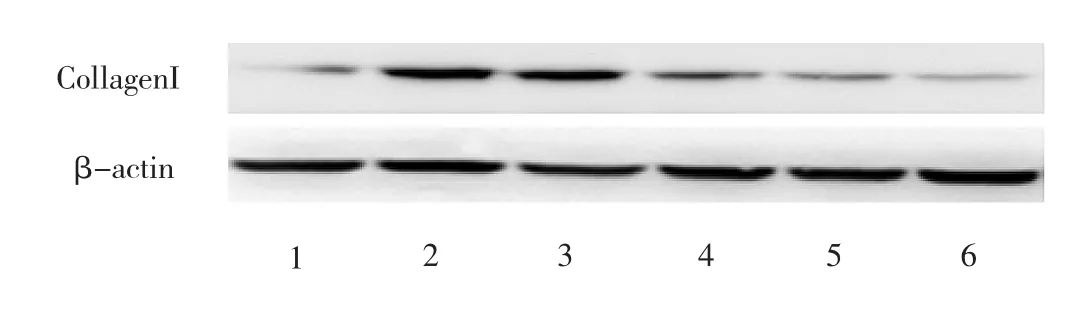
图4 各组大鼠肾脏CollagenⅠ蛋白的表达(1:正常对照组,2:模型组,3:低剂量组,4:中剂量组,5:高剂量组,6:贝那普利组)

图5 各组大鼠肾脏p-ERK1/2蛋白的表达(1:正常对照组,2:模型组,3:低剂量组,4:中剂量组,5:高剂量组,6:贝那普利组)
由表3可见,低、中、高剂量组及贝那普利组TGF-β1蛋白水平表达均低于模型组,其中中、高剂量组、贝那普利组更为显著(t=18.439、24.305、24.154,均P<0.01),中、高剂量组、贝那普利组的CollagenⅠ、p-ERK1/2蛋白水平表达均低于模型组,其中高剂量组、贝那普利组为显著(t=15.444、24.278、18.538、26.867,均P<0.01);模型组大鼠肾组织TGF-β1、CollagenⅠ、p-ERK1/2蛋白水平表达均明显高于正常对照组(t=-28.141、-19.447、-30.225,均P<0.01)。

表3 各组大鼠肾脏TGF-β1、CollagenⅠ、p-ERK1/2蛋白表达量比较
3 讨论
糖尿病肾病主要的特征是肾小球硬化、肾小管间质纤维化、蛋白尿以及Scr的升高,肾组织纤维化是糖尿病肾病进展至终末期肾病的病理特征,其发病机制是由多因素共同作用的结果,其中以高血糖是最关键的因素,糖代谢紊乱是糖尿病慢性并发症包括糖尿病肾病的启动因素,也是糖尿病肾病发生和发展的基本因素。肾组织系膜外基质过度积聚是糖尿病肾病时肾脏形态学改变的病理基础,最终可导致肾小球硬化。本研究采用经典的STZ诱导糖尿病肾病模型,发现在造模12周后,大鼠肾质量/体质量增加,生化指标如血糖、24h尿白蛋白定量、BUN及Scr均较正常对照组有不同程度的升高,病理学检查结果提示糖尿病肾病模型大鼠肾脏出现了早期糖尿病肾病的病理改变,肾小球体积增大,部分近端肾小管上皮细胞肿胀、空泡样变性,管腔变窄,肾小球系膜区扩大,基质增多,毛细血管基底膜弥漫性增厚,系膜细胞增生,与以往研究一致[10]。CollagenⅠ是细胞外基质的重要组成部分,正常情况下由系膜细胞产生。在病理情况下系膜细胞可表型转分化为肌成纤维细胞,大量表达CollagenⅠ等细胞外基质组成成分。本研究发现,模型组大鼠肾组织CollagenⅠ蛋白表达较正常组明显增强。
大蒜素为大蒜的主要有效成分,具有广泛的生物活性。近年研究发现,大蒜素对STZ所致糖尿病大鼠胰岛具有剂量依赖性的保护作用,可降低糖尿病大鼠的血糖,其作用机制可能与大蒜素能有效改善抗氧化酶活性、提高自由基清除能力、抑制氧化应激损伤有关[11]。本研究结果发现,大蒜素可显著降低糖尿病肾病大鼠的血糖,与报道相一致[11]。另有研究报道,大蒜素有抗肺、肝及心肌纤维化作用,主要与其抑制成纤维细胞增殖,抑制促纤维化因子的分泌及减少细胞外基质的合成等有关。本研究发现,大蒜素干预12周后,与模型组比较,各不同剂量大蒜素组大鼠的肾质量/体质量(即肾脏肥大指数,糖尿病肾病发生的重要危险因子)有所下降,且UAE、BUN和Scr呈不同程度地降低,肾脏结构有所改善,肾小球体积减小,系膜增生有所缓解,肾小球基底膜增厚程度减轻,肾小管上皮细胞肿胀、空泡变性等变化的程度较轻,尤以大蒜素高剂量组表现明显,且与贝那普利组无明显差异,提示大蒜素对糖尿病肾病大鼠肾损害具有一定的保护作用。
TGF-β1作为公认的关键致纤维化因子,可通过不同信号传导途径产生多种重要的生物学效应,在肾间质纤维化发生、发展的多个环节中发挥了核心作用[12]。TGF-β1参与细胞外基质成分的进行性积聚过程,如刺激细胞外基质中胶原、纤维连接蛋白等合成,减少蛋白酶表达和增加蛋白酶抑制合成,上调细胞外基质受体整合素的表达,促进细胞与间质黏附和基质沉积等。有研究表明,糖尿病大鼠肾小管上皮细胞存在转分化,在肾脏局部过度表达的TGF-β1在肾间质纤维化过程中可能发挥了重要作用[13]。本研究发现,糖尿病肾病组大鼠肾组织TGF-β1表达显著高于正常对照组,提示TGF-β1表达增加可能参与糖尿病肾病的早期发病机制,其表达水平高低在一定程度上反映糖尿病肾病肾小球硬化和间质损害的严重程度。与模型组比较,大蒜素干预12周后,大鼠肾组织TGF-β1蛋白表达下降,且随着药物剂量增高,TGF-β1的表达降低越明显,呈剂量依赖性,且肾脏病理形态学改变亦有明显改善,表明大蒜素可能通过下调TGF-β1的表达减少细胞外基质沉积,尿蛋白减少,肾功能得到改善,延缓糖尿病肾病肾脏损害的进程。
丝裂原活化蛋白激酶(MAPK)信号通路是广泛存在于细胞内的信号转导途径,由丝氨酸/苏氨酸蛋白激酶组成。有研究提示,在MAPK家族中,细胞外调节激酶(ERK)信号通路是细胞信号中传递丝裂原信号的关键激酶,与肾脏纤维化密切相关[14-15]。另有研究表明,无论在糖尿病大鼠模型还是糖尿病患者的肾组织中,ERK的蛋白含量及活性均明显高于正常对照;肾脏细胞增生、肥大、细胞外基质增多等糖尿病肾病的典型病理改变与ERK通路的激活关系密切[16-17]。本研究提示p-ERK1/2在正常对照组大鼠肾组织仅少量表达,而在模型组大鼠肾组织的表达明显增加,经大蒜素干预后,肾组织p-ERK1/2的表达较模型组明显减少。
综上所述,本研究发现在糖尿病肾病大鼠模型中,大蒜素对缓解肾脏损害、保护肾脏具有一定的疗效,其作用除与降低糖尿病肾病大鼠血糖、改善肾功能、减少尿蛋白有关外,还下调肾组织TGF-β1、CollagenⅠ和p-ERK1/2的表达,其作用机制是否与抑制ERK通路有关还有待进一步研究。
[1] Xie Y,Chen X.Epidemiology,major outcomes,risk factors,prevention and management of chronic kidney disease in China[J]. Am J Nephrol,2008,28(1):1-7.
[2] Li X,Cui X,Sun X,et al.Mangiferin prevents diabetic nephropathy progression in treptozotocin-induced diabetic rats[J].Phytother Res,2010,24(6):893-899.
[3] 张海啸,史载祥,贾海忠,等.大蒜素对NIH3T3细胞增殖及胶原合成的影响[J].中国中西医结合杂志,2007,27(5):431-434.
[4] 张海啸,贾海忠,李格,等.大蒜素对压力负荷大鼠心肌纤维化的影响[J].中国中医基础医学杂志,2008,14(2):149-151.
[5] 张殿新,任雨笙,刘兵,等.大蒜素对血管紧张素Ⅱ诱导血管平滑肌细胞增殖的抑制作用[J].中国现代医学杂志,2005,15(14):2136-2138.
[6] 朱兰香,陈卫昌,刘世增,等.大蒜素对实验性大鼠肝纤维化的作用研究[J].中华消化杂志,2003,7(23):441-443.
[7] DaiG L,He J K,Xie Y,et al.Therapeutic potentialofNaja naja atra venom in a rat model of diabetic nephropathy[J].Biomed Environ Sci,2012,25(6):630-638.
[8] Bruck R,Aeed H,Brazovsky E,et al.Allicin,the active component of garlic,prevents immune-mediated,concanavalin A-induced hepatic injury in mice[J].Liver Int,2005,25(3):613-621.
[9] Salama AA,Aboulaila M,TerkawiMA,et al.Inhibitory effect ofallicin on the growth of Babesia and Theileria equi parasites[J]. Parasitology Research,2014,113(1):275-283.
[10] 雷作熹,罗仁,董晓蕾,等.STZ诱导糖尿病肾病大鼠模型的建立[J].中国实验动物学报,2005,13(3):163-165.
[11] 丁志杰,陈鹏.大蒜素对链脲佐菌素所致糖尿病大鼠胰岛的保护作用[J].国际药学研究杂志,2015,42(5):616-620.
[12] Border W A,Noble N A.TGF beta in kidney fibrosis:a target for gene therapy[J].Kidney Int,1997,51(5):1388-1396.
[13] 叶迅,李红,张晋红,等.糖尿病大鼠肾皮质细胞表型转化的探讨[J].中国病理生理杂志,2007,23(8):1645-1647.
[14] Pollack V,Sarkozi R,Banki Z,et al.Oncostatin M-induced effects on TEMT in human proximal tubular cells:differential role of ERK signaling[J].Am J PhysiolRenal Physiol,2007,293(5): F1714-1726.
[15] Phanish MK,Wahab N A,Hendry B M,et al.TGF-beta1-induced connective tissue growth factor(CCN2)expression in human renal proximaltubule epithelialcells requires Ras/MEK/ERKand Smad signalling[J].NephronExp Nephrol,2005,100(4):e156-165.
[16] Toyoda M,SuzukiD,Honma M.High expression of PKC-MAPK pathway mRNAs correlates with glomerular lesions in human diabetic nephropathy[J].Kidney Int,2004,66(3):1107-1114.
[17] SakaiN,Wada T,FuruichiK.Involvement of extracellular signalregulated kinase and p38 in human diabetic nephropathy[J].Am J Kidney Dis,2005,45(1):54-65.
Renal protective effect of allicin on rats with experimental diabetic nephropathy
HUANG Hong,JIANG Ying,YUAN Fang,et al. Department of Endocrinology,Zhejiang Hospital,Hangzhou 310013,China
2015-09-07)
(本文编辑:杨丽)
浙江省自然科学基金项目(Y2110918);浙江省中医药科技计划项目(2011ZA008)
310013 杭州,浙江医院内分泌科
吴天凤,E-mail:wwttffzjyy@126.com
