杨树LAR基因的克隆及表达对儿茶素合成的影响
2016-12-21苏衍修常聚普郭利民王延伟
左 涛 ,包 海 ,陈 慧 ,苏衍修 ,常聚普 ,郭利民 ,贺 伟 ,王延伟
(1.北京林业大学 a.林木有害生物防治北京市重点实验室;b.北京林业大学林木育种国家工程实验室;c.林木花卉遗传育种教育部重点实验室,北京 100083;2. 濮阳市林业科学院,河南 濮阳 457000)
杨树LAR基因的克隆及表达对儿茶素合成的影响
左 涛1a,b,c,包 海1b,c,陈 慧1b,c,苏衍修2,常聚普2,郭利民2,贺 伟1a,王延伟1b,c
(1.北京林业大学 a.林木有害生物防治北京市重点实验室;b.北京林业大学林木育种国家工程实验室;c.林木花卉遗传育种教育部重点实验室,北京 100083;2. 濮阳市林业科学院,河南 濮阳 457000)
无色花色素还原酶基因(Leucoanthocyanidin reductase,LAR)是类黄酮生物合成途径中的一个重要基因,为了验证杨树中LAR的功能,明确LAR基因对抗病物质儿茶素合成的影响,本实验以接种后第6 d的一年生‘中林46’杨树树干的树皮为材料, 利用RT-PCR技术克隆了LAR基因的OFR序列,并构建LAR的过表达载体pCAMBIA1301-LAR。采用农杆菌介导的叶盘法转化烟草,获得了转LAR基因的烟草6株。用qRT-PCR检测转基因烟草的表达量,结果显示,在转基因植株中,LAR基因的表达量均显著上调。用高效液相色谱法检测转基因植株中的儿茶素含量,结果显示,6株转LAR的烟草植株中,有4株内源儿茶素含量显著升高。以上结果表明,中林46杨LAR是杨树类黄酮生物合成途径中的一个基因,该基因与儿茶素的合成有关。
类黄酮;无色花色素还原酶基因;过表达;儿茶素
类黄酮是一类重要的次生代谢物,广泛存在于整个植物界中,从苔藓植物到被子植物均含有此类物质。在杜仲组织中,类黄酮合成途径上游的查尔酮合成酶基因(CHS)和查尔酮异构酶基因(CHI)的表达量在不同的组织中呈现差异[1]。无色花色素还原酶基因(LAR)是类黄酮生物合成途径中下游的一个重要基因,可直接将无色花色素转化为2,3-反式黄烷-3-醇,即儿茶素[2]。该基因最早在银叶山蚂蝗Desmodium uncinatum中基于蛋白纯化后克隆得到,编码LAR的基因目前已被分离并在大肠杆菌中成功表达[3]。Li等[4]将玉米中的Lc(Leaf colour)调控基因转入苹果植株中,结果显示转基因植物中LAR的表达量升高,且儿茶素大量积累。马春雷[5-6]用半定量的方法研究了茶树中各基因的表达量,结果发现随着儿茶素含量的增加,LAR的表达量有所增加,而其它基因的表达量则没有增加。对不同茶树品种间与儿茶素合成相关的多种酶差异表达分析显示,只有DFR和LAR基因的表达量与茶树总儿茶素含量呈一定的相关性。在模式植物拟南芥中没有未发现LAR,而只能合成表儿茶素[7-8],说明LAR与儿茶素的合成紧密相关。
烟草是最早应用分子生物学和基因工程研究的植物之一,作为模式植物,容易进行组织培养和获得转基因植株。在烟草的研究中已形成一套较为成熟的转基因技术流程,并获得了大批抗逆转基因烟草材料,从而在植物生命科学研究中起到了重要作用[9]。前人将脱落酸(ABA)诱导基因转入烟草,转基因烟草在干旱胁迫下有大量的ABA产生,其抗旱性得到提高[10]。将水稻的Os-SPXl基因转入烟草,与野生型植株相比,其耐寒性有所提高[11]。利用AoPR1作为启动子将CrylAc基因转化烟草,转基因烟草遭受机械损伤后,CrylAc蛋白含量迅速增加,对棉铃虫和烟草天蛾的抗性增强[12]。
在本课题组前期研究中,发现‘中林 46’ 杨Populus×euramericanaNeva cv.‘Zhonglin 46’在受欧美杨细菌性溃疡病病菌Lonsdalea quercina(Hildebrand and Schroth)Brady.subsp.populi.侵染后,其发病率和发病指数高于‘107杨’[13],并且LAR基因明显上调[14],这一结果初步表明LAR基因受到病原菌的诱导,LAR可能与杨树抗病性有关,但未经验证。若能利用转基因的方法,证明‘中林46’杨LAR基因与儿茶素的含量有关,可为深入研究LAR基因的功能提供参考,并为抗病分子育种提供候选基因。为此,本研究克隆了‘中林46’杨接种细菌性溃疡病菌后诱导的LAR基因并构建其过表达载体,利用转基因技术转化烟草。在验证正义的LAR基因插入到烟草基因组后,用qRT-PCR对转基因烟草进行LAR的表达量检测,用HPLC法测定其相应的表达产物儿茶素的含量,确定该基因在烟草中的表达所引起的儿茶素含量变化,以期为分析LAR基因的功能提供进一步的研究线索。
1 材料与方法
1.1 材 料
从杨树组织中分离得到的欧美杨细菌性溃疡病致病菌株Lonsdalea quercinaN-5-1保存于北京林业大学森林病理实验室。于2015年9月,在河南濮阳市林科院苗圃,选取1年生‘中林46’杨苗木,用菌株Lonsdalea quercinaN-5-1伤皮接种。接种苗木共3株,在每株苗干上间隔30 cm接一个点,共接4个点,接种后裹胶带保湿。取同样的苗木3株,接无菌水作为对照,接种后第6 d采集接种处长2 cm、宽1 cm的树皮组织,液氮速冻后-80 ℃保存备用。烟草组培苗由北京林业大学林木育种国家工程实验室提供。pCAMBIA1301质粒购自杭州宝赛生物科技有限公司。根癌农杆菌菌株LBA4404由北京林业大学树木生长发育生化机理研究室提供。
1.2 RNA提取和cDNA合成
采用RNA试剂盒改良法[15]提取接种后第6 d的‘中林46’杨树皮总RNA。cDNA第一链的合成按照Invitrogen公司的反转录试剂盒(Superscript III Reverse Transcriptase First-Strand Synthesis System)说明书进行。RNA取2 μg,反转录体系为20 μL。
1.3 LAR基因的克隆
根据Phytozome数据库(http://www.phytozome.net/)中公布的毛果杨无色花色素还原酶基因(LAR)(登录号:Potri.009G118300)序列,利用Primer Premier5.0软件设计引物:

将反转录后的cDNA稀释100倍,并以其为模板进行PCR扩增,反应体系如下:

总体积 50 μL
PCR反应条件为94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸7 min。琼脂糖凝胶中电泳检测扩增产物,并按照琼脂糖凝胶DNA回收试剂盒说明书对PCR产物进行回收。将回收后的目的片段与pGEM-T(Progema)载体连接并转化大肠杆菌Top10感受态细胞,在LB培养基上(含100 mg/L氨苄青霉素)进行蓝白斑筛选。挑选阳性克隆于LB液体培养基中(含100 mg/L氨苄青霉素)振荡培养至浑浊,做菌液PCR扩增鉴定阳性克隆后,送上海英潍捷基生物公司测序。利用DNAMAN软件对克隆得到的LAR基因序列和Phytozome中公布的毛果杨LAR基因序列进行比对。
1.4 LAR序列载体构建
用NcoI和BglII内切酶双酶切克隆载体上的LAR片段和pCAMBIA1301载体,再将LAR片段和pCAMBIA1301连接,构建植物过表达载体,并做菌落PCR[13]和测序鉴定。
1.5 植物表达载体转入农杆菌
制备农杆菌LBA4404感受态[16],然后用冻融法[17]将表达载体转化农杆菌感受态细胞,在YEB固体培养基(含利福平50 mg/L、链霉素100 mg/L、卡那霉素50 mg/L)上28 ℃培养48 h,菌落PCR验证后,得到转基因工程菌。
1.6 农杆菌介导的烟草转化
剪下组培3~4周的烟草无菌幼嫩叶片,用无菌手术刀划出伤口。采用农杆菌介导法侵染叶片[18-19],将侵染后的烟草叶片暗培养3 d,之后将叶片放入含有浓度为200 mg/L的特美汀和20 mg/L的潮霉素的筛选培养基中分化筛选,在培养温度为25 ℃,光周期为16/8 h的组培室进行培养。
1.7 转基因植株的普通PCR检测
提取转基因烟草叶片和野生型烟草叶片的基因组DNA,按照植物基因组DNA提取试剂盒的说明书进行,以CaMV 35S和目的片段设计引物:
LARF:5’-TGACGCACAATCCCACTATC-3’;LARR:5’-GAGCAGCTGTAACTCCAATCT-3’。反应条件为:95 ℃预变性3 min; 95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。反应体系如下:

总体积 25μL
PCR产物用0.8%琼脂糖凝胶电泳检测。
1.8 转基因植株的qRT-PCR检测
从转基因烟草叶片和野生型烟草叶片中提取总RNA,RNA提取和反转录方法同上。qRT-PCR引物如下:

采用宝生物工程(大连)有限公司的SYBR Premix Ex Taq实时定量 PCR试剂盒进行表达分析,以Ubiquitin作为内参基因,分别检测转基因烟草和野生型烟草中的相对表达量的变化。PCR反应体系含SYBR Premix Ex Taq酶10 µL、ROX dyeII 0.4 µL、10 µmol/L 上下游引物各 0.4 µL、cDNA模板2 µL,用ddH2O补充体积至20 µL。PCR反应程序为:95 ℃预变性15 min,95 ℃变性10 s、60 ℃退火32 s、共45个循环,并采集荧光数据。
1.9 HPLC法测量植株中儿茶素含量
甲醇溶解1 mg儿茶素标准品,定容至10 mL,配制浓度为100 μg/mL的标准品溶液,用0.45 µm的微孔膜过滤。分别称取转基因烟草和野生型烟草的干重叶片粉末各100 mg,加入10 mL70%的乙醇[20],超声破碎30 min,12 000 r/min离心2 min,将清液用旋转蒸发仪60 ℃旋蒸后定容至10 mL,通过0.45 μm的微孔膜过滤后,在色谱条件下进行测定。色谱条件为:检测波长λ=280 nm;流动相为乙腈-0.1%磷酸(V∶V)[21];柱温为30 ℃;流速为1.0 mL/min。
2 结果与分析
2.1 LAR基因的扩增及克隆
提取中林46杨接种后第6 d的树皮总RNA,反转录后以cDNA为模板,PrLAR-F和PrLAR-R为引物扩增,凝胶电泳PCR扩增产物,得到一条约1 000 bp左右的片段(图1),片段大小与引物设计的预期结果一致。
2.2 测序结果及序列分析
测序后得到的LAR基因序列,利用DNAMAN软件,与Phytozome中公布的毛果杨LAR基因序列(Potri.005G229500)进行比对(图2)。中林46中的LAR基因(ATGGCCGCGAAAACTAAGA TTCTGTTCATCGGGGGAACAGGATACATAGGAA AATTCATAGTGGAAGCAAGTGCCAAGGCAGGC CACCCTACTTTTGCTCTTGTTAGAAAGTCCAGT CTTTCTAGCCCTGCCAAATCTAATGTGATTAACA AATTCAAGAATCTTGGTGTCAATTTTCTCACTG GAGATTTGTTTGATCATGAGAGTTTGGTGAAGG CGATAAAGCAAGTGGATGTGGTGATCTCTGCG GTTGGTCACTCTCAATTGGGTAACCAAGACAG GATCATTACTGCCATTAAAGAAGCTGGAAATGT TAAGAGGTTTTTCCCGTCCGAATTTGGAAATGA TGTTGATAGGGTGCATGCTGTTGAACCAGTAAA ATCAGCATATGCTCATAAGGTTAAACTACGCAG AGTTCTTGAGGCCGAAGGAATTCCATACACCAT TGTGTCAAATAATTTTTTTGCTGGTTATTTCCTT CCAACTTTGAACCAGATTGGAGTTACAGCTGC TCCAAGAGATAAAGTTGTCATCTGGGGTGATGG AAATCCTAAAGCGGTGTTTAACGTGGAAAATG ACATTGGCACCTATACTATCAGAGCAGTGGATG ATCCAAGAGCCTTGAACAAAATCCTCTACATTA GACCCCCAGCTAACACCATCTCATTCAACGATC TTGTGTCTTTGTGGGAGAGGAAGATTGGGAAA ACCCTTAAAAGGATTTACATTCCCGAGGAGCA ACTTTTGAAGAATATTCAAGAAGCTCCATTTCC AGACAGTGTGGAATTAGCACTTTTTCACTGTGT CTTTGTGAAGGGAGATCACACCAACTTCAAGA TTGAACCATCATTTGGTGTAGAGGCTTCTGAGC TTTACCCTGATGTCAAATACACTACCGTGGATG AATACCTTGATCAGTTTGTCTGA)与毛果杨中的LAR基因具有94.67%的相似性,保守性较高,其开放阅读框架为927 bp,编码308个氨基酸。

图1 ‘中林46’杨LAR基因RT-PCR扩增电泳Fig.1 Electrophoresis of LAR gene of P. euramericana cv.‘Zhonglin 46’ with RT-PCR ampli fi cation
2.3 表达载体的构建
克隆载体和pCAMBIA1301载体用NcoI和BglII双酶切,然后用T4 DNA Ligase连接酶切后的LAR和pCAMBIA1301,将连接产物转化农杆菌LBA4404感受态,做菌落PCR检测阳性克隆(图3),并将阳性克隆菌液送公司测序,检测LAR序列正确插入到了pCAMBIA1301载体CaMV 35S启动子的下游,检测正确的表达载体命名为pCAMBIA1301-LAR,转入农杆菌感受态细胞中并得到转基因工程菌株。

图3 阳性克隆的菌落PCRFig.3 Colony PCR analysis of positive clones
2.4 转基因植株的普通PCR检测
转基因工程菌侵染后的烟草叶片经过3 d暗培养后,将其放在筛选培养基上分化筛选,再将筛选得到的抗性植株置于生根培养基中生根,进而得到完整的烟草抗性苗。提取烟草抗性苗叶片的基因组DNA,以CaMV 35S和目的片段设计引物,以野生型烟草为阴性对照,重组质粒pCAMBIA1301-LAR为阳性对照,经普通PCR扩增后抗性植株得到长度为655 bp的特异扩增片段,与预期大小一致(图4),可以初步证明LAR基因已整合到烟草的基因组中。共检测转LAR基因的烟草抗性植株6株,得到阳性植株6株。
2.5 转基因植株的qRT-PCR分析
提取6株转基因烟草叶片和野生型烟草片的总RNA,将反转录后的cDNA作为模板进行qRTPCR的表达量分析,用2-ΔΔCT方法来进行相对定量计算。结果显示(图5),正义表达载体pCAMBIA1301-LAR转入烟草后,在转基因植株中,LAR基因的表达量均显著上调。
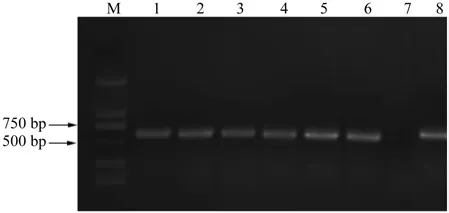
图4 转基因烟草再生苗的PCR鉴定Fig.4 PCR analysis of transgenic seedling of tobacco
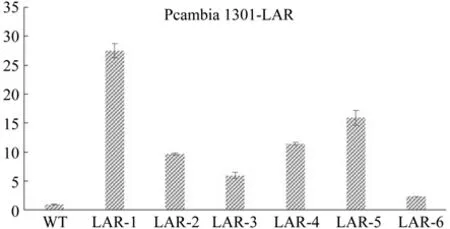
图5 转基因烟草再生苗LAR基因的表达量检测Fig.5 LAR gene expression detection of transgenic seedling of tobacco
2.6 转基因植株中儿茶素的含量测定
HPLC条件为:从0 min开始到40 min,流动相乙腈为10%,0.1%磷酸为90%;40 min以后流动相乙腈为100%,0.1%磷酸为0。标准品进样量为1 μL,样品进样量为10 μL。WT为对照组,TS为实验组,由图6可知,儿茶素标准品出峰的时间为6.8 min,WT在6.8 min时没有单峰(图7),TS1、TS2、TS5和TS6在6.8 min时均有单峰,而TS3和TS4在6.8 min时没有单峰(图8)。
根据面积比等于浓度比的关系,求出内源儿茶素含量,即内标面积/样品面积=内标浓度/样品浓度(表1)。

图6 儿茶素标准品HPLC分析图谱Fig.6 The HPLC analysis of catechin standard product

图7 野生型烟草对儿茶素的检测结果Fig.7 The HPLC analysis of catechin product from WT

图8 TS1~TS6对儿茶素的检测结果Fig.8 The HPLC analysis of catechin product from TS1~TS6

表1 各样品中儿茶素的液相峰面积与含量Table 1 The liquid phase peak area and content of catechin in the sample
由表1和表2可知,在野生型烟草中儿茶素含量未检测到,在转LAR的烟草植株TS1、TS2、TS5和TS6中,其内源儿茶素的含量大幅度增加,而TS3和TS4中没有检测到儿茶素。
3 结论与讨论
本研究克隆出了接种欧美杨溃疡病菌第6 d后的‘中林46’杨LAR基因,并构建了正义表达载体,通过农杆菌介导转入烟草中,得到6株正义LAR转基因阳性植株,在6株转基因株系中,LAR的表达量全部上调,其中有4株的儿茶素含量大幅度提高。说明外源的LAR促进了内源儿茶素的合成。
根据前人的研究结果可知,儿茶素在植物对病原物质的防御和抵抗中也发挥着重要作用。在棉枯萎病菌Fusarium oxysporumf. sp. vasinfectum(Atk.) W.C. Snyd. &H. N. Hans.侵染棉苗组织后,儿茶素的含量显著升高[22]。研究显示,棉花体内的儿茶素可使立枯丝核菌RhizoctoniasolaniKühn产生的的多聚半乳糖醛酸酶(PG)失活[23],并能抑制棉枯萎病菌的菌丝生长[24]。在后续的研究中,可对转基因烟草和野生型烟草进行欧美杨细菌性溃疡病菌的接种,观察发病情况,并作分子检测,进一步揭示儿茶素和其合成相关基因LAR在抗病中的作用。
在本研究中,转基因烟草有2株没有检测到儿茶素,可能与转基因沉默有关系。以往植物转基因研究发现,将查耳酮合成酶基因转入紫色矮牵牛花中以加深它的颜色,结果发现一些花色不但没有加深反而变浅,这是因为转入的查耳酮合成酶基因和牵牛花中正常的基因一起发生了沉默[25]。后续研究发现,该结果是一种转基因诱导的转录后基因沉默现象[26]。利用反义RNA阻断线虫中的par-1基因,结果发现,反义RNA阻断了par-1基因表达,但同时正义RNA的对照组也出现par-1基因失活现象[27]。之后有科学家提出, dsRNA对其同源序列的mRNA表达具有很强的干涉作用,并称这种现象为RNA干涉,即RNAi[28]。后来又有一些实验证明,在特定酶的参与下,外源和内源的双链RNA都可诱导生物体内同源的mRNA发生降解,从而阻断基因的表达,引发转录后水平的基因沉默[29]。为了明确转基因烟草中没有儿茶素的现象是否真的与RNAi有关,还需要做进一步的研究方可判断。
在本实验中还发现,野生型的烟草叶片中没有儿茶素。而在前人的研究中发现拟南芥没有LAR基因,其只能合成表儿茶素而不能合成儿茶素[30-31]。因此,野生型烟草的儿茶素类化合物的合成途径可能与拟南芥相似,在后续的研究中,可以分别检测野生型烟草中与儿茶素类化合物合成相关的基因是否存在和其表达情况,以做进一步分析。
[1]李铁柱,杜红岩,王璐.杜仲黄酮生物合成途径相关基因表达差异研究[J]. 经济林研究, 2014, 32(1):21-26.
[2]Furukawa T, Eshima A, Kouya M,et al.Coordinate expression of genes involved in chtechin biosynthesis in Polygonumhydropiper[J]. Plant Cell Reports, 2002(21):385-389.
[3]Tanner GJ, Francki KT, Abrahams S. Proanthocyanidin biosynthesis in plants: puri fi cation of legume leucoanthocyanidin reductase and molecular cloning of its cDNA[J]. The Journal of Biological Chemistry, 2003(278):31647-31656.
[4]Li H H, Flachowsky H, Fischer T C,et al.Maize Lc transcription factor enhances biosynthesis ofanthocyanins,distinct proanthocyanidins and phenylpropanoids in apple(Malus domesticaBorkh.) [J]. Planta, 2007(226):1243-1254.
[5]马春雷.茶树查尔酮异构酶、黄酮醇合成酶和无色花色素还原酶等基因的克隆与表达分析[D].北京:中国农业科学院, 2007.
[6]马春雷,乔小燕,陈 亮.茶树无色花色素还原酶基因克隆及表达分析[J].茶叶科学,2010,30(1):27-36.
[7]Pourcel L, Routaboul JM, Kerhoas L,et al. TRANSPARENT TESTA10 encodes alaccase-like enzyme involved in oxidative polymerization of flavonoids in Arabidopsis seed coat[J]. The Plant Cell, 2005(17):2966-298.
[8]Liang M, Davis E, Gardner D,et al.Involvement of AtLAC15 in lignin synthesis in seeds and in root elongation of Arabidopsis[J].Planta, 2006,(224):1185-1196.
[9]王津津,侯学文.基因工程技术提高烟草抗病虫性的研究进展[J].植物保护,2010,36(6):1-5.
[10]Imai R, Meena M S, Bray E A. Expression of an ABA induced gene of tomato in transgenic tobacco during periods of water de fi cit[J]. Journal of Experimental Botany,1995,(46):1077-1084.
[11]Zhao LN, Liu FX, Xu WY,et al. Incrcased expression of OSSPXl enhance cold/subfreezing tolerance in tobacco and Arabidopsis thaliana[J]. Plant Biotechnology, 2009,(7):550-561.
[12]Gulbitti-Onarici S, Zaidi M A, Taga I,et al. Expression of CrylAc in transgenic tobacco Plants under the control of a woundinducible promoter(AoPR1) isolated from Asparagus of fi cinalis to control Heliothis virescens and Manducasexta[J]. Molecular Biotechnology, 2009,42(3):341-349.
[13]倪 琳,贺 伟,常聚普.林分因子和气象因素对欧美杨溃疡病发生的影响[J].中南林业科技大学学报, 2014,34(8):53-58.
[14]Hou J, Wu Q, Zuo T,et al.Genome-wide transcriptomic pro fi les reveal multiple regulatory responses of poplar to Lonsdalea quercina infection[J]. Trees, 2016 (online,DOI: 10.1007/s00468-016-1376-7).
[15]侯 佳,孙丰硕,吴秋明,等.一种高效提取杨树发病树皮总RNA的方法及应用[J].植物生理学报,2014,5(2):223-228.
[16]朱 锦,权军利,何玉科.根癌农杆菌感受态细胞的制备以及质粒ProkⅡ对其转化的研究[J].西北农林科技大学学报,2006,34(7):91-95.
[17]Rhodes CA,Pierce DA,Metller IJ .Genetically transformed maize plants from protoplasts[J]. Science,1988,(240):204-207.
[18]Bevan MW, Flavell R B, Chilton M D. A chimaeric antibiotic resistance gene as a selectable marker for plant cell transformation[J]. Nature, 1983,(304):184-187.
[19]Horsch RB, Fry JE, Hoffman NL, Eichholtz D, Rogers SG,Fraley RT. Asimple and general method for transferring genes into plant[J]. Science,1985,227(7):1229-1231.
[20]贾可敬,李湘洲,殷 凯.长沙青皮竹叶中黄酮类化合物的提取工艺条件[J].经济林研究,2014, 32(2):125-129.
[21]张戎睿,王舒雅,王富济,等.HPLC法同时检测茶叶中八种儿茶素[J].黑龙江医药,2011,24(5):681-683.
[22]宋凤鸣,郑 重,童贤明,等.儿茶素对棉枯萎病菌胞壁降解酶的抑制及在棉花抗病性中的作用[J].真菌学报,1996,15(4):297-303.
[23]Hunter R.EInactivation of pectic enzymes by polyphenols in cotton seedlings of different ages infected with Rhizoctonia solani[J]. Physiological Plant Pathology,1974,(4):151-159.
[24]宋凤鸣,郑重,葛秀春,等.儿茶素在棉苗对枯萎病抗性中的作用[J].植物病理学报, 1998, 28(2):139-143.
[25]Napoli C,Lemieux C,Jorgensen R A. Introduction of a chimerieehaleone synthase gene into Petunia results in reversible cosuppression of homologous genesintrans[J]. The Plant Cell,1990:279-289.
[26]陈 文,王 东,何弈昆.RNA介导的转基因沉默:原理及应用[J]. 遗传 ,2003,25(4):459-494.
[27]Guo S, KemphuesK J, Par-1,a gene required for establishing polarity in C. elegans embryos,encodes a putative Ser/Thr kinase that is asymmetrically distributed[J]. Cell,1995,81(4):611-620.
[28]Fire A, Xu S, Montgomery M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabitis elegans[J]. Natrue, 1998,(391):806-811.
[29]Waterhouse P M, Wang M B, Lough T. Gene silencing as an adaptive defence against viruse[J]. Nature,2001,(411):834-842.
[30]Pourcel L, Routaboul J M, Kerhoas L,et al.TRANSPARENT TESTA10 encodes alaccase-like enzyme involved in oxidativ epolymerization of fl avonoids in Arabidopsis seed coat[J]. The Plant Cell, 2005,(17): 2966-2980.
[31]Liang M, Davis E, Gardner D,et al.Involvement of AtLAC15 in lignin synthesis in seeds and in root elongation of Arabidopsis[J].Planta, 2006,(224):1185-1196.
Cloning of Poplar Leucoanthocyanidin reductase gene(LAR) and transgenic analysis on catechin synthesis in tobacco
ZUO Tao1a,b,c, BAO Hai1b,c, CHEN Hui1b,c, SU Yan-xiu2, CHANG Ju-pu2, GUO Li-min2, HE Wei1a, WANG Yan-wei1b,c
(1a. Key Laboratory for Silviculture and Conservation of Ministry of Education of Beijing Forestry University; b. National Engineering Laboratory for Tree Breeding of Beijing Forestry University; c. Tree and Ornamental Plant Breeding and Biotechnology Laboratory of State Forestry Administration of Beijing Forestry University, Beijing Forestry University, Beijing 100083, China; 2. Forestry Research Institute of Puyang, Puyang457000, Henan, China)
Leucoanthocyanidin reductasegene (LAR) is one of important genes in fl avonoids biosynthesis pathway. This investigation was conducted in order to verify function ofLAR, and the in fl uence on the synthetsis of disease-resistant substances catechins. Total RNA was isolated from the infected bark ofPopulus×euramericanacv.‘Zhonglin 46’ 6 days after inoculation withLonsdalea quercinasubsp. populi. A speci fi cLARfragment of about 1000 bp was ampli fi ed by RT-PCR and sequenced, and then successfully constructed into an expression vector with sense-orientation driven by CaMV 35S promoter (pCAMBIA1301-LAR). Subsequently, Pcambia1301-LARwas transformed into tobacco usingAgrobacterium tumefaciensmediated method. Six transgenic lines was fi nally obtained and con fi rmed by PCR. qRT-PCR was further used to detect the expression ofLARin transgenic tobacco, which showed thatLARgene was signi fi cantly upregulated in transgenic lines compared to the wild type. High performance liquid chromatography (HPLC) was further used to detect the content of catechin in transgenic plants and wild type plants respectively. The results showed that the content of catechin in 4 transgenic plants were increased, however there were no catechin detected in 2 transgenic plants. The study shown thatLARofPopulus×euramericanacv.‘Zhonglin 46’is one of genes involved in fl avonoids biosynthesis pathway and is associated with the synthesis of catechin, which provides insights to the molecular mechanism ofLARcontrolling catechin synthesis and the utilization of resistance genes in the improvement of plant disease resistance.
fl avonoids;Leucoanthocyanidin reductasegene; sense expression vector; transformation; catechin
S792.11;S718.46
A
1673-923X(2016)12-0121-08
10.14067/j.cnki.1673-923x.2016.12.021
http: //qks.csuft.edu.cn
2016-03-29
国家林业公益性行业科研专项(201104054);国家自然科学基金(31470668, 31200511, J1103516)
左 涛,硕士研究生
贺 伟,教授,博士研究生;E-mail:hewei@bjfu.edu.cn
左 涛,包 海,陈 慧,等. 杨树LAR基因的克隆及表达对儿茶素合成的影响[J].中南林业科技大学学报,2016, 36(12):121-128.
[本文编校:文凤鸣]
