板栗愈伤组织诱导及外植体褐化研究
2016-12-21刘杜玲吕平会彭少兵何佳林
刘杜玲,吕平会,彭少兵,杨 艳,何佳林
(西北农林科技大学 林学院,陕西 杨凌 712100)
板栗愈伤组织诱导及外植体褐化研究
刘杜玲,吕平会,彭少兵,杨 艳,何佳林
(西北农林科技大学 林学院,陕西 杨凌 712100)
以‘泰山1号’板栗新梢茎段为试材,采用正交试验设计和单因素试验法,研究了不同培养基、消毒时间、外植体、激素、蔗糖含量、抗氧化剂及光照条件对愈伤组织诱导及外植体褐化的影响。结果表明:‘泰山1号’板栗愈伤组织诱导的最佳培养基是WPM培养基;用0.1%HgCl2消毒13~15 min,外植体褐化率明显降低;以茎段(带顶芽)为外植体,蔗糖浓度为30 g·L-1,愈伤组织诱导率最高;愈伤组织诱导最佳激素组合为:6-BA1.0 mg·L-1+NAA0.2 mg·L-1;100 mg·L-1VC和6 g·L-1PVP能有效抑制外植体褐化;先暗培养两周再进行光培养,可显著降低外植体褐化率。
板栗;愈伤组织诱导;外植体褐化;培养基筛选
板 栗Castanea mollissimaBl.是我国三大木本粮食树种之一。其坚果营养价值丰富,富含淀粉、糖、蛋白质、脂肪及多种维生素和矿物质,甘甜可口,并具有保健功效[1]。泰山1 号板栗具有早熟、个大、丰产、优质、较耐贮藏、抗逆性强和适应性强的特点,已在生产上推广应用,取得了良好的经济效益[2]。但传统的繁殖方法繁殖系数低,育苗速度慢,满足不了板栗生产对优质苗木的大量需求,制约了板栗产业的发展。组织培养是经济林树种繁殖的主要方式[3],是苗木规模化、良种化、工厂化的重要途径。然而在板栗组培过程中,愈伤组织诱导和外植体褐变是板栗组织培养成败的关键,这方面的研究国内外报道较多。Xing等[4]以美洲板栗不同基因型的成年树和一年生苗木为试材,在改良后的MS培养基中添加500 mg·L-1PVP,茎尖褐化坏死率低于23%。罗丽华等[5]的研究表明,在WPM培养基中加入VC(抗坏血酸))100 mg·L-1、适当的光照及较低的温度有利于减轻褐变。Yang等[6]的研究表明,在培养基中添加2, 4, 5-T对外植体愈伤组织诱导效果最佳。苏冬梅等[7]和陈建华等[8]的研究表明,培养基为WPM+6-BA 0.5 mg·L-1+NAA0.2 mg·L-1、外植体为胚,其愈伤组织诱导率最高,其次为茎段。本研究以‘泰山1号’板栗新梢茎段为外植体,采用正交试验和单因素试验法,研究了不同培养基、消毒时间、外植体、激素配比、抗氧化剂、蔗糖含量及光照条件对外植体褐化及愈伤组织诱导的影响,旨在筛选对板栗愈伤组织诱导、抑制外植体褐变的最佳处理,为‘泰山1号’板栗无菌培养系建立提供依据,为板栗再生体系的建立与种质创新奠定基础。
1 材料和方法
1.1 试验材料
试验材料为8年生板栗良种‘泰山1号’,于2015年5月4日在宝鸡市陈仓区坪头镇安坪村板栗良种生产基地采取生长健壮、无病虫害的新梢。
1.2 试验设计
采用正交试验设计L9(34)和单因素试验法,研究不同培养基、消毒时间、外植体、激素配比、抗氧化剂、蔗糖含量及光照条件对愈伤组织诱导及外植体褐化的影响。培养基筛选试验采用WPM、MS、DKW培养基,其余试验均采用WPM培养基。培养基均添加蔗糖 30 g·L-1、6-BA1.0 mg·L-1、NAA0.2 mg·L-1、琼脂 8 g·L-1,pH 值为 5.8(除激素配比试验外)。各试验处理均接种40个外植体,重复2次;激素配比试验每处理30个样本,重复3次。培养室温度(20±2) ℃,光照时间12 h /d,光照强度1 800~2 000 lx,接种后先暗培养2周再进行光培养。
1.3 试验方法
1.3.1 材料消毒处理
外植体消毒参照郭素娟等[9]的方法,将已消毒的‘泰山1号’嫩梢基部及上部叶片和顶芽除去,切割成长0.5 cm左右带有腋芽的小段,叶片切割成0.5 cm2的小块,接种于诱导愈伤组织培养基上(试验处理均以带腋芽茎段为外植体,除不同外植体诱导愈伤组织试验外)。
1.3.2 培养基筛选
将已灭菌的外植体分别接种在WPM、MS、DKW培养基上,培养15 d后观察外植体褐化及愈伤组织诱导情况。
1.3.3 外植体消毒时间比较
将新梢用0.1% HgCl2消毒处理10~12 min、13~ 15 min、16~ 18 min、19~21 min,接种4 d后观察统计外植体的褐化率及存活率。
1.3.4 外植体筛选
以带腋芽茎段、带顶芽茎段和叶片为外植体,接种于WPM培养基,15 d后观察外植体褐化及愈伤组织诱导情况。
1.3.5 激素配比试验
采用正交试验设计L9(34),在基本培养基(WPM)中添加不同浓度的NAA(0、0.1、0.2 mg·L-1)和 6-BA(0.5、1.0、1.5 mg·L-1), 以 不添加为对照(CK),接种20 d后观察统计愈伤组织诱导情况。
1.3.6 蔗糖诱导愈伤组织试验
在培养基中添加不同浓度(20、30、40 g·L-1)蔗糖,以不添加为对照(CK),接种20 d后统计愈伤组织诱导率。
1.3.7 抗氧化剂试验
在培养基中添加不同浓度的PVP(聚乙烯毗咯烷酮)(0、2、4、6 g·L-1)和VC(抗坏血酸)(0、100、150、200 mg·L-1),以不添加为对照(CK),接种20 d~25 d后统计外植体褐化率。
1.3.8 光照处理试验
试验设光培养、暗培养14 d后再光培养两个处理。光强为2 000 Lx、光照时数为12 h/d,20 d后观察统计外植体褐化及愈伤组织诱导情况。
1.4 数据统计分析
愈伤组织诱导率(%) = (形成愈伤组织的外植体数/ 接种外植体数) ×100%;外植体褐化率(%)= (外植体褐化数/接种外植体数) × 100%。用Excel 2015进行数据处理,SPSS21.0进行方差分析,Duncan法进行差异显著性检验。
2 结果与分析
2.1 培养基对外植体褐化和愈伤组织诱导的影响
由表1知,将外植体接种于MS、DKW、WPM 3种培养基后,外植体启动时间相近,初次褐化时间也相近;MS培养基外植体褐化率(80%)和DKW培养基外植体褐化率(83%)相近,都略高于WPM培养基的褐化率(71.6%);愈伤组织诱导率最高(10.1%)的是WPM培养基。方差分析结果表明,3种培养基之间外植体褐化时间差异不显著(P>0.05),外植体褐化率及愈伤组织诱导率差异显著(P<0.05)。经Duncan分析知,WPM与MS、DKW之间外植体褐化率、愈伤组织诱导率差异均显著,但MS与DKW之间差异不显著。故‘泰山1号’板栗组织培养的适宜培养基为WPM。
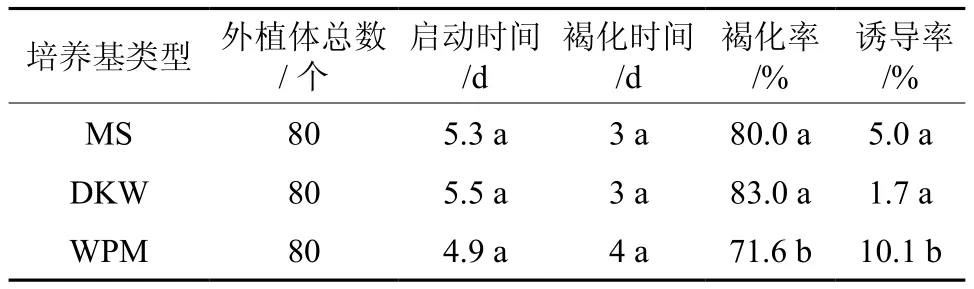
表1 培养基对愈伤组织诱导和外植体褐化的影响†Table 1 Effects of different culture medium on callus induction and explant browning
2.2 消毒时间对外植体褐化率及存活率的影响
由表2可知,随消毒时间延长,外植体褐化率、存活率降低。消毒10~12 min褐化率55.0%;消毒13~15 min褐化率为35.0%,较10~12 min褐化率下降20%;消毒16~18 min、19~21 min褐化率降为30.0%。消毒13~15 min外植体存活率为45.0%;消毒16~18 min外植体存活率为30.0%,较13~15 min下降15%。方差分析表明,消毒13~15 min外植体褐化率与消毒10~12 min差异显著(P<0.05),与消毒16~18 min差异不显著(P>0.05),但存活率差异显著(P<0.05)。故外植体消毒以13~15 min为好,褐化率较低(35.0%)且存活率达45.0%。
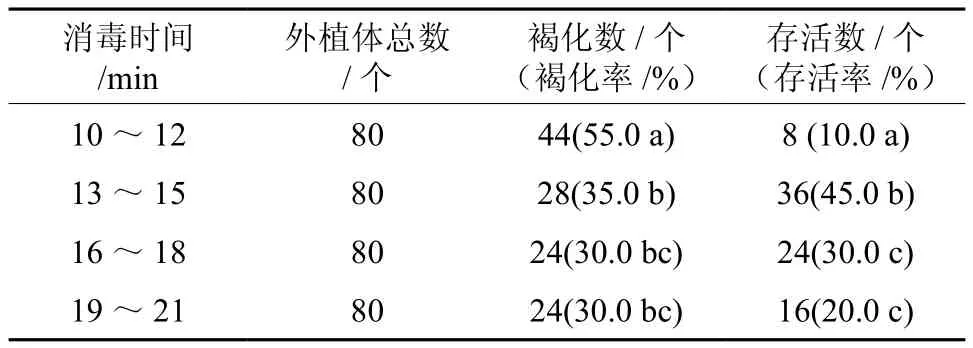
表2 消毒时间对外植体褐化率及存活率的影响Table 2 Effects of different sterilization time on the browning rate and survival rate of explants
2.3 不同外植体对愈伤组织诱导的影响
不同外植体对愈伤组织诱导的结果见表3。由表3知,带顶芽茎段褐变程度较轻(浅褐色),其愈伤组织诱导率最高(43.3%),产生量也大;带腋芽茎段诱导率次之(23.3%);叶片的诱导率最差(0.0%)。方差分析结果显示,不同外植体对愈伤组织诱导率有极显著的影响(P<0.01)。
2.4 激素种类及浓度对愈伤组织诱导的影响
NAA和6-BA对愈伤组织的诱导结果见表4。由各因素(6-BA、NAA、CK)的极差(R)知,6-BA的极差最大(17.2),NAA次之(13.8),对照最小(5.6),故影响板栗愈伤组织诱导的主次因素为:6-BA>NAA>CK,即6-BA对于愈伤组织诱导作用最大。由愈伤组织诱导率的平均值知,NAA的3水平愈伤组织诱导率最高(61.6%),6-BA的2水平愈伤组织诱导率最高(67.2%)。由各因素不同水平对愈伤组织诱导的影响及正交试验方差分析(表5)知,6-BA和NAA各水平间差异显著(P<0.05)。经多重比较知,6-BA的2水平与1、3水平差异显著,愈伤组织诱导率比1水平和3水平约高17%;NAA的1水平和3水平差异不显著,但均与2水平差异显著。经综合分析,板栗愈伤组织诱导最佳激素组合为:NAA 0.2 mg·L-1+6-BA 1.0 mg·L-1。X1、X2、X3分别为各因素水平的平均值;R为极差。

表3 不同外植体对愈伤组织诱导的影响†Table 3 Effects of different explants on callus induction
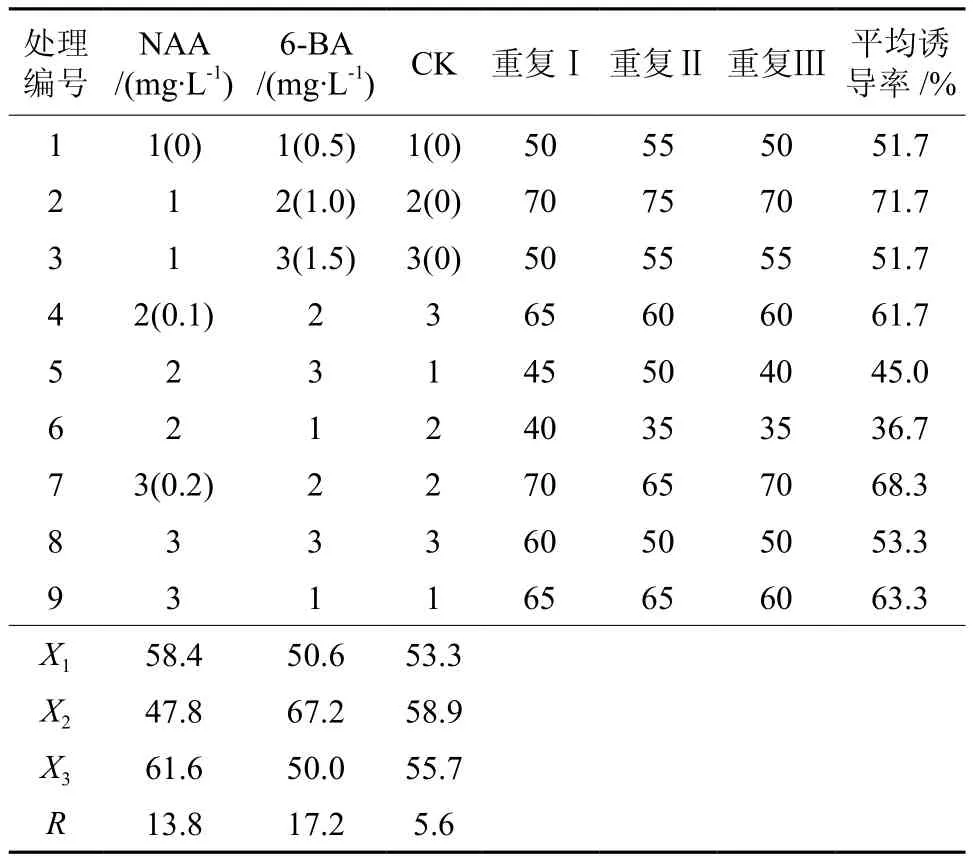
表4 激素种类及浓度对愈伤组织诱导的影响Table 4 Effects of hormone kinds and concentration on callus induction
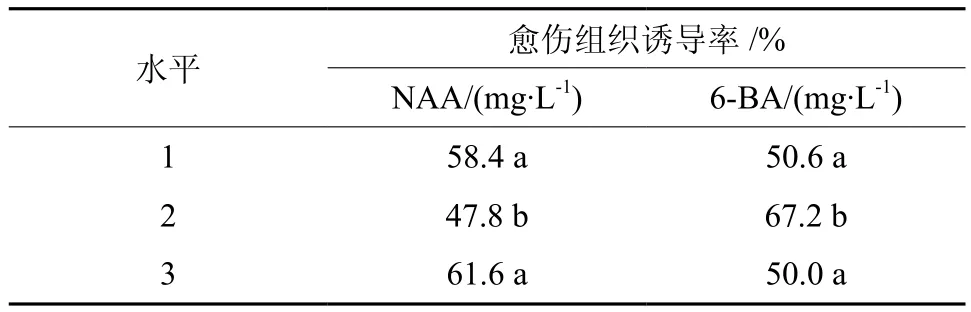
表5 NAA和6-BA不同水平对愈伤组织诱导的影响Table 5 Effects of different levels of NAA and 6-BA on callus induction
2.5 蔗糖含量对愈伤组织诱导的影响
由表6知,添加蔗糖与不添加蔗糖(对照)、不同蔗糖含量愈伤组织诱导率均高于对照,且与对照差异极显著(P<0.01);蔗糖含量为30 g·L-1时愈伤组织诱导率最高(13.3%)。多重比较结果显示,蔗糖含量30 g·L-1与20 g·L-1之间愈伤组织诱导率差异极显著,30 g·L-1与 40 g·L-1之间差异不显著。故在培养基中添加30 g·L-1蔗糖对茎段愈伤组织的诱导效果最佳。

表6 蔗糖含量对愈伤组织诱导的影响Table 6 Effects of sucrose content on callus induction
2.6 抗氧化剂对外植体褐化率的影响
在培养基中添加不同浓度的抗坏血酸(VC)及聚乙烯吡喏烷酮(PVP)后,外植体褐变率均低于对照,且与对照差异显著(表7)。当加入VC 100 mg·L-1后,外植体褐化率最低(53.8%)。方差分析结果表明,不同浓度VC对外植体褐化的影响差异极显著(P<0.01)。进行多重比较知,添加VC后外植体褐化率(53.8%~65.2%)显著低于对照(80.0%);添加 100 mg·L-1VC 与添加 50 mg·L-1、150 mg·L-1VC之间外植体褐化率差异极显著,但50 mg·L-1与 150 mg·L-1之间差异不显著。可见,VC为100 mg·L-1时抑制外植体褐化效果明显。
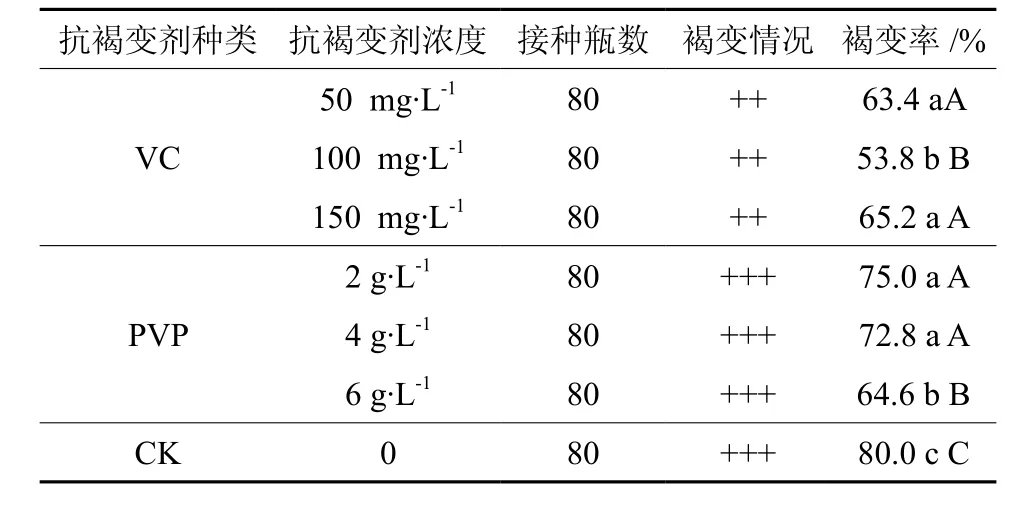
表7 抗氧化剂对外植体褐化的影响Table 7 Effects of antioxidants on the browning of explants
由表7还可知,在培养基中加入PVP 6 g·L-1后,外植体褐化率最低(64.6%)。进行多重比较可知,6 g·L-1与 2 g·L-1、4 g·L-1之间外植体褐变率差异极显著,2 g·L-1与4 g·L-1之间外植体褐变率差异不显著。故在培养基中添加PVP 6 g·L-1对外植体褐化有明显的抑制作用。
2.7 光照条件对外植体褐化及愈伤组织诱导的影响
不同光照处理对外植体褐化和愈伤组织诱导的影响见表8。由表8知,对接种后的培养基进行“暗培养+全光照”处理后,外植体褐化率(51.67%)低于全光照处理(63.67%),且愈伤组织诱导率(17.54%)高于全光照处理(11.32%)。方差分析结果显示,光照条件对外植体褐化率的影响差异极显著(P<0.01),对愈伤组织诱导率的影响差异不显著(P>0.05)。因此在板栗组培时,先暗培养14 d再进行光培养可以降低外植体的褐变率,且愈伤组织诱导率较高。
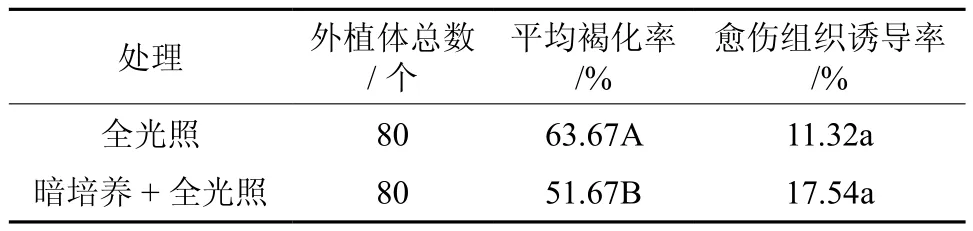
表8 光照条件对外植体褐化及愈伤组织诱导的影响Table 8 Effects of light conditions on the browning of explants and callus induction
3 结论与讨论
基本培养基提供了植物生长发育所需的营养元素,由于各种植物组织培养对营养的需求不同,因此对基本培养基的优化和筛选显得尤为重要[10-11]。本研究将外植体接种于MS、DKW、WPM 3种培养基上,研究不同培养基对外植体褐化和愈伤组织诱导的影响。结果表明,WPM培养基的褐化率最低,愈伤组织诱导率最高。这与苏冬梅等[7]、陈建华等[8]、徐晨等[12]在板栗组培上的研究结果一致,但与孙小兵[1]的研究结果不一致。
外植体消毒获得无菌材料是决定植物组织培养能否成功的关键。本研究表明,外植体用0.1%HgCl2消毒13~15 min,褐化率较低而存活率最高,这与袁云香[13]在枇杷叶荚蒾上的研究结果基本一致。但与冯金玲等[14]、周新华等[15]和陈容等[16]的研究结果不尽一致,这可能是由于消毒剂浓度、试验材料或消毒方式不同所致。
一般认为外植体来源不同,其愈伤组织诱导率存在一定差异。本研究将‘泰山1号’带腋芽茎段、带顶芽茎段、叶片接种于培养基后,发现带顶芽茎段褐变程度较轻,其愈伤组织诱导率最高,产生量也大。这主要是由于顶芽茎段幼嫩,木质化程度低,其细胞再生能力强,故褐化率低。这一结果与苏冬梅等[7]在板栗、胡爱双等[3]在平欧杂种榛、刘建军等[17]在银杏上的研究结果一致。
在愈伤组织诱导的诸因素中,激素种类及其浓度配比是影响板栗愈伤组织诱导和生长的主要因素。本研究表明,板栗愈伤组织诱导的最佳激素组合为:NAA 0.2 mg·L-1+6-BA 1.0 mg·L-1。这与苏冬梅等[7]在板栗、郭彦彤等[18]在柚木上的研究结果基本一致。
在植物组织培养中,糖的用量影响培养物的生长速度和生长量,是影响植物组织培养成功与否的关键因素之一。本研究表明,在WPM+6-BA1.0 mg·L-1NAA0.2 mg·L-1中添加 30 g·L-1的蔗糖对茎段愈伤组织的诱导效果最佳,该结果与白芝兰等[19]在野生毛桃、孙源蔚等[20]在中国李上的研究结果一致。
防止外植体褐变死亡是板栗组织培养能否成功的关键。有研究表明,在培养基中加入吸附剂与抗氧化剂可以减轻褐变[21]。本研究表明,分别在 培养 基 WPM+6-BA1.0 mg·L-1NAA0.2 mg·L-1中添加不同浓度的抗坏血酸(VC)及聚乙烯吡喏烷酮(PVP)吸附剂后,外植体褐变率显著降低,这与罗丽华[7]的研究结果一致,但与张建瑛等[22]在核桃楸上的研究结果不一致,这可能是因植物种类、培养基种类不同所致。
光照时间不同对愈伤组织的诱导及外植体褐变的影响存在差异,暗培养有利于减轻褐变及愈伤组织的形成,而全光照下褐变程度加重[23]。本研究表明,对接种后的培养基先暗培养两周再进行光培养,可以显著降低外植体的褐化率,且愈伤组织诱导率较高。说明全光照既加重了外植体的褐化程度,又不利于愈伤组织的形成。该结果与张建瑛等[22]在核桃楸、罗丽华等[23]在板栗上的研究结果一致。
本研究仅对板栗愈伤组织诱导及外植体褐化进行了初步研究,在试验设计时均采用单因素(除激素种类及浓度对愈伤组织诱导的影响外)试验,且涉及的因素及水平较少。在今后的研究中应增加试验因素及各因素的水平,优化试验设计,进一步综合深入研究诱导板栗愈伤组织及遏制外植体褐化的最佳培养基及培养条件,为板栗无菌培养系的建立提供依据。
[1]孙小兵,郭素娟.成龄板栗组培快繁体系的建立及影响因素的研究[J].中南林业科技大学学报,2015,35(4):51-55.
[2]赵永孝,明桂冬,公庆党. 泰山1号早熟大板栗新品种芽变选种研究报告[J]. 落叶果树,2000 (1):10-12.
[3]胡爱双,赵玉辉,刘镇东,等.优良榛资源快繁体系的建立与优化[J]. 沈阳农业大学学报, 2015,46(4): 476-480.
[4]Xing Z Z, Satchwell M F, Powellw A,et al. Micropropagation of American chestnut: Increasing rooting rate andpreventing shoo-t tip necrosis [J]. In vitro Cellular & Development Biology, 1997,33(1): 43-48.
[5]罗丽华, 陈建华, 苏冬梅. 板栗组培过程中褐变研究初探[J].经济林研究,2003, 21 (4) : 30-31.
[6]YANG G C, LU Z G. In VitroCallus Induction and Shoot Initiation of American Chestnut (Castanea dentata)[J]. Journal of Jilin Agricultural University,2008,30(4):466-471.
[7]苏冬梅, 罗丽华, 杨定海, 等. 板栗愈伤组织的诱[J].经济林研究,2004,22 (3):17-19.
[8]陈建华, 罗丽华, 苏冬梅, 等. 不同板栗品种的组培技术[J].中南林业科技大学报,2007,12(6):83-87.
[9]郭素娟,任 鹏,王桂云. 燕山红栗下胚轴再生体系的建立[J].西南林学院学报,2005,25(4):102-105.
[10]郭彦彤, 梁坤南, 黄桂华, 等. 柚木愈伤组织诱导培养的研究[J]. 中南林业科技大学学报,2012,32(3):53-58.
[11]金亚征, 俞凤芳, 车瑞香, 等. 药用百合组织培养快繁技术研究[J]. 经济林研究,2013, 31(1):124-128.
[12]徐 晨, 陈双双, 王金金, 等. 板栗高效组培体系的建立和优化[J]. 北京农学院学报, 2013,28(3):6-9.
[13]袁云香. 枇杷叶荚蒾的愈伤组织诱导及植株再生[J]. 植物生理学,2012, 48 (12): 1205-1209.
[14]冯金玲,陈 辉,杨志坚.锥栗组织培养外植体消毒和选择[J].福建林学院学报,2006,26(1): 22- 25.
[15]周新华,曾满生,肖智勇,等. 多花黄精嫩茎与根茎芽离体培养技术[J]. 经济林研究,2014, 32(4): 68-72.
[16]陈 容,张党权,郑玉娟,等.红檵木腋芽高效快繁研究[J].经济林研究,2015,33(4): 96-101.
[17]刘建军,龚一富,王世安,等.银杏愈伤组织诱导的多因子正交试验研究[J]. 广西植物,2014,34(1) : 116 -119.
[18]郭彦彤, 梁坤南, 黄桂华, 等. 柚木愈伤组织诱导培养的研究[J]. 中南林业科技大学学报,2012,32(3):53-58.
[19]白芝兰,李果果,吴晓冉,等. 野生毛桃叶片愈伤组织诱导及不定芽再生[J]. 果树学报,2012,29(5): 814-819.
[20]孙源蔚,李果果,姚延兴,等. 中国李Nubiana 胚性愈伤组织诱导及植株再生[J]. 果树学报,2011,28(1): 42-45.
[21]孙 婧. 山核桃外植体诱导培养及褐化机理的初步研究[D].合肥:安徽农业大学,2013.
[22]张建瑛,祁永会,吕跃东,等. 核桃楸腋芽再生体系研究[J].植物研究,2015,35(1) : 22- 26.
[23]罗丽华. 板栗组织培养及褐变研究[D]. 长沙:中南林学院,2004.
Research on callus induction and explant browning of chestnut(Castanea mollissima Bl.)
LIU Du-ling, LV Ping-hui, PENG Shao-bing, YANG Yan, HE Jia-lin
(College of Forestry, Northwest A & F University, Yangling 712100, Shaanxi, China)
The ‘Taishan 1’ stem segment were used as test materials to study the effects of different medium, sterilization time, explants,hormone, sucrose content, antioxidant and light conditions on callus induction and browning of explants by orthogonal test design and single factor test method. The results show that the best medium for callus induction of ‘Taishan 1’ was WPM medium; the browning rate of explants was signi fi cantly decreased by 0.1% HgCl2solution for 13~15 min; the rate of callus induction was highest when stem segment(with bud) was used as explant and sucrose concentration was 30 g·L-1; the best hormone combination for callus induction screened out by orthogonal test was 6-BA1.0 mg·L-1+NAA0.2 mg·L-1; 100 mg·L-1VC and 6 g·L-1PVP effectively inhibited the browning of explants; the browning rate of explants was signi fi cantly decreased by two weeks in dark condition then turned to light condition.
chestnut; callus inducement; explant browning; culture medium selection
S722.3+7
A
1673-923X(2016)12-0026-05
10.14067/j.cnki.1673-923x.2016.12.005
http: //qks.csuft.edu.cn
2015-12-18
国家“十二五”科技支撑计划项目(2013BAD14B0404)
刘杜玲,副教授,硕士生导师
何佳林,副研究员; E-mail:hejialinhjl@126.com
刘杜玲,吕平会,彭少兵,等. 板栗愈伤组织诱导及外植体褐化研究 [J].中南林业科技大学学报,2016, 36(12): 26-30.
[本文编校:文凤鸣]
