LEAFY同源基因系统进化及研究进展
2016-12-21冯延芝李芳东魏琦琦傅建敏
冯延芝 ,李芳东 ,王 璐 ,魏琦琦 ,何 潇 ,赵 广 ,张 悦 ,傅建敏
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2.中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004)
LEAFY同源基因系统进化及研究进展
冯延芝1,2,李芳东1,王 璐1,魏琦琦2,何 潇2,赵 广2,张 悦1,傅建敏1
(1.中国林业科学研究院 经济林研究开发中心,河南 郑州 450003;2.中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004)
LEAFY(简称LFY)同源基因是一个调控植物花分生组织和花器官形成的特征基因,它是启动开花的枢纽,而且还可防止花分生组织的逆转。本文分别利用软件Vector NTI software(Invitrogen)和MEGA5.1对36种植物LFY基因编码的氨基酸序列特征、系统进化等进行分析,结果表明,其蛋白质平均含有397个氨基酸,分子量为44.35 kDa,等电点为7.32;多序列比对显示它们有37个完全保守的氨基酸残基,另外还存在丙氨酸、赖氨酸、组氨酸等氨基酸富集区;系统进化显示裸子植物与单子叶植物聚为一类,后与双子叶植物聚在同一进化树中。上述研究不仅对植物成花机理的研究具有重要的参考价值,而且为植物花发育以及早花早果奠定了理论基础。
LFY同源基因;系统进化;表达;功能
花是植物重要的生殖器官,在植物生长发育过程中发挥关键作用。植物在营养生长向生殖生长转变的过程中需要很多基因的调控和一系列的信号转导,其中LFY基因就起着至关重要的作用。LFY基因能够启动植物的开花过程,并且控制植物花的生长发育[1-4]。LFY基因最早是在金鱼草Antirrhinum majusL.中克隆获得的[5],进一步研究发现LFY基因的突变影响花形态的正常发育导致其突变,但花序生长正常。Weigel[6]将拟南芥Arabidopsis thalianaL.LFY基因敲除后获得突变体植株的表型与金鱼草A. majus相似。LFY基因的过量表达使拟南芥A. thaliana的花期提前,并且侧枝均被单一花器官所替代[7]。野生型山杨Populus davidiana Dode.的正常花期是8~12年,但是LFY基因过量表达的山杨P. davidiana突变体植株的花期只需要5个月[8]。进而研究发现转基因枳橙Poncirus trifoliataCitrange.的童期可提早到12~20个月,而野生型枳橙P. trifoliata的童期一般为5年[9]。
近来LFY基因的研究又扩大到木本植物,相继从白杨Populus. nigraL.[10]、辐射松Pinus radiateD.DON[11]、杧果Mangifera indicaL.[12]、葡萄Vitis viniferaL.[13]中克隆获得LFY基因,这些LFY同源基因具有非常保守的核苷酸和氨基酸序列[14],但是它们的表达特性相差甚大[15-18]。例如金鱼草A. majusLFY的同源基因(FLO)仅表达于植物的花期,而葡萄V. vinifera中的LFY基因不仅在开花阶段表达,而且还表达于植物的叶原基中。这种表达特性的差异与其启动子结构功能密切相关,迄今为止,LFY基因的启动子已在葡萄V. vinifera[19]、龙眼Dimocarpus longanLour.[20]、毛白杨Populus tomentosaCarr.[21]等植物中成功获得,序列比对表明其在保守的基础上存在一定的差异,因而决定LFY基因不同的表达特征以及功能差异。
目前对LFY基因的生物学特性研究比较多,但是都是一些零散的信息,并没有对其进行专门的系统性整理。为此,本研究收集整理了相关数据库中已登录的植物LFY同源基因的核苷酸和氨基酸序列,并对其进行同源比对、系统进化等分析,为更深入研究该基因的结构功能等提供一定的参考价值。
1 LFY同源基因的获得
LFY同源基因是指编码蛋白不具有MADS结构域但可作为转录因子参与花分化等有关过程的一类基因。研究者首先在金鱼草A. majus、拟南芥A. thaliana等模式植物中发现LFY基因,继而在木本植物中展开了对LFY同源基因的进一步研究。目前已在多种植物中克隆得到LFY同源基因,例如苹果(Malus pumilaMill.[17]、桉树Eucalyptus globulus[22]和银杏Ginkgo bilobaL.[23]等,该基因在进化上具有一定的保守性,但也存在差异。LFY同源基因是通过拟南芥A.thalianaLFY序列(登录号:NM_125579.1)和与NCBI对立的非冗余核苷酸和氨基酸序列数据库检索到的。总共33个全长和7个将近全长的LFY基因序列来自于36种植物。在分析中使用的LFY的名称和它们对应的物种、LFY的同源基因名称、GenBank登录号均在表1中列出。每个序列的名称由植物拉丁名的首字母,后面紧接着是在数据库中LFY基因名称,最后是GenBank登录号。
2 LFY同源基因的基本结构特征及系统进化
2.1 LFY同源基因的基本结构特征
2.1.1 LFY同源基因的结构特征
33个全长的LFY基因核苷酸序列的平均长度是1 217 bp,标准偏差是40 bp,多序列比对显示其核苷酸同源性较高,不同物种间的同源性最高可达87%,最低为42%。在LFY基因的非编码结构区域中,最长的基因组是7 308 bp的拟南芥,最短的仅有1 500 bp的桉树。在对其基因组序列的比较中发现大部分序列均含有2个内含子,位置也大致相同,只是内含子的长度差异较大,第一个内含子中最长的是1 378 bp的银杏,最短的是62 bp的桉树;而第二个内含子中最长的是1 937 bp的金鱼草,最短的是88 bp的台湾苣苔。LFY同源基因内含子的这种特征不仅为研究基因组中内含子的作用机理提供了重要的参考依据,而且对于植物系统进化的分析非常有价值。
表1所示LFY同源基因在二倍体植物中大部分以单拷贝形式存在,LFY基因在二倍体烟草中以单拷贝形式存在,但是在四倍体烟草中却存在两个同源基因,其同源性达96%。但是在对芜菁Brassica rapaLinn.、萝卜Raphanus sativusLinn.、苹果Malus x domestica等双子叶植物以及草胡椒类植物中LFY基因拷贝数的研究发现,二倍体植物中LFY同源基因并不总是以单拷贝的形式存在,推测可能在植物的整个进化过程中LFY同源基因的拷贝数有整体减少的趋势。
2.1.2 LFY同源基因编码的氨基酸特征和组成
表1可看出不同植物中LFY基因编码的氨基酸序列差异不大,33个全长LFY同源基因编码的蛋白质平均拥有397个氨基酸残基,标准偏差为31个氨基酸残基,其分子质量约为44.35 kDa,等电点为7.32±1.22。该蛋白包含13.45%的酸性氨基酸残基和14.07%的碱性氨基酸残基,此外该内在膜蛋白还拥有63.10%的疏水性氨基酸残基(表2)。同时多序列比对分析发现不同物种间其氨基酸序列的同源性较高,最高为91%,最低为44%,这表明该基因在植物进化过程中比较保守。
2.2 LFY同源基因及系统进化
利用33个LFY基因的蛋白质序列构建系统发育树(图1)。首先利用MEGA 5.1软件的Align将蛋白质序列进行同源比对,参数为软件默认值。再使用MEGA 5.1软件Phylogeny的neighborjoining tree构建和分析系统发育树,每一节点的数字表示bootstrap值所占1000个重复的百分比(图1)。参数均使用软件默认参数。该系统发育树显示裸子植物和被子植物均处在同一进化树中,但是裸子植物银杏G. biloba、辐射松P. radiate先与单子叶植物水稻Oryza sativaL.、百合LiliumL.聚为一类,后与双子叶植物汇聚。另外分析发现被子植物虽然全都处于同一系统发育树中,但是单子叶植物和双子叶植物的分界限并不十分明显。

表1 LFY基因的序列信息†Table 1 LFY sequence information
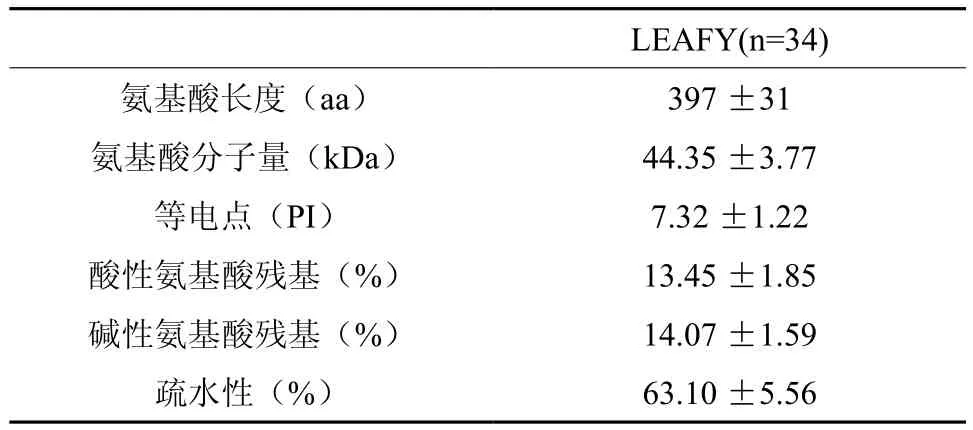
表2 LFY基因氨基酸组成Table 2 LFY gene amino acid composition
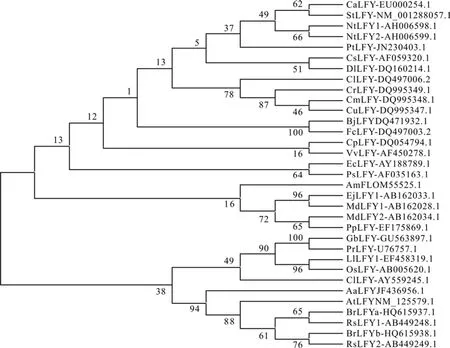
图1 LFY基因氨基酸序列的系统发育分析Fig. 1 Phylogenetic analysis of LFY gene amino acid sequences
3 LFY基因的功能研究
LFY是植物主要花分生组织特征基因之一,其功能主要表现在花分生组织决定方面,在植物由营养生长向生殖生长转变过程中发挥重要作用。其作用特点是在不同植物之间LFY基因的结构等具有保守性,但在同一植物不同组织器官或不同植物中其表达模式又有一定的差异。
3.1 保守性
LFY基因的保守性在结构上表现为不同植物LFY基因的核苷酸序列和氨基酸序列表现出一定程度的保守性,在功能上表现为所研究的LFY基因均与花的分化过程有关,主要参与花分生组织的形成,而且LFY基因的过量表达能够促进植物提早开花,这种功能上的保守性正是其结构保守性的体现。
3.1.1 LFY基因结构上的保守性
官磊[24]从龙眼花芽中分离和测定了LFY基因的全长cDNA序列,扩增得到1 167 bp的片段,共编码388个氨基酸,将其与柑橘CitrusreticulateBanco.、柚子Citrus maximaBurm.、芒果Mangifera indicaLinn.和苹果Malus x domestica等植物的LFY基因的氨基酸序列进行比对,发现其同源性分别为:78.9%、78.1%、78.7%和72.8%,这说明LFY同源基因在不同植物中具有较高的同源性。
另外针对33个LFY基因的核苷酸序列进行多重序列比对,该比对是利用Vector NTI 软件的AlignX程序的ClustalW算法进行分析的(多序列比对图未列出)。通过该比对分析发现,不管是单子叶、双子叶等被子植物还是裸子植物其核苷酸序列均存在一定程度的保守性,这些研究结果表明LFY同源基因在整个系统进化过程中具有较高的保守性。
3.1.2 LFY基因功能上的保守性
LFY基因功能主要是在花的早期发育和分化过程中发挥关键作用。1995年Nilsson和weigel[8]研究发现:LFY基因的过量表达能够使拟南芥所有的侧枝均转化成单一的花,而且使拟南芥的花期大大提前。另有研究表明转入LFY同源基因LFY/FLO和AP1/SQUA的转基因植株的花期均大大提前,而且侧生的花芽均被单独的花所替代,但在野生型植株中发育不确定的顶芽则终止于顶生花[25-26]。这些表型以及相关分子生物学基础研究证明LFY同源基因是上游花诱导途径的靶基因[27],同时LFY和AP1作为下游同源异型基因的诱导启动因子对这些基因起表达诱导作用[28]。通过比对金鱼草A. majus、水稻O. sativa[29]以及桉树E.globulus[30]LFY的氨基酸序列发现,它们同源性均接近70%,尤其是C端的保守性最高。
利用33个LFY的氨基酸序列进行多重序列比对(图2),所用软件是Vector NTI 软件的AlignX程序的ClustalW算法。方法是根据氨基酸残基的一致性和序列的相似性程度给分的算法来确定的。在比对中完全相同的氨基酸残基比那些比相同或者相似性较低的残基会有更多的得分。通过比对分析发现,所用的33个序列存在37个完全保守的氨基酸残基,分别是络氨酸、精氨酸以及苏氨酸等,另外还存在其它的保守氨基酸富集区(表3),其主要类型为丙氨酸富集区RYGIKAAVRA、赖氨酸富集区VARGKKN、组氨酸和酪氨酸富集区KMRHYVHCYA和NVGAWR等,由此可见LFY基因在不同植物功能上具有一定的保守性。

图2 LFY基因的保守氨基酸残基比对分析Fig. 2 Conservation of amino acid residue in all LFY genes
3.2 差异性
LFY基因表达的差异性主要表现在时空性上,也即它在不同植物或者同一植物不同组织器官中的表达特性以及表达产物不同,这种差异主要是通过基因的可变剪辑来实现的。例如LFY同源基因(AFL2)不仅强表达于苹果M. pumila的花分生组织,且在其根和叶片中也有较高的表达量[17];柑橘C. reticulataLFY同源基因在营养芽中的表达强度显著低于其花芽[31];LFY同源基因在龙眼D.longan嫁接苗幼树期的叶芽中不表达,但其微弱表达于成年树的叶芽中[24];DFL基因(LFY的同源基因)在甘菊Dendranthema lavandulifoliumLing.[32]的幼叶和幼茎中微弱表达,但在花芽中的表达量较高;芥菜Brassica junceaCzernajew.[33]的LFY基因在根中不表达,而在幼茎和花芽中的表达模式与甘菊D. lavandulifolium相似;LFY同源基因在核桃Juglans regiaLinn.[34]的花芽中表达量最高,幼茎次之,叶片中最低等。
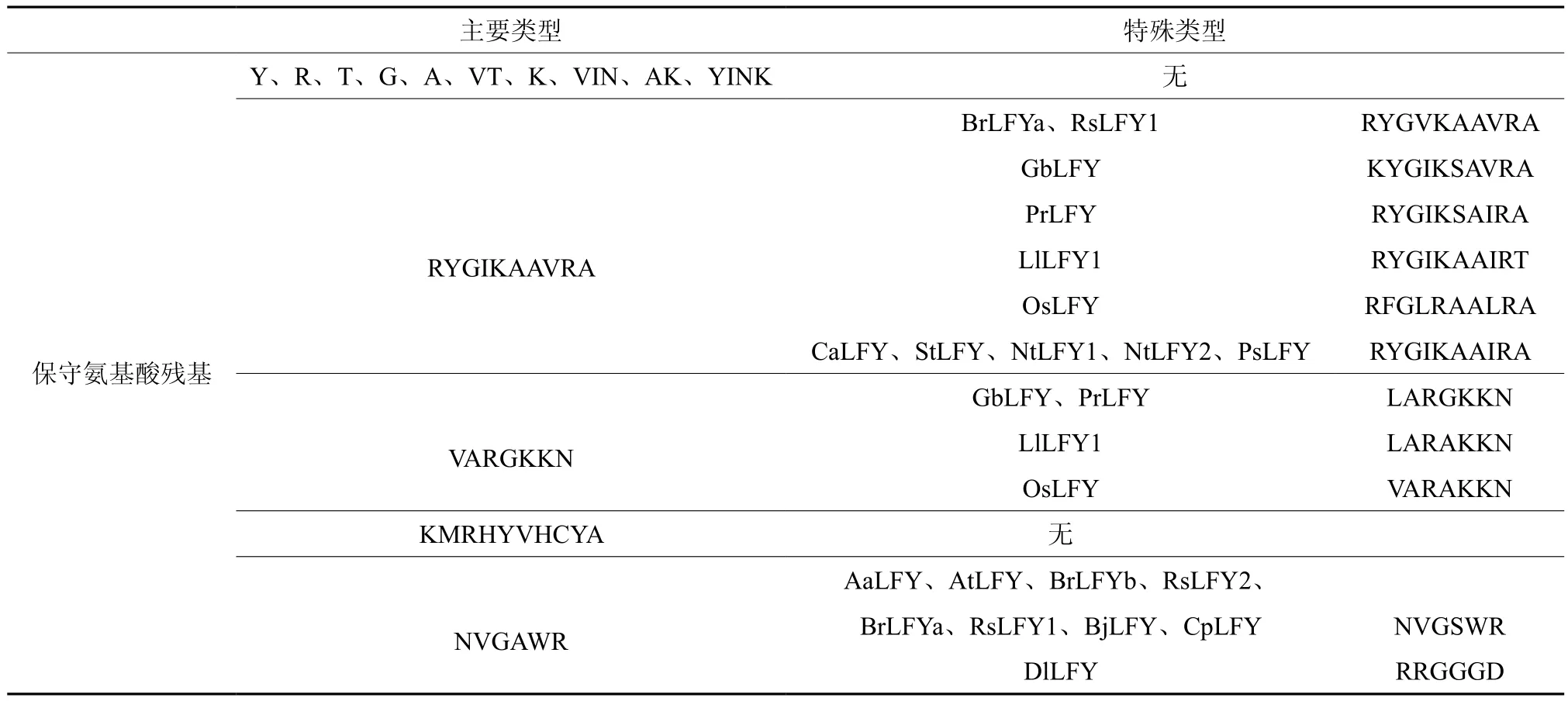
表3 LFY基因氨基酸序列保守区分析Table 3 Conservative area analysis of LFY gene amino acid sequence
3.3 其它功能研究
LFY同源基因普遍被认为与花分生组织分化有关,但也有很多研究表明,LFY基因不仅参与花分化,还存在其它一些功能。例如拟南芥A.thalianaLFY基因不仅与花器官的形成有关,而且负调控抑制成花基因TFL1,编码AP1、AP2(花分生组织特征基因)的转录因子,并可激活PI、AG和AP3基因的表达[35]。因此,LFY同源基因不仅可调控植物花转变和童期长短,而且在花序生长和花发育整个过程都起关键的作用。另外Edwige等[36]在2009年研究发现该基因可以改变豌豆叶子的形状,类似的现象也出现在苜蓿属和莲属等其他豆科植物中[37-38]。
4 LFY同源基因的表达调控
植物的花发育是受多基因调控的复杂生理过程,基因之间通过直接或间接的方式来共同调控其花发育,下面以拟南芥A. thaliana为例简单阐述LFY与其上下游基因之间相互作用机理。FT(FLOWERING LOCUS T)与FD(FLOWERING LOCUS D)上游基因结合后促进LFY和AP1基因的表达[39-40],同时非转录因子TFL1(TERMINAL FLOWER1)的低水平表达可间接抑制LFY和AP1基因表达,使其晚花[41];Jack[42]等人进一步研究发现LFY、API基因对TFL1基因的表达也有抑制作用,即三者之间是相互抑制的关系;又有研究表明,主要靶基因是FT的CO(CONSTANS)基因的mRNA积累到一定域值时对LFY基因的表达有着极其显著的促进作用,即CO通过植物叶片处的FT基因间接作用于LFY基因,促进植物开花[43-44]。
AP1基因的mRNA在LFY基因表达后才逐渐的开始积累,功能上存在部分冗余的这两个间具有加性效应,可相互促进表达[45];另外在花分生组织形成后LFY基因可持续促进PI(PISTILLATA)、AG(AGAMOUS)和AP3 (APETALA3)等 花 器官特性决定基因的表达[6];且LFY基因对于SEP2(SEPALLATA2)、SEP3(SEPALLATA3)等 E-功能基因也有促进作用[46],并与AP2、UFO和CAL等其它花分生组织特征基因之间存在相互正调控的关系[47-50]。
5 问题与展望
开花是植物个体生长发育的中心环节,如何缩短童期、提早开花对于林木遗传育种和栽培的意义非常重大,因此近年来对于开花关键基因LFY研究较多,目前已在多种植物中克隆得到LFY同源基因,但由于其基因组结构的复杂性以及技术手段的限制,单个基因LFY的作用机理仍不十分清楚, 因此还需要进一步的突变体实验来验证其功能;而且LFY同源基因的表达调控主要受其上下游基因之间网络的调控,但是与其外界环境条件例如日照时间、激素以及蔗糖等的波动情况也紧密相关,因此我们在研究植物成花过程中LFY基因的表达调控规律时要从分子生物学和植物生理学两个方面相结合的方法去找寻线索,同时在实验设计上不仅要注重在相同条件下单一因子的作用,更要探究若干重要因子之间相互的综合作用和关系。分子生物学对于基因结构和功能研究的最终目的就是为了更好的应用,但是目前LFY基因在应用过程中出现了很多困难,例如转基因杨树P.tremula的花药不能正常开裂[8];转基因柑橘C.reticulata的茎和叶片顶端均出现不同程度的卷曲,并且叶面积变小[9];转基因水稻O. sativa的有些花不能正常发育,而且产量也有所下降[51],目前还无法解释出现这些异常现象的原因,仍有待于进一步的深入研究。
[1]田淑兰, 陈 敏, 白书农.LFY/FLO基因与高等植物成花诱导分子机理的研究进展[J]. 生物学通报, 1999, 34(9): 5-7.
[2]NG M, YANOFSKY M F. Three ways to learn the ABCs[J].Current Opinion in Plant Biology, 2000, (3): 47- 52.
[3]许家辉, 朱 娜, 温 超. 龙眼LEAFY同源基因启动子的克隆与序列分析[J]. 果树学报, 2011, 28(4): 689-693.
[4]冯延芝. 枣和菲油果LFY基因的基因组DNA序列克隆及表达模式比较研究[D]. 长沙: 中南林业科技大学, 2013.
[5]Coen E S, Romero J M, Doyle S,et al.Florieaula: A Homeotic gene required for flower development in antirrhnum majus[J].Cell, 1990, 63: 1311-1322.
[6]Weigel D, Meyerowitz E M. Aetivation of fl oral homeotic genes in Arabidopsis [J]. Science, 1993, 261: 1723-1726.
[7]Blazquez MA, Soowal LN, Lee I, Weigel D.LFYexpression and fl ower initiation in Arabidopsis[J]. Development, 1997, 124:3835-3844.
[8]Weigel D, Nillson O. A developmental switch sufficient for fl ower initiation in diverse plants [J]. Nature, 1995, 377: 495-500[9]Pe aL, Martn-Trillo M, Ju·rez J,et al. Constitutive expression of ArabidopsisLEAFYorAPETALA1 gene in citrus reduces their generation time [J]. Nature Biotechnolgy, 2001, 19: 263-267
[10]Rottman W H, Meilan R, Sheppard LA,et al.Divers Effects of over expression ofLFYandPTLF, a popla (Populus) homolog ofLEAFY/FLORICAULA, in transgenic poplar and Arabidopsis[J]. Plant, 2000, 22: 235-245
[11]Mellerowiez E J, Horgan K, Walden A,et al. PRFLLa Pinus radiate homologue ofFLORICA-ULAandLFYis expressed in buds containing vegetative shoots and undifferentiated male cone primodia[J]. Plant, 1998, 206(4): 619-629
[12]胡柱兵, 林顺权, 叶白行. 芒果LEAFY同源基因的分离及序列分析[J]. 亚热带植物科学, 2004, 33(2): 1-4.
[13]Carmona M J, Cubas P, Martine-Zapater J M. VFL, the grapevineFLORICAULAP LEAFYortholog, is expressed in meristematic regions independently of their fate [J]. Plant Physiology, 2002,130(9): 68-77
[14]Frohlich M W, Parker D S. The mostly male theory of flower evolutionary origins: from genes to fossils [J]. Australian Systematic Botany, 2000, 25: 155-170
[15]Kelly A J, Bonnlander M B, Meeks-Wagner D R.NFL, the tobacco homolog ofFLORICAULAandLEAFY, is transcriptionally expressed in both vegetative and fl oral meristems[J]. Plant Cell,1995, 7: 225-234
[16]Kyozuka J, Konishi S, Nemoto K,et al. Down-regulation ofRFL, theFLO/LFYhomolog of rice, accompanied with panicle branch initiation [J]. Proceedings of the National Academy of Sciences, 1998, 95: 1979-1982
[17]Wada M, Cao Q F, Kotoda N,et al.Apple has two orthologues ofFLORICAULA/LEAFYinvolved in fl owering [J]. Plant Molecular Biology, 2002, 49: 567-577
[18]Mouradov A, Glassick T, Hamdorf B,et al.NEEDLY, a Pinus radiate ortholog ofFLORICAULA/LEAFYgenes, expressed in both reproductive and vegetative meristems[J]. Proceedings of the National Academy of Sciences USA, 1998, 95: 6537-6542
[19]宗成文, 章 镇, 房经贵, 等. 葡萄LEAFY基因启动子的克隆与序列分析[J]. 南京农业大学学报, 2007, 30(4): 20-25.
[20]朱 娜. 龙眼LFY同源基因表达及启动子克隆[D]. 福州: 福建农林大学, 2010.
[21]李 昊, 陈 仲, 李 英, 等. 毛白杨PtLFY基因启动子的克隆及其瞬时表达分析[J].中国生物工程杂志,2012,32(4):41-46.
[22]SOU THERTON S G, STRAUSS S H, OLIVE M R,et al.Eucalyptus has a functional equivalent of the Arabidopsis fl oral meristem identity geneLFY[J]. Plant Molecular Biology, 1998,37: 897- 910.
[23]ZHANG J Y, CHEN L G, HU X Q,et al.LEAFYhomologous gene cloned in maidenhair tree (Ginkgo bilobaL.) [J]. Scientia Silvae Sinicae, 2002, 38(4): 167-170.
[24]官 磊. 龙眼LEAFY基因克隆与功能研究[D]. 福州: 福建农林大学, 2008.
[25]Mandel M A, Yano fsky M F. A gene triggering fl ower formation in Arabidopsis [J]. Nature.1995,(377):522-524.
[26]Weigel D. The genetics of fl ower development: from induction to ovule morphogenesis [J].Annu Rev. Genet, 1995,(29):19-39.
[27]Blazquez M A, Lazquez M A, Weigel D. IndePendent regulation of flowering by Phytochrome B and gibberellins in Arabidopsis[J]. Plant Physiology, 1999, (120):1025-1032.
[28]Busch M A, Bomblies K, Weigel D. Activation of a floral homeotic gene in Arabidopsis [J]. Sciense, 1999, 285:585-587.
[29]Kyzuka J, Harcourt R, Peacock WJ,et al. Eucalyptus has functional equivalents of the ArabidopsisAPIgene [J]. Plant Molecular Biology, 1997,35: 573-584.
[30]Southerton S G, Marshall H, Mouradow A,et al. Eucalypt MADS-box genes expressed in development [J], Plant Physiologists 1998, 118(2 ): 365-372.
[31]陈大明, 金勇丰, 张上隆. 柑橘LEAFY同源基因片段分离及特性研究田[J]. 园艺学报, 2001, 28(4): 295-300.
[32]马月萍. 甘菊LEFAY同源基因的克隆与表达分析[D]. 北京:北京林业大学, 2005.
[33]张 敏. 芥菜生殖发育转变的生化机理及LFY基因的克隆与分析[D]. 重庆: 西南大学, 2009
[34]何富强. 核桃LFY同源基因的克隆和表达[D]. 保定: 河北农业大学 , 2011
[35]吕玲玲, 孙光明, 刘玉革, 等.LEAFY同源基因研究进展[J].西北植物学报, 2011, 31(1): 197-203.
[36]EDWIGE M, GABRIELLE T, FRANµIS P. T heLEAFYfl oral regulators in angiosperms: Conserved proteins with diverse roles[J]. J. Plant Biology, 2009, 52: 177-185.
[37]DONG Z C, ZHAO Z, LIU C W,et al.Floral patterning in Lotus jap onicus [J]. Plant Physiologists. , 2005, 137: 1272-1282.
[38]WANG H, CHEN J, WEN J,et al.Control of compound leaf development byFLORICAULA /LEAFYortholog SIN GL E LEA FLET 1 in Medicago truncatula [J]. Plant Physiologists, 2008,146: 1759- 1772.
[39]ABE M, KOBAYASHI Y, YAMAMOT O S,et al. FD, a bZIP protein mediating signals from the fl oral pathway integratorFTat the shoot apex [J]. Science, 2005, (309): 1052- 1056.
[40]HUANG T, BOHLENIUS H, ERIKSSON S,et al. The mRNA of the Arabidopsis geneFTmoves from leaf to shoot apex and induces fl owering [J]. Science, 2005, (309): 1694- 1696.
[41]BRADELEY D, RAT CLIFF O,et al. In fl orescence commitment and architecture in Arabidopsis [J]. Science, 1997, 275(5296):80-83.
[42]JACK T. Molecular and genetic mechanisms of fl oral control [J].Plant Cell, 2004, 16: 1-17.
[43]PUTTERIL L J, ROBSON F, LEE K,et al. The CONST ANS gene of Arabidopsis promotes fl owering and encodes a protein showing similarities to zinc fi nger transcription factors [J]. Cell,1995, 80(6): 847- 857.
[44]YOO S K, CHUNG K S, KIM J,et al. Constans activates suppressor of over expression of constans throughFLOWRIN G LOCUS Tto promote flowering in Arabidopsis [J].Plant Physiology, 2005, 139: 770- 778.
[45]L ILJEGREN S J, GUST AFSON - BROWN C, PINYOPICH A,et al. Interactions amongAPETALA1,LEAFYandTERMINAL FLOWER1 specify meristem fate [J]. Plant Cell, 1999, (11): 1 007- 1 018.
[46]WILLIAM D A, SU Y, etal. Genomic identification of direct target genes ofLEAFY[J]. Proc. Natl. Acad. Sci., 2004, 101:1775- 1780.
[47]PINEIRO M, COUPLAND G. The control of fl owering time and fl oral identity in Arabidopsis [J].Plant Physiology, 1998,117:1- 8.
[48]PARCY F, NILSSON O, BU SCH M A, WEIGEL D. A genetic framework for fl oral patterning [J]. Nature, 1998, 395: 561- 566.
[49]LEE Y, WOLFE D S, NIL SSON O,et al. A LEAFY core gulator encoded by UN US UAL FLORAL ORGAN S [J]. Curr. Biol.,1997, 7: 95-104.
[50]邹 智,杨礼富,安 锋,等. 4种大戟科植物Lhca基因家族的全基因组鉴定、分类与进化分析[J]. 中南林业科技大学学报, 2014, 34(10): 56-60.
[51]马月萍, 陈 凡, 戴思兰. 植物LEAFY同源基因的研究进展[J].植物学通报, 2005, 22 (5): 605-613.
[52]HE Z H, ZHU Q, DABI T,et al.Transformation of rice with the Arabidopsis fl oral regulatorLFYcauses early heading [J]. Transgenic Research, 2001, (9): 223-227.
Phylogeny and research progress of LEAFY homologous gene
FENG Yan-zhi1,2, LI Fang-dong1, WANG Lu1, WEI Qi-qi2, HE Xiao2, ZHAO Guang2, ZHANG Yue1, FU Jian-min1
(1.Non-timber Forestry Research and Development Centre, CAF, Zhengzhou 450003, Henan, China; 2.Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees, Ministry of Education, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
LEAFY(LFY) is a tagged gene which regulates the formation of fl oral meristem and fl ower organs, It is the hub of starting the fl owering, and prevent the reversal of fl oral meristem. The deduced amino acid sequences characteristics, phylogeny ofLFYgene were analyzed by using software Vector NTI and MEGA5.1 from 36 kinds of plant species respectively, the results showed that its protein contains an average of 397 amino acids, an average of Molecular weight and isoelectric point respectively are 44.35 kDa and 7.32;Multiple sequence alignment showed that to remove the 37 completely conservative amino acid residues, there are also amino acids enrichment region such as alanine, lysine and histidine; Phylogenetic tree displays gymnosperms and monocotyledon gathered for a class and then gets together with Dicotyledonous plants; This study would provide very important reference value for better understanding the mechanisms of plant fl owering and a theoretical basis for accelerating fl owering and fruit setting.
LEAFYhomologous gene; phylogenetic analysis; expression; function
S718.46
A
1673-923X(2016)02-0025-08
10.14067/j.cnki.1673-923x.2016.02.005
http: //qks.csuft.edu.cn
2014-08-14
国家自然科学基金面上项目(31370682 )
冯延芝,博士研究生
傅建敏,副研究员;E-mail:fujm209@126.com
冯延芝,李芳东,王 璐,等. LEAFY同源基因系统进化及研究进展[J].中南林业科技大学学报,2016, 36(2): 25-32.
[本文编校:吴 彬]
