α-萘乙酸的非等温动力学研究
2016-12-20任宜霞蔡敬礼
陶 燕, 任宜霞, 蔡敬礼
(1. 陕西能源职业技术学院, 陕西 咸阳 712000; 2. 延安大学 化学与化工学院, 陕西 延安 716000)
α-萘乙酸的非等温动力学研究
陶 燕1, 任宜霞2, 蔡敬礼2
(1. 陕西能源职业技术学院, 陕西 咸阳 712000; 2. 延安大学 化学与化工学院, 陕西 延安 716000)
对α-萘乙酸(C12H10O2)的热分解机理进行了研究,采用TG曲线确定了它的热分解过程,并通过四种方程对其热分解过程的活化能En进行了计算,利用 41种不同的机理方程f(a)(微分机理方程)和G(α)(积分机理方程),对其热分解过程的非等温动力学数据进行了线性回归处理,并推断出其热分解机理为n=1/4的化学反应机理,最可几函数为,并建立了其动力学方程。
萘乙酸;热分解;非等温动力学;机理方程
α-萘乙酸[1],分子式为 C12H10O2,其通用名为NAA。白色针状结晶,无味,熔点134.5~135.5 ℃,加热分解,不溶于水但能溶于热水,易溶于乙醇、甲醇等有机溶剂,目前生产上多用其钠盐。α-萘乙酸是一种广谱型植物生长调节剂,农业上用作植物生长刺激素,促进作物的新陈代谢和光合作用,如促进细胞分裂与扩大,诱导形成不稳定根、增加座果、防止落果、改变雌雄花的比例率等。我国 70年代在河南安阳石油化工厂开始生产α-萘乙酸,近几年来,对于α-萘乙酸的研究也越来越多。
中国人口众多,耕地面积相对较少,且随着城镇化建设的发展和人口的不断增长,我国的耕地面积将越来越少,如何增加粮食和蔬菜等农作物的产量是人们面临的一个重要问题。近几年来,人们对环境保护越来越重视,有毒农药的使用和污染问题受到挑战,因而,低毒高效农药的发展是解决问题的关键之一。α-萘乙酸作为一种有效无毒的生长调节剂将会受到人们的广泛关注,因此对α-萘乙酸的理论研究意义重大。本文利用TG曲线等表征确定了它的热分解过程,并着重对其热分解机理及非等温动力学进行了研究,为此物质的制备和广泛应用提供了理论依据。
1 实验部分
1.1 主要试剂
α-萘乙酸(1 mmol, 0.186 2 g)、无水乙醇均为西安化学试剂厂生产。
1.2 仪器
ZRY-2P型高温综合热分析仪(升温速率 2.5 K∙min-1, 空气氛,上海精密科学仪器有限公司天平仪器厂); 熔点仪。
1.3 α-萘乙酸的重结晶及熔点测定
称取C12H10O2(1 mmol, 0.186 2 g) 0.186 2 g 于100 mL干净的小烧杯中,用无水乙醇溶解后,在磁力搅拌器上加热搅拌致使固体全部溶完,然后关掉搅拌器取下烧杯,过滤,再用塑料薄膜蒙住有滤液的烧杯口并戳上小孔,一周后乙醇挥发得到纯的针状晶体。经测定其熔点为134.8~135.5 ℃,证明其为α-萘乙酸。
2 实验结果与讨论
2.1 热分解机理
由α-萘乙酸的TG实验曲线可知,α-萘乙酸的热分解过程为一步分解,测定了不同速率下的TG曲线如图1:
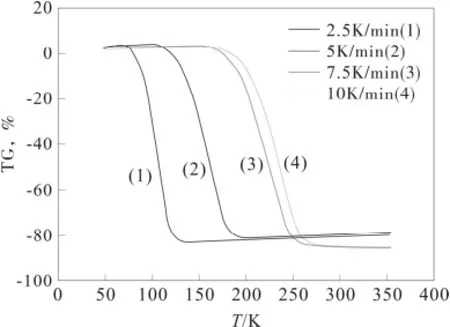
图1 α-萘乙酸的热分解过程Fig.1 The thermal decomposition process of NAA
2.2 非等温动力学计算
为了获得α-萘乙酸热分解过程的活化能和指前因子的数据,采用以下四种方法:
integral isoconversional non-linear[NL-INT4]方程[2]
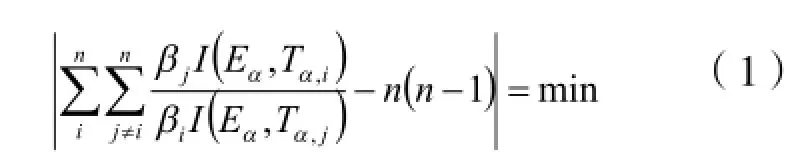
integral isoconversional non-linear[NL-INT0]方程[3]

Flynn-Wall-Ozawa (F-W-O) 方程[4]
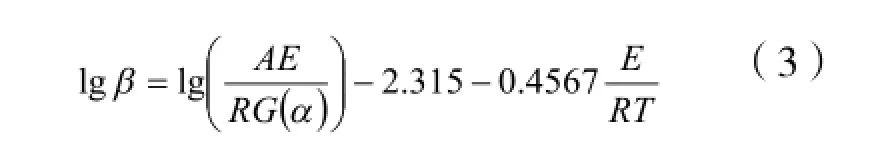
Kissinger方程[5]

在不同的升温速率下α~T图如图2, 不同方法计算的活化能Ea~α如图3。
表 1为同一 α下对应不同方法所计算的活化能。
将α-萘乙酸在四种不同升温速率下的 TG数据分别代入 41种常见的积分和微分形式的动力学函数中。分别用下面五种方法进行线性回归处理,求得α-萘乙酸的热分解反应动力学参数:表观活化能E,指前因子A和相关系数r 列于表2。
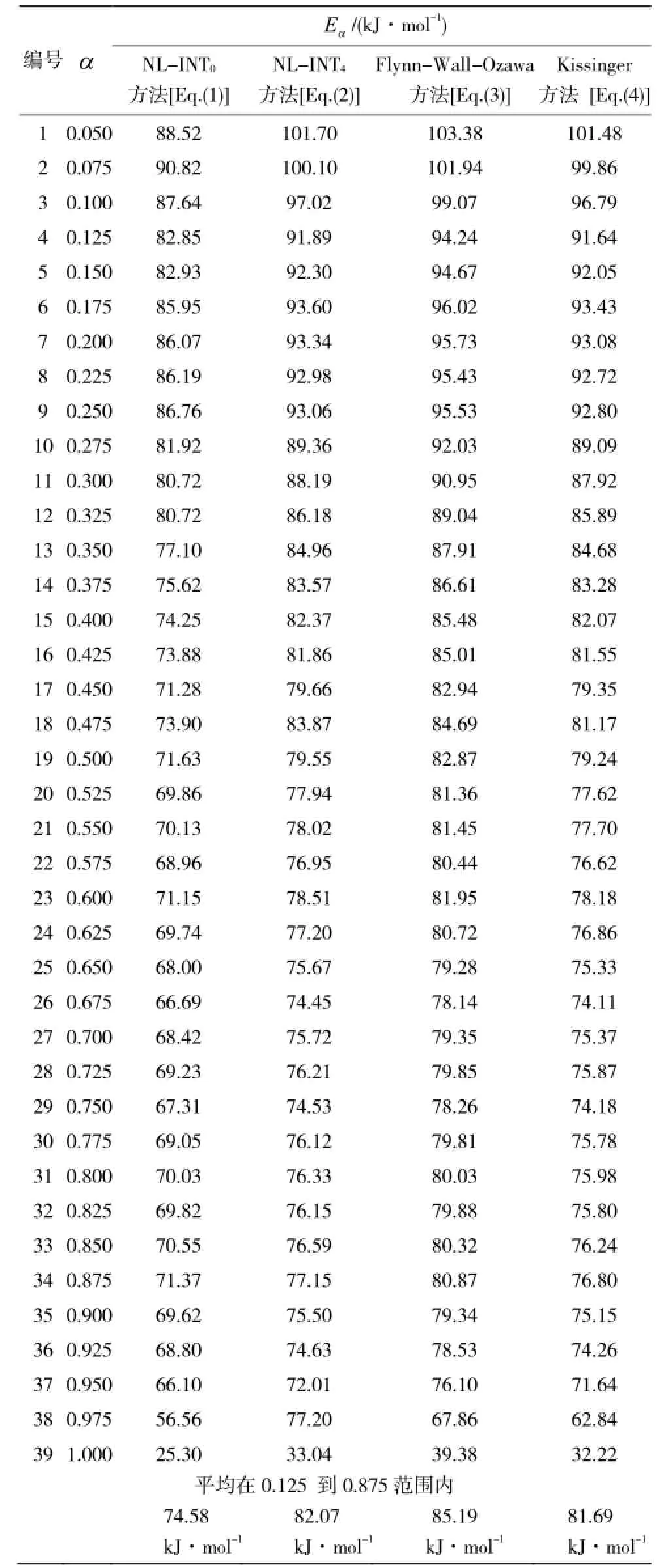
表1 同一α下对应不同方法所得的活化能Table 1 Activation energy obtained by different methods under the same α
所有计算是在C++所编的程序下进行的。五种计算方法如下:
一般积分法[6]

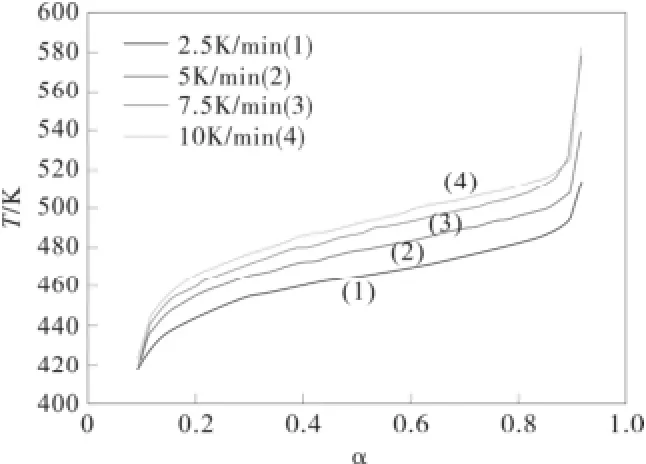
图2 在不同的升温速率下α~T图Fig.2 The α~T diagram at different heating rates

图3 不同方法计算的活化能Ea~αFig.3 The activation energy calculated by different methods Ea~α
普适积分法[7]

MacCallum-Tanner法[8]

Satava-Sestak法[4]

Agrawal 法[7]

根据选择合理的动力学参数[9]及最可几机理函数的依据[10],本文对各种计算结果做一筛选,其结果分别列于表 2。从表中可以看出,尽管所选计算方法不同,但所计算的各种动力学参数都非常接近,线性相关系数均大于 0.99。α-萘乙酸的表观活化能为 77.10~95.89 kJ/mol, 指前因子的对数 lgA为4.316 0~7.219 5 s-1, 其热分解机理为n=1/4化学反应机理,最可几函数为

得到了该过程的动力学方程 :
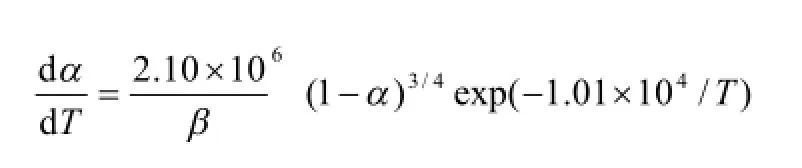

表2 α-萘乙酸在四种不同升温速率下的动力学参数Table 2 The kinetic parameters of NAA in four kinds of different heating rates
3 结 论
本实验研究了α-萘乙酸的热分解机理,并通过热重分析及非等温动力学的计算可知:α-萘乙酸的热分解过程为一步分解,其热分解机理为n=1/4的化学反应机理,最可几函数为 f (a)=4(1-α)3/4。
其动力学方程为:
Non-isotemperature Kinetics of α-Naphthylacetic acid
TAO Yan1, REN Yi-xia2, CAI Jing-li2
(1. Shaanxi Energy Institute, Shaanxi Xianyang 712000, China; 2. College of Chemistry and Chemical Engineering, Yan’an University, Shaanxi Yan’an 716000, China)
The thermal decomposition mechanism of α-naphthylacetic acid(C12H10O2)was studied. The thermal decomposition process was identified by TG-DTG technique. The activity energy Eain thermal decomposition process was calculated by four kinds of equations. 41 Kinds of different mechanism equations including f(a) (differential mechanism equation) and G(α) (integral mechanism equation) were used to treat the non-isothermal kinetic data in the thermal decomposition process with linear regression. The thermal decomposition mechanism was inferred as n = 1/4 chemical reaction mechanism. The most probable function wasThe kinetic equation was established.
Naphthaleneactic acid; Thermal decomposition; Non-isothermal dynamics; Mechanism equation
TQ 225
A
1671-0460(2016)03-0523-03
2016-01-06
陶燕(1982-),女,陕西咸阳人,讲师,硕士,2007年毕业于西北大学有机化学专业,研究方向:从事应用化学研究与技术工作。E-mail:taoyan0219@126.com。
