糖脂平对胰岛素抵抗大鼠骨骼肌IRS-1磷酸化及GLUT4分布的影响
2016-12-20高彦彬周焰实张涛静
周 晖 高彦彬 李 丽 夏 晶 周焰实 张涛静
(1 北京中医药大学东方医院,北京,100078; 2 首都医科大学中医药学院,北京,100069; 3 北京大学医学部生理学与病理生理学系,北京,100191)
糖脂平对胰岛素抵抗大鼠骨骼肌IRS-1磷酸化及GLUT4分布的影响
周 晖1高彦彬2李 丽3夏 晶1周焰实1张涛静1
(1 北京中医药大学东方医院,北京,100078; 2 首都医科大学中医药学院,北京,100069; 3 北京大学医学部生理学与病理生理学系,北京,100191)
目的:观察糖脂平对胰岛素抵抗大鼠骨骼肌IRS-1磷酸化及GLUT4分布的影响。方法:将24只清洁级SD大鼠随机分为对照组、模型组、中药组和西药组,采用高糖高脂饲料喂养方法造模成功后,分别给予生理盐水、糖脂平和二甲双胍灌胃,给药8周后,用Western Blot方法检测大鼠骨骼肌酪氨酸磷酸化IRS-1和磷酸化Akt的含量,用免疫荧光法观察大鼠骨骼肌GLUT4的分布情况。结果:实验末,与对照组比较,模型组大鼠骨骼肌酪氨酸磷酸化IRS-1和磷酸化Akt含量明显降低,中药组和西药组大鼠的骨骼肌酪氨酸磷酸化IRS-1和磷酸化Akt含量与模型组比较均明显升高,差异有统计学意义(P<0.01),中药组和西药组的组间差异无统计学意义(P>0.05)。对照组GLUT4分布于骨骼肌肌膜表面,模型组GLUT4膜分布明显减少,出现胞质分布,中药组和西药组GLUT4的膜分布较模型组明显改善。结论:糖脂平通过促进IRS-1的酪氨酸磷酸化,激活其下游PI3K,增加磷酸化Akt含量,进而使胞质内GLUT4膜转位增加,从而改善胰岛素抵抗。
胰岛素抵抗;糖脂平;骨骼肌;胰岛素受体底物1;葡萄糖转运体4
胰岛素抵抗(Insulin Resistance,IR)是多种代谢疾病发生发展的共同的病理生理学基础。IR的发生主要涉及肝脏、骨骼肌和脂肪组织,其中骨骼肌是葡萄糖代谢过程中最为重要的组织,所以有关骨骼肌IR的研究抗越来越受到重视,甚至有人认为骨骼肌胰岛素抵抗的发生早于其他组织,是外周胰岛素抵抗的主要靶位[1]。糖脂平是我们在临床上干预糖调节受损和早期糖尿病的经验方药,具有确切的临床疗效[2-3]。本研究通过观察糖脂平对IR大鼠骨骼肌细胞受体后信号转导通路中胰岛素受体底物1(Insulin Receptor Sbstrate 1,IRS-1)的酪氨酸磷酸化及葡萄糖转运体4(Glucose Transporter Type 4,GLUT4)在骨骼肌细胞膜分布的影响,从而探究糖脂平改善IR的作用机制。
1 材料
1.1 实验动物 清洁级雄性SD大鼠24只,体重180~200 g,采购自北京大学医学部实验动物中心。
1.2 动物饲料 基础饲料购自北京科澳协力饲料有限公司;高脂高盐饲料是在基础饲料的基础上加猪油21%、胆固醇1.5%、食盐2%制成,热量比为碳水化合物占20%,脂肪占59%,蛋白质占21%,购自北京科澳协力饲料有限公司。
1.3 实验药品与试剂 糖脂平由丹参、泽泻、鬼箭羽、黄连等组成,由北京中医药大学东方医院制剂中心加工,制成2 g生药/ML的药液;盐酸二甲双胍片购自北京中医药大学东方医院药房,中美上海施贵宝制药有限公司生产;裂解缓冲液;蛋白标准品;1∶200 p-IRS-1抗体(兔来源);1∶200 IRS-1抗体(兔来源)1∶200 p-Akt抗体(兔来源);1∶200 Akt抗体(兔来源);1∶200羊抗兔二抗;20%马血清封闭液;GLUT4抗体(羊来源1∶100);兔抗羊FITC标记的荧光二抗(1∶400);ECL发光液。
1.4 实验仪器 稳压稳流电泳仪:DYY-6B型,中国北京六一仪器厂生产;图像分析系统:550IW型,德国LEICA公司生产;紫外/可见分光光度计:Biophotometer型,德国EPPENDORF公司生产;激光共聚焦扫描显微镜:TCSSP2型,Leica公司生产;低温台式离心机:5417R型,德国EPPENDORF公司生产。
2 方法
2.1 建立模型 采用高脂高盐饲料喂养方法造模[4]。用基础饲料适应性饲养1周后的SD大鼠被随机分为4组:对照组、模型组、中药组、西药组,对照组继续用基础饲料喂养,另3组改用高脂高盐饲料喂养,自由摄食、饮水,明暗周期12/12 h。第九周末空腹断尾采血测血糖(FPG)和胰岛素(FINS),计算胰岛素作用指数[IAI=-ln(FPG×FINS)],以对照组IAI的均数减2个标准差为标准,低于该值的大鼠为造模成功。
2.2 分组处理 造模成功的大鼠从第10周开始按不同组别给药,西药组给予盐酸二甲双胍200 mg/(kg·d)灌胃;中药组给予糖脂平10 mL/(kg·d)[生药20 g/(kg·d)]灌胃;模型组和对照组灌服等量的蒸馏水。各组大鼠喂养饲料和条件不变,连续给药观察8周。
2.3 取材与组织准备 禁食12 h后处死,迅速取腓肠肌于-70 ℃冻存备用。
2.4 Western blot检测酪氨酸磷酸化IRS-1的含量提取骨骼肌总蛋白,并用Bradford’s法测定所提蛋白质浓度。使用Tris-HCl/SDS进行聚丙烯酰胺凝胶电泳,然后采用湿法电转印将蛋白转到硝酸纤维素膜上。硝酸纤维素膜在5%脱脂奶粉中室温温育2 h后,加入封闭液和1∶200 p-IRS-1抗体(一抗),4 ℃孵育过夜。用1×PBST洗膜3次,10 min/次,然后加入1∶200二抗,37 ℃孵育2 h后用1×PBST洗膜3次,10 min/次。用化学发光法检测条带(p-IRS-1)。洗膜后重复上述操作,一抗改为非磷酸化IRS-1抗体,用化学发光法检测条带(总IRS-1)。各样本光密度值经非磷酸化IRS-1的光密度值校正后,以对照组为100%,计算其余各组的相对值。
2.5 Western blot检测磷酸化Akt的含量 实验方法同2.4,一抗分别改为1∶200 p-Akt抗体和1∶200非磷酸化Akt抗体。各样本光密度值经非磷酸化Akt的光密度值校正后,以对照组为100%,计算其余各组的相对值。
2.6 观察大鼠骨骼肌GLUT4膜转位情况 制作7 μm骨骼肌组织冰冻切片后用冷丙酮固定,PBS洗涤后马血清室温封闭10 min,滴加抗GLUT4的抗体,4 ℃湿盒内孵育过夜。PBS冲洗后滴加FITC标记的二抗,室温孵育1 h。PBS洗涤,甘油封片,立即在激光共聚焦扫描显微镜下观察。
2.7 数据处理 所有数据录入SPSS 18.0统计分析软件包并进行数据分析,计量资料以均数±标准差(±s)表示。组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
3 结果
3.1 各组大鼠骨骼肌酪氨酸磷酸化IRS-1含量的变化情况 实验末,与对照组比较,模型组大鼠骨骼肌酪氨酸磷酸化IRS-1含量明显降低,中药组和西药组大鼠的骨骼肌酪氨酸磷酸化IRS-1含量与模型组比较均明显升高,差异有统计学意义(P<0.01),中西药组的组间比较,差异无统计学意义(P>0.05)。
3.2 各组大鼠骨骼肌磷酸化Akt含量的变化情况实验末,与对照组比较,模型组大鼠骨骼肌磷酸化Akt含量显著降低,中药组和西药组大鼠的骨骼肌磷酸化Akt含量与模型组比较均升高,升高幅度差异有统计学意义(P<0.01),中西药组的组间比较,差异无统计学意义(P>0.05)。
表1各组大鼠骨骼肌酪氨酸磷酸化IRS-1含量的比较(±s)

表1各组大鼠骨骼肌酪氨酸磷酸化IRS-1含量的比较(±s)
注:▲与模型组比较,P<0.01。
组别例数灰度值(%)对照组6100模型组643.44±3.30中药组677.28±6.10▲西药组678.38±9.28▲

图1
表2 各组大鼠骨骼肌磷酸化Akt含量的比较(±s)
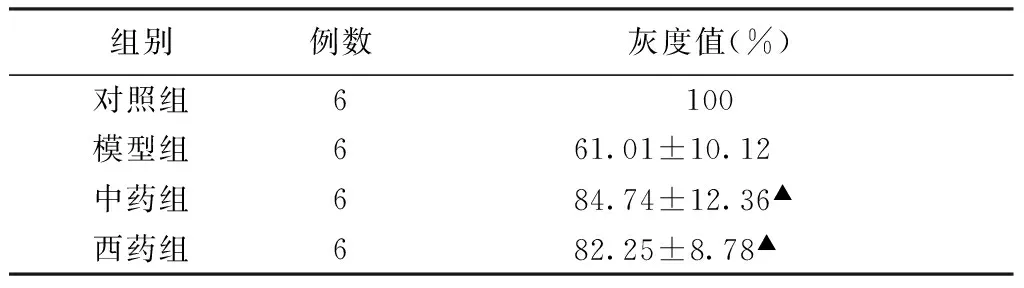
表2 各组大鼠骨骼肌磷酸化Akt含量的比较(±s)
注:▲与模型组比较,P<0.01。
组别例数灰度值(%)对照组6100模型组661.01±10.12中药组684.74±12.36▲西药组682.25±8.78▲
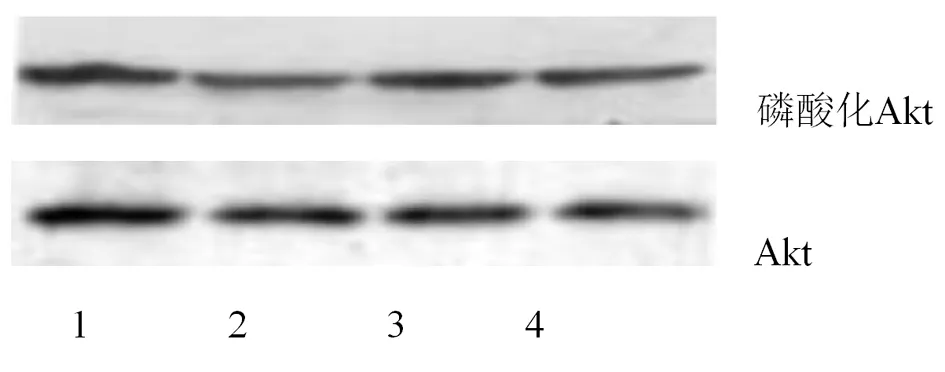
图2
3.3 各组大鼠骨骼肌GLUT4膜转位的情况 结果见图3,从图中可以看出,对照组GLUT4分布于骨骼肌肌膜表面,模型组GLUT4膜分布明显减少,且荧光强度减弱,出现胞质分布,中药组和西药组GLUT4表现为膜分布增多,较模型组明显改善。

图3 各组大鼠骨骼肌GLUT4的膜分布情况
4 讨论
IR是指骨骼肌、肝脏和脂肪等外周组织对胰岛素作用的敏感性和反应性下降,进而出现正常胰岛素水平产生低于正常生物学效应的一种病理状态。临床研究证实,肥胖和2型糖尿病人群普遍存在胰岛素抵抗,且贯穿于2型糖尿病的整个发生发展过程中;胰岛素抵抗与脂代谢紊乱、高血压病、冠心病、脑卒中以及微量白蛋白尿有关,是导致这些疾病共同的病理生理学基础[5]。胰岛素抵抗的发生机制极为复杂,涉及骨骼肌、肝脏和脂肪等多个组织和器官,至今仍不能完全明了。由于骨骼肌是人体内葡萄糖代谢最重要的组织,所以骨骼肌IR越来越引起专家学者的重视,甚至有人认为骨骼肌胰岛素抵抗的发生早于其他组织,是外周胰岛素抵抗的主要靶位[1]。
骨骼肌细胞线粒体功能障碍导致的肌细胞内脂质蓄积是引发胰岛素受体后信号转导通路缺陷的重要因素[6]。线粒体是脂肪酸β-氧化的重要场所,当骨骼肌线粒体生物合成减少或氧化磷酸化能力下降时,线粒体内脂肪酸的氧化利用减少,导致胞质内长链脂酰基辅酶A及二酰基甘油(DG)堆积,后者可激活新型PKC(nPKC),nPKC能促进IRS-1的丝氨酸位点发生磷酸化,继而干扰胰岛素刺激下IRS-1的酪氨酸位点磷酸化,使其对下游磷脂酰肌醇3-激酶(PI3K)的激活能力下降,胞质内GLUT4膜转位减少,阻碍胰岛素信号通路的正常转导,进而导致胰岛素抵抗的发生[7]。
通过参阅大量古今文献,结合证候学研究结果,我们认为,IR的发生是在先天禀赋异常的基础上,加之后天饮食不节,嗜卧少动,精神紧张,忧思过度等多种因素共同作用的结果。饮食不节,过食肥甘,五谷精微停聚内蕴,化生湿浊,凝结为痰,阻遏气机,气机不畅,血运随之,而致气血壅滞,终致血瘀痰阻。嗜卧少动,“形不动则精不流,精不流则气郁”,气郁血停,津液不化,凝聚为痰,痰浊血瘀互结为患。精神紧张,忧思过度,气机郁结不行,导致痰浊血瘀停滞互结。痰浊与血瘀,互为因果,相互影响,互为促进,随着疾病的发展,痰瘀互结壅遏气机,影响到脏腑功能,使五脏六腑功能失常,气血津液代谢失衡,从而变证百出[8]。基于这一认识并结合大量临床资料,我们提出IR发生的核心病机是痰瘀互阻,中医药干预IR的基本治法应该是化痰活血,临床上我们将糖脂平用于治疗痰瘀互阻型的早期糖尿病或糖尿病前期,疗效显著[9]。我们前期完成的国家“十一五”科技支撑计划课题和国家中医药管理局课题证实,糖脂平可降低糖耐量低减患者发生糖尿病的危险度,明显增加代谢综合征患者的胰岛素敏感性,纠正糖脂代谢紊乱[2-3],并且可以抑制炎性反应因子的分泌,改善血管内皮功能[10-11]。我们在高脂喂养的胰岛素抵抗大鼠模型上发现:糖脂平通过增加脂肪组织PPAR-γ和脂联素的基因表达,抑制炎性反应因子的分泌来改善胰岛素敏感性、纠正糖脂代谢紊乱。
有氧运动能够使骨骼肌有氧代谢酶类浓度增加,提高糖脂代谢能力,增加脂肪供能的比例和肌细胞内线粒体的体积与数量,改善胰岛素抵抗。其作用机制包括增加骨骼肌IRS-1(Tyr612)磷酸化和GLUT4 mRNA表达[12],增加骨骼肌中AMPK蛋白表达[13],激活骨骼肌AMPK/SIRT1/PGC-1α信号传导通路,使线粒体生物合成和氧化能力提高[14]。从以往中医药干预胰岛素抵抗的实验研究来看,多种中药成分及复方可以通过调节肝脏胰岛素信号转导通路,从而改善实验性动物模型肝脏的胰岛素抵抗[15-17],而关于骨骼肌胰岛素抵抗及其信号转导通路的干预研究比较少。通过本研究的结果,我们发现,采用高盐高脂饲料喂养的IR模型大鼠骨骼肌酪氨酸磷酸化IRS-1含量明显降低,中药干预后的酪氨酸磷酸化IRS-1含量较模型大鼠明显升高,进而使磷酸化Akt水平升高,从而使GLUT4在肌细胞膜表面分布增加,增加骨骼肌细胞对葡萄糖的转运利用,改善骨骼肌细胞的胰岛素抵抗。
综上所述,中药糖脂平通过改善降低的骨骼肌酪氨酸磷酸化IRS-1水平,从而改善GLUT4肌细胞膜表面分布状况,达到增加骨骼肌对葡萄糖的转运和利用,改善胰岛素抵抗。
[1]Petersen KF,Dufour S,Savage DB,et al.The role of skeletal muscle insulin resistance in the pathogenesis of the metabolic syndrome[J].Proc Natl Acad Sci USA,2007,104(31):12587-12594.
[2]高彦彬,周晖,关崧,等.中药糖脂平胶囊干预糖耐量低减的临床研究[J].北京中医药大学学报,2007,30(12):846-849.
[3]周晖,高彦彬.化瘀降浊合剂对代谢综合征患者糖脂代谢的影响[J].天津中医药,2008,25(5):364-366.
[4]曹廷兵,闫振成,沈成义,等.代谢综合征大鼠模型的建立及其相关基因表达变化的研究[J].解放军医学杂志,2005,30(8):702-705.
[5]刘超,祝群.代谢综合征的争议与共识[J].医学与哲学:临床决策论坛版,2009,30(6):58-59.
[6]Itani SI,Ruderman NB,Schmieder F,et al.Lipid-induced insulin resistance in human muscle is associated with changes in diacylglycerol,protein kinase C,and IkappaB-alpha[J].Diabetes,2002,51(7):2005-2011.
[7]kim JA,Wei Y,Sowers JR.Role of mitochondrial dysfunction in insulin resistance[J].Circ Res,2008,102(4):401-414.
[8]周晖,罗文益,陈莹,等.2型糖尿病合并代谢综合征中医证候演变规律研究[J].北京中医药大学学报:中医临床版,2009,16(6):1-3.
[9]周晖,高彦彬,罗文益,等.中西医结合治疗Ⅱ型糖尿病合并代谢综合征病例回顾研究[J].中国民族民间医药,2009,18(1):73-75.
[10]周晖,高彦彬.糖脂平合剂对代谢综合征患者血管内皮功能的影响[J].北京中医药,2011,30(12):918-920.
[11]周晖,高彦彬.糖脂平对代谢综合征患者胰岛素敏感性及炎症因子的影响[J].现代中医杂志,2015,22(3):11-14.
[12]张明军.运动对Fetuin-A诱导的胰岛素抵抗鼠骨骼肌IR和IRS1磷酸化的影响[J].体育学刊,2014,21(2):141-144.
[13]牛燕媚,苑红,刘彦辉,等.有氧运动对胰岛素抵抗小鼠骨骼肌球形脂联素及腺苷酸活化蛋白激酶的影响[J].中国运动医学杂志,2009,28(1):36-40.
[14]Iwabu M,Yamauchi T,Okada-Iwabu M,et al.Adiponectin and AdipoR1 regulate PGC-1alpha and mitochondria by Ca(2+)and AMPK/SIRT1[J].Nature,2010,464(7293):1313-1319.
[15]梁湘樱,张红杰,朱凌云,等.金银花提取物对小鼠肝脏和人肝细胞PGC-1α表达及胰岛素抵抗的影响[J].中国糖尿病杂志,2011,19(3):197-200.
[16]王琪,柴单单,吴晓华,等.太子参多糖减轻高脂诱导的小鼠肝脏胰岛素抵抗[J].中国病理生理杂志,2015,31(4):685-689.
[17]张先慧,胡照娟,张艳红,等.辛开苦降方对初发2型糖尿病KKay小鼠肝脏胰岛素抵抗及IRS-2/PI3K通路的影响[J].中华中医药杂志,2015,30(5):1774-1779.
(2015-07-30收稿 责任编辑:张文婷)
The Effect of Tangzhiping on Phosphorylation of IRS-1 and Distribution of GLUT4 in Skeletal Muscle in Rats with Insulin Resistance
Zhou Hui1, Gao Yanbin2, Li Li3, Xia Jing1, Zhou Yanshi1,Zhang Taojing1
(1OrientalHospitalaffiliatedtoBeijingUniversityofChineseMedicine,Beijing100078,China; 2CapitalMedicalUniversitySchoolofTraditionalChineseMedicine,Beijing100069,China; 3DepartmentofPhysiologyandPathophysiology,PekingUniversityHealthScienceCenter,Beijing100191,China)
Objective: To investigate the effect of Tangzhiping on phosphorylation of IRS-1 and distribution of GLUT4 in skeletal muscle in rats with insulin resistance. Methods: SD rats of total 24 were randomly divided into four groups: Chinese medicine group, western medicine group, control group and model group. The rat model of insulin resistance (IR) was established by feeding with high-fat and high-salt diet. Rats in Chinese medicine and western medicine group were treated with Tangzhiping and metformin respectively for eight weeks. Eight weeks later, western blot test was used to detect tyrosine phosphorylation of IRS-1 and phosphorylation of Akt. Immunofluorescence assay was used to observe distribution of GLUT4 in skeletal muscle. Results: The level of tyrosine-phosphorylated IRS-1and phosphorylated Akt in rats of the model group was significantly lower than that in rats of control group. Treatment of IR rats with Tangzhiping or metformin elevated the level of tyrosine-phosphorylated IRS-1and phosphorylated Akt (P<0.01), when compared with the model group. There was no statistical differences between Chinese medicine group and western medicine group (P>0.05). GLUT4 was distributed predominantly on the membrane of skeletal muscle in rats of control group. GLUT4 distribution on membrane was significantly attenuated and GLUT4 distribution in plasma appeared in skeletal muscle of rats in the model group, which was improved by Chinese medicine and western medicine treatment. Conclusion: Tangzhiping can elevate insulin resistance by promoting the phosphorylation of IRS-1 and its downstream signal Akt and increasing the translocation of GLUT4 from cytoplasm to membrane.
Insulin resistance; Tangzhiping; Skeletal muscle; Insulin receptor substrate 1; Glucose transporter 4
北京中医药大学自主选题项目(编号:2009JYBZZ-JS085)——“胰岛素抵抗大鼠骨骼肌线粒体损伤机制及中药改善作用研究”
周晖(1975.10—),男,医学博士,副主任医师,研究方向:糖尿病及其血管并发症的中医药防治研究,E-mail:emailzhouhui@163.com
R285.5
A
10.3969/j.issn.1673-7202.2016.01.032
