药用多孔菌DNA条形码鉴定研究
2016-12-20苏燕燕雷志勇李志明李西文
汤 欢 苏燕燕 雷志勇 李志明 李西文
(1 中国中医科学院中药研究所,中药鉴定与安全性检测评估北京市重点实验室,北京,100700; 2 北京千菌方菌物科学研究院,北京,100005)
药用多孔菌DNA条形码鉴定研究
汤 欢1苏燕燕1雷志勇2李志明2李西文1
(1 中国中医科学院中药研究所,中药鉴定与安全性检测评估北京市重点实验室,北京,100700; 2 北京千菌方菌物科学研究院,北京,100005)
目的:筛选采用DNA条形码技术鉴定药用多孔菌的有效条形码及该方法的可行性。方法:对29种药用多孔菌的69份样品进行DNA提取,通过聚合酶链式反应(PCR)扩增ITS序列并进行双向测序,去除低质量区和引物区,得到ITS序列,通过BLAST比对及基于K2P遗传距离构建系统聚类NJ树开展ITS鉴定效率评价。结果:经过优化的DNA提取方法,可对所有样品成功提取到足量DNA,PCR扩增产物测序并经过序列拼接剪切后均能得到高质量ITS序列;物种内ITS最大遗传距离均远小于物种种间最小遗传距离;基于GenBank数据库进行BLAST比对,鉴定效率达到100%;基于K2P遗传距离构建NJ树,结果显示相同物种均聚为一支。结论:DNA条形码技术可以对多孔菌进行快速准确鉴定,ITS序列可作为药用多孔菌有效候选DNA条形码。
药用多孔菌;DNA条形码;真菌;ITS
多孔菌是子实体呈孔状且质地革质至木质的一类大型担子菌,属于寄生或腐生生物,主要生长在木材上,与高等绿色植物相比,多不常见。多孔菌包括多种大型药用真菌,《神农本草经》中就有以灵芝、茯苓、猪苓、雷丸等多孔菌药用的记载。人类认识和利用真菌的历史在西方已有3 500年以上,我国则超过6 000年,但真菌分类学的产生和发展却是在近200年左右。瑞典博物学家林奈在SpeciesPlantarum[1]中,首次记载了8种多孔菌。Christiaan Hendrik Persoon[2]将多孔菌归入裸果纲(Gymnocarpi)褶体目(Hymenothii)菇型类(Agaricoidei)中。Elias Magnus Fries[3]在Christiaan Hendrik Persoon的分类系统基础上,采用新的分类标准,进行了新的科属划分。我国的多孔菌研究起步较晚,基础薄弱,胡先骕先生将其最初采集的多孔菌送往国外进行物种鉴定[4]。邓叔群[5]和戴芳斓[6]先后记载中国多孔菌有50个属。卯晓岚[7]、赵继鼎、张小青[8-9]等对我国的灵芝科、多孔菌科真菌也做了大量深入的研究。与绿色植物以花和果实作为主要鉴定器官不同,传统鉴定真菌的主要依据是菌丝和孢子的特征,需要鉴定者有多年的经验积累,主观性较强。同时多孔类真菌亲缘关系和进化趋向比较复杂,用传统方法进行鉴定所需周期长,鉴定方法重现性较差。因此,急需寻求一种客观且快速高效的鉴定方法。
DNA条形码技术摆脱了传统形态鉴定方法依赖长期经验的束缚,鉴定快速准确,易于实现标准化,是传统生物鉴定方法的有效补充和重大突破[10]。真菌是数量仅次于昆虫的第二大真核生物类群,与动、植物相比,真菌DNA条形码研究鲜有报道。为此,国际生命条形码组织专门为其设立了工作组,并成立了国际真菌条形码专业委员会以组织协调国际真菌DNA条形码相关研究工作。DNA条形码技术可准确辨别形态分类难以区分的真菌,任何生长发育时期的真菌均可使用该技术进行鉴定,是传统鉴定方法所不能比拟的[11]。因真菌多寄生或腐生,没有叶绿体,适用于植物叶绿体的rbcL、matK、psbA-trnH序列不适用于真菌的鉴定,Conrad L Schoch等[12]经过大量研究,推荐使用细胞核中的ITS基因片断作为真菌的条形码序列。目前,该体系已广泛应用于各类植物及真菌的鉴定中,均表现出较强的鉴定能力[13-32]。本研究运用DNA条形码技术对多种药用多孔菌进行鉴定研究,进一步评估ITS作为DNA条形码鉴定多孔类真菌的可行性,以期筛选多孔真菌通用条形码,为实现多孔类真菌的快速准确鉴定奠定基础。
1 材料与方法
1.1 材料 本研究共涉及29种药用多孔菌的69份样品。其中,51份来自北京陈康林野生药用真菌研究院,5份来自大兴安岭漠河县,5份来自西藏林芝,3份来自四川康定,1份来自四川攀枝花,4份来自市场购买,以上样品经过大型真菌分类专家卯晓岚教授鉴定,详细信息见表1。本研究中的69份样品均获得了ITS序列,其序列均已提交至GenBank。另外,从GenBank下载了这29个物种的ITS序列。样品信息见表1。
1.2 方法
1.2.1 样品DNA提取、PCR扩增和测序 样品DNA提取:用乙醇棉擦拭真菌后刮去真菌表面,取靠近里面的组织(木耳等不适宜刮的真菌仅用乙醇棉擦拭后即可取样),用刀片切成细块,称取样品约40 mg。用高通量组织研磨仪(Sceintz Biotech Co.,China),在50 Hz频率下研磨200 s,加入核分离液(100 mmol/L Tris-HCl(pH 8.0),20 mmol/L EDTA(pH 8.0),0.7 mmol/L NaCl,2% PVP-40,0.4% β-巯基乙醇)[33]清洗2~4次(800 μL/次)至上清液无色,用移液枪小心吸去上清液,留沉淀,加裂解液后,置于56 ℃水浴过夜(水浴约8 h),再采用植物基因组DNA提取试剂盒(Tiangen Biotech Co.,China)提取样品总DNA。详细操作步骤参见2015版中国药典“中药材DNA条形码分子鉴定指导原则”及试剂盒说明书。

表1 实验所用样品信息表
PCR扩增和测序:采用ITS序列通用引物ITS5F/4R进行扩增,ITS序列PCR扩增正向引物序列为ITS5F:5-GGAAGTAAAAGTCGTAACAAGG-3;反向引物序列为ITS4R:5-TCCTCCGCTTATTGATATGC-3。PCR反应体系:以25 μL为参照,2×Taq PCR Master Mix(Aidlab Biotech Co.,China)12.5 μL,正向和反向引物各1.0 μL(2.5 μmol/L),模板DNA量为50~100 ng(约4.0 μL所提的DNA液),再用dd H2O补至25 μL。PCR扩增程序:94°C变性5 min;再进行30个循环(每个循环均为:94 ℃变性1 min、50 ℃退火1 min、72 ℃延伸90 s);72°C延伸7 min。用琼脂糖凝胶电泳检测PCR情况,对出现清晰目的条带的样品进行纯化后,采用ABI 3730XL测序仪(Applied Biosystems Co.,USA)进行双向测序。
1.2.2 数据处理 使用CodonCode Aligner V3.7.1(CodonCode Co.,USA)对测序序列进行质量分析和校对拼接,去除低质量区,导出序列。运用MEGA 6.0(Molecular Evolutionary Genetics Analysis.,USA)软件将98条(包括实验的69条和下载的29条)ITS序列进行序列分析,并基于Kimura 2-parameter model(K2P)计算种内和种间遗传距离,用邻接法(Neighbor Joining,NJ)构建系统聚类树,并用自举检验法Bootstrap 1 000次检验各分支的支持率[34]。
2 结果与分析
2.1 DNA提取及PCR扩增 样品DNA提取是开展DNA条形码研究的首要环节。药用多孔菌中普遍含有大量的次生代谢产物,采用核分离液洗涤后,可去除细胞核中大部分的多糖、多酚等物质,提高DNA纯度。将69份样品用高通量组织研磨仪研磨后,用核分离液洗涤2~4次(800 μL/次),至上清液无色为止,再按DNA提取试剂盒的操作步骤提取样品DNA,均能得到高质量的DNA,其PCR产物经电泳后均能显示单一目的条带,扩增效率100%。
2.2 遗传距离分析 29种药用多孔菌的98条ITS序列的种内和种间遗传距离见表2。由表2可知:各物种的种内最大遗传距离均远小于物种间最小遗传距离,各物种在遗传距离上差异明显。
2.3 BLAST分析 将实验获得的69条药用多孔菌的ITS序列在GenBank数据库中进行BLAST比对,结果见表3:在29种药用多孔菌中,19个物种的最大BLAST相似度为100%,10个物种的最大BLAST相似度为99%,在69条序列中,只有漆柄小孔菌的1条序列的最大BLAST相似度为98%。BLAST相似度不是100%的序列中,其最大BLAST相似度对应的物种均为所鉴定的基原物种。
2.4 NJ树分析 运用K2P模型,选取实验获得的69条和从GenBank下载的29条ITS序列,以邻接(NJ)法构建系统聚类树。见图1。结果显示,各物种的ITS序列均聚为一支。由此可知,运用ITS序列能准确鉴定此类药用多孔菌,具有较强的鉴定能力。
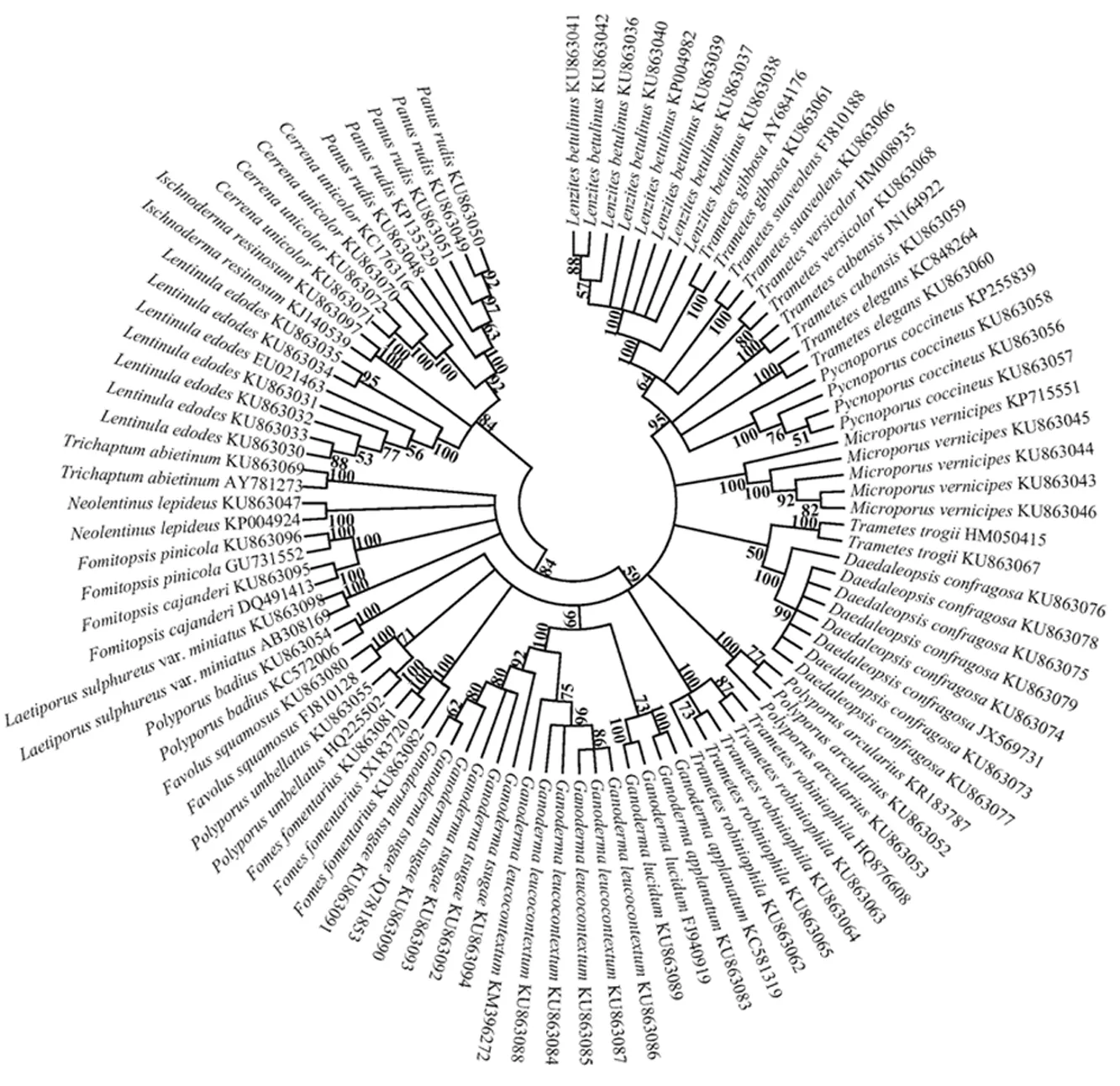
图1 基于ITS序列构建的药用多孔菌邻接(NJ)树
3 讨论
3.1 DNA提取 药用多孔菌的子实体中含有较多的多酚、多糖类物质,研磨时,多酚极易氧化成醌类,使提取出的DNA液带颜色,在纯化过程中很难去除,影响后续PCR反应。本研究通过多次反复实验发现,对DNA提取试剂盒操作步骤进行优化后能获得高质量DNA。具体优化步骤如下:1)取样:刮去样品表皮,称取子实体里面的组织;2)洗涤:向每管研磨好的样品中加核分离液清洗2~4次(800 μL/次)至上清液无色,提高所提DNA的纯净度;3)水浴:加裂解液后放入56 ℃水浴锅中水浴约8 h,使样品细胞中的DNA充分溶出。
3.2 鉴定 药用多孔菌形态多种多样,在不同发育时期的形态差异较大,运用传统鉴定方法对其进行鉴定较困难。并且,适用于植物叶绿体的rbcL、matK、psbA-trnH序列不适用于叶绿体已退化的真菌。因此,本研究选用细胞核中的ITS序列作为DNA条形码,鉴定药用多孔菌。本研究中,从不同产地收集的69份样品均可稳定获得其ITS序列,各样品种内最大遗传距离均远小于种间最小遗传距离,所有样品在GenBank数据库中均能BLAST比对到正确的物种。同时,NJ树结果显示各物种的ITS序列均聚为一支。由此可知,运用ITS序列能准确鉴定此类药用多孔菌,具有较强的鉴定能力。
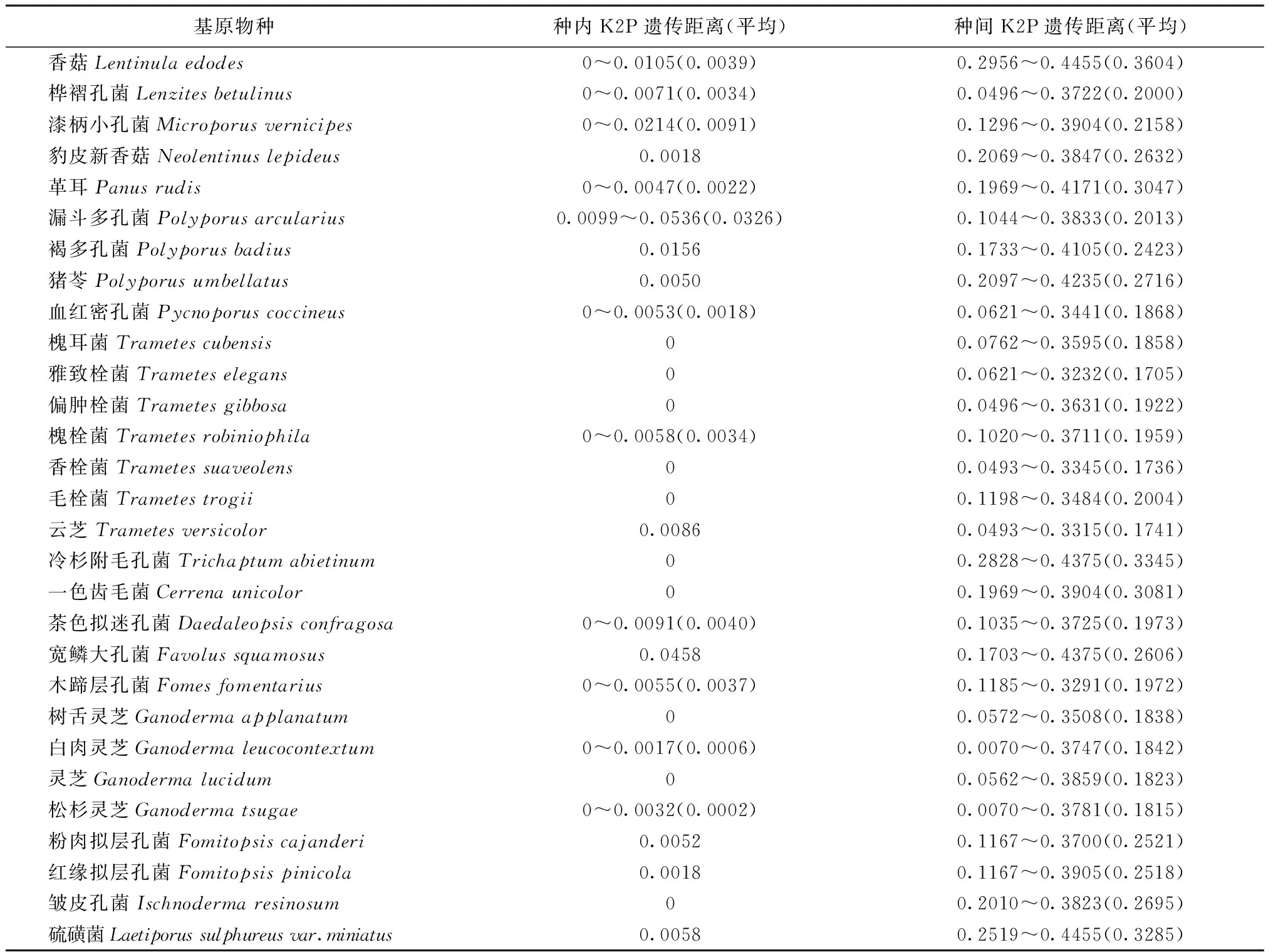
表2 药用多孔菌种内及种间遗传距离表
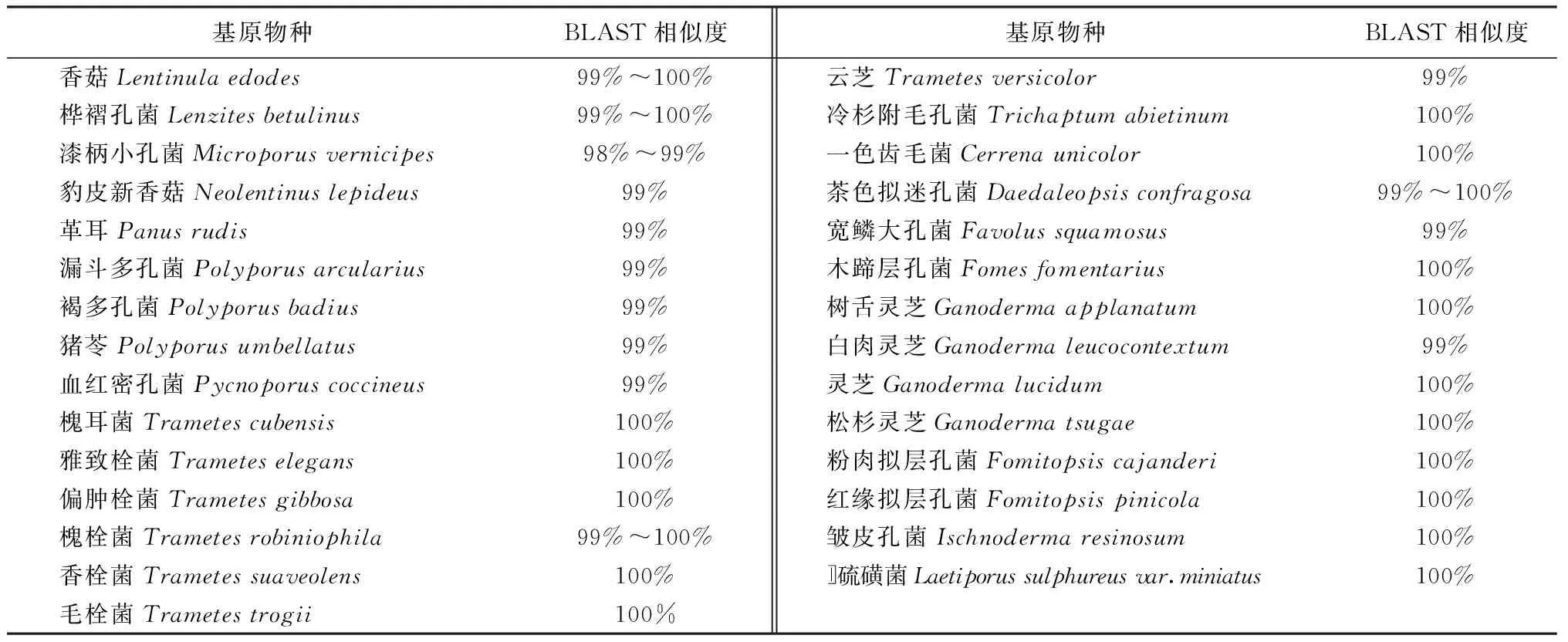
表3 BLAST比对结果表
3.3 结论 依据真菌的形态特征、生长特性以及生理生化指标进行分类鉴定的传统方法,重复性差,由于受到许多主观因素影响,易于发生误判。并且,由于真菌的鉴定不同于维管植物,分类特征微小,进化更为复杂,需要鉴定者有较丰富的鉴定经验,给真菌的传统分类鉴定带来了严峻挑战。DNA条形码技术作为一种分子鉴定技术,不受物种外部形态的影响,对能提取出DNA的各类型样品均能进行鉴定。DNA条形码技术经过10余年的发展,已被用于中药鉴定学、系统分类学、生态学、发育进化、生物多样性保护等领域[35]。Scott E.Miller称DNA条形码技术推动了分类学的“文艺复兴”[36],能够给日渐萎缩的传统形态分类学带来新的发展机遇。向丽等[37]使用ITS序列对冬虫夏草进行了准确鉴定,Conrad L Schoch等推荐使用ITS基因片断作为真菌的有效DNA条形码序列。本研究对多种药用真菌的条形码鉴定研究结果表明ITS序列可作为潜在的多孔菌通用条形码序列。
[1]Carl Linnaeus.Species Plantarum[M].London:Ray Society,1753.
[2]Persoon CH.Synopsis Methodica Fungorum[M].Göttingen:Henricus Dieterich,1801.
[3]Fries EM.Systema Mycologicum[M].Lundae:Sweden,1821.
[4]裘维蕃.菌物学大全[M].北京:科学出版社,1998.
[5]邓叔群.中国的真菌[M].北京:科学出版社,1963.
[6]戴芳澜.中国真菌总汇[M].北京:科学出版社,1979.
[7]卯晓岚.中国大型真菌[M].郑州:河南科学技术出版社,2000.
[8]赵继鼎.中国真菌志·第三卷多孔菌科[M].北京:科学出版社,1998.
[9]赵继鼎,张小青.中国真菌志·第十八卷灵芝科[M].北京:科学出版社,2000.
[10]陈士林,姚辉,宋经元,等.基于DNA barcoding(条形码)技术的中药材鉴定[J].世界科世界科学技术-中医药现代化,2007,9(3):7-12.
[11]Velmurugan S,Prasannakumar C,Manokaran S,et al.DNA barcodes for marine fungal identification and discovery[J].Fungal Ecol,2013,6(5):408-418.
[12]Schoch CL,Seifert KA,Huhndorf S,et al.Nuclear ribosomal internal transcribed spacer(ITS)region as a universal DNA barcode marker for Fungi[J].Proc Natl Acad Sci USA,2012,109(16):6241-6246.
[13]宫诗林,曹玉峰,王淑敏.吉林省食药用真菌马勃的资源及鉴别研究[J].亚太传统医药,2013,9(12):49-52.
[14]刘春卉,瞿伟菁,张雯,等.药用真菌金耳的rDNA ITS序列分析与鉴别[J].天然产物研究与开发,2007,19(2):216-220.
[15]曹小迎,蒋继宏,孙勇,等.刺革菌科4种药用真菌的ITS区序列分析[J].中草药,2007,38(2):261-264.
[16]Schwarz P,Bretagne S,Gantier JC,et al.Molecular identification of zygomycetes from culture and experimentally infected tissues[J].J Clin Microbiol,2006,44(2):340-349.
[17]Nguyen HDT,Seifert KA.Description and DNA barcoding of three new species of Leohumicola from South Africa and the United States[J].Persoonia,2008,21(1):57-69.
[18]Tedersoo L,Jairus T,Horton BM,et al.Strong host preference of ectomycorrhizal fungi in a Tasmanian wet sclerophyll forest as revealed by DNA barcoding and taxon-specific primers[J].New Phytol,2008,180(2):479-490.
[19]Cai L,Hyde KD,Taylor PWJ,et al.A polyphasic approach for studying Colletotrichum[J].Fungal Divers,2009,39(1):183-204.
[20]Sahadevan S,Pascoal C,Marvanová L,et al.DNA barcoding of fungi:a case study using ITS sequences for identifying aquatic hyphomycete species[J].Fungal Divers,2010,44(1):77-87.
[21]Robideau GP,De Cock AW,Coffey MD,et al.DNA barcoding of oomycetes with cytochrome c oxidase subunit I and internal transcribed spacer[J].Molecular ecology resources,2011,11(6):1002-1011.
[22]Li XW,Yang Y,Henry RJ,et al.Plant DNA barcoding:from gene to genome[J].Biol Rev,2015,90(1):157-166.
[23]Xin TY,Li XJ,Yao H,et al.Survey of commercial Rhodiola products revealed species diversity and potential safety issues[J].Sci Rep,2015,DOI:10.1038/srep08337.
[24]Wu L,Sun W,Wang B,et al.An integrated system for identifying the hidden assassins in traditional medicines containing aristolochic acids[J].Sci Rep,2015,DOI:10.1038/srep11318.
[25]Xin TY,Yao H,Gao HH,et al.Super food Lycium barbarum(Solanaceae)traceability via an internal transcribed spacer 2 barcode[J].Food Res Int,2013,54(2):1699-1704.
[26]Hou DY,Song JY,Shi LC,et al.Stability and accuracy assessment of identification of traditional Chinese materia medica using DNA barcoding:A case study on Flos Lonicerae Japonicae[J].Biomed Res Int,2013,DOI:10.1155/2013/549037.
[27]Luo K,Chen SL,Chen KL,et al.Assessment of candidate plant DNA barcodes using the Rutaceae family[J].Sci China Ser C,2010,53(6):701-708.
[28]曾昭清,赵鹏,罗晶,等.从真菌全基因组中筛选丛赤壳科的DNA条形码[J].中国科学:生命科学,2012,42(1):55-63.
[29]蔡箐,唐丽萍,杨祝良.大型经济真菌的DNA条形码研究——以我国剧毒鹅膏为例[J].植物分类与资源学报,2012,34(6):614-622.
[30]林惠娇,蒋湘,王新国,等.DNA条形码技术及其在真菌研究中的应用[J].植物检疫,2013,27(2):11-18.
[31]张宇,郭良栋.真菌DNA条形码研究进展[J].菌物学报,2012,31(6):809-820.
[32]刘娜,李梦臻.DNA条形码技术在病原真菌分类鉴定中的应用[J].江苏农业科学,2015,43(3):10-12.
[33]陈士林.中国药典中药材DNA条形码标准序列[M].北京:科学出版社,2015:24.
[34]Tamura K,Stecher G,Peterson D,et al.MEGA6:molecular evolutionary genetics analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
[35]裴男才,陈步峰.生物DNA条形码:十年发展历程、研究尺度和功能[J].生物多样性,2013,21(5):616-627.
[36]Miller SE.DNA barcoding and the renaissance of taxonomy[J].Proc Natl Acad Sci USA,2007,104(12):4775-4776.
[37]Xiang L,Song JY,Xin TY,et al.DNA barcoding the commercial Chinese caterpillar fungus[J].Fems Microbiol Lett,2013,347(2):156-162.
(2016-04-12收稿 责任编辑:洪志强)
Identification of medicinal polypore using DNA barcoding
Tang Huan1,Su Yanyan1,Lei Zhiyong2,Li Zhiming2,Li Xiwen1
(1InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,KeyLaboratoryofBeijingforIdentificationandSafetyEvaluationofChineseMedicine,Beijing100700,China; 2BeijingQianjunfangMycologicalResearchInstitute,Beijing100005,China)
Objective:To study the feasibility of applying DNA barcoding technique to identify medicinal polypore.Methods:The genomic DNAs were extracted from 69 samples,and the ITS sequences were amplified and bidirectionally sequenced.All the sequences were assembled.The genetic distances were computed by Kimura 2-parameter(K2P)model and Neighbor-joining(NJ)phylogenetic tree was constructed.Results:The maximum intraspecific genetic distance of each species were all less than the minimum interspecific genetic distance.The ITS sequences were identified using Basic Local Alignment Search Tool(BLAST)method in the GenBank database.The ITS sequences of each species were clustered into one clade respectively using NJ tree method.Conclusion:The ITS sequence can be used as a candidate DNA barcode of medicinal polypore.
Medicinal polypore; DNA barcoding; Fungi; ITS sequence
重大新药创制国家科技重大专项(编号:2014ZX09304307001-014;2014ZX09301308-007);国家科技支撑计划(编号:2015BAI05B02);中央科研院所公益项目(编号:ZXKT15029,ZZ2014029)
汤欢(1986—),男,博士研究生,研究方向:经典植物分类及中药材分子鉴定
李西文(1978—),男,博士,副研究员,电话/传真:(010)84084107,E-mail:xwli@icmm.ac.cn
R282.5
A
10.3969/j.issn.1673-7202.2016.01.005
