基于ITS2条形码鉴定水红花子及其混伪品
2016-12-20辛天怡郭梦月庞晓慧
任 莉 辛天怡 郭梦月 姚 辉 庞晓慧
(中国医学科学院北京协和医学院药用植物研究所,北京,100193)
基于ITS2条形码鉴定水红花子及其混伪品
任 莉 辛天怡 郭梦月 姚 辉 庞晓慧
(中国医学科学院北京协和医学院药用植物研究所,北京,100193)
目的:利用ITS2条形码对中药材水红花子及其混伪品进行鉴定研究。方法:为对该中药材进行准确鉴定,共收集71份样本,包含药材正品及其混伪品。通过对样品进行DNA提取、PCR扩增、双向测序,利用CodonCode Aligner软件进行序列质量评价与拼接,获得ITS2序列。用MEGA软件进行序列比对、变异位点及遗传距离分析,采用最近距离法和构建NJ(邻接)树法来评价ITS2条形码的鉴定能力。结果:水红花子药材基原物种红蓼ITS2序列种内遗传距离为0~0.0124,与其混伪品水蓼、酸模叶蓼以及春蓼的种间遗传距离分别为0.0334~0.0508、0.0688~0.0875、0.0379~0.0467。红蓼种内最大遗传距离小于其与混伪品的种间最小遗传距离,表明ITS2条形码可以准确鉴定水红花子与其混伪品。此外,基于ITS2序列构建的NJ树也可将水红花子及其混伪品明显区分开。结论:ITS2条形码是鉴别水红花子药材的有效工具,可为保障该药材生产投料安全提供新的技术手段。
水红花子;DNA条形码;ITS2;分子鉴定
水红花子为蓼科蓼属植物红蓼PolygonumorientaleL.的干燥成熟果实,具有散血消症、消积止痛、利水消肿等功效[1]。现代药理研究表明水红花子具有抗氧化、抗肿瘤、抗心肌缺血等作用[2-7],临床上可用于治疗胃癌、肠癌、肝癌、胃痛、糖尿病等[8-9]。红蓼的全草、花序、果实和根均可入药[10]。除具有重要药用价值外,红蓼还可食用,并有望被制成杀虫剂与吸附剂[11-15],具有重要开发价值。然而,由于其同属物种形态特征高度相似、地方习用品广泛存在,使其混伪现象严重,常见的混伪品有水蓼P.hydropiperL.、酸模叶蓼P.lapathifoliumL.以及春蓼P.persicariaL.[4]等,为其质量控制以及深入研究带来了困难。因此,为保障水红花子的用药安全以及进一步研究开发的顺利进行,需要一种快速、准确的方法对其进行鉴定。
DNA条形码是利用相对较短的、标准的DNA片段来进行物种鉴定的一项新的分子鉴定技术,是近年来的研究热点[16]。Chen等[17]比较了7个候选DNA条形码(psbA-trnH,matK,rbcL,rpoC1,ycf5,ITS2,ITS)对药用植物鉴定的有效性,发现ITS2序列的物种水平鉴定效率达到92.7%,首次提出以ITS2为核心,psbA-trnH为补充序列的药用植物条形码鉴定体系。随后,ITS2条形码被广泛应用于中药材鉴定[18-31],并建立以ITS2为主体的中药材鉴定体系和网络鉴定数据库(http://www.tcmbarcode.cn),该鉴定体系现已纳入《中华人民共和国药典》[32]。我们利用ITS2条形码对水红花子药材进行鉴定研究,拟解决该药材的真伪鉴别问题,为保障水红花子用药安全提供理论依据。
1 材料与方法
1.1 材料 本研究共收集实验材料71份。其中水红花子样本44份,包含药材样本29份,原植物样本15份;其混伪品样本27份,包含酸模叶蓼18份,春蓼9份。样品采自北京、吉林、四川、上海、福建、浙江等地,凭证标本经中国医学科学院药用植物研究所林余霖研究员及通化师范学院于俊林教授鉴定,并保存于中国医学科学院药用植物研究所。另外,从GenBank下载ITS2序列5条,分别为酸模叶蓼1条,水蓼4条。样本信息详见表1。

表1 样品信息
1.2 方法
1.2.1 DNA提取 分别取水红花子药材样本约40 mg(适当粉碎,加入样本量10%的PVP-40),硅胶干燥的基原植物叶片约20 mg,均用DNA提取研磨仪(Retsch MM400,Germany)研磨2 min(30次/s)后,利用植物基因组DNA提取试剂盒(Tiangen Biotech Co.,China)提取总DNA。
1.2.2 PCR扩增及测序 采用ITS2序列通用引物,正向ITS2F:5' -ATGCGATACTTGGTGTGAAT-3' ,反向ITS3R:5' -GACGCTTCTCCAGACTACAAT-3' 。扩增体系及程序参照“中药材DNA条形码分子鉴定指导原则”[32]。PCR扩增产物委托上海美吉测序公司进行双向测序。
1.2.3 数据处理 测序峰图利用CodonCode Aligner V3.7.1(CodonCode Co.,USA)校对拼接,去除引物区。将所获序列及GenBank下载序列采用基于隐马尔可夫模型的HMMer注释方法去除两端5.8 S和28 S区段获得ITS2间隔区序列[33]。将所有序列用软件MEGA5.1分析比对[34],并基于K2P模型进行遗传距离分析,用邻接(NJ)法构建系统聚类树,利用bootstrap(1 000次重复)检验各分支的支持率。
2 结果与分析
2.1 水红花子及其混伪品ITS2序列特征 水红花子基原物种红蓼44条ITS2序列的长度为245 bp,GC含量为66.9%~67.8%。红蓼序列间存在3个变异位点,分别为73位点A-G变异,133位点C-T变异,228位点G-A变异,分为6个单倍型。混伪品水蓼、酸模叶蓼以及春蓼ITS2序列长度分别为245 bp、250 bp和245 bp,GC含量为66.1%~68.0%。红蓼与水蓼、酸模叶蓼以及春蓼ITS2序列间存在较多的变异位点,详见图1。

图1 水红花子及其混伪品ITS2序列种间变异位点信息

表2 水红花子种内及与其混伪品种间K2P遗传距离
2.2 水红花子及其混伪品种内及种间遗传距离分析 将红蓼的ITS2序列进行遗传距离分析,种内最小遗传距离为0,最大遗传距离为0.0124。水蓼、酸模叶蓼以及春蓼ITS2序列种内遗传距离分别为0~0.0292、0~0.0040和0。红蓼与水蓼,红蓼与酸模叶蓼以及红蓼与春蓼之间的遗传距离分别为0.0334~0.0508、0.0668~0.0875、0.0379~0.0467。红蓼与其混伪品种间最小遗传距离大于红蓼种内最大遗传距离,说明采用ITS2序列可以将水红花子与其混伪品准确区分开。
2.3 构建NJ树鉴别水红花子及其混伪品从基于ITS2序列构建的NJ树图(图2)可以看出,红蓼单独聚为一支,支持率为87%,表现出单系性。混伪品水蓼、酸模叶蓼及春蓼各自聚为一支,明显与红蓼分开。因此,ITS2条形码可准确鉴别水红花子药材及其混伪品。
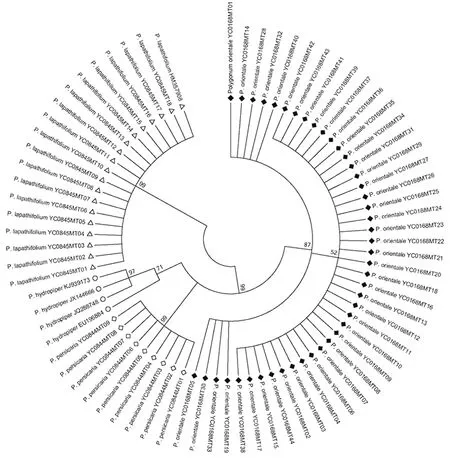
图2 基于ITS2序列构建的水红花子及其混伪品NJ树
3 讨论
3.1 水红花子药材样本亦可成功获得ITS2序列 DNA条形码技术有望实现对物种进行快速、准确、自动的识别和鉴定,在物种鉴定方面显示了广阔的应用前景,因此一经提出便受到了广泛关注。然而,由于加工、炮制、贮藏时间长等因素,常常导致中药材DNA降解严重,是否能成功获得条形码序列是很多专家关注的问题。研究表明许多中药材可成功获得条形码序列,如木香类药材[18]、党参[19]、柴胡[20]、羌活[21]、大青叶[22]、人参[23]、合欢花[24]、合欢皮[24]、五加皮[25]、红景天[26]、枸杞子[27]、秦艽[28]等。本研究中在提取水红花子药材样本的DNA时,增加了取样量(40 mg),是叶片样本用量的两倍,并且在研磨前加入样本量10%的PVP-40,结果PCR产物电泳后条带单一明亮,所有样本均可成功获得ITS2序列。据报道一些药材样品DNA降解特别严重,提取到的DNA经电泳后条带呈弥散状态,甚至有少数是不可见的,但PCR产物电泳后可显示出条带,并能成功测序[20-21,24]。就其原因,主要是ITS2序列较短,且在基因组内为多拷贝,降低了扩增和测序的难度,有利于鉴定DNA降解的药材样品,对于中药材DNA鉴定具有重要实践意义。
3.2 ITS2条形码是准确鉴定水红花子药材的好工具 鉴于ITS2序列具有较强的鉴定能力,Chen等提出将其作为药用植物鉴定的标准条形码[17],并将其推广应用于中药材鉴定研究中。罗焜等运用ITS2条形码对药材秦艽进行了鉴定研究,结果显示ITS2序列可有效鉴定秦艽药材及其混伪品[28]。辛天怡等研究了ITS/ITS2条形码对羌活药材鉴定的稳定性与准确性,结果表明ITS/ITS2序列可稳定、准确地鉴别羌活药材[21]。赵莎等应用ITS2序列对中药材五加皮及其混伪品进行鉴定研究,发现ITS2条形码可准确鉴别五加皮及其混伪品[25]。本研究应用ITS2条形码对水红花子进行鉴定研究。为确保研究的准确性和可重复性,收集了大量样本(共71份),其中水红花子正品样本44份,包含药材样本29份。通过对水红花子基原植物红蓼44条ITS2序列进行种内变异分析,发现红蓼ITS2序列种内遗传距离较小。种间变异分析表明红蓼与其混伪品ITS2序列间的遗传距离较大。红蓼与其混伪品种间最小遗传距离大于红蓼种内最大遗传距离。另外,从基于ITS2序列构建的NJ树可看出红蓼单独聚为一支,明显与其混伪品分开。因此,本研究显示ITS2条形码能够稳定、准确地鉴别水红花子药材及其混伪品,是鉴定水红花子的好工具。
3.3 运用DNA条形码技术鉴定中药材具有重要实践价值 近年来,随着分子生物学技术的迅猛发展,促进了DNA分子标记鉴定技术的诞生,目前已在中药鉴定领域中广泛应用,推动着中药鉴定技术不断进步和完善。DNA条形码是目前国际上物种鉴定的最新技术,与其他分子鉴定方法相比具有如下优势:鉴定结果可重复性良好;方法通用性强;可构建统一数据库和鉴定平台,易于推广和标准化[35]。目前该技术已在中药材鉴定领域广泛应用,大大加快了中药鉴定标准化的进程。水红花子为我国传统中药,据报道其同属植物酸模叶蓼、春蓼、水蓼等在不同地区被作为水红花子入药,严重影响其药材品质及疗效[4]。由于水红花子的混伪品来自同属近缘植物,药材形态近似,采用传统的鉴定方法通常会较为困难,只有具备丰富鉴别经验的专业人员才能准确地识别出混伪品,因此建立有效的水红花子鉴定方法十分必要。本研究采用ITS2条形码对其进行鉴定,可以准确便捷地鉴别水红花子与其混伪品,为水红花子药材的准确客观鉴定提供了新的技术手段。DNA条形码技术不仅可解决中药材的鉴定问题,而且非专业分类人员通过DNA条形码鉴定体系也可准确鉴定药材的正品及混伪品。鉴于DNA条形码技术的诸多优势,必将在今后的中药材鉴定、流通管理以及药材市场监管等领域发挥更大的作用。
[1]国家药典委员会.中华人民共和国药典2015版(一部)[S].北京:中国医药科技出版社,2015:83.
[2]张振明,雷晓燕,许爱霞,等.水红花子醇提物的抗脂质过氧化作用[J].中国药学杂志,2005,40(13):991-993.
[3]Wei Y,Chen X Q,Jiang X Y,et al.Determination of taxifolin in Polygonum orientale and study on its antioxidant activity[J].J Food Compos Anal,2009,22(2):154-157.
[4]翟延君.水红花子质量标准规范化研究[D].沈阳:辽宁中医药大学,2005.
[5]程飞.水红花子药效学及毒性实验研究[D].沈阳:辽宁中医药大学,2011.
[6]沈祥春,陶玲,王永林,等.注射用复方荭草冻干粉针剂对麻醉犬实验性心肌梗塞的保护作用[J].时珍国医国药,2007,18(3):539-541.
[7]陶玲,沈祥春,王永林,等.注射用复方荭草冻干粉针剂对兔离体心脏缺血再灌注损伤的保护作用[J].时珍国医国药,2006,17(9):1650-1652.
[8]沈丕安.中药药理与临床运用[M].北京:人民卫生出版社,2006:924-925.
[9]林启寿.中草药成分化学[M].北京:科学出版社,1977:282.
[10]杨志云,秦民坚,钱士辉.红蓼研究进展[J].中国野生植物资源,2008,27(1):11-15.
[11]刘娟,刘程诚,关力.红蓼的开发利用及研究进展[J].黑龙江医药,2012,25(4):542-544.
[12]李秀岚,李友莲.红蓼提取物对桃蚜拒食活性及触角电位的研究[J].山西农业大学学报,2005,25(3):228-230.
[13]胡冠芳,刘敏艳,沈慧敏,等.红蓼提取物对13种农业害虫触杀活性的研究[J].草业学报,2011,20(4):229-235.
[14]Wang L,Zhang J,Zhao R,et al.Adsorption of basic dyes on activated carbon prepared from Polygonum orientale Linn:Equilibium,kinetic and thermodynamic studies[J].Desalination,2010,254(1-3):68-74.
[15]Wang L,Zhang J,Zhao R,et al.Adsorption of 2,4-dichlorophenol on Mn-modified activated carbon prepared from Polygonum orientale Linn[J].Desalination,2011,266(1-3):175-181.
[16]Chen S L,Pang X H,Song J Y,et al.A renaissance in herbal medicine identification:From morphology to DNA[J].Biotechnol Adv,2014,32:1237-1244.
[17]Chen S L,Yao H,Han J P,et al.Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species[J].PLoS One,2010,5(1):e8613.
[18]马晓冲,姚辉,邬兰,等.木香、川木香、土木香、青木香和红木香药材的ITS2条形码分子鉴定[J].中国中药杂志,2014,39(12):2169-2175.
[19]赵莎,辛天怡,侯典云,等.党参药材及其混伪品的ITS/ITS2条形码鉴定研究[J].世界科学技术-中医药现代化,2013,15(3):421-428.
[20]于俊林,赵莎,任明波,等.基于ITS2条形码鉴定柴胡与大叶柴胡[J].中国中药杂志,2014,39(12):2160-2163.
[21]辛天怡,姚辉,罗焜,等.羌活药材ITS/ITS2条形码鉴定及其稳定性与准确性研究[J].药学学报,2012,47(8):1098-1105.
[22]孙稚颖,庞晓慧.基于DNA条形码技术探讨板蓝根及大青叶基原物种问题[J].药学学报,2013,48(12):1850-1855.
[23]Chen X C,Liao B S,Song J Y,et al.A fast SNP identification and analysis of intraspecific variation in the medicinal Panax species based on DNA barcoding[J].Gene,2013,530:39-43.
[24]赵莎,庞晓慧,宋经元,等.应用ITS2条形码鉴定中药材合欢皮、合欢花及其混伪品[J].中国中药杂志,2014,39(12):2164-2168.
[25]Zhao S,Chen X C,Song JY,et al.Internal transcribed spacer2 barcode:a good tool for identifying Acanthopanacis cortex[J].Front Plant Sci,2015,6:840.
[26]Xin T Y,Li X J,Yao H,et al.Survey of commercial Rhodiola products revealed species diversity and potential safety issues[J].Sci Rep,2015,5:8337.
[27]Xin T Y,Yao H,Gao H H,et al.Super food Lycium barbarum(Solanaceae)traceability via an internal transcribed spacer 2 barcode[J].Food Res Int,2013,54:1699-1704.
[28]罗焜,马培,姚辉,等.多基原药材秦艽ITS2条形码鉴定研究[J].药学学报,2012,47(12):1710-1717.
[29]Xiang L,Song J Y,Xin T Y,et al.DNA barcoding the commercial Chinese caterpillar fungus[J].FEMS Microbiol Lett,2013,347:156-162.
[30]Pang X H,Shi L C,Song J Y,et al.Use of the potential DNA barcode ITS2 to identify herbal materials[J].J Nat Med,2013,67:571-575.
[31]Hou D Y,Song J Y,Yao H,et al.Molecular identification of Corni Fructus and its adulterants by ITS/ITS2 sequences[J].Chin J Nat Med,2013,11(2):121-127.
[32]陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志,2013,38(2):141-148.
[33]Keller A,Schleicher T,Schultz J,et al.5.8S-28S rRNA interaction and HMM-based ITS2 annotation[J].Gene,2009,430:50-57.
[34]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[35]陈士林,郭宝林,张贵君,等.中药鉴定学新技术新方法研究进展[J].中国中药杂志,2012,37(8):1043-1055.
(2016-04-12收稿 责任编辑:洪志强)
Identification of Polygoni Orientalis Fructus and its adulterants using ITS2 barcode
Ren Li,Xin Tianyi,Guo Mengyue,Yao Hui,Pang Xiaohui
(InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100193,China)
Objective:The ITS2 barcode was used to identify Polygoni Orientalis Fructus and its adulterants in this study.Methods:For the accuracy of the identification,a total of 71 samples from Polygoni Orientalis Fructus and its adulterants were collected.The DNA was extracted from the samples and the ITS2 regions were amplified and sequenced.The sequences were then assessed and assembled using the CodonCode Aligner.The genetic distances and variable sites of ITS2 region were analyzed using MEGA after sequence alignment.Nearest distance and phylogenetic tree(NJ-tree)methods were used to test the identification efficiency of the ITS2 barcode.Results:The intraspecific genetic distances of Polygonum orientale were 0~0.0124,while the interspecific genetic distances between P.orientale and its adulterants were 0.0334~0.0508,0.0688~0.0875 and 0.0379~0.0467,respectively.The maximum intraspecific genetic distance of P.orientale was lower than the minimum interspecific genetic distance between P.orientale and its adulterants,which showed that ITS2 barcode could discriminate P.orientale and its adulterants accurately.Besides,the NJ tree based on ITS2 sequences supported that P.orientale and its adulterants can be easily differentiated.Conclusion:The ITS2 barcode is an effective tool for the identification of P.orientale and its adulterants.Our study may provide a new technique to ensure the production feeding security of traditional Chinese medicine.
Polygoni Orientalis Fructus; DNA barcoding; ITS2; Molecular identification
重大新药创制国家科技重大专项“中药新药安全性检测技术与标准研究”(编号:2014ZX09304307001);国家科技支撑计划(编号:2011BAI07B08)
任莉,在读硕士研究生,E-mail:renliwangyi@163.com
庞晓慧,博士,副研究员,主要研究方向:中药分子鉴定研究,Tel:(010)57833051,E-mail:xhpang@implad.ac.cn
R282.5
A
10.3969/j.issn.1673-7202.2016.01.007
