白芍饮片标准汤剂质量标准研究
2016-12-20朱广伟李西文陈士林
朱广伟 李西文 陈士林
(中国中医科学院中药研究所,北京,100700)
专题——现代生物学技术在中药资源研究中的应用
白芍饮片标准汤剂质量标准研究
朱广伟 李西文 陈士林
(中国中医科学院中药研究所,北京,100700)
目的:制备白芍饮片标准汤剂,并进行质量标准研究。方法:以水为溶剂,以标准化工艺制备标准汤剂,采用UPLC-DAD法测定芍药苷含量,并进行转移率、出膏率计算及指纹图谱研究。结果:10批次白芍样品制成的标准汤剂中芍药苷含量为1.69~2.60 mg/mL,转移率为60.47%~85.16%,平均转移率为71.62%,标准偏差为8.74%。出膏率范围为19.00%~26.50%,平均出膏率为21.89%,标准偏差为2.51%。指纹图谱共有峰11个,确认5个,分别是:氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、苯甲酰芍药苷。结论:本方法处理样品简单,重复性好,可用于白芍标准汤剂的制备及质量标准研究。
白芍;饮片;标准汤剂;指纹图谱
白芍为毛茛科植物芍药PaeonialactifloraPall.的干燥根,主产于安徽、浙江、四川、山东等地。白芍饮片呈圆形薄片,气微,味微寒、酸,含有芍药苷、芍药内酯苷、氧化芍药苷、苯甲酰芍药苷[1-5]等,具有养血调经,敛阴止汗,柔肝止痛[6-8],平抑肝阳的功效,用于治疗月经不调,胁痛,腹痛,四肢挛急[9-10]等症。本研究以市售5个产地(湖南、安徽、山东、浙江、四川)10批次白芍饮片为材料,以标准化工艺制备白芍饮片标准汤剂[11],考察含量、转移率、出膏率范围,及指纹图谱研究,为规范根及根茎类饮片的煎煮工艺流程,为白芍饮片标准汤剂质量标准的制定提供基础研究数据。
1 材料
1.1 仪器 Agilent 1290高效液相色谱仪,HP真空脱气泵,HP四元泵,HP自动进样,HP柱温箱,UPLC-DAD检测器;WRX-1S型BP110S电子分析天平;Thermo-18色谱柱(1.5 mm×210 mm,2.6 μm)。
1.2 受试药物 芍药苷(含量≥98%,批号130815),购自成都普菲德生物技术有限公司。白芍购自河北省安国药材市场,分别产自湖南(一等品至三等品)、安徽亳州(一等品至四等品)、浙江、山东、四川,经DNA条形码技术鉴定均为毛茛科植物芍药PaeonialactifloraPall.的干燥根。见表1。
2 方法
2.1 对照品溶液的制备 精密称取芍药苷对照品适量,加甲醇配制成含芍药苷0.54 mg/mL的对照品溶液,至于冰箱中,4 ℃保存,备用。
2.2 供试品溶液的制备
2.2.1 白芍饮片 乙醇提取液制备精密称取表1各批次白芍饮片5 g,按照2015版《中华人民共和国药典》制备各样品溶液。
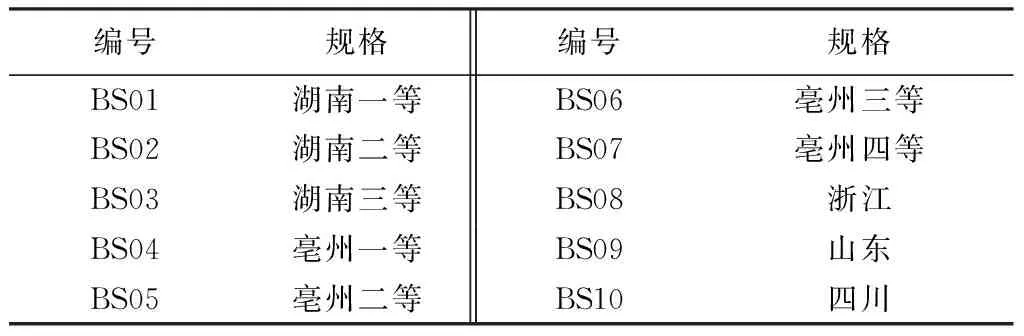
表1 样品来源
2.2.2 白芍饮片标准 汤剂的制备精密称取表1各批次白芍饮片100 g,分别加7倍量的水,先浸泡30 min,煮沸60 min,过滤分离出煎煮液,最后再加6倍量水煎煮40 min。合并煎煮液,浓缩成500 mL溶液,即浓度为0.2 g/mL的原药材溶液,取该浓缩液1 mL至10 mL的容量瓶中,用甲醇稀释至刻度,静置20 min,分出上清液,即得供试品,进样前用0.45 μm滤膜过滤。
2.3 色谱条件 色谱柱为Thormo-18色谱柱(2.1 mm×150 mm,2.6 μm);流动相为乙腈(B)-0.1%醋酸水溶液(A),梯度洗脱,0~6 min,5%~15%B,6~11 min,15%~20%B,11~15 min,20%~25%B,15~21 min,25%~40%B,21~26 min,40%~50%B,26~27 min,50%~95%B,体积流量0.4 mL/min,进样量3 μL,柱温30 ℃,检测波长为230 nm,色谱如见图1,图2。

图1 芍药苷对照品UPLC-DAD色谱图
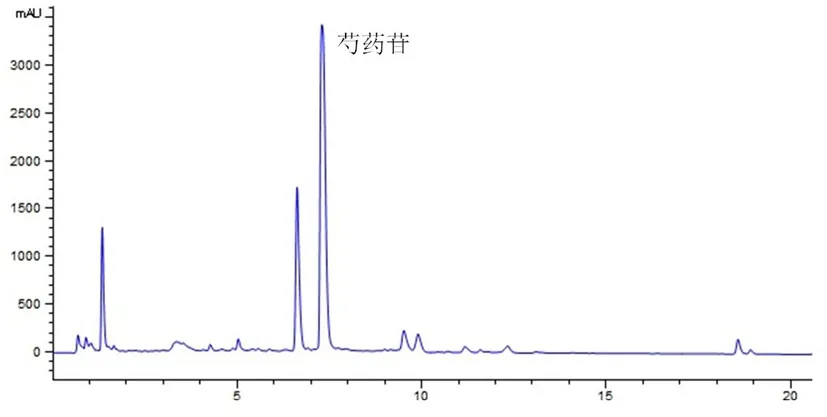
图2 白芍饮片标准汤剂UPLC-DAD色谱图
2.4 线性关系考察 精密吸取“2.1”中对照品溶液0.2 μL、0.4 μL、0.6 μL、0.8 μL、1.0 μL分别加到5 mL容量瓶中,定容至刻度。按2.3色谱条件测定各成分的峰面积,以峰面积积分值为纵坐标(Y),对照品进样量(μg)为横坐标(X),绘制标准曲线,计算回归方程,结果见图3。

图3 芍药苷标准曲线
2.5 精密度考察 取同一批白芍供试品溶液,按照2.3色谱条件进样,连续6次,测定并计算芍药苷峰面积的RSD值。RSD分别为0.4%,表明仪器精密度良好。见表2。
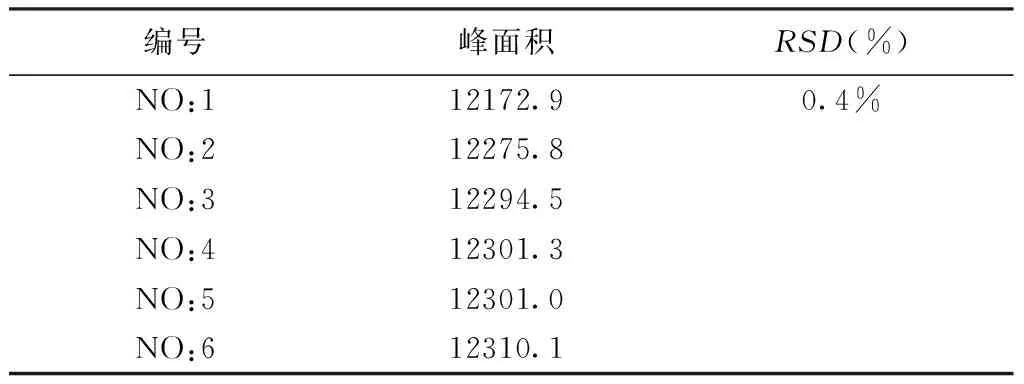
表2 精密度试验结果
2.6 稳定性试验 精密称取白芍饮片适量,制备供试品溶液,按照2.3色谱条件进样,分别于配制后0,4,8,10,12,24 h进样,测定并计算芍药苷峰面积的RSD值。RSD分别为1.3%,表明24 h内供试品溶液稳定性良好。见表3。

表3 稳定性试验结果
2.7 重复性实验 精密称取白芍饮片适量,平行制备6批次供试品溶液,按照2.3色谱条件进样,测定并计算芍药苷峰面积的RSD值。RSD为1.4%,表明本方法重复性良好。见表4。
2.8 加样回收率试验 精密称取同一批已知含量的供试品,分别精密加入等量药苷对照品,按照色谱条件测定含量,计算芍药苷的平均回收率为98.5%,RSD值为1.4%。见表5。
3 结果
3.1 转移率及出膏率考察
3.1.1 白芍饮片及标准汤剂中芍药苷含量测定 分别精密吸取2.2.1中各溶液1 μL进样,按照2.3色谱条件测定峰面积,根据外标法计算白芍饮片中芍药苷含量。见表6。
分别精密吸取2.2.2中供试品溶液各5 μL进样,按照2.3色谱条件测定峰面积,根据外标法计算标准汤剂中芍药苷含量,结果见表6。
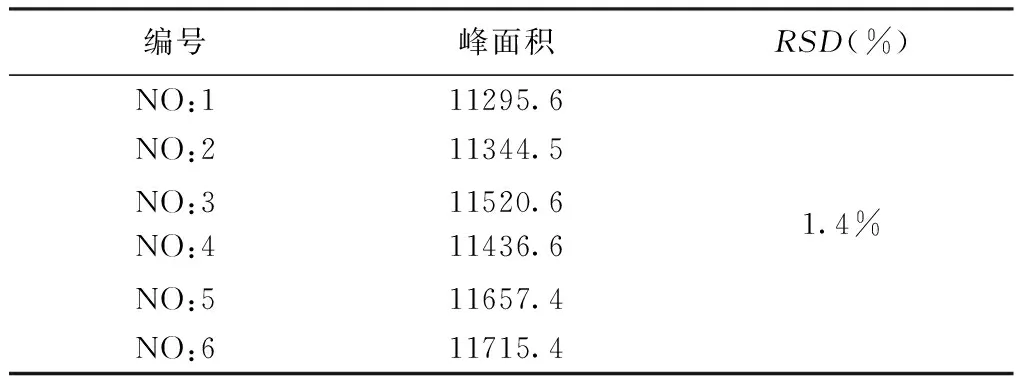
表4 重复性试验结果
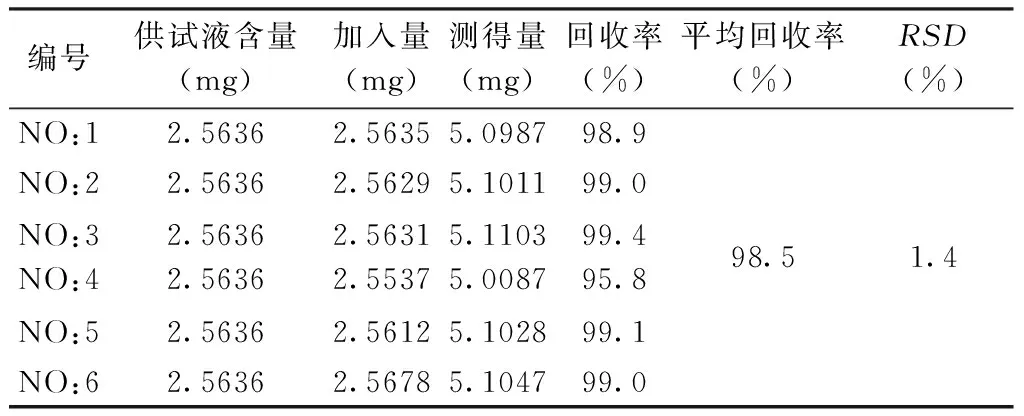
表5 加样回收率试验结果

表6 白芍饮片及标准汤剂中芍药苷含量
3.1.2 芍药苷转移率 根据3.1.1测定结果,按照转移率计算公式计算芍药苷转移率,转移率计算公式为:
转移率(%)=W(mg)/M(mg)×100%
注:W表示汤剂中芍药苷的量(mg),M表示饮片中芍药苷的量(mg)。
3.1.3 标准浸膏出膏率计算结果 精密吸取混合均匀的2.2.2供试品溶液10 mL于蒸发皿中,40 ℃真空干燥至恒重,称量重量,根据出膏率公式计算标准汤剂出膏率。见表8。
出膏率(%)=(w×V)/(v×M)×100%
注:M表示药材量(g),V表示中药饮片标准汤剂体积(mL),v表示取样体积(mL),w表示取样所得干膏量(g)。
表7 芍药苷转移率计算结果(±s)

表7 芍药苷转移率计算结果(±s)
样品编号转移率(%)x±sBS0177.96%BS0265.61%BS0375.29%BS0462.03%BS05BS0660.47%64.47%71.62%±8.74%BS0781.69%BS0876.51%BS0967.02%BS1085.16%
表8 标准汤剂出膏率计算结果(±s)
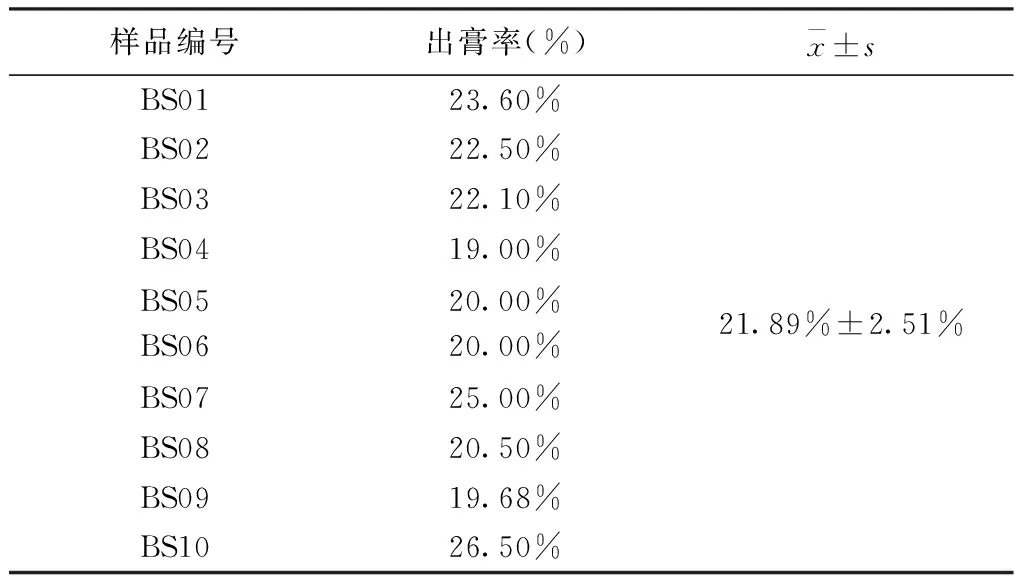
表8 标准汤剂出膏率计算结果(±s)
样品编号出膏率(%)x±sBS0123.60%BS0222.50%BS0322.10%BS0419.00%BS05BS0620.00%20.00%21.89%±2.51%BS0725.00%BS0820.50%BS0919.68%BS1026.50%
3.2 白芍饮片标准汤剂UPLC-DAD指纹图谱研究
3.2.1 指纹图谱的建立及共有峰的标定 按照“2.3”色谱条件分别将10批次白芍饮片标准汤剂供试品溶液进样分析,准确吸取各供试品溶液5 μL,注入UPLC记录色谱峰信息。见图4,生成的对照指纹图谱见图5。其中共有峰11个,通过UPLC-ESI-MS/MS指认5个,分别是1号峰:氧化芍药苷(Rt=4.661);2号峰:儿茶素(Rt=5.696);3号峰:芍药内酯苷(Rt=6.447);4号峰:芍药苷(Rt=7.102);11号峰:苯甲酰芍药苷(Rt=18.709)。见表9。

图4 10批白芍样品UPLC-DAD指纹图谱

图5 共有峰及其化学归属
3.2.2 相对保留时间及相对峰面积 对照指纹图谱中,以芍药苷色谱峰的保留时间和峰面积为1,计算各峰的相对保留时间和相对峰面积,结果见表10。3.2.3 指纹图谱相似度评价 运用“中药指纹图谱相似度评价系统(2004A版)”软件,经过数据导入,峰点校正和数据匹配,以中位数法建立对照指纹图谱。根据峰匹配结果,以峰面积为参数,计算出待测指纹图谱与对照图谱的整体相似度,结果表明,相似度均大于0.9,符合指纹图谱相似度要求。具体计算结果如下:S1:0.984;S2:0.978;S3:0.981;S4:0.984;S5:0.989;S6:0.987;S7:0.987;S8:0.988;S9:0.973;S10:0.981。
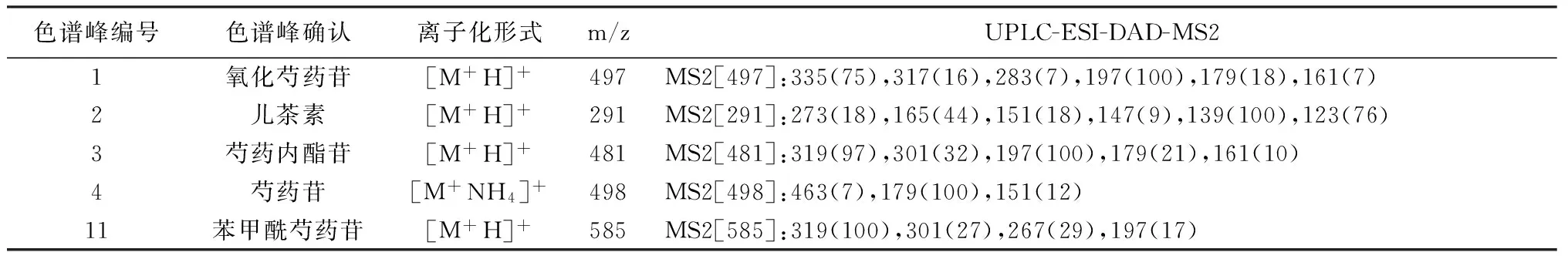
表9 主要色谱峰的归属
4 结果
通过对入选的10批次白芍进行含量测定,各批次的芍药苷含量均符合药典的要求(芍药苷含量≥1.2%),含量分别为:湖南一等1.48%、湖南二等1.29%、湖南三等1.22%、亳州一等2.07%、亳州二等2.01%、亳州三等1.91%、亳州四等1.59%、浙江1.34%、山东1.56%、四川1.52%。从数据看,各产地的白芍指标成分含量存在一定的差异,亳州一等质量最优,为药典最低值1.725倍。
选定的符合药典含量要求的白芍饮片(芍药苷含量1.34%~2.07%),按照标准化工艺制备成的标准汤剂指标成分含量为1.69~2.60 mg/mL,转移率为60.47%~85.16%,平均转移率为71.62%,标准偏差为8.74%。出膏率范围为19.00%~26.50%,平均出膏率为21.89%,标准偏差为2.51%。
通过分析可以看出,作为原材料的饮片,其质量优劣与汤剂含量、转移率、出膏率并无明显的线性关系(图6),通过比较发现,饮片的切制方式、质地疏松度也是影响这些指标的重要因素。因此,工业生产时,既要考虑到饮片质量,还要考虑到饮片的加工方式等因素。
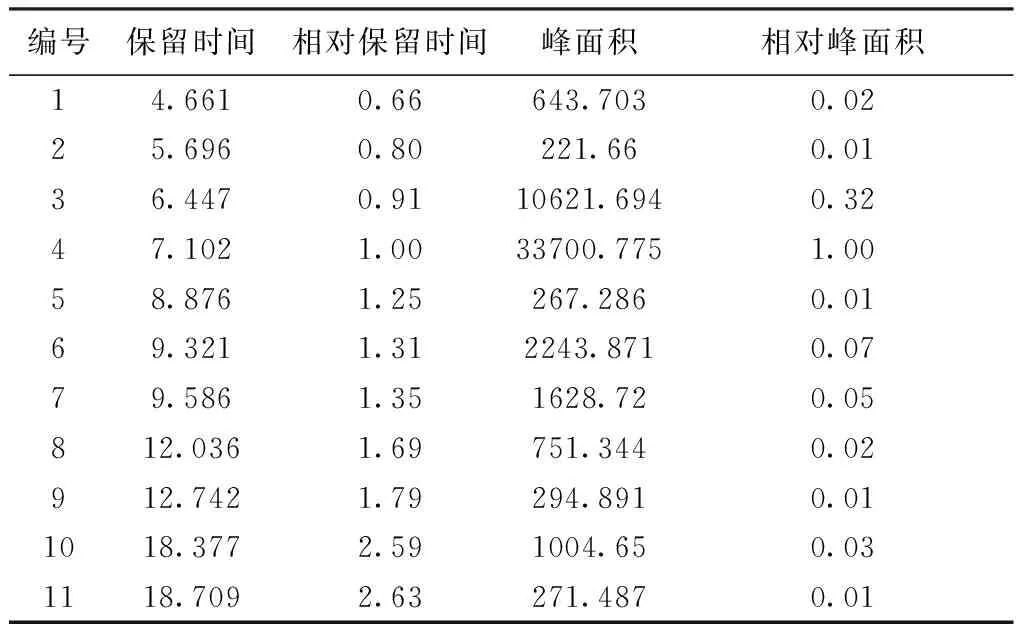
表10 各共有峰相对保留时间和相对峰面积
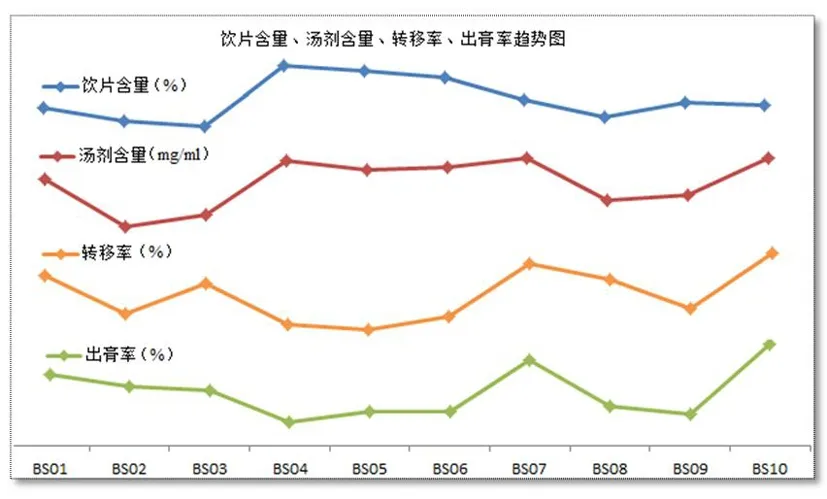
图6 饮片含量、汤剂含量、转移率、出膏率趋势图
通过对10批次白芍饮片标准汤剂的指纹图谱研究发现,汤剂的指纹图谱相似度较高,均达到0.9以上,共有峰总计11个,确认5个,包括氧化芍药苷、儿茶素、芍药内酯苷、芍药苷、苯甲酰芍药苷,5个峰的相对保留为0.66∶0.80∶0.91∶1.00∶2.63;相对峰面积为0.06∶0.01∶0.32∶1.00∶0.01。
5 讨论
中药饮片标准汤剂作为一种标准物质和标准体系,是对传统汤剂煎煮工艺的传承和创新,传统汤剂在煎煮时一般没有固定的加水量、煎煮时间、浓缩体积等,大多根据经验操作,如《伤寒论》中有记载:“……右二味,以水三升,煮取一升五合……”;又有记载“……右六味,以水七升,煮取三升……”,传统煎煮方法也没有明确的时间计量,一般以加水量及浓缩体积来控制煎煮时间,如将三升水煎煮至一升五合时即可停止煎煮,以此进行时间计量,这种粗略的计算原则不利于中药现代化,更无法保证汤剂质量标准的制定及临床给药剂量的均一性。现代煎煮规范虽对不同部位、不同功效的饮片加水量、煎煮时间作了细化,如加水量“浸过药面2~5 cm”,煎煮时间“一般药物20~30 min;解表、清热、芳香类15~20 min;滋补类40~60 min;二煎时间比头煎略缩短”,但数值范围较宽,容易受人为因素影响而产生较大误差。
中药饮片标准汤剂既传承了按照药用部位的不同,设计不同层次的加水量,如:根及根茎类饮片首煎加7倍水,二煎加6倍水。同时也根据功效的差异及饮片的特质设计不同煎煮时间,如:一般饮片,头煎30 min,二煎20 min;对于质地坚硬、滋补类饮片,头煎60 min,二煎40 min,从根本上解决了工艺不统一的问题,解决了以往因煎煮工艺的不同,而导致用药剂量无法统一的现状,为规范根及根茎类饮片的煎煮工艺流程,为白芍饮片标准汤剂质量标准的制定提供基础研究数据。同时,中药饮片标准汤剂对于生产配方颗粒具有重要的指导作用,对于同种饮片,由于给定了具体的操作规范,可以从根本上减少不同批次、不同厂家间产品的差异,确保质量的均一性,保障了用药安全及临床疗效。
[1]金林,赵万顺,郭巧生,等.白芍饮片的化学成分测定及质量评价[J].中国中药杂志,2015,40(3):484-489.
[2]李岩.白芍及其化学成分的药理研究进展[J].职业与健康,2015,31(15):2153-2156.
[3]李震宇,范玛莉,秦雪梅.基于NMR代谢组学技术的白芍及其醋制品的化学比较[J].药学学报,2015,50(2):211-217.
[4]方新华,吴鑫,曹岗,等.白芍和白术配伍麸炒前后主要化学成分变化HPLC分析(英文)[J].Journal of Chinese Pharmaceutical Sciences,2015,24(4):231-235.
[5]张亮.白芍加工炮制对其化学成分的影响研究[J].中国科技博览,2015,24(16):397-397.
[6]闫亚超,冷伟.白芍除痹止痛临床应用浅探[J].四川中医,2015,33(4):42-44.
[7]戴淑萍,颜勤明.白芍总苷在心血管疾病模型动物中的药理研究进展[J].中国药房,2015,26(10):1418-1420.
[8]王红权,詹杰.白芍总苷治疗类风湿关节炎药理作用及机制[J].医药导报,2015,34(2):199-201.
[9]田林,邵智,王海凌.白芍的现代炮制研究[J].时珍国医国药,2003,14(11):697-698.
[10]蒋国强,杨水新,叶勇.RP-HPLC法测定生白芍免煎饮片中芍药苷[J].Chinese Traditional and Herbal Drugs,2007,38(8):1190-1191.
[11]陈士林,刘安,李琦,等.中药饮片标准汤剂研究策略[A].世界中医药学会联合会中药新药创制专业委员会成立大会暨第一届学术年会论文集[C].世界中医药学会联合会中药新药创制专业委员会,2016:24.
(2016-04-12收稿 责任编辑:洪志强)
Quality standard research on standard decoction of paeonialactiflora
Zhu Guangwei,Li Xiwen,Chen Shilin
(InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicinalSciences,Beijing100700,China)
Objective:To study the preparation and quality standard of the standard decoction of paeonia lactiflora.Methods:The standard decoction of paeonia lactiflora was preparated with water by using standardization method and the content of peoniflorin was determined by UPLC-DAD.Then calculate the transfer rate,the rate of extractum and carry on the research of fingerprint.Results:The content of paeoniflo-rin in 10 batches of standard decoction of paeonia lactiflora is 1.69~2.60 mg/mL,the transfer rate is 60.47%~85.16%,the average transfer rate is 71.62% and the standard deviation is 8.74%.The rate of extractum is 19.00%~26.50%,the average yield is 21.89% and the standard deviation is 2.51%.There were 11common peaks,5 of which were identified,including oxypaeoniflorin,catechins,albiflorin,paeoniflorin and benzoylpaeoniflorin.Conclusion:The method is simple with good repeatability,and it can be used to study the preparation of the standard decoction of paeonia lacti-flora.
Paeonia lactiflora; Medicinal slices; Standard decoction; Fingerprint
中国中医科学院综合性大平台项目(编号:Z2014003-05)
朱广伟,博士,助理研究员,研究方向:中药药效物质基础研究、中药药效组分评价体系研究,E-mail:gwzhu@icmm.ac.cn
陈士林,博士研究生导师,主要从事中药资源学研究,Tel:(010)57203877,E-mail:slchen@icmm.ac.cn
R284.1
A
10.3969/j.issn.1673-7202.2016.01.001
