维甲酸诱导成釉细胞瘤细胞分化的研究*
2016-12-20雷印涛王旭霞
雷印涛 王旭霞 孙 钢
(1.泰山医学院附属医院口腔科,山东 泰安 271000; 2.山东大学口腔医学院口腔颌面外科,山东 济南 250012;3.浙江大学医学院附属第二医院口腔颌面外科,浙江 杭州 310009)
维甲酸诱导成釉细胞瘤细胞分化的研究*
雷印涛1王旭霞2孙 钢3
(1.泰山医学院附属医院口腔科,山东 泰安 271000; 2.山东大学口腔医学院口腔颌面外科,山东 济南 250012;3.浙江大学医学院附属第二医院口腔颌面外科,浙江 杭州 310009)
目的 探讨全反式维甲酸对成釉细胞瘤细胞分化的影响。方法 实验采用10-4M,10-5M,10-6M三种浓度梯度的全反式维甲酸对原代培养的成釉细胞瘤细胞进行48小时,4天,5天,7天四个阶段的体外诱导实验。利用MTT,流式细胞术和透射电镜技术对细胞的增殖,细胞周期和凋亡的改变进行检测。结果 发现ATRA10-6M组作用5天效果最好,增殖抑制率31%,细胞S期减少13%,提高了静止期细胞数,凋亡指数由初始细胞的8.7%升高到39.3%,细胞形态也发生相应变化。结论 维甲酸可能促进成釉细胞瘤细胞诱导分化的作用。
全反式维甲酸;成釉细胞瘤;分化
成釉细胞瘤作为最常见的牙源性肿瘤,具有局部浸润性生长等恶性肿瘤的特征,属临界肿瘤,但罕见转移,多见于青壮年,目前主要治疗手段是外科治疗,手术切除后复发率较高,这与其生长方式有关,为了减少复发,常常需要扩大切除范围,给患者的容貌和口腔功能造成很大的破坏。因此有必要从其发生发展的分子生物学基础上进行深入研究,认识疾病机制,探索新的有效防治方法。维甲酸具有调节上皮细胞生长、分化的功能,通过细胞核内DNA结合蛋白调节有关基因的表达而发挥其生物学效应。临床上常用于粘膜、皮肤病的治疗。国内外学者应用其进行了大量的细胞诱导分化实验,包含干细胞、神经细胞、上皮细胞、成骨细胞,以及牙周膜细胞、成纤维细胞和成釉细胞等诸多方面,取得了满意的效果[1-4]。成釉细胞瘤细胞是上皮细胞,类似于幼稚的未成熟的前成釉细胞和星网状层细胞,分化水平保持在牙胚发育的帽状期/钟状期,具备向正常细胞转化的潜能。本实验应用全反式维甲酸诱导成釉细胞瘤分化,检测其生物学性状的变化。
1 材料与方法
1.1 原代培养成釉细胞瘤细胞,选取第二代细胞
1.1.1 在超净工作台内将取材标本在双抗瓶中取出,放入无血清的培养基中5 min,将组织块剪成小块,直至成0.5 mm2大小为止。加入4.5 ml含10%胎牛血清的DMEM培养液,加0.5 mlⅠ型胶原酶(2000 u/ml),盖好橡胶塞,放在37 ℃水浴中消化4 h,用吸管反复吹打,使大部分组织块自然下沉,然后将细胞悬液移入消毒的离心管中,离心1000 r/min 8 min,吸去上清,加入6 ml DMEM培养基,吹打混匀,取样计数。
1.1.2 接种培养 用Ⅰ型胶原铺底的25 ml培养瓶接种1 ml细胞悬液,加4 ml 培养液,盖紧瓶塞,放入37 ℃ 5% CO2恒温恒湿箱中孵育。培养3天后观察,5天换液,以后每隔3天换一次培养液,同时每天观察细胞形态,有无污染。
1.1.3 细胞传代培养 加入5滴0.25%胰蛋白酶,转动培养瓶,使其侵过整个瓶底,室温下放置3 min,反转瓶子,观看细胞单层,如出现小孔状间隙,再消化1 min。加入3 ml培养液中止消化,用吸管吸取培养液反复冲击瓶底的细胞层,直至细胞全部被冲下,再轻轻吹打混匀,制成单细胞悬液,然后吸取1 ml悬液加入新的25 ml培养瓶中。原瓶留下1 ml细胞悬液,并向每个瓶中加培养液5 ml,盖好瓶塞,放入37 ℃恒温箱中孵育。
1.1.4 光镜下观察,免疫组化研究(免疫组织化学SABC法)进行角蛋白CK-18,CK-19、波形蛋白、bcl-2抗体的免疫组化实验。
1.2 诱导分化后的形态学观察 用含体积分数为0.1%的无水乙醇的DMEM对照液将全反式维甲酸(ATRA)稀释成10-4,10-5,10-6mol/L(M)浓度后,加入已培养24 h的细胞培养液中,分别于48 h、4天,5天,7天,在倒置相差显微镜下观察实验组和对照组肿瘤细胞的形态变化。
1.3 MTT法检测细胞抑制率
1.3.1 实验组分别加入终浓度10-4、10-5、10-6mol/L三种不同浓度去全反式维甲酸。对照组加入DMEM(含体积分数为0.1%的无水乙醇)。加药后2、4、5、7 天各取一板,每孔加入(5 mg/ml)的四甲基偶氮唑盐(MTT)20 μl, 150 μl的二甲亚砜(DMSO) 。酶联免疫检测仪检测,波长为570 nm,测定各孔光吸收值,记录结果。
1.3.2 统计学检验 应用SPSS18.0统计分析软件,计量资料描述用均数±标准差表示,以方差分析进行统计分析,P≤0.05具有统计学意义。
1.4 流式细胞仪检测 根据MTT检测结果,选择最高和最低浓度组进行流式细胞仪检测。第二代细胞的培养瓶中加入终浓度10-4M、10-6M两种不同浓度全反式维甲酸,对照组加入DMEM(含体积分数为0.1 %的无水乙醇)。收集维甲酸处理5天的成釉细胞瘤细胞,加1 ml 50 mg/ml碘化丙碇(PI)综合染液。在4 ℃ DNA染色20 min,离心,在Elite ESP型流式细胞仪(Coulter公司)上检测,激光光源为氩离子激光,波长488 nm,检测前以标准微球液核准仪器使其变异系数(CV)<2%,测出各标本DNA含量,以G0/G1前期亚2倍峰为凋亡峰,通过FCM-Elite随机软件进行分析计算出各值。
1.5 透射电镜观察 根据维甲酸对成釉细胞瘤细胞诱导的MTT法和FCM检测结果,选择作用效果最好的维甲酸浓度10-6M组为实验组,作用瘤细胞5天,收集同期对照组和药物处理后的细胞。日立H-600IV型透射电镜观察、照像。
2 结 果
2.1 病理结果 肉眼见标本约7 cm×9 cm大小,位于下颌角和升支,浸润骨组织,骨吸收明显,肿瘤表面包膜不完整,剖面有囊性和实性混合存在,实性区灰白色,取实性区。切片HE染色光镜下见肿瘤上皮形成多个上皮岛,中心由多边或多角形细胞构成,细胞间疏松连接,有囊液,周边围绕柱状和立方状细胞,细胞栅栏状排列,核极性倒置,岛间夹杂一些中间层和成纤维细胞,有玻璃样变(图1)。

图1 滤泡型成釉细胞瘤病理切片(HE)由类似牙囊的肿瘤细胞岛组成,岛中央囊性变
2.2 原代培养细胞生长特点
2.2.1 第一代成釉细胞瘤细胞形态 原代培养8天后,成釉细胞瘤细胞围绕组织块呈铺路石子样紧密排列,形态多边形(图2)。

图2 第一代AM细胞形态 200×
2.2.2 第二代细胞形态 第一代培养1周后,成釉细胞瘤细胞布满瓶底90%左右,形态正常,进行消化传代,一传二。肿瘤细胞出现少量小的多角细胞,有些散在分布在簇外,形态稍长,多边形,胞核大,有少量细胞出现空泡性变,主要在簇中位置,悬浮的死亡细胞稍增多,成纤维细胞也开始增多(图3)。
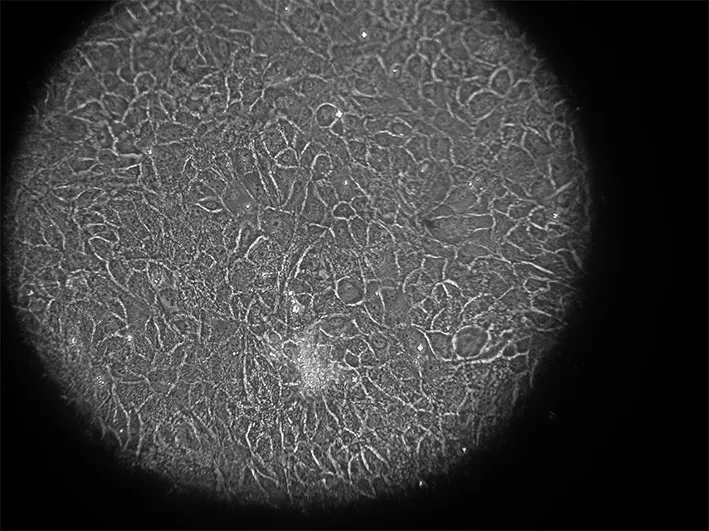
图3 AM细胞第二代形态 200×
2.3 免疫组化结果 先用HE染色定位细胞,瘤细胞成簇生长,周围有散在分布的少量成纤维细胞(图4)。成釉细胞瘤细胞属于上皮细胞,镜下示扁平多角形,对上皮特异性抗体角蛋白18、19表达阳性,在胞浆染色黄色,胞核不着色(图5,6)。波形蛋白主要是间叶组织抗体,肿瘤细胞不染色,表达阴性(图7)。在肿瘤细胞周围存在的成纤维细胞是间质细胞,染色正好相反,角蛋白抗体染色阴性,而波形蛋白抗体染色呈阳性。Bcl-2抗体是凋亡抗体,表达阳性(图8)。
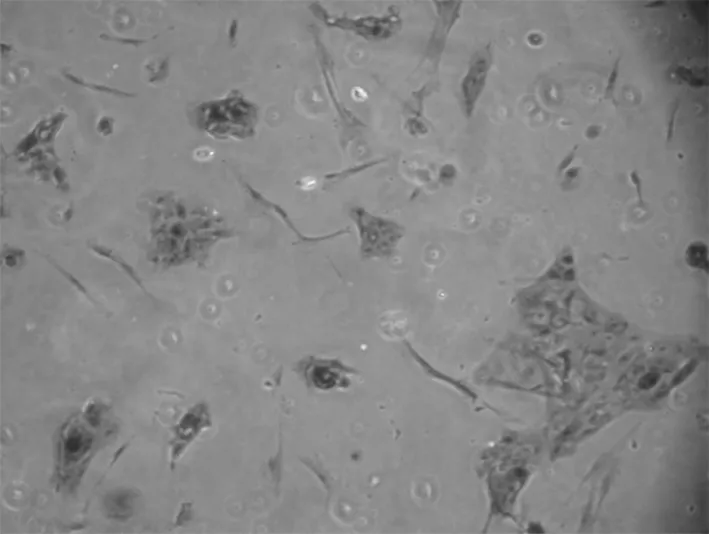
图4 HE染色定位细胞 200×
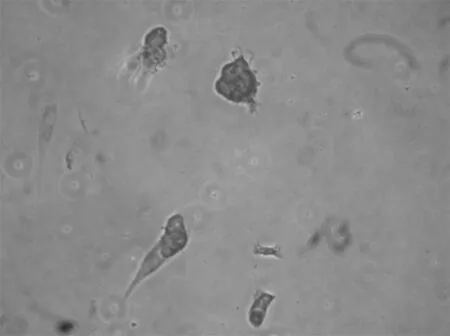
图5 角蛋白18染色阳性 200×

图6 角蛋白19染色阳性 200×
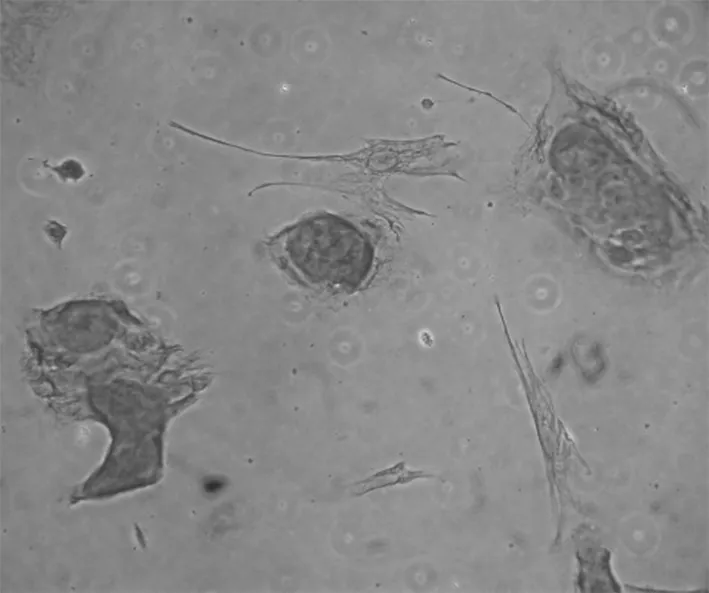
图7 波形蛋白染色阴性 200×
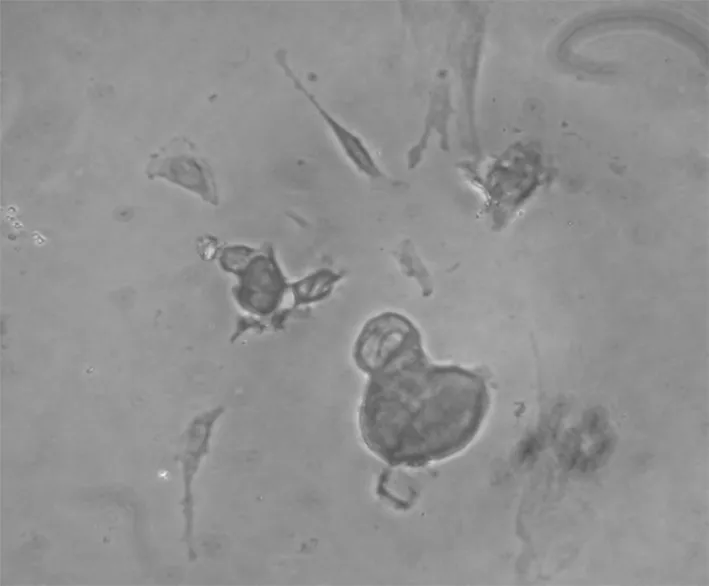
图8 bcl-2染色阳性 200×
2.4 MTT结果 成釉细胞瘤细胞生长慢,3种浓度维甲酸处理48 h细胞生长抑制率变化不明显,浓度组间差异明显,10-6M抑制效果最好,而10-4M组效果最差。随时间延长,抑制率逐渐提高,在作用5天后,抑制作用达到最高峰,各组都有显著提高,仍是10-6M浓度组抑制效果最好,成釉细胞瘤细胞生长减慢,主要是坏死细胞增多,细胞量减少。形态由立方形向长星形转化,用药组转化慢。第7天抑制率又明显下降,各组间差别不显著。见表1~4。

表1 ATRA对AM细胞诱导作用48 h的OD值及抑制率
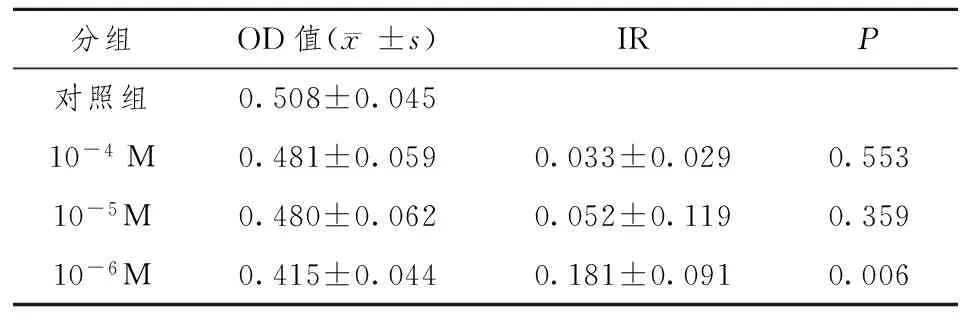
表2 ATRA对AM细胞诱导作用4天的OD值及抑制率
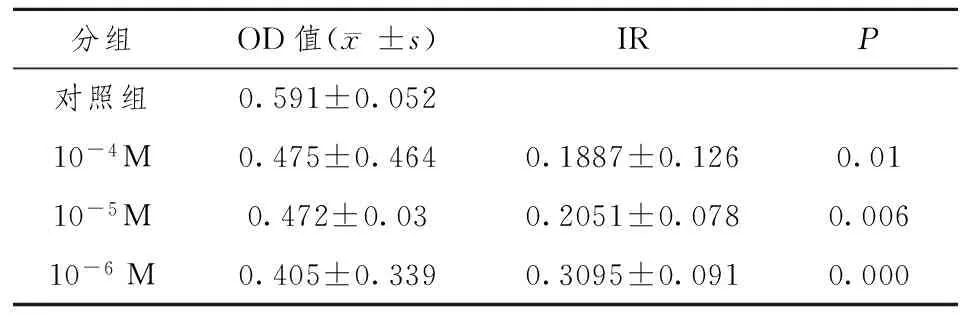
表3 ATRA对AM细胞诱导作用5天的OD值及抑制率

表4 ATRA对AM细胞诱导作用7天的OD值及抑制率
2.5 流式细胞仪检测结果 根据MTT结果,我们发现在维甲酸诱导第5天,增殖抑制效果最好,其中又以10-6M组效果最佳,而10-4M组效果最差。我们选取维甲酸效果最好与最差两个浓度组细胞,即10-6M和10-4M,作为实验组,添加0.1%无水乙醇的成釉细胞瘤细胞作为对照组,诱导第5天进行流式细胞仪检测细胞周期和凋亡情况。发现10-6M组细胞S期和G2/M期细胞数都减少,相应G1期细胞数增多。10-4M组变化不明显,和对照组没有差异。见表5。
2.6 超微结构观察 在透射电镜下观察,成釉细胞瘤细胞核较大,不规则,有深核沟,核内以常染色质为主,胞浆内核糖体、粗面内质网丰富,胞浆内见少量微丝,糖原丰富。经过维甲酸诱导后细胞核膜完整,核呈椭圆形,线粒体清楚,结构好,糖原少,微丝多,粗面内质网扩张,形态向正常细胞转化。见图12,13。

表5 ATRA对AM细胞诱导作用5天的SPF值及PI
三组的凋亡指数AI有明显差异,10-6M组最高为39.3%,10-4M组为10.7%,而对照组最低为8.7%。见图9~11。
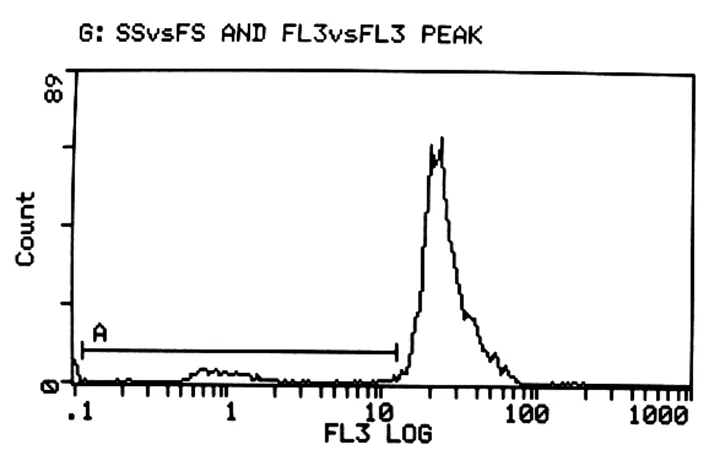
图9 对照组细胞凋亡指数8.7%
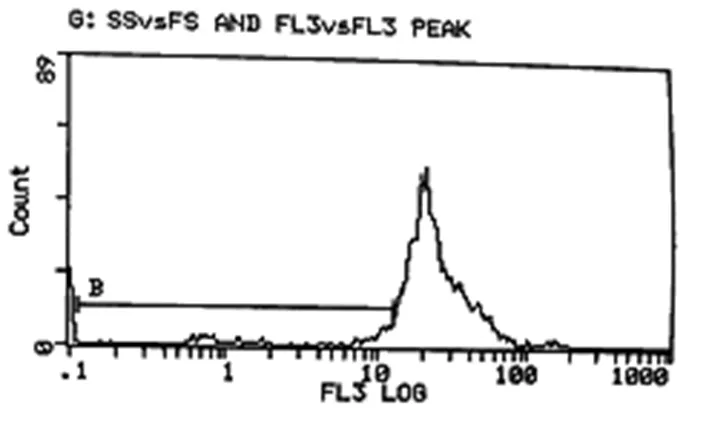
图10 10-4M组细胞凋亡指数10.7%

图11 10-6M组细胞凋亡指数为39.3%
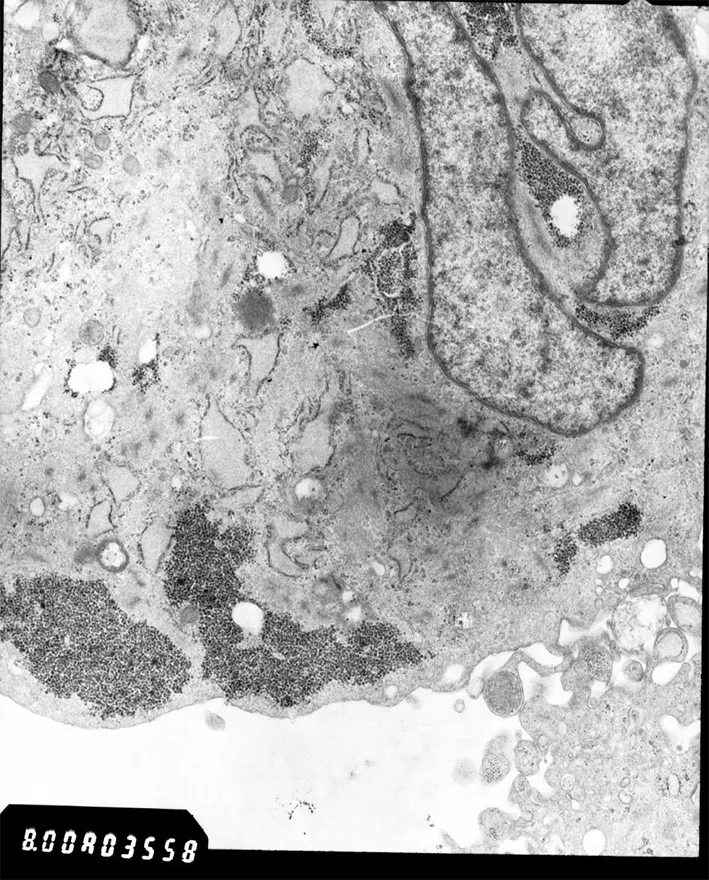
图12 透射电镜观察AM细胞细胞核较大,不规则,有深核沟,核糖体、粗面内质网丰富,微丝少,糖原丰富。

图13 透射电镜观察经维甲酸处理的AM细胞,核膜完整,核呈椭圆形的,线粒体结构好,微丝多,糖原少,粗面内质网扩张。
3 讨 论
维甲酸(ratinoic acid,RA)是维主素A的衍生物,通过细胞核上不同受体产生包括细抱分化、代谢等多种生物学效应。维甲酸系统具有大量不同的靶基因,发挥转录和非转录等多种作用。维甲酸受体可以分为两大类:维甲酸受体(RAR)和维甲类X受体(RXR),都属于核受体超家族。正常情况下,RAR和RXR形成异二聚体,与靶基因启动子部位的特定序列-维甲酸反应元件特异地结合而发挥功能[5]。维甲酸与RARα结合,改变其构象,导致共抑制因子复合物从RARα上解离,使共激活因子与其结合,激活转录。由此转录合成的一些调节蛋白又可以激活下游的基因表达,这样就形成一个连锁反应,最后维甲酸介导的信号就被传递到庞大的信息网络中,产生极其多样化的生物学效应[6]。1987年我国首次报导应用全反式维甲酸治疗急性早幼粒细胞白血病(APL)获得成功,在肿瘤领域掀起了研究其机制的高潮。维甲酸在胚胎发育、细胞分化、内环境稳定中发挥多种作用。维甲酸具有不同的生物效应,可以调整成骨细胞的增殖、牙周膜细胞分化为成牙骨质细胞和成骨细胞形成矿化组织。研究[7]表明,维甲酸类化合物可能通过调节蛋白激酶C(PKC)和蛋白激酶A(PKA)途径,影响细胞内信号传导系统,进而影响细胞内mRNA和蛋白质的合成,在诱导肿瘤细胞向正常细胞分化中发挥作用。
通过MTT实验发现,维甲酸针对成釉细胞瘤(AM)细胞,可以使其增殖减弱,抑制增殖作用在第5天最强,三个浓度梯度组中,尤以10-6M组最明显,达到31%,10-4M组作用最弱。我们继而选择这两个浓度梯度组进行下一步流式细胞仪(FCM)的检测,发现维甲酸诱导成釉细胞瘤5天后,细胞周期改变,静止期细胞增多,合成期及分裂期细胞减少,改变幅度不大,平均降低15%左右,这可能与AM细胞增殖活力不强有关。更重要的是凋亡细胞数明显增加,促进了肿瘤细胞的凋亡,经过诱导后肿瘤细胞的凋亡率从8.7%升到39.3%,作用非常显著。AM细胞浸润生长特性与抑制凋亡有关,通过抑制凋亡有可能会改变成釉细胞生长特性。实验证实维甲酸的不同浓度产生不同的效应,10-6M浓度产生的诱导作用最强,增加浓度反而降低了效应。另外还与作用时间有关,诱导48 h没有产生明显效果,5天效果最好,以后就逐渐减弱,这与药物效力和肿瘤细胞对其耐受有关。细胞分化主要表现在形态和功能两个方面。形态分化是细胞分化的表形特征, 也是最基本的特征,能客观地反应分化诱导剂对细胞的诱导分化作用。透射电镜观察发现成釉细胞瘤细胞核较大,不规则,有核沟,胞浆内核糖体、粗面内质网丰富,胞浆内见少量微丝,糖原丰富,表明瘤细胞活性大,蛋白合成旺盛。经过维甲酸诱导后细胞核膜完整,核呈椭圆形,线粒体清楚,结构好,糖原少,微丝多,粗面内质网扩张,形态向正常细胞转化,合成作用减弱,活性减低。
[1] Natsuko Shibuya, Eiji Nemoto, Sousuke Kanaya,et al.Retinoic acid is a potential negative regulator for differentiation of human perio-dontal ligament cells[J]. International Congress Series,2005,1284:217-218.
[2] Asma Hatoum, Marwan Eid El-Sabban, Joe houry,et al.Overex-pression of retinoic acid receptors alpha and gamma into neoplastic epidermal cells causes retinoic acid-induced growth arrest and apoptosis[J].Carcinogenesis,2001,22(12):1955-1963.
[3] Michaela Kneissel, Anne Studer, Reto Cortesi,et al Retinoidinduced bone thinning is caused by subperiosteal osteoclast activity in adult rodents[J]. Bone,2005,36: 202-214.
[4] 宋维铭,孙广慈,管正玉,等.维甲酸对成纤维细胞作用的体外观察[J].中华医学美容杂志,1998,4(4):190-192.
[5] Huang D. Chen SW. Gudas LJ. Analysis of two distinct retinoic acid response elements in the homeobox gene Hoxb1 in transgenic mice[J]. Developmental Dynamics, 2002,223(3):353-370.
[6] 孙宇强,王雪,关兴芳, 等.维甲酸及其受体与肿瘤关系的研究进展[J].生命科学,2014,26(3):295-297.
[7] 洪凡青,陈飞虎,吴菲,等.新型维甲酸衍生物ATPR体外诱导消化系统肿瘤细胞分化的研究[J].肿瘤防治研究,2011,38(12):1375-1379.
Role of retinoic acid in the differentiation of ameloblastoma cells
LEI Yin-tao1WANG Xu-xia2SUN Gang3
(1.Affiliated Hospital of Taishan Medical University, Taian 271000, China;2.School of Stomatology, Shandong University,Jinan 250012,China;3.Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, China)
Objective: To explore the affection of all-trans retinoic acid (ATRA) in progression and occurrence of the ameloblastoma. Methods: Primacy AM cells were cultivated. The cells' morphous and growth were observed, and detected with specific antibody. AM cell was induced by ATRA(10-4M,10-5M,10-6M)for two, four, five and seven days. By phase-contrast microscopy, transmission electron microscope, MTT, FCM and immunohistochemistry, the proliferation index, growth inhibittion ratio, cell cycle and apoptotic index were obtained. Results: AM cells in primary culture maintained epithelial cell morphology and expressed cytokeratins K18 and K19, but none expressed vimentin. Furthermore, bcl-2 protein, which prevented apoptosis, was expressed. AM cells underwent senescent within twenty-eight days. Time course and dose response had the effect on ATRA induced AM cells activity. Treated with 10-6M ATRA for five days, the effect on the differentiation of AM cell was the most significant. Proliferative activity of AM cell decreased and growth inhibition ratio was 31%. After being induced, the cell population of S stage was reduced and the cells of G0 stage were increased. Meanwhile, the apoptosis was obviously increased from 8.7% to 39.3%. Conclusion: ATRA can promote AM cells' morphological to be changed, and induce them differentiate to normal cell.
ATRA; ameloblastoma; induce
高等院校博士点新教师基金(20070335042)。
雷印涛(1969—),男,副教授,主要从事口腔科教学和临床工作。
孙钢,E-mail:sungang531@163.com。
R782
A
1004-7115(2016)11-1205-05
10.3969/j.issn.1004-7115.2016.11.002
2016-06-20)
