海洋酸化对水生动物骨骼和耳石钙化、生长发育的影响与机理
2016-12-20许友卿王宏雷刘永强丁兆坤
许友卿,王宏雷,刘永强,丁兆坤
( 广西大学 水产科学研究所,广西高校水生生物健康养殖与营养调控重点实验室,动物科学科技学院,广西 南宁 530004 )
海洋酸化对水生动物骨骼和耳石钙化、生长发育的影响与机理
许友卿,王宏雷,刘永强,丁兆坤
( 广西大学 水产科学研究所,广西高校水生生物健康养殖与营养调控重点实验室,动物科学科技学院,广西 南宁 530004 )
海洋酸化;骨骼;耳石;钙化;生长;水生动物
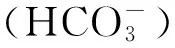
20世纪末,有学者就开始研究海洋酸化对海洋生物的影响[4],并取得了可喜进展,当前主要集中于两个方面:(1)海洋酸化对于钙化海洋生物,主要是钙化浮游生物、珊瑚、软体动物、头足类等[5-8]矿化作用的影响;(2)海洋酸化对一些海洋生物的行为、生理机能如呼吸代谢、嗅觉、摄食、游泳等的影响[9-11]。然而,海洋酸化多方面影响海洋生物,且多为负面[12]。大量研究已证实,海洋酸化显著影响多种海洋动物的受精、发育、生物钙化、基因表达等生命活动[13]。水生动物的钙化骨骼系统由内骨骼和其他骨质结构如耳石等组成。钙化生物对海洋酸化最敏感,对海洋生态系统和海洋经济至关重要,因而研究海洋酸化对生物钙化作用的影响及机理具有重要的现实意义。
目前关于生物钙化的研究主要集中于某些无脊椎动物、低等钙质藻类等[14]。鲜见海洋酸化对海洋鱼类的生物矿化作用的影响研究,而海洋鱼类对海洋生态系统和海洋经济非常重要。
笔者主要综述了海洋酸化对水生动物,特别是鱼类骨骼和耳石钙化、生长发育的影响与机理,为全面评估、深入理解和研究海洋酸化的影响提供信息,为控制、预防海洋酸化,保护海洋生态环境和海洋生物提供参考。
1 海洋酸化对水生动物骨骼钙化、生长发育的影响
水生动物,尤其是硬骨鱼类的骨骼系统是构成机体的重要部分,它可以支撑机体、运动、保护身体,还储存钙、磷等矿质元素,维持体内矿物质平衡,具有重要的生长和存活意义。
海洋酸化影响水生动物内骨骼的生长发育。Campbell[15]发现,海洋酸化导致河鳟(Salmotrutta)尾部生长畸形,畸形程度与pH变化几近成正比。Fraser等[16]报道,George 湖酸化(pH=4.65)使白亚口鱼(Catostomuscommersonn)近尾部脊椎骨的平均长度短于另外3个pH近中性湖中的同种鱼,部分鱼的尾鳍畸形。这些异常鱼骨的矿物质流失,其平均钙含量(9.44 mg/g干质量)显著低于另外3个近中性湖的同种鱼(11.18 mg/g干质量)。Steingraeber等[17]发现,暴露于pH=5.0的美洲红点鲑(Salvelinusfontinalis)全鱼钙含量下降,骨骼结构骨化延迟,生命早期阶段的骨骼异常。Perry等[18]报道,暴露在二氧化碳分压为1200 μatm~2600 μatm(1 μatm=0.101325 Pa)环境中8周,门齿鲷(Stenotomuschrysops)生长、存活没有显著影响,但是其骨骼骨化程度略高于空气对照组,耳石也随着二氧化碳的含量升高而增大。
海洋酸化影响水生动物内骨骼的矿物元素代谢。Ishimatsu等[19]在实验室条件下,以pCO2=330 μatm为对照,逐步将pCO2由470 μatm升至1660 μatm养殖135 d,发现高pCO2下大西洋鲑(Salmosalar)的骨中Ca、P比例较高,还有较高的骨骼重构现象,但经X射线检验没有形态学差异。Munday等[20]发现,多刺棘光鳃鲷(Acanthochromispolyacanthus)幼鱼在不同pCO2(397、551、741 μatm和1036 μatm)条件下,29种主体骨架结构中有3种(眼骨、尾前脊椎骨、第二尾脊椎骨)长度不同,但差异不显著。多重比较检验表明,这些差异不是由pCO2含量差异引起。James等[21]报道,直接降低水体pH后,斑点叉尾(Ictaluruspunctatus)血液中pH和升高不显著,对Ca2+或含量的影响也不显著,但骨钙流出增加。也有研究表明,海水pH降低和温度升高显著影响水生动物血细胞免疫学相关指标,具体表现为透明细胞钙离子含量增加而颗粒细胞钙离子含量降低,间液中游离钙离子含量增加,表明海洋酸化和温度升高对生物矿化有负调控作用[22]。Mu等[23]研究表明,二氧化碳导致海水酸化(pH=7.6和7.2)对黑点青鳉(Oryziasmelastigma)胚胎孵化率无显著影响,但pH 7.2组的仔鱼骨骼畸形率(25%)显著高于对照组(10%)。Frommel等[24]研究表明,大西洋鲱(Clupeaharengus)初孵仔鱼暴露在高含量CO2(4204.3 μatm)环境中39 d,与对照组(380 μatm)相比,鳍软组织变大,骨骼和软骨结构异常,甚至畸形;个体体长的平均长度(18 mm)比对照组(20 mm)缩短10%。Depasquale等[25]发现,海洋酸化(pH=7.4)也会导致美洲原银汉鱼(Menidiaberyllina)和北美鳉(Cyprinodonvariegatus)体长比对照组(pH=7.9)减少15%~45%,这表明海洋酸化可导致水生动物内骨骼发育异常。

值得关注的是,暴露于高pCO2的鱼骨矿物质和2D骨容量较高。高pCO2导致大西洋鲑鳃和肠道吸收钙、磷量增加,骨骼其他部分的矿元素代谢增强。肠道吸收是体内磷的主要来源,骨是由钙和磷矿化而来,而CO2触发骨代谢增加,以提供足够的磷酸盐,防止矿化降低和骨骼畸形[28]。
鱼类对海洋酸化的反应不如其他钙化生物敏感。海洋酸化导致其他海洋钙化生物的碳酸钙饱和度下降而严重影响生物钙化活动;其他海洋钙化生物的钙化结构一般位于体表,直接暴露于海水中的高pCO2环境中,更易受海洋酸化的影响;其他海洋钙化生物缺乏海洋鱼类那样高效的酸碱平衡调节机制,因此,对海洋酸化的影响比鱼类敏感得多[20,26]。
磷是鱼类体内pH值缓冲系统的重要组成部分,在应对外界pH值变化过程中起重要作用。鱼类矿化器官和组织主要沉积磷酸钙是鱼类对酸化不敏感的原因之一[14]。
2 海洋酸化对水生动物耳石钙化、生长发育的影响
海洋鱼类不是主要的钙化者,但膜迷路中的耳石碳酸钙占99%以上,主要为文石或球文石等亚稳定状态的碳酸钙结晶[29-30]。与鱼骨、鳞片和牙齿相比,鱼耳石是最容易受到海洋酸化影响的矿化器官[14]。耳石的主要作用是探测、维持平衡和听声音等,还是鉴定鱼类年龄、生活史、种属和生长的重要依据,研究海洋酸化对海洋鱼类耳石生长、形态及相关功能的影响具有重要意义[30-32]。
当前主要发现:(1)海洋酸化增加鱼类耳石的钙化程度,耳石表面积及直径增加;(2)海洋酸化对耳石的生长没有显著影响。例如,Munday等[33]发现,小丑鱼(Amphiprionpercula)在pH=7.6,pCO2=1721 μatm下耳石面积和直径比对照组(pH=8.15,pCO2=404 μatm)有所增加。Bignami等[34-35]报道,于pCO2=800 μatm下,军曹鱼(Rachycentroncanadum)微耳石、矢耳石面积显著大于(高至25%)对照组(300 μatm),耳石相对质量增加14%以上;pCO2=2100 μatm组耳石体积增加49%,相对质量增加58%,耳石密度增加6%。Maneja等[36]发现,大西洋鳕(Gadusmorhua)于pCO21800 μatm和4200 μatm下,耳石平均面积大于对照组(370 μatm),最大相差83.8%。Clemmesen等[37]研究表明,高CO2含量(1000 mg/kg)下,大西洋鳕稚鱼耳石大小和增长速度明显高于对照组,但对其稚鱼的生长发育没有负面影响。Checkley等[38]研究发现,提高CO2含量的情况下,同规格的鲈鱼(Atractoscionnobilis)仔鱼(7~8 日龄)的耳石增大,长度增加7%~9%;随着pCO2(430 μatm~2500 μatm)的升高,石首鱼(Atractoscionnobilis)的耳石面积也不断变大,pCO2=2500 μatm最大,比对照组(430 μatm)增加116%。Hurst等[39]研究表明,在pCO2=450 μatm环境中6周,黄线狭鳕(Theragrachalcogramma)耳石钙化速率增加7.2%,但不影响其耳石元素组成;而pCO2=1805 μatm组的耳石长度比对照鱼增加了50%。Schade等[40]研究表明,暴露在海洋酸化(pCO2=1000 μatm)环境中90 d,可抑制三刺鱼(Gasterosteusaculeatus)的生长发育,其体长比对照组低53%,但耳石面积比对照组大20%,耳石比对照组质量增加6%。Bignami等[41]研究表明,在pCO2=2170 μatm暴露21 d的鲯鳅(Coryphaenahippurus)仔鱼的耳石面积比对照组(pCO2=450 μatm)显著增大,耳石长度由110 μm增至125 μm,宽度由76 μm增至85 μm,面积由6500 μm2增至7800 μm2。Freeburg等[42]研究表明,克氏双锯鱼(A.clarkii)和白条双锯鱼(A.frenatus),暴露于不同的pCO2的条件下,随着pCO2升高,这两种鱼的圆形矢耳石呈现长方形变化。
然而,Munday等[20]报告,CO2(pCO2450~850 μatm)对多棘雀鲷(Acanthochromispolyacanthus)稚鱼耳石大小、形状和对称性等没有显著影响。Mu等[23]研究表明,CO2导致海水酸化(pH=7.6和7.2)抑制了黑点青鳉仔鱼耳石的生长,其中pH=7.6组的耳石平均面积(6500 μm2)显著小于对照组(7500 μm2);但在极端pH(7.2)情况下,耳石平均面积增加,为6800 μm2。
海洋酸化影响鱼类耳石生长发育,改变其形态和大小,进而损伤鱼类感官和运动机能[43]。Simpson等[44]发现,小丑鱼幼鱼在pCO2600、700、900 μatm下对珊瑚声音的响应显著低于对照组(pCO2390 μatm)。CO2含量提高到700 mg/kg时,4 d后小丑鱼仔鱼的行为与对照组显著不同[45],近50%的仔鱼失去摄食和躲避敌害的能力,而在850 mg/kg下,所有仔鱼从第2天就失去躲避捕食的能力。Branch等[46]也指出,海水pH的降低能够损伤某些经济鱼类的感觉器官,降低这些鱼类的存活率。pCO2=2100 μatm下军曹鱼听觉范围比对照组(300 μatm)降低了50%[35],这些变化可能会影响其听觉的灵敏度,增加二氧化碳分压,改变军曹鱼对听觉信息的感知。
3 海洋酸化对水生动物骨骼和耳石钙化、生长发育的影响机理
Hamilton等[47]研究表明,海水酸化(pCO2=1125 μatm,pH=7.75)可影响斑马鱼体内γ-氨基丁酸A型受体(GABAA受体),抑制其受体功能,影响鱼类的嗅觉、捕食,乃至耳石大小。与对照组相比,斑马鱼脑部GABAA受体含量明显降低。
海洋酸化导致鱼类神经递质传递障碍而影响其骨骼、耳石的生长发育及功能[48]。Mizuno等[49]研究发现,重力感应缺陷的青鳉突变体在耳石发育过程中,囊状耳石钙化紊乱。
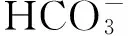
海洋酸化通过影响海洋动物的反馈补偿机制而影响其钙化。研究表明,耳石增大可能是鱼类自身所具有的酸碱调节能力,通过反馈补偿机制而增加了耳石内淋巴可获得的碳酸盐含量,因此,加速了耳石在酸性条件下的矿化过程[52]。
海洋酸化通过改变金属离子的形态和分子亲和力而影响海洋动物钙化。Réveillac等[53]认为,耳石增大是高含量CO2可促进耳石的钙化过程。在酸性条件下,某些化学元素,如金属和非金属都可以代替钙参与耳石钙化。二氧化碳增加引起的pH值降低和海水化学变化可以改变金属离子的形态和分子亲和力,促进水生动物对微量元素的吸收,从而影响其生物利用度,影响耳石的生长和化学组成[23]。
海洋酸化正以不同的方式影响着不同物种的钙化[27,54-56]。然而,海洋酸化对海洋动物尤其是鱼类内骨骼、耳石生长发育及钙化过程的影响及机理研究还处于起始阶段,许多问题尚待探讨。
[1] Sabine C L, Feely R A, Gruber N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305(5682):367-371.
[2] Kump L R, Bralower T J, Ridgwell A. Ocean acidification in deep time[J]. Oceanography (Washington D.C.), 2009, 22(4):94-107.
[3] Zhai W D, Zheng N, Huo C, et al. Subsurface pH and carbonate saturation state of aragonite on the Chinese side of the North Yellow Sea: seasonal variations and controls[J]. Biogeosciences, 2014, 11(4):1103-1123.
[4] Kleypas K A, Buddemeier R W, Archer D, et al. Geochemical consequences of increased atmospheric carbon dioxide on coral reefs[J].Science, 1999, 284(5411):118-120.
[5] Hannisdal B, Henderiks J, Liow L H.Long-term evolutionary and ecological responses of calcifying phytoplankton to changes in atmospheric CO2[J]. Global Change Biology, 2012,18(12):3504-3516.
[6] Comeau S, Carpenter R C C, Edmunds P J.Coral reef calcifiers buffer their response to ocean acidification using both bicarbonate and carbonate[J]. Proc R Soc B, 2012, 280(1753):2012-2374.
[7] Barton A, Hales B, George G, et al. The Pacific oyster,Crassostreagigas, shows negative correlation to naturally elevated carbon dioxide levels: implications for near-term ocean acidification effects [J]. Limnol Oceanogr, 2012, 57(3):698-710.
[8] Gutowska M A, Pörtner H O, Melzner F. Growth and calcification in the cephalopodSepiaofficinalisunder elevated seawater pCO2[J]. Mar Ecol Prog Ser, 2008, 373:303-309.
[9] 丁兆坤, 李虹辉, 许友卿. 海洋酸化对海洋生物呼吸代谢的影响及机制[J]. 饲料工业, 2012, 23(20):15-17.
[10] Munday P L, Dixson D L, Donelson J M,et al. Ocean acidification impairs olfactory discrimination and homing ability of a marine fish [J]. PNAS, 2009, 106(6):1848-1852.
[11] Chan K Y K, Grünbaum D, O′Donnell M J. Effects of ocean-acidification-induced morphological changes on larval swimming and feeding [J]. The Journal of Experimental Biology, 2011, 214(4):3857-3867.
[12] Kroeker K J, Kordas R L, Crim R N, et al. Meta-analysis reveals negative yet variable effects of ocean acidification on marine organisms[J]. Ecol Lett, 2010, 13(11):419-1434.
[13] 赵信国, 刘广绪. 海洋酸化对海洋无脊椎动物的影响研究进展[J]. 生态学报, 2015, 7(7):2388-2398.
[14] 刘洪军, 张振东, 官曙光,等. 海洋酸化效应对海水鱼类的综合影响评述[J]. 生态学报, 2012, 10(10):3233-3239.
[15] Campbell R N B. Tail deformities in brown trout from acid and acidified lochs in Scotland[G]//Mainland P S, Lyle A A, Cample R N B. Acidification and fish in Scottish lochs. Grange-over-Sands. Institute of Terrestrial Ecology, 1987:54-63.
[16] Fraser G A, Harvey H H. Elemental composition of bone from white sucker (Catostomuscommersoni) in relation to lake acidification [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1982, 39(9):1289-1296.
[17] Steingraeber M T, Gingerich W H. Hatching, growth, ion accumulation, and skeletal ossification of brook trout (Salvelinusfontinalis) alevins in acidic soft waters [J]. Canadian Journal of Zoology, 1991, 69(8):2266-2276.
[18] Perry D M, Redman D H, Widman J C, et al. Effect of ocean acidification on growth and otolith condition of juvenile scup,Stenotomuschrysops[J]. Ecology & Evolution, 2015, 5(18):4187-4196.
[19] Ishimatsu A, Hayashi M, Kikkawa T. Fishes in high-CO2, acidified oceans [J]. Mar Ecol Prog Ser, 2008(373):295-302.
[20] Munday P L, Gagliano M, Donelson J M. Ocean acidification does not affect the early life history development of a tropical marine fish [J]. Mar Ecol Prog Ser, 2011(423):211-221.
[21] James B Y, Cameron N. The bone compartment in a teleost fish,Ictaluruspunctatus:size, composition and acid-base response to hypercapnia[J]. J Expt Biol, 1985(117):307-318.
[22] 李世国, 刘阳嘉, 刘闯,等. 合浦珠母贝血细胞分类及其对海洋酸化与暖化的响应[G]//中国海洋湖沼学会:“全球变化下的海洋与湖沼生态安全”学术交流会论文摘要集,南京:中国海洋湖沼学会, 2014.
[23] Mu J, Jin F, Wang J, et al. Effects of CO2-driven ocean acidification on early life stages of marine medaka (Oryziasmelastigma)[J]. Biogeosciences Discussions, 2015, 12(1):1-20.
[24] Frommel A Y, Rommel M, David L, et al. Organ damage in Atlantic herring larvae as a result of ocean acidification[J]. Ecological Applications A Publication of the Ecological Society of America, 2014, 24(5):1131-1143.
[25] Depasquale E, Baumann H, Gobler C. Vulnerability of early life stage Northwest Atlantic forage fish to ocean acidification and low oxygen [J]. Marine Ecology Progress, 2015(523):145-156.
[26] Witten P E, Huysseune A, Hall B K. A practical approach for the identification of the many cartilaginous tissues in teleost fish [J]. J Appl Ichthyology, 2011(26):257-262.
[27] Edmunds P J, Brown D, Moriarty V. Interactive effects of ocean acidification and temperature on two scleractinian corals from Moorea, French Polynesia[J]. Global Change Biology, 2012, 18(7):2173-2183.
[28] Gil-Martens L, Witten P, Fivelstad S, et al. Impact of high water carbon dioxide levels on Atlantic salmon smolts (SalmosalarL.): effects on fish performance, vertebrae composition and structure[J]. Aquaculture, 2006, 261(1):80-88.
[29] 史方, 孙军, 林小涛,等. 唐鱼仔鱼耳石的形态发育及日轮[J]. 动物学杂志, 2006, 41(4):10-16.
[30] Payan P, Pontua H D, Boeuf G, et al. Endolymph chemistry and otolith growth in fish [J]. C R Palevo, 2004(3):535-547.
[31] Tohse H, Mugiya Y. Sources of otolith carbonate: experimental determination of carbon incorporation rates from water and metabolic CO2, and their diel variations [J]. Aquat Biol, 2008(1):259-268.
[32] Maneja R H. Influence of ocean acidification on otolith calcification and behavior in fish larvae [D]. Published PhD dissertation, Kiel: Kiel University, 2012.
[33] Munday P L, Hernaman V, Dixson D L, et al. Effect of ocean acidification on otolith development in larvae of a tropical marine fish [J]. Biogeosciences, 2011(8):1631-1641.
[34] Bignami S, Sponaugle S, Cowen R K. Response to ocean acidification in larvae of a large tropical marine fish,Rachycentroncanadum[J]. Global Change Biology, 2013, 19(4):996-1006.
[35] Sean B, Enochs I C, Manzello D P, et al. Ocean acidification alters the otoliths of a pantropical fish species with implications for sensory function[J]. Proceedings of the National Academy of Science, 2013, 110(18):7366-7370.
[36] Maneja R H, Frommel A Y, Geffen A J, et al. Effects of ocean acidification on the calcification of otoliths of larval Atlantic codGadusmorhua[J]. Marine Ecology Progress, 2013, 477(1):251-258.
[37] Clemmesen C, Stiasny M, Sswat M, et al. Ocean acidification and warming afect survival and growth of Atlantic cod (Gadusmorhua) larvae [G]//Aalto E, Aarestrup K, Aas-Hansen, et al. Quebec, Canada:American Fisheries Society 144th Annual Meeting, 2014.
[38] Checkley D M Jr,Dickson A G,Takahashi M,et al. Elevated CO2enhances otolith growth in young fish [J].Science,2009,324(5935):1683.
[39] Hurst T P, Fernandez E R, Mathis J T, et al. Resiliency of juvenile walleye pollock to projected levels of ocean acidification [J]. Aquatic Biology, 2012, 17(3):247-259.
[40] Schade F M, Clemmesen C, Wegner K M. Within- and transgenerational effects of ocean acidification on life history of marine three-spined stickleback (Gasterosteusaculeatus)[J]. Marine Biology, 2014, 161(7):1667-1676.
[41] Bignami S, Su S, Cowen R K. Effects of ocean acidification on the larvae of a high-value pelagic fisheries species, mahi-mahiCoryphaenahippurus[J]. Aquatic Biology, 2014(21):249-260.
[42] Freeburg W, Eric D. Exploring the link between otolith growth and function along the biological continuum in the context of ocean acidification [D]. Boston, USA:University of Massachusetts Boston,2014.
[43] 许友卿, 张仁珍, 丁兆坤. pH对鱼类繁育及生长发育的影响[J]. 水产科学, 2014, 33(2):133-136.
[44] Simpson S D, Munday P L, Wittenrich M L, et al. Ocean acidification erodes crucial auditory behaviour in a marine fish[J]. Biol Lett, 2011(7):917-920.
[45] Munday P L,Dixson D L,Donelson J M,et al. Ocean acidification impairs olfactory discrimination and homing ability of a marine fish (Plectropomusleopardus)[J].Proceedings of the National Academy of Sciences of the United Stated of America,2009,106(6):1848-1852.
[46] Branch T A, Dejoseph B M. Impacts of ocean acidification on marine seafood [J]. Trends in Ecology & Evolution, 2013, 28(3):178-186.
[47] Hamilton T J, Holcombe A, Tresguerres M. CO2-induced ocean acidification increases anxiety in rockfish via alteration of GABAA receptor functioning [J]. Proceedings of the Royal Society of London B Biological Sciences, 2014, 281(1775):536.
[48] Nilsson G E, Dixson D L, Domenici P, et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function[J]. Nature Climate Change, 2012(2):201-204.
[49] Mizuno R, Jiri K. Otolith formation in a mutant medaka with a deficiency in gravity-sensing [J]. Adv Pace Res, 2003, 32(8):1513-1520.
[50] Jokiel P L. Ocean acidification and control of reef coral calcification by boundary layer limitation of proton flux[J]. Bull Mar Sci, 2011, 87(3):639-657.
[51] Tohse H, Murayama E, Ohira T, et al. Localization and diurnal variations of carbonic anhydrase mRNA expression in the inner ear of the rainbow trout,Oncorhynchusmykiss[J]. Comparative Biochemistry and Physiology Part B, 2006(145):257-264.
[52] Moya A, Tambutté S, Bertucci A, et al. Carbonic anhydrase in the scleractinian coralStylophorapistillata[J]. Journal of Biological Chemistry, 2008(283):25475-25484.
[53] Réveillac E, Lacoue-Labarthe T, Oberhänsli F, et al. Ocean acidification reshapes the otolith-body allometry of growth in juvenile sea bream[J]. Journal of Experimental Marine Biology & Ecology, 2015(463):87-94.
[54] Saderne V, Wahl M. Effect of ocean acidification on growth, calcification and recruitment of calcifying and non-calcifying epibionts of brown alga[J]. Biogeosciences Discuss, 2012, 9(3):3739-3766.
[55] Catarino A L, Ridder C D, Gonzalez M, et al. Sea urchinArbaciadufresnei(Blainville 1825) larvae response to ocean acidification[J]. Polar Biology, 2012, 35(3):455-461.
[56] Bednaršek N, Tarling G A, Bakker D C E, et al. Description and quantification of pteropod shell dissolution: a sensitive bioindicator of ocean acidification [J]. Global Change Biology, 2012, 18(7):2378-2388.
EffectofOceanAcidificationonCalcificationandGrowthofEndoskeletonandOtolithinAquaticAnimals
XU Youqing, WANG Honglei,LIU Yongqiang, DING Zhaokun
( Institute for Fishery Sciences, Key Laboratory of Healthy Breeding and Nutritional Regulation of Aquatic Animals, Faculty of Animal Sciences and Technology, Guangxi University, Nanning 530004, China )
ocean acidification; endoskeleton; otolith; calcification; growth; aquatic animal
10.16378/j.cnki.1003-1111.2016.06.025
S917
A
1003-1111(2016)06-0741-06
2015-11-09;
2016-01-08.
国家自然科学基金资助项目(31360639);广西生物学博士点建设项目(P11900116,P11900117);广西自然科学基金资助项目(2012GXNSFAA053182,2013GXNSFAA019274,2014GXNSFAA118286,2014GXNSFAA118292);广西科技项目(1298007-3).
许友卿(1958—),女,教授,博士生导师;研究方向:环境生物学、水生动物营养、生理、生化和分子生物学.E-mail:zhaokund@hotmail.com.通讯作者:丁兆坤(1956—),男,教授,博士生导师;研究方向:环境生物学、水生动物营养、生理、生化和分子生物学.E-mail:youqing.xu@hotmail.com.
