丁香酚的分离及其杀多子小瓜虫活性研究
2016-12-20姚嘉赟袁雪梅蔺凌云尹文林潘晓艺郝贵杰沈锦玉
姚嘉赟,徐 洋,袁雪梅,蔺凌云,尹文林,潘晓艺,郝贵杰,沈锦玉
( 浙江省淡水水产研究所,农业部淡水渔业健康养殖重点实验室,浙江省鱼类健康与营养重点实验室,浙江 湖州,313001 )
丁香酚的分离及其杀多子小瓜虫活性研究
姚嘉赟,徐 洋,袁雪梅,蔺凌云,尹文林,潘晓艺,郝贵杰,沈锦玉
( 浙江省淡水水产研究所,农业部淡水渔业健康养殖重点实验室,浙江省鱼类健康与营养重点实验室,浙江 湖州,313001 )
利用不同极性大小的溶剂石油醚、乙酸乙酯、氯仿、甲醇回流提取丁香制备粗提物,进行杀灭多子小瓜虫幼虫和包囊的药效活性追踪,确定丁香杀虫的活性部位为石油醚提取部分,进而利用硅胶柱层析和中压制备液相等分离技术结合活性追逐试验追踪分离丁香石油醚提取物(对多子小瓜虫幼虫和包囊的100%致死质量浓度分别为50 mg/L和80 mg/L),最终分离获得一种杀虫活性物质,经质谱、核磁氢谱、核磁碳谱等多种波谱分析技术确定该活性物质为丁香酚。体外杀虫结果表明,丁香酚对多子小瓜虫具有较强的杀灭作用,其对幼虫15 min、1 h、2 h、3 h和4 h的半数致死质量浓度分别为6.21 (5.85~6.65) mg/L、3.50 (3.24~3.84) mg/L、2.90 (2.62~3.22) mg/L、2.33 (2.10~2.50) mg/L 和2.15 (1.98~2.32) mg/L,对幼虫4 h的100%杀灭的质量浓度为3.5 mg/L,对包囊6 h的100%杀灭质量浓度为3.5 mg/L。结果表明,丁香酚是一种具有较好开发前景的杀多子小瓜虫药物。
丁香酚;多子小瓜虫;活性追踪;杀虫活性
多子小瓜虫(Ichthyophthiriusmultifilis),属纤毛门、寡膜纲、膜口目、凹口科、多子小瓜虫属,是一种世界性分布的淡水鱼类专性寄生虫,其几乎能感染所有的淡水鱼类,患多子小瓜虫病的鱼死亡率很高,一旦患有多子小瓜虫病就难以治愈,因此多子小瓜虫病被称为鱼类的“癌症”,给我国乃至世界的淡水鱼类养殖业造成巨大的经济损失[1]。
对于多子小瓜虫病的防治,国内外已做了大量的研究工作,倪达书[2]在20世纪60年代就筛选出用醋酸亚汞治疗多子小瓜虫病,并对醋酸亚汞的治疗机理和治疗用量都做了阐述。但由于醋酸亚汞的毒性强,早已被禁止在食用鱼上使用。同样,对多子小瓜虫病疗效较好的孔雀石绿,也因为对人体有致癌性和毒性,已被禁止在食用鱼上使用[3]。近年来国内对多子小瓜虫病治疗的研究也比较多,如用辣椒和生姜、五倍子、食盐、生石灰等治疗多子小瓜虫,但这些药物大多数对掠食体阶段有一定效果,而对滋养体阶段效果不明显。国外用于防治多子小瓜虫病的药物和方法也较多,甲醛[4]、叶绿酸[5]、溴硝醇[6]、高锰酸钾[7]和高铁酸钾[8]等,但这些药物和方法都受到一定的限制,对多子小瓜虫的滋养体和包囊阶段效果不明显。同时,长期使用带来的环境污染、药物残留、耐药性等一系列问题,也成为目前食品安全和水产品出口的绿色贸易壁垒问题,因此,寻找对多子小瓜虫病的治疗行之有效、环境友好型药物是一项迫在眉睫的任务。
天然植物资源作为自然资源的一大宝库,蕴藏着巨大的潜力,具有结构新颖、功能多样性的活性物质,因此在有效创制医药、兽药和农药等新药及探索具有生物活性的先导化合物等方面越来越受到重视和青睐。同时,具有低毒、低残留、对非靶标生物毒害较低,对环境无污染等优点,可降低或避免目前化学药物带来的“药物公害”。笔者也一直致力于从天然植物中寻找新型的杀虫药物,利用提取分离技术从天然植物博落回和小果博落回中分离到3 种化合物血根碱[9]、二氢血根碱和二氢白屈菜红碱[10],对多子小瓜虫具有较强的杀灭作用。前期筛选中,发现丁香的提取物具有杀多子小瓜虫的作用,因此本研究利用提取分离技术并结合杀虫活性追踪法分离丁香中的杀虫活性成分,并对其结构进行鉴定,为开发新的杀虫药物奠定基础,并为寻求新的杀虫母体药源,研究杀虫活性成分并进行仿生合成提供科学依据。
1 材料与方法
1.1 材料
1.1.1 药材
丁香(Eugeniacaryophyllata)购自安徽中药材市场。
1.1.2 试验用鱼
金鱼(Carassiusauratus),体长(7.4±1.8) cm,严重感染多子小瓜虫,购自湖州市花鸟鱼虫市场,草鱼(Ctenopharynodonidellus)体质量(13.8±2.7) cm,来自浙北水产新品种繁育技术开发有限公司。
1.2 仪器与试剂
R-210/215型旋转蒸发仪(瑞士Buchi),Olympus-BX51显微镜(日本),石油醚、乙酸乙酯、氯仿、甲醇等化学试剂均为分析纯,上海化学试剂有限公司提供。
1.2 方法
1.2.1 多子小瓜虫的活体传代
将感染有多子小瓜虫的金鱼与草鱼混养于80 cm×60 cm×60 cm的阶梯式PP循环养殖水槽,水温控制为(22±1) ℃,溶解氧>5 mg/L,水体经砂层过滤。每3日换水50%,感染约7 d,鱼体表面即可出现密集的小白点,可用于多子小瓜虫的收集以及幼虫的培养,同时要注意及时加入未感染的草鱼,未使用的病鱼应及时捞出以免免疫力提高而影响虫体传代。
1.2.2 虫体的收集与培养
将严重感染多子小瓜虫的草鱼放置于玻璃缸中,并于玻璃缸底部放置5~10个塑料培养皿,待成熟虫体黏附于培养皿底部后,收集虫体。一部分虫体用于多子小瓜虫幼虫(掠食体)的培养,一部分用于包囊的收集。
1.2.3 体外杀多子小瓜虫幼虫(掠食体)试验
药液的配制:各提取物及活性单体经旋转干燥后,精确称取10 mg,溶解于二甲基亚砜并放置于冰箱保存备用。待进行药效试验时取出,并利用曝气的自然水稀释至所需质量浓度后进行体外杀虫试验。
试验在24孔细胞培养板上进行,于每个细胞孔中加入约2 mL不同质量浓度的药液和约100个多子小瓜虫幼虫,于用药后15 min、1 h、2 h、3 h、4 h镜检观察一次,4 h后统计各孔的多子小瓜虫死亡率。试验设置二甲基亚砜对照组和充分曝气自然水对照组,每组试验重复3次。
多子小瓜虫幼虫死亡判断标准:虫体纤毛不运动,胞质不流动,胞膜破裂,细胞核破碎。
1.2.4 体外杀多子小瓜虫包囊的试验
试验在24孔细胞培养板上进行,于每个细胞孔中均加入不同质量浓度的药液和30个多子小瓜虫包囊,于用药后6 h,吸出药液,加入充分曝气的自然水。于22 ℃下培养24 h后先镜检观察各孔的包囊存活及虫体孵化情况,之后将有幼虫孵化的细胞孔利用移液枪混匀,并吸取10 μL液体用1%甲醛固定后计数,进而计算各孔的包囊孵化虫数。每孔取5次样品,去平均值,试验设置3个重复。
包囊孵化虫数=每孔孵化虫体数/包囊个数
多子小瓜虫包囊死亡判断标准:包囊破裂、未分裂或包囊未孵出幼虫。
1.2.5 丁香杀虫活性部位的确定
称取丁香粉末50 g,利用不同极性溶剂(石油醚、乙酸乙酯、氯仿、甲醇)分别进行提取,溶剂的使用量500 mL,每次提取2 h,并合并提取液,经减压浓缩后用于体外杀虫试验,并根据药效结果确定丁香的杀虫活性部位。
1.2.6 杀虫活性追逐试验
称取5 kg丁香粉,用石油醚回流连续提取3次,合并提取液,经旋转蒸发后湿法上硅胶柱层析,依次用石油醚、石油醚∶乙酸乙酯、乙酸乙酯进行梯度洗脱,每200 mL洗脱液作为一个馏分,共收集476个馏分,经TLC合并为5个组分(FrA:1~78; FrB: 79~156; FrC: 157~268; FrD:269~378; FrE:379~476)。对这6个组分进行体外杀虫(掠食体和包囊)试验,其中FrC对多子小瓜虫掠食体和包囊的杀灭效果最强,故而利用中压制备系统(Flash)对FrC以石油醚∶乙酸乙酯=1∶2为洗脱剂进行进一步分离纯化,分离获得一种具有杀虫活性的单体化合物,对其进行波谱分析鉴定。
1.2.7 数据处理与分析
用SPSS 16.0处理药效数据,以平均数±标准差表示,采用方差分析进行差异显著性分析。
2 结 果
2.1 丁香杀虫活性部位的确定
丁香不同极性溶剂(石油醚、氯仿、乙酸乙酯、甲醇)提取液对多子小瓜虫幼虫的杀灭作用见表1。由表1可知,各提取液在所测的质量浓度范围内对多子小瓜虫幼虫均具有一定的杀灭作用,且随着溶剂极性的增大其杀虫效果逐渐降低。而杀虫效果最好的为石油醚提取物,其质量浓度为50.0 mg/L时,在4 h即可杀灭100%幼虫,而甲醇的杀虫效果最差,其质量浓度为80 mg/L时杀灭率为30.0%。各提取物对多子小瓜虫的杀灭活性的顺序则依次是石油醚>乙酸乙酯提取物>氯仿提取物>甲醇提取物。
丁香不同极性溶剂(石油醚、氯仿、乙酸乙酯、甲醇)提取液对多子小瓜虫包囊的杀灭作用见表2。由表2可知,各提取液对多子小瓜虫的包囊均具有杀灭或抑制作用,且随着溶剂极性的增大其杀虫效果逐渐降低。而杀虫效果最好的为石油醚提取物,其质量浓度为80.0 mg/L时可100%杀灭包囊,而甲醇提取物的效果最差,其质量浓度为80.0 mg/L时包囊的死亡率为30%。各提取物对多子小瓜虫的杀灭活性的顺序则依次是石油醚>乙酸乙酯提取物>氯仿提取物>甲醇提取物。
通过上述试验,确定丁香杀多子小瓜虫的活性部位为丁香的石油醚提取部位,对该部位进行进一步的分离。

图1 丁香4种不同极性溶剂提取物对多子小瓜虫幼虫的杀灭作用(4 h)注:PE-E:石油醚提取物;CL-E:氯仿提取物;EA-E:乙酸乙酯提取物;ME-E:甲醇提取物.

质量浓度/mg·L-1死亡率/%孵化虫数/个·包囊-1质量浓度/mg·L-1死亡率/%孵化虫数/个·包囊-100.0±0.0a656.7±45.2a00.0±0.0a656.7±45.2a石油醚提取物20.026.7±3.3b684.3±55.7a氯仿提取物20.00.0±0.0a666.2±63.2a40.056.7±6.7c617.1±33.5a40.013.3±6.7b638.6±39.3a60.083.3±3.3d205.3±38.5b60.033.3±3.3d543.6±35.0b80.0100±0.00e0.00±0.00c80.043.3±6.7e341.5±22.8c乙酸乙酯提取物20.013.3±3.3b661.1±55.5a甲醇提取物20.00.0±0.0a651.3±33.7a40.026.7±3.3c633.4±41.0a40.00.0±0.0a628.7±46.3a60.040.0±6.7d611.5±28.0a60.010.0±0.0b615.3±45.7a80.060.0±6.7e436.3±24.5a80.030.0±2.2c433.3±35.3b
注:字母表示与对照组差异显著(P<0.05).
2.2 杀虫活性成分的结构鉴定
对丁香石油醚提取物进行进一步的提取分离后获得一种对多子小瓜虫幼虫和包囊均具有较好杀灭作用的单体化合物,该化合物为黄色液体,有芳香气味,溶于乙醇、乙醚、氯仿,极微溶于水。对该化合物进行波谱分析:EI-MS m/z:165[M++1];1H-NMR (CDCl3 )δ 6.76 (1H, d,J = 8.0 Hz,H-6) ,6.74 (1H, dd,J= 8.02.0 Hz,H-5) ,6.70(1H, d,J= 2.0 Hz,H-3),5.92(1H,ddt,J= 16.0,10.0, 0.7, 0 Hz, H-8), 5.05(2H, m, H-9a,9b), 3.80 (3H,s,2-OCH),3.28 (2H,d,J=7.0 Hz,H-7);13C-NMR(CDCl3)δ 147.9(C-1), 148.9(C-2), 111.9(C-3), 133.1(C-4), 120.65(C-5), 112.3(C-6), 39.8(C-7), 137.4(C-8), 115.8(C-9), 56.2(2-OCH3)。上述图谱数据与文献[11]基本一致,故鉴定该化合物丁香酚。
2.3 丁香酚对多子小瓜虫的杀灭作用
丁香酚对多子小瓜虫幼虫的杀灭作用见图2。由图2可知,丁香酚对多子小瓜虫具有较强的杀灭作用,随着质量浓度的增加其杀灭作用逐渐增强。其15 min、1 h、2 h、3 h 和 4 h的半数致死质量浓度(95% 置信区间) 分别为6.21 (5.85~6.65) mg/L、3.50 (3.24~3.84) mg/L、2.90 (2.62~3.22) mg/L、2.33 (2.10~2.50) mg/L 和 2.15 (1.98~2.32) mg/L,其质量浓度为3.5 mg/L时,对多子小瓜虫幼虫的杀灭率为100%。
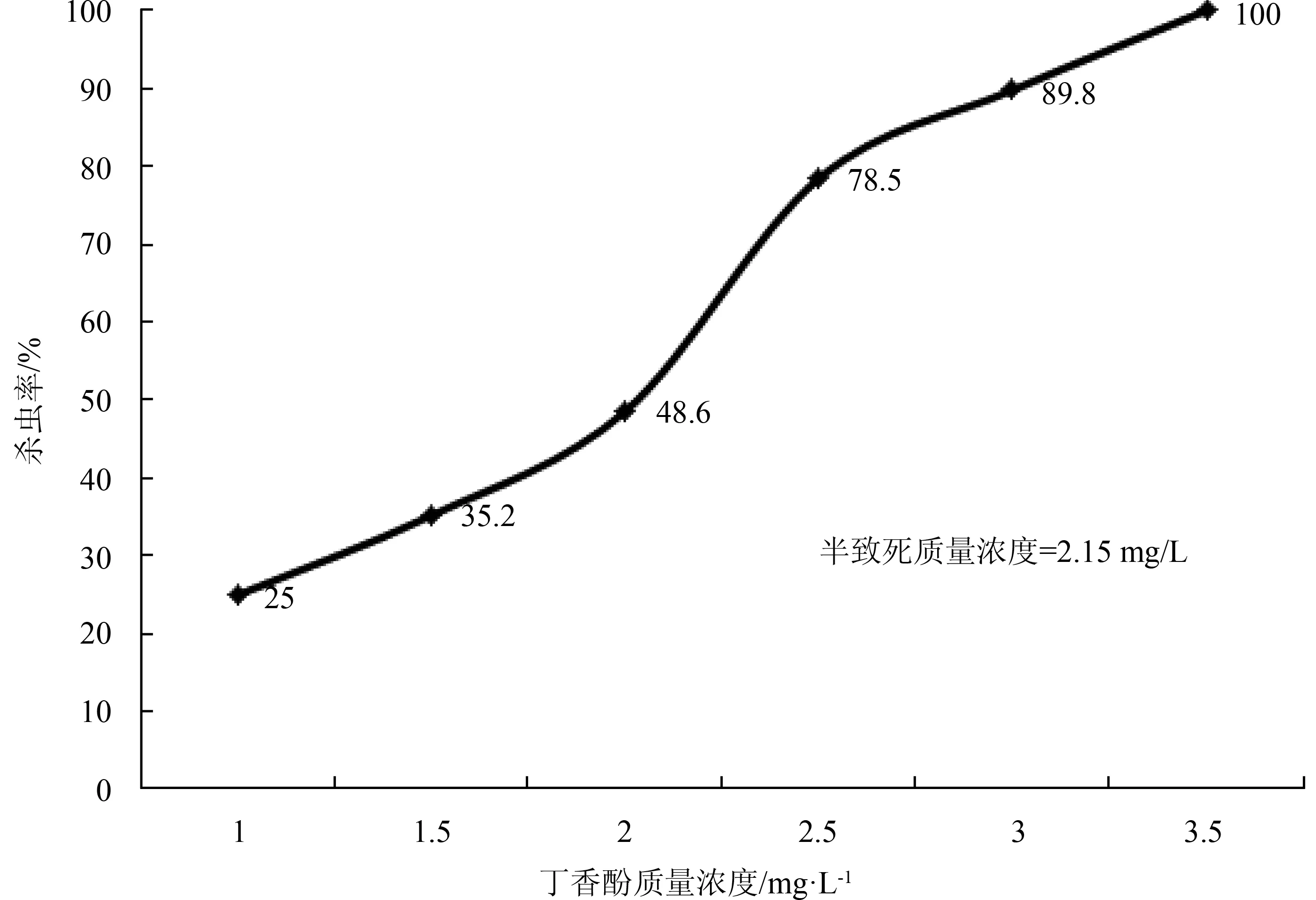
图2 丁香酚对多子小瓜虫幼虫的杀灭作用4 h
丁香酚对多子小瓜虫幼虫的杀灭作用见表2。由表2可知,丁香酚作用多子小瓜虫包囊后,可显著抑制包囊的分裂,其质量浓度为16.0 mg/L时,包囊未分裂,没有幼虫孵化,提示其可100%杀灭包囊。而8.0 mg/L和12.0 mg/L质量浓度组均有幼虫浮出,但其虫体孵化数分别为(435.1±12.6)个/包囊和(222.5±26.5)个/包囊,均显著低于对照组(598.5±38.0)个/包囊。
包囊抑制试验结果还显示,丁香酚对多子小瓜虫的包囊的结构具有极大的破坏作用。16.0 mg/L试验组经6 h作用后,多子小瓜虫的包囊结构完全破坏,胞质外流,细胞核不可见。而对照组包囊结构完好,且分裂完全(图3)。

表2 丁香酚对多子小瓜虫包囊的成活和孵化影响(6 h)
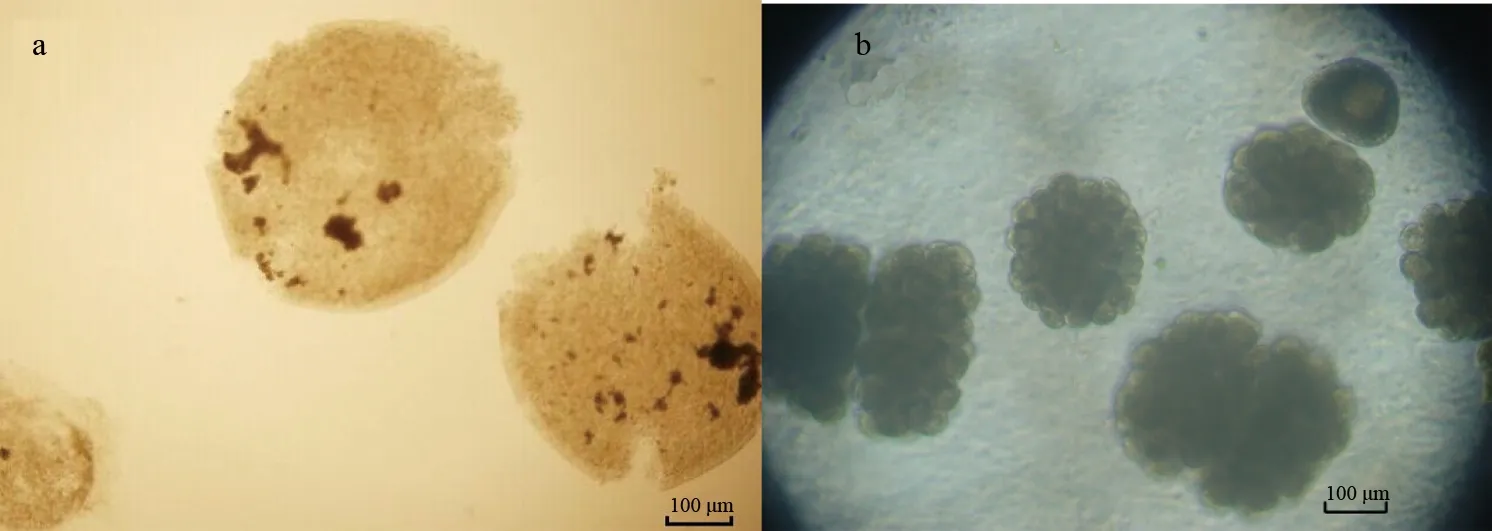
图3 丁香酚作用多子小瓜虫包囊后的显微结构a:丁香酚作用6 h后;b:正常分裂包囊.40×.
3 讨 论
3.1 丁香的杀小瓜虫活性部位
天然植物因其源于自然,具有易降解、不易产生耐药性、生物安全性高且结构多样性的优点而越来越受新药研究者的重视,并逐渐成为研究的热点。中药活性部位筛选,多根据化合物结构“相似相溶”的原理,采用极性由弱渐强的不同溶剂进行系统提取[12],进而在相同条件下进行部位活性比较试验来判断活性部位。本研究通过石油醚、氯仿、乙酸乙酯、甲醇等4种溶剂对丁香进行系统提取,发现其杀多子小瓜虫的高效活性成分主要存在于石油醚提取物中,同时本研究也主要针对石油醚提取部位进行追踪分离纯化,并分离得到一种单体化合物,经波谱分析鉴定为丁香酚,其对多子小瓜虫幼虫的100%杀灭的质量浓度为3.5 mg/L,其杀虫效果明显优于从博落回中分离到的二氢血根碱和二氢白屈菜红碱[10],以及从五倍子中分离到五没食子酰葡萄糖[13],说明丁香酚具有较强的杀虫活性和较广的应用的前景。同时,天然植物化学成分比较复杂,有些成分具有较高的活性成分,但是其在植物中的含量极低,故而可能在初筛中体现不出活性优势,因而本研究中乙酸乙酯提取物和氯仿提取物也表现一定的杀虫活性,可能存在的更好杀虫活性成分。
3.2 丁香酚杀虫作用及机理
丁香酚即4-烯丙基-2-甲氧基苯酚,又称子丁香酚,广泛存在于丁香酚、肉桂叶油、樟脑油等芳香油中[14]。在水产养殖中丁香酚主要作为麻醉剂,在鱼类亲鱼采卵、活鱼运输过程中应用[15-16]。而在医药上,具有抑菌、麻醉、解热、抗氧化、抗肿瘤、促进透皮吸收、驱蚊等多种药理活性[17-19],本研究发现丁香酚具有较强的杀多子小瓜虫的作用,这是首次发现该化合物具有杀水产动物寄生虫功能。张杰等[20]在研究丁香酚对灰葡萄孢(Botrytiscinerea)孢子细胞膜透性中发现,在短时间(15 min)内丁香酚即可破坏菌丝细胞膜的通透性,使菌丝细胞膜对K+的选择通透性增加,随着处理时间延长,细胞破裂,进而可能导致蛋白质及其他大分子物质的外流情况。Gill等[21]发现丁香酚能抑制李斯特菌(Listeriamonocytogenges)和沙克乳酸杆菌(Lactobacillussakei)的三磷酸腺苷酶活性,进而影响其能量代谢。Usta等[22]研究表明,丁香酚可抑制小鼠肝脏细胞膜上Na+/K+-三磷酸腺苷酶活性,进而影响K+运输,打破膜内外浓度平衡,进而导致内外物质交换失衡细胞损伤。而本研究丁香酚对包囊的研究结果也显示,其可导致多子小瓜虫包囊的破裂,其作用机理也可能是改变了包膜上通透性或某些物质的运输进而导致包膜破裂,但其具体的作用位点、作用模式和作用机制还需进一步研究。
笔者从丁香中提取到一种对多子小瓜虫具有较好杀灭作用的活性物质丁香酚,从植物中提取丁香酚的提取率高,成本低,且该化合物结构比较简单较易合成。因此,丁香酚有望成为一种高效、低毒、环保型的绿色水产动物杀虫剂,具有广阔的开发利用前景。
[1] Dickerson H W, Dawe D L.IchthyophthiriusmultifiliisandCryptocaryonirritans(Phylum Ciliophora)[G]//Woo P T K. Fish Diseases and Disorders. Volume 1: Protozoan and Metazoan Infections. 2nd ed. Wallingford, UK:CAB International, 2006:116-153.
[2] 倪达书,李连祥.多子小瓜虫的形态、生活史及其防治方法和一新种的描述[J]. 水生生物学集刊,1960(2):197-225.
[3] Wahli T, Schmitt M, Meier W. Evaluation of alternatives to malachite green oxalate as a therapeutant for Ichthyophthiriosis in rainbow-trout,Oncorhynchusmykiss[J]. J Appl Ichthyol, 1993, 9(7):237-249.
[4] Rowland S J, Mifsud C, Nixon M, et al. Use of formalin and copper to control ichthyophthiriosis in the Australian freshwater fish silver perch (BidyanusbidyanusMitchell) [J].Aquacult Res, 2009, 40(5):44-54.
[5] Wohllebe S, Richter P, Häder D P. Chlorophyllin for the control ofIchthyophthiriusmultifiliis(Fouquet) [J].Parasitol Res, 2012, 111(9):729-733.
[6] Straus D L, Griffin B R. Efficacy of potassium permanganate in treating Ichthyophthiriasis in channel catfish[J]. Aquat Anim Health, 2002, 14(2):145-148.
[7] Shinn P, Camacho A P, Bron S M, et al. The anti-protozoal activity of bronopolonthe key life-stages ofIchthyophthiriusmultifiliisFouquet, 1876 (Cilio-phora)[J]. Vet Parasitol,2012, 186(3):229-236.
[8] Ling F, Wang J G, Wang G X, et al. Effect of potassium ferrate(Ⅵ) on survival and reproduction ofIchthyophthiriusmultifiliistomonts[J]. Parasitol Res, 2011, 109(2):1423-1428.
[9] Yao J Y, Shen J Y, Li X L, et al. Effect of sanguinarine from the leaves ofMacleayacordataagainstIchthyophthiriusmultifiliisin grass carp (Ctenopharyngodonidella)[J].Parasitolo Res,2010, 107(7):1035-1042.
[10] Yao J Y, Zhou Z M, Li X L, et al. Antiparasitic efficacy of dihydrosanguinarine and dihydrochelerythrine fromMacleayamicrocarpaagainstIchthyophthiriusmultifiliisin richadsin (Squaliobarbuscurriculus) [J]. Vet Parasitol, 2011, 183(1/2):8-13.
[11] 张永强,丁伟,赵志模,等.中药植物丁香杀虫杀螨活性研究[J]. 西南农业大学学报:自然科学版,2004,26(4):429-433.
[12] 宋晓平,王晶钰,李引乾,等.地锦草体外抑菌有效部位的筛选试验[J].西北农业大学学报,1999,27(5) :75-78.
[13] Zhang Q,Xu D H,Klesius P H. Evaluation of an antiparasitic compound extracted fromGallachinensisagainst fish parasiteIchthyophthiriusmultifiliis[J].Veterinary Parasitology,2013,198(1/2):45-53.
[14] 刘长琳,何力,陈四清.鱼类麻醉研究综述[J].渔业现代化,2007,34(5):21-25.
[15] Keene J,Noakes D, Moccia R. The efficacy of clove oil as an anaesthetic for rainbow trout,Oncorhynchusmykiss(Walbaum)[J].Aqua Res,1998, 29(2):89-101.
[16] Weber R,Peleteiro J, Mart N L. The efficacy of 2-phenoxyethanol metomidate, clove oil and MS-222 as anaesthetic agents in the Senegalese sole[J].Aqua,2009,288(1):147-150.
[17] 楼兴隆,李晓明,张鞍灵.丁香油抑菌成分研究[J]. 西北农业学报,2006,15(3):91-93.
[18] 王树桐,曹克强,张凤巧.中药丁香提取物对番茄灰霉病菌抑制作用及生防效果[J].植物病理学报,2005,35(6):91-94.
[19] Ghosh R, Nadmnty N, Fitzapatrick J E. Eugenol causes melanoma growth suppression through inhibition of E2f1 trascriptionl activity [J].J Boil Chem, 2005,280(7):5812-5819.
[20] 张杰,王春梅,程罗根,等. 丁香酚对灰葡萄孢的抑制作用研究[J].农药药学学报,2008,10(1):68-74.
[21] Gill A Q, Holley R A. Mechanisms of bactericidal action of cinnamaldehude againstListeriamonocytogenes and of Eugenol against monocytogenes andLactobacillyssakei[J].Appl Environ Microb, 2004, 70(10):5750-5755.
[22] Usta J, Kpeydiyyeh S, Bamabe P. Comparative study on the effect of cinnamon and clove extracts and their main components on different types of ATPases [J].Hum Exp Toxicol, 2003(22):355-362.
IsolationofActiveCompoundsfromEugeniacaryophyllataagainstIchthyophthiriusmultifiliisinVitro
YAO Jiayun, XU Yang, YUAN Xuemei, LIN Lingyun, YIN Wenlin, PAN Xiaoyi, HAO Guijie, SHEN Jinyu
( Key Laboratory of Healthy Freshwater Aquaculture, Ministry of Agriculture, Key Laboratory of Fish Health and Nutrition of Zhejiang Province,Zhejiang Institute of Freshwater Fisheries,Huzhou 313001, China )
Ichthyophthiriusmultifiliisis a holotrichous protozoan that invades the gills and skin surfaces of fish and can cause morbidity and high mortality in most species of freshwater fish worldwide. The present study was undertaken to investigate the antiparasitic activity of crude extracts and pure compounds fromEugeniacaryophyllata. The driedE.caryophyllatawas extracted successively in a separating funnel with petroleum ether, ethyl acetate, chloroform and methanol, in which only the petroleum ether extract showed promising activity (100% effectiveness againstI.multifiliistheronts and encysted tomonts at the concentration of 50.0 mg/L and 80.0 mg/L respectively) and therefore, was fractionated on silica gel column chromatography in a bioactivity-guided isolation affording a compound showing potent activity. The structure of the compound was elucidated as clove oil by hydrogen and carbon-13nuclear magnetic resonance spectrum and electron ionization mass spectrometry. The in vitro tests revealed that clove oil was found to be 100% effective against encysted tomonts at the concentration of 16.0 mg/L. The results showed that clove oil has potent anti-parasitic efficacy with the 15 min-, 1 h-, 2 h-, 3 h- and 4 h-LC50(95% Confidence Intervals) of 6.21 (5.85—6.65) mg/L, 3.50 (3.24—3.84) mg/L, 2.90 (2.62—3.22) mg/L, 2.33 (2.10—2.50) mg/L and 2.15 (1.98—2.32) mg/L against theronts ofI.multifiliis, respectively. The findings provide important information for the potential application of clove oil in the therapy of serious infection caused byI.multifiliis.
clove oil;Ichthyophthiriusmultifilis; active site; bioactivity-guided isolation
10.16378/j.cnki.1003-1111.2016.06.011
S941.5
A
1003-1111(2016)06-0669-06
2015-12-28;
2016-03-08.
国家自然科学基金青年科学基金资助项目(31302211);浙江省公益技术应用研究项目 ( 2014C32055 ).
姚嘉赟(1980—),男,副研究员,硕士;研究方向:水产动物疾病防治. E-mail:yaojiayun@126.com. 通讯作者:沈锦玉(1963—),女,研究员,硕士;研究方向:水产动物病害防治. E-mail:sjinyu@126.com.
