放流三疣梭子蟹遗传多样性和贡献率初步研究
2016-12-20刘海映吕海波谢婉琳李宝宝王连顺王溪洪
刘海映,吕海波,崔 帆,谢婉琳,李宝宝,王连顺,刘 奇,陈 雷,邢 坤,王溪洪,史 航,宋 斌
( 1.大连海洋大学 辽宁省海洋牧场工程技术研究中心,辽宁 大连 116023;2. 大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点试验室,辽宁 大连 116023;3. 大连海洋大学 水产与生命学院,辽宁 大连 116023; 4.辽宁省水产苗种管理局,辽宁 大连 116015 )
放流三疣梭子蟹遗传多样性和贡献率初步研究
刘海映1,2,吕海波1,2,崔 帆1,2,谢婉琳1,2,李宝宝1,2,王连顺3,刘 奇1,2,陈 雷1,2,邢 坤1,2,王溪洪4,史 航4,宋 斌4
( 1.大连海洋大学 辽宁省海洋牧场工程技术研究中心,辽宁 大连 116023;2. 大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点试验室,辽宁 大连 116023;3. 大连海洋大学 水产与生命学院,辽宁 大连 116023; 4.辽宁省水产苗种管理局,辽宁 大连 116015 )
近年来我国沿海三疣梭子蟹自然资源明显下降,为恢复现有资源,辽宁省自2012年开始,连续实施了4年大规模人工放流工作。在目前的增殖放流中,为检测参与繁殖的三疣梭子蟹亲本和即将放流的子代间的遗传差异以及亲本对其子代的繁殖贡献率水平,利用10对具有丰富遗传多态性的微卫星分子标记,分别对9只三疣梭子蟹雌性亲本和179只即将放流的子代进行了遗传多样性分析及亲子鉴定。结果发现,子代的平均观测杂合度、平均期望杂合度和平均多态性信息含量数值均低于参与繁殖的雌性亲本,亲本和放流子代之间在观测杂合度、多态性信息含量参数方面并无显著差异(P>0.05),但期望杂合度遗传参数存在显著差异(P<0.05),子代的遗传多样性较雌性亲本呈下降的趋势。使用4个微卫星分子标记时,累积排除率≥0.998,亲子鉴定的准确率为56.98%;微卫星分子标记为6个时,累积排除率≥0.9999,准确率达到97.21%;当使用8个微卫星分子标记鉴定时,准确率达100%。同时发现,9只雌性亲本对子代均有贡献,最高为29.61%,最低为3.35%,不同亲本之间的贡献率存在显著差异(P<0.05)。研究表明,微卫星可以作为有效的标记手段用于三疣梭子蟹增殖放流遗传评估中。上述试验结果将为我国三疣梭子蟹增殖放流的科学发展提供基础资料。
三疣梭子蟹;微卫星分子标记;遗传多样性;亲子鉴定;贡献率
三疣梭子蟹(Portunustrituberculatus)广泛分布于我国沿海及日本、朝鲜、马来西亚等水域[1]。具有肉质好、食物链短、生长快等特点,常被用作沿岸增殖放流的目标种,在东北亚各国增殖放流中占有重要地位[2-3]。
自20世纪60年代开始,日本率先开展了三疣梭子蟹的增殖放流工作[4]。在我国,辽宁省营口市于1986—1988年首次放流稚蟹(C2期)共60余万只[5]。近几十年,随着环境恶化、过度捕捞等影响,我国近海三疣梭子蟹自然资源明显下降。1996年的产量尚可维持在59 000 t,而2001年则降至11 000 t[6]。面对日益增长的水产品需求和捕捞压力,单纯依靠自然种群重建已不能修复受损的渔业资源。辽宁省自2012年开始,连续4年实施了三疣梭子蟹大规模增殖放流工作,共放流稚蟹(C2期)约1.4亿只,其中2015年放流量超过1000万只,增殖放流活动产生了一定的经济效益[2]。然而若放流大量遗传多样性较低的人工苗进入自然海域,很可能降低自然海域种群的遗传多样性水平;改变整体的遗传结构,例如发生基因替换及遗传漂变等,最终给该物种的生长、繁殖带来深刻的影响[7]。因此,对繁殖亲本和放流子代进行遗传评估显得非常必要。放流群体的遗传多样性主要由其亲本情况决定,三疣梭子蟹具有很高的产卵能力,最终抱卵量可达1.3×105~22×105粒[8],即少量的亲本可繁殖出大量的子代。在人工环境下,自然选择压力被削弱,人工苗成活率高,放流后易造成群体中的遗传瓶颈效应[9]。在三疣梭子蟹的增殖放流中,常存在使用数量较少的雌蟹作为繁殖亲本的情况,非常有必要监测放流群体间的遗传多样与亲本对子代的贡献率,为今后评估放流是否对自然群体的遗传多样性造成影响奠定基础。
微卫星分子标记为共显性遗传,具有多态性高、数量丰富、遵循孟德尔遗传规律等特点[10],近年来已广泛应用于水产动物,如鱼类、甲壳类和贝类的遗传育种方面[11-12]。同时,微卫星分子标记也可用于放流工作中,是遗传评估、亲子鉴定、贡献率分析的有力工具[12-16]。Sekino等[13]利用4个微卫星分子标记对褐牙鲆(Paralichthysolivaceus)进行亲子鉴定,发现亲本间贡献率差异很大。陈睿毅等[14-15]也发现类似现象。王洪霞等[16]亦分析了甲壳动物不同亲本对子代贡献率的差异。在对三疣梭子蟹的研究中,多数报道主要集中于遗传育种和谱系认证方面[17-25],而分子标记在增殖放流中的应用鲜有报道。
本试验利用10对微卫星分子标记,对增殖放流中参与繁殖的亲本和即将放流的子代群体间,进行遗传多样性分析,同时评估亲本对子代的繁殖贡献率,以期为将来建立完善的放流遗传评估机制,构建负责任的增殖放流新模式提供基础资料。
1 材料与方法
1.1 试验材料
繁殖亲蟹为2014年辽宁省三疣梭子蟹增殖放流承担企业所使用的海捕雌蟹。在亲蟹暂养期间,每日投喂鲜活贝类并控制水温,促熟产卵。当抱卵雌蟹的卵色呈茶褐色后,随机挑选即将排卵的亲蟹共9只放置于同一个水池内,编号为Fe1~Fe9,待翌日产卵后,取出亲蟹,并对子蟹进行培育。在子蟹中间育成期间,根据其生长程度投喂藻粉、酵母、轮虫和卤虫(Artemia)等不同饵料。幼体培育时,注意足量投饵,避免发生自残、疾病,影响成活率。到稚蟹 2 期后,于放流前一天,在育成池的不同位置,随机取子蟹179只。
1.2 基因组DNA的提取
1.3 微卫星引物
微卫星引物序列参考刘磊等[19-20]和李晓萍等试验方案。所有引物5′端加FAM荧光修饰,由上海生工生物公司合成。使用亲本及子代DNA样品最终筛选出10对多态性高且扩增效果好的微卫星引物(表1)用于试验。

表1 10个多态性微卫星位点的特征
1.4 PCR反应
反应总体积为25 μL,其中包括100 ng三疣梭子蟹基因组DNA模板(50 ng/μL),10 mmol/L 10×PCR Buffer (Mg2+free),0.2 mmol/L dNTP(10 mmol/L each),2.0 mmol/L MgCl2(25 mmol/L),双向引物各0.8 μmol/L,1.0 U Tap DNA聚合酶(5 U/μL)。反应条件为:94 ℃预变性5 min;94 ℃变性40 s,退火(退火温度见表1)1 min,72 ℃延伸1 min,循环30次;72 ℃延伸5 min,4 ℃下避光保存。扩增产物经琼脂糖凝胶电泳检测后,经上海桑尼生物科技公司进行微卫星分型分析。
1.5 毛细管电泳检测
反应体系为10 μL,包括 PCR产物1 μL,分子量内标和甲酰胺混合液(0.5∶8.5)9 μL。95 ℃变性3 min,然后利用ABI3730XL基因分析仪(Applied Biosystems,USA)的片段分析功能进行毛细管电泳,使用GeneMapper软件收集数据,并进行人工校正。
1.6 遗传参数分析
遗传多样性分析方面使用POPGENE32和CERVUS 3.0软件分析亲代和子代群体中等位基因的数目(NA),有效等位基因数目(NE),观测杂合度(Ho),期望杂合度(He),多态性信息含量(PIC),哈迪温伯格平衡检验(HW)等参数。哈迪温伯格平衡的显著性标准经Bonferroni多重检验校正。亲本与子代间的遗传指标差异经SPSS22.0中的Wilcoxon signed-rank test检验,P<0.05认为差异显著,各亲本间的繁殖贡献率差异经SPSS 22.0中的Nonparametric chi-square test检验,P<0.05认为差异显著。
亲子鉴定方面:通过CERVUS 3.0软件中的模拟功能估算亲子鉴定所需要的位点数及其鉴定效率。模拟参数配置如下:模拟子代数目为10000,亲本检测率为100%,位点检测率为100%,分型误差1%,置信水平设置为95%。经CERVUS 3.0软件中亲子鉴定功能计算每个分子标记的非亲排除率(PE)和多个分子标记的累积排除率(CPE),根据鉴定成功的子代数量计算鉴定准确率,最终计算出亲本对子代的贡献率。遗传参数分析中所用公式推导如下:
观测杂合度、期望杂合度和多态信息含量的计算公式:
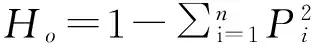
例1:“分钟合计降水量(60个分钟值求和)与小时正点降水量0不一致”。实际工作中发现,该疑误出现的原因多为分钟雨量出现缺测现象,值班员在“台站未处理”项对疑误信息进行正确值“0”的反馈,然后进入“数据查询与质疑”,选好站点后,在观测类型选择“分钟”,观测要素选择“降水量”,查询到缺测的分钟数,将“-”改为“0”即可。
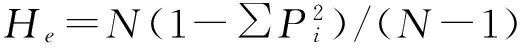

式中,n为等位基因数目,i为等位点数,Pi、Pj为等位基因频率。
非亲排除率(PE):子代的非亲生父母本能够被遗传标记系统排除的概率,计算方法为:
式中,Pi为微卫星分子标记第i个等位基因的基因频率。
累积排除率(CPE):所用若干遗传标记排除子代非亲父母的概率。
⑤CPE=1-(1-PE1)(1-PE2)…(1-PEk)
式中,PEk是第k个微卫星位点的排除率。
根据位点的多态信息含量值由高至低,逐一增加微卫星位点(4~10)来计算位点累积非亲排除率,利用软件进行亲子关系分析。在确定亲缘关系后, 统计所有遗传标记下的亲子鉴定准确的比率,计算方法为:
⑥P=A/B×100%
式中,A为成功鉴定出父母本的子代个体数,B为取样子代数。
2 结果与分析
2.1 遗传多样性分析
10个微卫星分子标记在所分析的9只雌性亲蟹群体(表2、表3)中,等位基因数为5~14,有效等位基因为2.7~11.6。 所有位点在亲本中共出现69.9种有效等位基因,其中微卫星位点Ptri05的有效等位基因数目最多,为11.6个;而微卫星位点Pot09在所有亲本中仅存在2.7种有效等位基因,数量最少。亲蟹群体中,平均每个微卫星位点的有效等位基因的数目约为7.0个。在子代中,等位基因数为14~21,有效等位基因为4.6~13.4。微卫星位点Ptri05的有效等位基因数目同样最多,为13.4个;而微卫星位点Ptri11在子代中具有的等位基因数量最少,为4.6个。子蟹群体中,平均每个微卫星位点的等位基因的数目约为9.5个。由于雄性亲代的样本信息缺失,亲代在各位点的等位基因数和有效等位基因数平均值均显著低于子代(Wilcoxon signed-rank test,P<0.05)。
子代的平均观测杂合度、平均期望杂合度和平均多态性信息含量数值均低于亲本, Wilcoxon signed-rank test(SPSS)表明,亲本和放流子代之间在观测杂合度、多态性信息含量参数方面并无显著差异(P>0.05),但期望杂合度遗传参数存在显著差异(P<0.05),子代群体的遗传多样性较亲本呈下降趋势(表4)。例如,微卫星位点Pot09,子代的观测杂合度、期望杂合度和多态信息含量分别为0.514、0.477和0.455,而亲代为0.778、0.752和0.668。有效等位基因数目多的位点在遗传多样性方面,其缓冲能力明显强于等位基因数目偏少的位点,例如微卫星位点Ptri05和Pot09。本试验还发现,利用哈迪温伯格平衡对子代群体中每个位点基因平衡状态进行检验,子蟹群体中有6个微卫星位点符合哈迪温伯格平衡,剩余4个位点中Ptri02表现为显著偏离哈迪温伯格平衡(P<0.05),Ptri01、Ptri04、Ptri11表现为极显著偏离哈迪温伯格平衡(P<0.01)。

表2 雌性亲蟹基因型和等位基因数

表3 10个微卫星位点遗传统计指标
注:NS表示差异不显著(P>0.05);*表示差异显著(P<0.05);**表示差异极显著(P<0.01);ND表示数据量不足以进行哈迪温伯格平衡检验;YLJ为鸭绿江野生蟹群体;LZW为莱州湾野生蟹群体.

表4 亲本与子代的观测杂合度、期望杂合度和多态性信息含量符号秩和显著性检验
注:*表示差异显著(P<0.05).
2.2 亲子鉴定准确率
亲子鉴定结果显示,4个微卫星分子标记时,累积排除率≥0.998;微卫星分子标记为6个时,累积排除率≥0.9999;微卫星分子标记为8个时,累积排除率≥0.99999;微卫星分子标记为10个时,累积排除率≥0.999999。累积排除率随着标记数量的增加呈递增趋势,累积排除率越高,亲子鉴定的准确率也就越高。利用4个微卫星分子标记进行亲子鉴定,亲子鉴定的准确率为56.98%;当微卫星分子标记为5个时,则可以确定160个子代为亲本的后代,亲子鉴定的准确率上升至89.39%。依次增至6个或7个微卫星分子标记时,无法确定亲本的后代逐渐减少,亲子鉴定准确率分别为97.21%和98.88%。当标记数≥8个时,179只子蟹均能确定其母本,准确率达100%(图1)。同样的,任宪云等[21]使用10个微卫星分子标记成功地从156只候选亲本中鉴定出其子代群体,鉴定率也达到100%,与本试验结果类似。

图1 不同位点数的亲子鉴定准确率
2.3 不同亲本对子代的贡献率
所有亲蟹对子代均有贡献,但贡献率差异显著(χ2=97.687,df=8,P=0.00,Nonparametric chi-square test)。在179只子代中,有53只均是Fe5的后代,占29.61%;有37只来自Fe7,占20.67%。Fe4对子代的贡献率最小,仅有6只是它的子代,只占3.35%。其他亲蟹对子代的贡献率维持在4.47%至12.29%之间(表5)。

表5 雌性亲蟹对子代贡献率
3 讨 论
在增殖放流中与传统的标记方法相比较,微卫星分子标记不仅可以阐明增殖放流过程中,放流群体的遗传多样性水平及亲本繁殖贡献率,最终为评估放流群体的遗传健康度提供重要支撑;还可以用于准确区分放流群体与自然群体,进而追踪放流群体的时空动态特征[14]。本研究首次尝试在增殖放流过程中,对增殖放流承担企业某一子蟹育成池中的所有亲蟹和随机抽检的即将放流子代进行分析,旨在为评估放流群体的遗传基础、最终为评估维持放流子代遗传多样性所必需的有效繁殖群体数量奠定基础。
3.1 微卫星多样性分析
已有研究发现,人工养殖群体的遗传多样性较自然野生群体低[27],如果使用遗传多样性不高的子代大量放流,很可能会对野生群体产生不利影响[28]。本研究中,10对微卫星引物在被检测的亲本和子代中,其平均等位基因数、平均观测杂合度、平均期望杂合度、平均多态性信息含量分别达到了①9.8、0.8668、0.8863、0.8121;②18.2、0.8315、0.8101、0.7906(①为亲本组;②为子代组)。所有遗传多样性指标均高于李晓萍等[29]报道的鸭绿江与莱州湾的野生三疣梭子蟹群体(表3),表现出放流群体较好的遗传多态性。以衡量标记遗传信息含量的多态信息含量为例,Bostestin等[30]认为多态信息含量>0.5的分子标记具有丰富的遗传信息,0.5>多态信息含量>0.25的遗传标记能提供合适的遗传信息,多态信息含量<0.25 的标记含有较少的遗传信息,本试验使用的10对微卫星位点,其位点平均多态信息含量在亲体和子代群体中均>0.5,显示出丰富的多态性。然而,一个不可忽视的事实是,尽管亲本和放流子代之间在观测杂合度、多态性信息含量方面并无显著差异,但期望杂合度遗传参数却存在显著差异(P<0.05)。与描述微卫星位点由亲本遗传到子代时,多态性变化的多态信息含量参数不同,因期望杂合度对样本大小的敏感度小于观测杂合度,期望杂合度常被用作描述种群遗传多样性的主要指标[31]。故基于本试验数据显示,即将放流的子代群体的遗传多样性较亲本呈下降趋势,显示出繁殖亲本数目过少可能会造成遗传变异水平的降低[16]。目前增殖放流中,虽然雄性繁殖亲蟹的遗传信息未知,但使用较少的雌性亲蟹作为繁殖群体,极易造成生态系统中的自然选择压力变为人为选择压力[32],Selly等[12]使用10个微卫星分子标记对放流大西洋鲑(Salmosalar)的研究中也发现类似现象。故大规模增殖放流三疣梭子蟹,是否会对放流海区三疣梭子蟹群体的遗传多样性水平造成影响尚需关注。本试验还发现,在子蟹群体中,有4个微卫星位点偏离哈迪温伯格平衡。造成这种现象的可能原因,包括①繁殖亲本较少、②无效等位基因的存在[17]、③所检测的子蟹数量稍显不足等。
3.2 亲子鉴定准确率分析
非亲排除率作为评估亲子鉴定的重要指标,其值越大,亲子鉴定的准确率就越高[14]。按照人类亲子鉴定的标准,单个位点的非亲排除率≥0.5714,累积排除率达到0.9995以上是亲子关系界定的标准,一般情况下,人类需要15个微卫星分子标记可以完成亲子鉴定[33]。本研究中,使用4个标记时,累积排除率≥0.998,三疣梭子蟹亲子鉴定准确率为56.98%;使用6个标记时,累积排除率≥0.9999,亲子鉴定准确率达到97.21%。故理论上使用约6个微卫星分子标记就能对增殖放流中的三疣梭子蟹的亲缘关系进行鉴定。
3.3 亲本贡献率分析
亲本对子代贡献率在一定程度上体现了自然选择的作用,是繁殖生物学和进化生态学研究的热点问题[16]。亲本对子代的贡献率不平衡可能导致等位基因丢失,经过累代的繁殖,造成群体中的遗传多样性降低[14]。另一方面,这种不平衡性也摒弃了群体中的致死基因或不好的性状。在海洋动物中,鱼类亲本贡献率方面的研究开展较早,Sekino等[13]利用4个微卫星分子标记对褐牙鲆进行亲子鉴定发现亲本间贡献率差异很大,Campton等[34-35]认为精液的质量及鱼群中的等级制度导致贡献率不平衡。目前关于虾蟹类贡献率的研究相对较少,王鸿霞等[16]对凡纳滨对虾(Litopenaeusvannamei)的贡献率研究发现,不同亲本之间的贡献率存在明显差异,最高为54.28%,最低为8.57%。在本试验中,9只雌蟹对后代均有贡献,最高的为29.61%,最低为3.35%,不同亲本贡献率差异显著(P<0.05,Nonparametric chi-square test)。故在增殖放流子代的人工培育过程中,不仅要直接评估繁殖亲体的遗传多样性水平,亲本的繁殖贡献率水平也会影响到放流子代的遗传结构。
本试验研究成果将深化对三疣梭子蟹增殖放流的认知,为这一物种增殖放流管理提供遗传学背景资料。
[1] 戴爱云,杨思谅,宋玉枝,等.中国海洋蟹类[M].北京:海洋出版社,1986:213-214.
[2] 张秀梅,王熙杰,涂忠,等.山东省渔业资源放流现状与展望[J].中国渔业经济,2009,27(2):51-58.
[3] Masuda R, Tsukamoto K. Stock enhancement in Japan: review and perspective[J]. Bulletin of Marine Science, 1998, 62(2):337-358.
[4] Hamasaki K, Kitada S. A review of kuruma prawnPenaeusjaponicusstock enhancement in Japan[J]. Fisheries Research, 2006, 80(1):80-90.
[5] 陈永桥.三疣梭子蟹稚蟹标志方法的探讨[J].水产科学,1991,10(1):26-28.
[6] Yang F, Xu H T, Dai Z M, et al. Molecular characterization and expression analysis of vitellogen in the marine crabPortunustrituberculatus[J].Comparative Biochemistry and Physiology—Part B: Biochemistry and Molecular Biology, 2005, 142(4):456-464.
[7] Cross T F, King J. Genetic effects of hatchery rearing in Atlantic salmon[J]. Aquaculture, 1983, 33(1/4):33-40.
[8] Liu Z J, Cordes J F. DNA marker technologies and their applications in aquaculture genetics[J]. Aquaculture, 2004, 238(1/4):1-37.
[9] Norris A T, Bradley D G, Cunningham E P. Microsatellite genetic variation between and within farmed and wild Atlantic salmon(Salmosalar) populations[J].Aquaculture,1999, 180(3/4):247-264.
[10] 董志国.中国沿海三疣梭子蟹形态、生化与分子遗传多样性研究[D].上海:上海海洋大学, 2012.
[11] Fuji K, Kobayashi K, Hasegawa O, et al. Identification of a single major genetic locus controlling the resistance to lymphocystis disease in Japanese flounder (Paralichthysolivaceus)[J]. Aquaculture, 2006, 254(1):203-210.
[12] Selly S-L C, Hickey J, Stevens J R, et al. A tale of two hatcheries: assessing bias in the hatchery process for Atlantic salmon (SalmosalarL.) [J].Aquaculture,2014,434(1):254-263.
[13] Sekino M, Saitoh K, Yamada T, et al. Microsatellite-based pedigree tracing in a Japanese flounderParalichysolivaceushatchery strain:implications for hatchery management related to stock enhancement program[J]. Aquaculture, 2003, 221(1):255-263.
[14] 陈睿毅,王桂兴,刘海金,等.牙鲆亲本对子代贡献率的试验研究[J].中国水产科学,2013,20(4):698-705.
[15] Herlin M, Delghandi M, Wesmajervi M, et al. Analysis of the parental contribution to a group of fry from a single day of spawing from a commercial Atlantic cod(Gadusmorhua) breeding tank[J]. Aquaculture,2008,274(2):218-224.
[16] 王鸿霞,吴长功,相建海,等.凡纳滨对虾繁殖中不同亲本对子代遗传贡献率的差异[J].动物学报, 2006, 52(1):175-181.
[17] 刘磊, 李健, 刘萍, 等.微卫星DNA 标记用于三疣梭子蟹家系亲子关系的鉴定[J].渔业科学进展, 2010, 31(5):76-82.
[18] 刘磊,李健,刘萍, 等.基于微卫星分子标记的三疣梭子蟹家系系谱认证[J].中国海洋大学学报:自然科学版,2012,42(7/8):38-44.
[19] Liu L, Li J, Liu P, et al. A genetic linkage map of swimming crab(Portunustrituberculatus)based on SSR and AFLP markers[J]. Aquaculture, 2012, 344(3):66-81.
[20] 李晓萍,刘萍,宋协法, 等.三疣梭子蟹微卫星富集文库的构建与群体遗传分析[J].中国水产科学, 2011,18(1):194-201.
[21] 任宪云,刘萍,李健,等.三疣梭子蟹微卫星多重PCR技术建立及条件的优化[J].渔业科学进展,2011,32(3):76-83.
[22] 任宪云,刘萍,高保全,等.微卫星多重PCR基因扫描技术在“黄选1号”三疣梭子蟹的个体识别和有效群体含量中的应用[J].水生生物学报,2012,36(4):1-9.
[23] 韩智科,刘萍,李健,等.三疣梭子蟹多态性微卫星分子标记的筛选及评价[J].渔业科学进展,2012,33(1):74-80.
[24] 韩智科,刘萍,李健,等.三疣梭子蟹选育家系微卫星分析[J]. 水产学报,2012,36(1):25-31.
[25] Liu Y, Cui Z, Shi G, et al. PtPLC, a pacifastin-related inhibitor involved in antibacterial defense and prophenoloxidase cascade of the swimming crabPortunustrituberculatus.[J]. Fish & Shellfish Immunology, 2015, 43(1):36-42.
[26] Kalinowski S T, Taper M L, Marshall T C. Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment[J]. Mole Ecol,2007, 16(5):1099-1106.
[27] Xu Z K, Primavera J H. Genetic diversity of wild and cultured black tiger shrimp(Penaeusmonodon) in the Philippines using microsatellites[J].Aquaculture,2001,199(1/2):13-40.
[28] 杨爽,宋娜,张秀梅,等.基于线粒体控制区序列的三疣梭子蟹增殖放流亲蟹遗传多样性研究[J].水产学报, 2014, 38(8):1090-1096.
[29] 李晓萍,刘萍,李健, 等.应用SSR分析5个三疣梭子蟹野生群体的遗传多样性[J].中国水产科学,2011,18(6):1327-1334.
[30] Botsein D, White R L, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3):314-331.
[31] 法兰克汉R,巴卢丁D,布里斯科D A,著.黄宏文,康明,译.保育遗传学导论[M].北京:科学出版社, 2005:50-53.
[32] Ward R D. The importance of identifying spatial population structure in restocking and stock enhancement programmes[J]. Fisheries Research, 2006, 80(1):9-18.
[33] 伍新尧,童大跃,朱运良,等.用STR分型技术作亲权鉴定时判断标准的研究[J].中山大学学报:医学科学版, 2010,31(1):1-6.
[34] Campton D C. Sperm competition in salmon hatcheries: the need to institutionalize genetically benign spawning protocols[J]. Trans Am Fish Soc, 2004, 133(5):1277-1289.
[35] Tuyttens F A M, Macdonald D W. Consequences of social perturbation for wildlife management and conservation[M].Behaviour and Conservation,Cambridge:Cambridge University Press, 2000:315-329.
ParentalContributionandGeneticDiversitybetweenBroodstockandOffspringsinSwimmingCrab(Portunustrituberculatus)ReleasingintoNaturalWaters
LIU Haiying1,2, LÜ Haibo1,2, CUI Fan1,2, XIE Wanlin1,2,LI Baobao1,2, WANG Lianshun3, LIU Qi1,2,CHEN Lei1,2, XING Kun1,2, WANG Xihong4, SHI Hang4, SONG Bin4
( 1.Center for Marine Ranching Engineering Science Research of Liaoning Province, Dalian Ocean University, Dalian 116023, China; 2. Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province, Dalian Ocean University, Dalian 116023, China; 3. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China; 4. Fisheries Seedlings Authority of Liaoning Province,Dalian 116015,China )
The releasing and enhancement of swimming crab (Portunustrituberculatus) stock has been carried out since 2012 as the wild resources is decreased significantly in recent years. We used 10 microsatellite markers to estimate genetic diversity, the Probability of Exclusion (PE), paternity test accuracy, and the parental contribution of 9 female parents, based on 179 offsprings of swimming crab to consider the difference in contribution to reproduction between parents in the effectiveness of enhancement programs. It was found that there were significantly lower average heterozygosity and polymorphic information content (PIC), observed heterozygosity (Ho)in offsprings than those in the female parents, with significant difference in excepted heterozygosity (He)between broodstock and offsprings (P<0.05, Wilcoxon signed-rank test) and without significant difference in Ho and PIC(P>0.05), showing lower genetic diversity in the offsprings than in their female parents. The 4 microsatellite markers analysis revealed that the PE was ≥0.998 and accuracy was 56.98%. Using 6 microsatellite markers, however, the PE was ≥0.9999 and accuracy was 97.21%, and by using 8 microsatellite markers, the accuracy was 100%, indicating that the accuracy was increased with an increase in the number of microsatellite markers. Nine female parents were all found to be contributed in the production of offspring tested in this experiment, with the maximal contribution of 29.61% and the minimal of 3.35% (P<0.05, Nonparametric chi-square test). The findings indicate that the microsatellite markers as an effective means can be used for assessment of the genetic diversity of swimming crab in enhancement programs, and that provide scientific basic data for the scientific development of crab breeding and releasing in China.
swimming crab; microsatellite marker; genetic diversity; paternity test; contribution
10.16378/j.cnki.1003-1111.2016.06.002
S917
A
1003-1111(2016)06-0613-07
2016-04-05;
2016-05-27.
2016年大学生创新创业训练计划项目;辽宁省科学技术计划项目(2014203016);农业部北方海水增养殖重点实验室基金开放课题(2014-MSENC-KF-14);大连海洋大学博士启动项目(2014017349).
刘海映(1957—),男,教授;研究方向:海洋资源修复.E-mail:hyliu@dlou.edu.cn.通讯作者:刘奇(1983—),男,博士;研究方向:海洋资源修复. E-mail:liuqisunson@dlou.edu.cn.
