MoO42-取代对Nasicon型Li3Fe2(PO4)3正极材料电化学性能的影响
2016-12-20张勃何珺华正伸鲁豪祺王新彭会芬
张勃 何珺 华正伸 鲁豪祺 王新 彭会芬*,,2
MoO42-取代对Nasicon型Li3Fe2(PO4)3正极材料电化学性能的影响
张勃1何珺1华正伸1鲁豪祺1王新1彭会芬*,1,2
(1河北工业大学,材料科学与工程学院,天津300130)
(2天津市材料层状复合与界面控制技术重点实验室,天津300130)
以MoO42-部分取代Li3Fe2(PO4)3中的PO43-,研究表明:加入的MoO42-离子主要以固溶形式存在于Li3Fe2(PO4)3中,起到了显著改善其电化学性能的作用。其中,MoO42-掺杂浓度为0.3的样品表现出最佳的电化学性能,其在0.5C倍率下的首次放电容量为113.7 mAh·g-1,这一数值比未掺杂的提高了20.7%;经过60次循环充放电,容量保持率为94%。将放电倍率从0.5C逐步增大至5C,再降至初始的0.5C,并在每个倍率循环10次,这一材料的最终放电容量可达首次0.5C的95%。这些优异的性能应归因于MoO42-掺杂使材料的氧化还原能力增强,氧化还原电对的电势差减小,电池内部的电荷转移电阻减小,以及Li+扩散系数增加。
正极材料;锂电池;混合阴离子效应;阴离子掺杂;电化学性能
锂离子电池因比能量大、自放电小、循环寿命长、重量轻和环境友好等特点成为便携式电子产品的理想电源,也是未来电动汽车和混合动力汽车的首选电源[1-3]。其中,正极材料因价格、放电容量以及放电电压等问题成为制约锂电池大规模发展的瓶颈[4-5]。近年来,具有良好电化学性能的聚阴离子化合物广受关注,极有可能成为第三代锂离子电池正极材料[6-8]。其中,橄榄石型LiFePO4因安全性高、成本低、循环性能稳定等优势已实现商业化生产。但是,这种化合物只允许锂离子在二维通道内自由穿梭,对于常规多晶状态的电极材料来说是十分不利的。而且,从材料制备角度考虑,为防止LiFePO4中Fe2+的氧化,整个处理工艺都要在保护气氛中进行,增加了材料制备成本。
Nasicon结构的Li3Fe2(PO4)3虽与LiFePO4具有相同的化学组成,但它拥有的三维通道使得Li+在充放电过程中进行快速穿梭变得很容易。另外,这种化合物还具有结构稳定、离子导电率高、合成工艺简单以及成本低等优点[9-12]。Sun等[13]采用Ti4+和Mn2+同时对其中的Fe3+进行取代,结果发现两者取代量分别为0.1时,所得产物Li3Fe1.8Ti0.1Mn0.1(PO4)3的电化学性能最佳,在0.5C倍率的放电容量可达94 mAh· g-1。而用Ti4+单独掺杂的Li2.8Fe2Ti0.2(PO4)3表现出更好的电化学性能,其在0.5C倍率的放电容量达到100.1 mAh·g-1[14]。尽管此数值几乎是目前已报道的有关该化合物的最高数值,但距离锂电池的性能要求尚有很大差距。
混合阴离子效应常用于改善离子导电玻璃的电导率[15-18],但人们发现这种效应对于改善电极材料的电化学性能也同样有效[19-22]。然而,有关对Li3Fe2(PO4)3化合物进行阴离子取代的报道却很少。一方面,最近我们分别利用VO43-和SiO44-阴离子对Nasicon结构的Li3Sc2(PO4)3固体电解质进行阴离子掺杂,发现材料的离子电导率均显著提高[23-24]。另一方面,考虑到Fe2(MoO4)3是与Li3Fe2(PO4)3具有相同晶体结构的正极材料,而且Mo的电负性(2.35)高于P(2.19)[25],若以Mo取代其中的P,极有可能通过诱导效应降低Li3Fe2(PO4)3化合物-O-X-O-Fe-O-X-O-连接中Fe-O键的共价键成分,从而可提高材料的放电平台和容量[25-26]。为此,本文利用MoO42-阴离子对同样具有Nasicon结构的Li3Fe2(PO4)3中PO43-进行部分取代,以期显著改善其电化学性能。
1 试验材料及方法
1.1样品的制备
以LiNO3(大茂化学,99%)、Fe(NO3)3·9H2O(骅跃化工,98.5%)、NH4H2PO4(风船化工,99%)、(NH4)6Mo7O24(博迪化工,99%)为原料,采用溶胶-凝胶法制备MoO42-掺杂的Li3-xFe2(PO4)3-x(MoO4)x(x=0~0.45)目的产物。按上述化学式要求的化学计量比分别称取上述原料,并将其溶解在去离子水中,均匀搅拌,控制金属离子浓度为0.07 mol·L-1。柠檬酸(博迪化工,99.5%)和乙二醇(博迪化工,99%)分别作为配位剂和分散剂,二者以物质的量之比为1:1的比例加入到溶液中。搅拌均匀后添加适量氨水(风船化工,25%),使pH值保持在7.5左右,保持一定时间。将溶液加热到80℃,使多余的水分蒸发,形成凝胶。静置一定时间后逐步升温,除去凝胶中易挥发的物质,形成干凝胶。最后,将干凝胶在空气中于适当温度加热,得到目的产物。
1.2性能测试与表征
将制备的产物作为活性物质,科琴黑(孚华实业,上海)作为导电剂,按照7:2的质量比分别称取两物质,将其在研钵中混合均匀后置于不锈钢球磨罐中,添加Φ10 mm及Φ5 mm的不锈钢球各5个,将球磨罐在充有Ar气的手套箱中密封,置于Fritsch P-7高能球磨机以300 r·min-1的转速进行机械研磨。将一份PTFE粘结剂添加到上述研磨的粉末中,加入适量无水乙醇均匀混合后得到浆料。将制备好的浆料碾压成厚度为100μm的薄膜,切成Φ10 mm的电极片,在真空条件下130℃烘干15 h。以所制备的极片为正极,金属锂片为负极,Celgard 2400为隔膜,1 mol·L-1的LiPF6在EC/DMC(体积比为1:1)混合体系的溶液为电解液,在充有氩气的手套箱中装配电池。为了使电池内部达到平衡,装配好的电池在室温静置3 h后进行电化学性能测试。
物相分析采用日本理学Smart Lab型X射线衍射仪,以Cu Kα为辐射源,波长为0.154 nm,电压为40 kV,电流为40 mA,扫描角度为10°~60°,扫描速度为10°·min-1。为了详细了解材料的结构变化,我们又对2θ≈21°附近的主峰进行慢扫,扫描速度1°·min-1。电池的恒流充放电测试采用LAND CT2001A测试系统,充放电电压范围为2.0~4.0 V。利用Zahner IM6e型电化学工作站进行循环伏安特性曲线测试,扫描速率为0.1 mV·s-1,电压范围为2.0~4.0 V。
2 结果与讨论
2.1材料的相组成与制备工艺优化
图1a是未掺杂(x=0)以及MoO42-掺杂浓度为x= 0.3的样品在不同温度热处理后的XRD图。对于前者,当热处理温度较低(≤600℃)时,所得产物虽然含有一定目的相Li3Fe2(PO4)3,但是另一化合物Li9Fe3(P2O7)3(PO4)2所占比例却很高。只有当处理温度不低于750℃时,才能获得单一的Li3Fe2(PO4)3化合物。考虑到温度再进一步升高,材料的晶粒显著长大,会减少其与导电剂的有效接触,不利于电池充放电过程中离子和电子的传输,故我们将其热处理温度定为750℃。当用MoO42-取代Li3Fe2(PO4)3中的部分PO43-时,我们发现材料中Li3Fe2(PO4)3相的形成温度有所降低,但是无论如何调整处理工艺,也很难获得单纯的Li3Fe2(PO4)3相。其中总伴有少量Fe2(MoO4)3相存在,而且其含量随着热处理温度的升高有所增加。另外,结合图1b的充放电曲线我们可知,x=0.3的样品在热处理温度为600℃时的充放电性能最好。据此,我们将MoO42-掺杂样品的热处理温度定为600℃。

图1 MoO42-取代前后所制备产物的XRD图(a)及MoO42-掺杂浓度为0.3的样品经不同温度处理后的充放电曲线(b)Fig.1 XRD patterns of the products before and after MoO42-substitution(a),and charging-discharging carves of the samples heated at different temperatures with the MoO42-content of 0.3(b)
图2是利用不同浓度MoO42-对Li3Fe2(PO4)3进行掺杂后制备的干凝胶经不同温度热处理后的XRD图。在x=0~0.6范围内,各样品大部分XRD峰都与Li3Fe2(PO4)3化合物吻合得很好,说明此时的主要产物为Li3Fe2(PO4)3。x=0及x=0.15两个样品的XRD图中几乎看不到其它杂相衍射峰,说明基本可以得到纯的Li3Fe2(PO4)3化合物,添加的MoO42-离子已完全溶于其晶格形成固溶体。随着MoO42-掺杂量的增加,除了Li3Fe2(PO4)3相的衍射峰外,在2θ=25.9°附近又出现一新的衍射峰,其强度随着MoO42-掺杂量的增加而提高。与标准物质的XRD卡片对比,我们发现这一衍射峰与Fe2(MoO4)3相吻合得较好,说明MoO42-掺杂浓度较高时,很难形成单一的Nasicon型化合物,总伴有少量Fe2(MoO4)3相生成。

图2 不同浓度MoO42-替代PO43-后制备的Li3-xFe2(PO4)3-x(MoO4)x(x=0~0.6)干凝胶于不同温度热处理的XRD图Fig.2 XRD patterns of the xerogels heat-treated at different temperatures.The xerogels were prepared according to the formula Li3-xFe2(PO4)3-x(MoO4)x,where x is from 0 to 0.6
为进一步探究MoO42-的掺杂效果,我们又对图2中各样品主峰进行慢速扫描,结果如图2右侧附图所示。当x≤0.3时,随着MoO42-加入量的增加,衍射峰逐渐向左移动。这是由于Mo的原子半径(130 pm)比P的原子半径(110 pm)大[27],当大尺寸的MoO42-离子占据Li3Fe2(PO4)3中PO43-位置时,使其晶胞参数增大,衍射角变小的缘故。然而,MoO42-掺杂量进一步增加(x>0.3),衍射峰反而向右移动。这应归因于MoO42-掺杂量太多,导致部分MoO42-与Fe3+结合形成Fe2(MoO4)3相,并未真正起到取代Li3Fe2(PO4)3中PO43-的作用。

图3 对应图2中的各样品在0.5C倍率下充放电曲线(a)及不同倍率下的放电容量(b)Fig.3 Initial charge-discharge curves at 0.5C(a)and initial discharge capacities at different rates(b)of the samples corresponding to those in Fig.2
2.2材料电化学性能测试
图3(a)为对应图2中产物在0.5C倍率下的充放电曲线。放电电压截止到2 V时,未掺杂样品的首次放电容量为94.2 mAh·g-1。MoO42-的加入使样品的放电容量逐渐提高,并在x=0.3时达到最大值(113.7 mAh·g-1)。这一数值比未掺杂的提高了20.7%,达到Li3Fe2(PO4)3理论放电容量的89%。继续提高MoO42-浓度,材料的放电容量有所下降。尽管如此,x=0.45样品的放电容量达到109.5 mAh·g-1,比未掺杂的样品仍高16.2%。
为了进一步检测材料在大电流密度下的电化学性能,我们提高了放电倍率,测试结果如图3(b)所示。为便于比较,我们将他人报道的有关数据也列于其中。尽管材料的放电容量都随放电倍率的增加而降低,但相同倍率下,掺杂MoO42-的材料放电容量明显高于未掺杂样品。而且,随着MoO42-掺杂浓度的提高,材料的放电容量增加。其中,MoO42-掺杂浓度为0.3的样品放电容量最高,在5C倍率下放电容量为79.7 mAh·g-1,这一数值比未掺杂的样品提高了35.1%,约是0.5C倍率下放电容量的70%。但掺杂量进一步增加,材料的放电性能有所下降。即便如此,x=0.45样品在各个倍率下的放电容量也优于未掺杂的样品,导致这种现象的原因可能与图2中第二相析出有关。尽管Ti4+掺杂样品低倍率下的放电数据与MoO42-掺杂浓度为0.3的相当,并优于其它样品,但是0.5C倍率下的放电容量却低于我们的结果,说明本研究所制备的MoO42-掺杂样品具有较好的倍率性能。
虽然Fe2(MoO4)3与本研究的Li3Fe2(PO4)3目的产物一样,同为Nasicon结构化合物,也可作为锂电池的正极材料,但在2~4 V范围内,Fe2(MoO4)3要实现完全可逆地充电,只有2个Li+可进行脱嵌反应,故其理论容量较低(约90 mAh·g-1)[25]。因此,Fe2(MoO4)3相的析出是导致MoO42-掺杂浓度高样品放电容量降低的主要原因。
图4为x=0和x=0.3两样品在不同倍率下的首次充放电曲线,以及对其进行微分的结果。未掺杂样品的放电平台随放电倍率的提高而下降,且变得愈加不明显,逐渐变为平滑的曲线,说明材料内部的反应机制由两相向单相反应机制转变[29],同时,充放电平台间的电压差逐渐增大。x=0.3样品在0.5C倍率下能看到十分明显的平直放电平台(图4b),该平台在放电倍率增加到2C时变短、降低,但依然清晰可辨。另外,比较图4c和4d两个样品相应峰所对应的电压数值也可清楚地断定,MoO42-掺杂确实能够减少材料充放电过程的电势差,说明电池内部的极化变小、充放电的可逆性改善。
图5a为x=0.3的样品在0.5C倍率下多次循环的充放电曲线,经过60次循环,这些充放电曲线变化并不明显,说明Li+的嵌入/脱出并未引起材料结构和性能发生大的变化。样品的放电容量由113.7 mAh·g-1降为106.9 mAh·g-1,容量保持率高达94%,而未掺杂样品的容量保持率只有87%,这再次证明了MoO42-掺杂的有益作用。
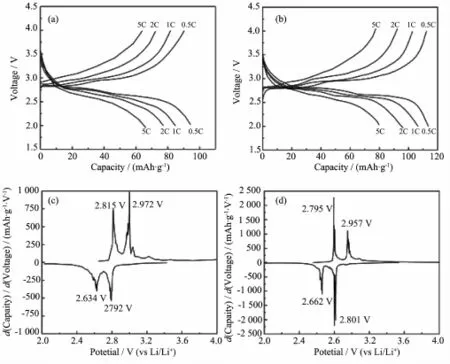
图4 x=0和x=0.3样品在不同倍率下的首次充放电曲线,以及二者分别对0.5C放电曲线进行微分的结果,(a,c)x=0,(b,d)x=0.3Fig.4 Initial charge-discharge curves at different rates and the differentiation to the curves at 0.5C for the Li3-xFe2(PO4)3-x(MoO4)xsamples when x=0(a,c),0.3(b,d)
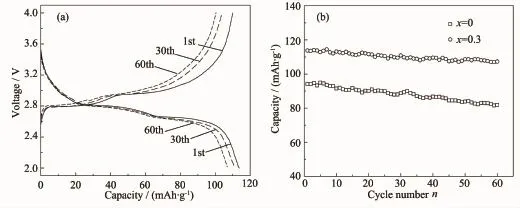
图5 Li2.7Fe2(PO4)2.7(MoO4)0.3样品在0.5C倍率下多次循环的充放电曲线(a)以及不同循环次数下的放电容量(b)Fig.5 Cyclic charge-discharge curves at 0.5C rate of the Li2.7Fe2(PO4)2.7(MoO4)0.3(a),and variation in discharge capacity with cycle number for the samples of x=0 and 0.3
图6(a)是将Li2.7Fe2(PO4)2.7(MoO4)0.3样品进行变倍率放电的试验结果,放电倍率由0.5C逐步增加至1C、2C、5C,再降至0.5C,并在每个倍率下进行10次充放电循环。尽管材料的放电容量随放电倍率的增加不断减小,但在每个放电倍率下,材料的放电容量变化不大。值得注意的是,当放电倍率再次降至0.5C时,其容量仍可达到初次同倍率放电容量的95%。充分说明样品的电化学性能,尤其是循环充放电的稳定性很好。为了进一步确认样品的稳定性,我们将经过上述程序充放电后的极片进行XRD检测,结果如图6(b)。为了便于比较,放电前极片及粉末的XRD图也列与此图。放电前极片的XRD图对应图6 (a)中A点,放电后极片的XRD图对应图6(a)中B点。经过50次不断变换倍率的充放电循环,与放电前相比,极片的XRD图几乎没有明显变化。说明MoO42-掺杂材料的结构十分稳定,经过多次充放电循环仍能够实现其结构的可逆转化。
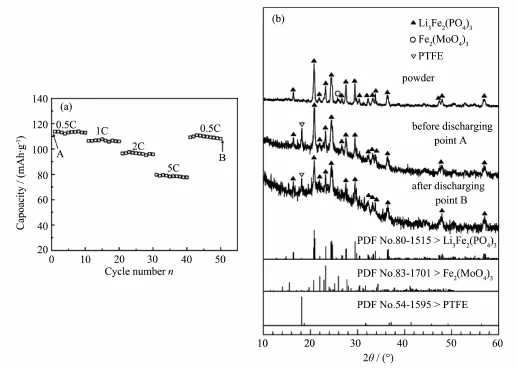
图6(a)Li2.7Fe2(PO4)2.7(MoO4)0.3样品在逐渐增加倍率下放电容量变化(a)及对应图(a)中不同点的XRD图Fig.6 Variation in discharge capacity at gradually raising rates(a),and XRD patterns of the Li2.7Fe2(PO4)2.7(MoO4)0.3corresponding to the points A and B in(a),respectively
图7是掺杂MoO42-后材料的CV曲线。与未掺杂样品的相比,掺杂使材料氧化还原峰的强度明显提高,氧化还原峰之间的电势差变小。其中,x=0.3样品2对氧化还原峰的强度最高,相应的电势差也最小。掺杂量进一步增加,曲线的变化趋势相反,上述结果与图3的结果完全吻合,再次证明MoO42-掺杂使材料的电化学活性改善。掺杂MoO42-量为0.45的样品于3 V附近存在的一对较小氧化还原峰,与文献[25-26]中报道的Fe2(MoO4)3化合物存在3.0 V的放电平台相吻合,这是产物中少量Fe2(MoO4)3相析出造成的。
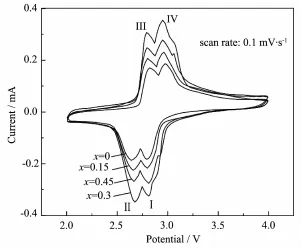
图7 Li3-xFe2(PO4)3-x(MoO4)x(x=0~0.45)CV曲线Fig.7 CV curves of the Li3-xFe2(PO4)3-x(MoO4)x(x=0~0.45)samples
2.3材料的交流阻抗分析
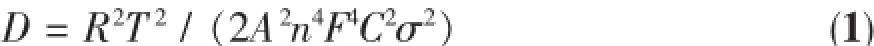
图8a是以不同浓度MoO42-掺杂样品为正极活性物质,锂片为负极所装配电池的交流阻抗谱,它们均由高频区的半圆与低频范围的直线构成。其中,半圆与实轴的交点即为材料的电荷转移电阻Rct。这一数值随着MoO42-掺杂浓度的增加而逐渐减小,并在x=0.3时达到最小值。但MoO42-掺杂量进一步增加,Rct又略有增加。根据阻抗谱低频区直线部分阻抗的实部与角频率的关系曲线(图8b)斜率,再利用公式(1)可计算出各样品中Li+扩散系数D,结果如表1所示。其中,R为气体常数,8.314 J·mol-1·K-1;T为绝对温度;A为正极片的面积(d=1 cm,故A=0.785 cm2);n为单位Li+携带的电荷数目;F为法拉第常数,96 485 C·mol-1;C为Li+物质的量浓度(mol·L-1);σ为Warburg系数。随着MoO42-掺杂浓度的增加,极片中Li+扩散系数逐渐增加,并在x=0.3时达到最大值(3.73×10-11cm2·s-1),这一数值比未掺杂样品提高了一个多数量级,与上述电荷转移电阻、CV曲线及图3的放电结果相吻合。
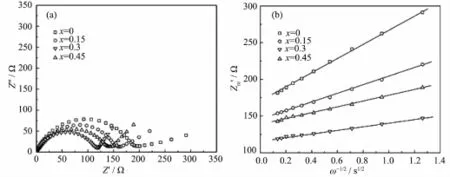
图8 Li3-xFe2(PO4)3-x(MoO4)x样品的交流阻抗谱(a)和实部Zre′与ω-1/2的关系(b)Fig.8 AC impedance spectra(a)and relations between Zre′andω-1/2(b)of the Li3-xFe2(PO4)3-x(MoO4)xsamples

表1 根据图8计算的各样品电荷转移电阻Rct、Warburg系数σ以及Li+离子扩散系数DTable 1 Charge transfer resistance(Rct),warburg coefficients(σ)&Li+diffusion coefficients(D)of the Li3-xFe2(PO4)3-x(MoO4)xsamples
3 结论
利用溶胶-凝胶法能够用MoO42-部分取代Li3Fe2(PO4)3中的PO43-阴离子。当MoO42-掺杂浓度低(≤0.15)时,基本可获得均一的Li3Fe2(PO4)3相,MoO42-增加,会有少量Fe2(MoO4)3第二相形成。电化学性能测试结果表明:MoO42-阴离子掺杂能够显著改善Li3Fe2(PO4)3的电化学性能。其中,掺杂量为0.3时,所得产物在0.5C倍率下的首次放电容量可达113.7 mAh· g-1,比未掺杂样品提高20.7%;60次充放电循环后,该材料的放电容量为106.9 mAh·g-1,容量保持率为94%。放电倍率由0.5C逐渐增加到5C,再降低至0.5C,并在每个倍率循环10次,这一样品的最终放电容量仍可达到首次0.5C倍率的95%。导致这些变化的原因是MoO42-掺杂使电池内部极化减小,电荷转移阻抗减小以及Li+扩散系数增加。
[1]Armand M,Tarascon J M.Nature,2008,451:652-657
[2]ZHAN Yu(张钰),SU Zhi(粟智),PAN Hui(潘会).Chinese J. Inorg.Chem.(无机化学学报),2015,31(9):1827-1830
[3]Shukla A K,Kumar T P.Curr.Sci.India,2008,94(3):314-331
[4]PANG Chun-Hui(庞春会),WU Chuan(吴川),WU Feng (吴锋),et al.J.Ceram.Soc.(硅酸盐学报),2012,40(2):247-255
[5]Hassoun J,Kim J,Lee D J,et al.J.Power Sources,2012, 202:308-313
[6]Padhi A K,Nanjundaswamy K S,Goodenough J B.J. Electrochem.Soc.,1997,144(4):1188-1194
[7]SONG Jian-Jun(宋建军),SHAO Guang-Jie(邵光杰),ZHAO Jian-Wei(赵健伟),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30(3):615-620
[8]Gummow R J,Sharma N,Peterson V K,et al.J.Solid State Chem.,2012,188:32-37
[9]Plylahan N,Vidal-Abarca C,Lavela P,et al.Electrochim. Acta,2012,62:124-131
[10]Yang S F,Zavalij P Y,Whittingham M S.Electrochem. Commun.,2001,3:505-508
[11]Andersson A S,Kalska B,Eyob P,et al.Solid State Ionics, 2001,140:63-70
[12]Karami H,Taala F.J.Power Sources,2011,196:6400-6411
[13]Sun J K,Huang F Q,Wang Y M,et al.J.Alloys Compd., 2009,469(1/2):327-331
[14]Liu Z Q,Huang F Q,Sun J K.Mater.Sci.Eng.,B,2011, 176:1313-1316
[15]Tatsumisago M,Yoneda K,Minami T.J.Am.Ceram.Soc.,1988,71(9):766-769
[16]Tatsumisago M,Machida N,Minami T.J.Ceram.Soc.Jpn., 1987,95(2):197-201
[17]Magistris A,Chiodelli G.Solid State Ionics,1983,9-10(1): 611-615
[18]Carrette B,Ribes M,Souquet J L.Solid State Ionics,1983, 9-10(1):735-737
[19]Hagh N M,Amatucci G G.J.Power Sources,2014,256:457 -469
[20]Bensch W,Bredow T,Ebert H,et al.Solid State Chem., 2009,37(2/3):206-225
[21]Wu Y P,Rahm E,Holze R.Electrochim.Acta,2002,47(21): 3491-3507
[22]SU Zhi(粟智),YE Shi-Hai(叶世海),WANG Yong-Long (王永龙).Chinese J.Inorg.Chem.(无机化学学报),2010,26: 693-700
[23]Geng S X,Yang Y G,Zhang Y G,et al.Electrochim.Acta, 2015,176:327-333
[24]PENG Hui-Fen(彭会芬),GAO Mei-Ling(高美伶),WANG Ming-Fang(王明芳),et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27:1969-1974
[25]Okada S,Yamaki J.J.Ind.Eng.Chem.,2004,10(7):1104-1113
[26]Manthiram A,Goodenough J B.Solid State Chem.,1987,71: 349-360
[27]MA Li(马荔),CHEN Jin-Hong(陈虹锦).Basic Chemistry. 2nd Ed.(无机化学.2版).Beijing:Chemical Industry Press, 2011:478-478
[28]Masquelier C,Padhi A K,Nanjundaswamy K S,et al.J. Solid State Chem.,1998,135:228-234
[29]Xia Y,Zhang W K,Huang H,et al.Mater.Sci.Eng.,B, 2011,176:633-639
Effect of MoO42-Substitution on Electrochemical Properties of Nasicon Li3Fe2(PO4)3Cathode
ZHANG Bo1HE Jun1HUA Zheng-Shen1LU Haoqi1WANG Xin1PENG Hui-Fen*,1,2
(1School of Material Science&Engineering,Hebei University of Technology,Tianjin 300130,China)
(2Tianjin Key Laboratory of Laminating Fabrication&Interface Control Technology for Advanced Materials,Tianjin 300130,China)
MoO42-polyanion wastried to substitute forPO43-partially in the Li3Fe2(PO4)3compound.The resultsproved that the introduced MoO42-anions mainly dissolved in the Li3Fe2(PO4)3and the corresponding electrochemical properties were improved apparently.Among the MoO42-substituted materials,the sample with MoO42-contentof0.3 presented the excellentelectrochemicalproperties.Itsinitialdischarging capacity was113.7 mAh·g-1ata rate of0.5C, which was about20.7%higherthan thatwithoutany MoO42-.The capacity retention was about94%ata rate of0.5C after 60 cycles.Moreover,this materialcould restore 95%ofthe initialcapacity when the discharging rate was reset back to 0.5C even after higher cycling rate of 5C.The boost in electrochemical properties for the MoO42-substituted samples is ascribed to the synergistic effects ofimproved redox ability,decreased potentialpolarization and charge transferresistance aswellasincreased diffusion coefficientoflithium ions.
cathode;lithium battery;mixed anion effect;anion substitution;electrochemical properties
TQ152;O614.61+2
A
1001-4861(2016)12-2109-08
10.11862/CJIC.2016.267
2016-05-19。收修改稿日期:2016-09-19。
河北省自然科学基金(No.E2016202358)资助项目。
*通信联系人。E-mail:peng@hebut.edu.cn
