杂色蛤中ACE抑制肽的分离鉴定与分子对接研究
2016-12-19吴体智盛乃娟毛丽娟
吴体智,盛乃娟,杨 丽,毛丽娟,王 川,吴 皓,刘 睿
(南京中医药大学,江苏省海洋药用生物资源研究与开发重点实验室,江苏南京 210023)
杂色蛤中ACE抑制肽的分离鉴定与分子对接研究
吴体智,盛乃娟,杨 丽,毛丽娟,王 川,吴 皓,刘 睿*
(南京中医药大学,江苏省海洋药用生物资源研究与开发重点实验室,江苏南京 210023)
目的:建立一种快速、准确筛选杂色蛤酶解物中活性多肽的方法。方法:在ACE抑制活性导向下,以超滤技术与离子交换法对杂色蛤酶解物进行分离,确定ACE抑制活性多肽,通过质谱分析与已有序列比对的方法,确定活性多肽的氨基酸序列;通过计算机模拟将多肽与ACE蛋白对接,筛选活性多肽,并确定其与ACE蛋白的作用位点。结果:共鉴定67个多肽,其中QIIVQDLTKR、LDYRPGDKFKGT、NTQIIVQDLTKR和LLFDRAPVNFGNYR这四个多肽能与ACE稳定结合,ACE的Glu403为一重要的结合位点,且Ala356和Arg522对多肽与ACE的稳定结合也产生了重要影响。结论:基于串联质谱与分子对接技术,建立从混合多肽中快速筛选、鉴定活性多肽的方法,明确活性多肽与ACE可能的结合位点,为后续的深入研究提供了依据和参考。
杂色蛤,ACE抑制肽,分子对接
杂色蛤(Ruditapesphilippinarum)是广泛分布于江苏沿海的一种重要双壳经济贝类[1]。传统中医理论认为其贝壳和软体部份均可入药,蛤蜊肉咸、冷、无毒,归胃、肝、膀胱经,宋代《嘉祐本草》中关于蛤蜊有记载:“润五脏,止消渴,开胃,解酒毒。主老癖能为寒热者,及妇人血块,宜煮食之”。现代研究表明蛤蜊酶解肽具有抗肿瘤、抗氧化、血管紧张素转化酶(angiotensin converting enzyme,ACE)活性抑制等多种生物活性[2-4]。然而现阶段对蛤蜊酶解肽这类生物活性肽进行分离、鉴定与评价的思路和方法较为缺乏[5]。基于此点,本论文以中医药理论为依据,结合超滤技术,离子交换法及串联质谱等现代技术方法来探寻和建立一种快速、准确地筛选杂色蛤酶解肽的方法,为中国沿海地区贝类中酶解肽活性的评价与研究提供实验基础与理论依据,为优化生物活性肽的分离鉴定及其活性评价方法奠定基础。
1 材料与方法
1.1 材料与仪器
杂色蛤软体 江苏省海洋水产研究所提供,批号:201409;胰蛋白酶 北京索莱宝公司;血管紧张素转化酶ACE,马尿酰-组氨酰-亮氨酸HHL 美国西格玛奥德里奇公司;乙腈 色谱级 Tedia company;甲酸 国产分析纯 13020110155;超纯水(实验室自制),其他试剂均为国产分析纯。
BP 211D电子天平,BT1250D电子天平 德国Sartorious公司;JJ-2型组织捣碎匀浆机 江苏省金坛市荣光仪器制造公司;3-16PK高速冷冻离心机 德国Sigma公司;Mini Pellicon超滤系统 美国Merck Millipore公司;RotavaporR-210旋转蒸发仪 德国BUCHI公司;Free zone 4.5 plus冷冻干燥机 美国Labconco公司;pHs-3C型精密pH计 上海精密科学仪器有限公司;Waters e2695 高效液相色谱仪 美国沃特斯公司;AKTA 900 蛋白质纯化仪 瑞典AKTA公司。
1.2 实验方法
1.2.1 ACE抑制活性测定方法 活性测定方法参照贾梦蛟等人的方法[6]。ACE与HHL溶液的配制:取适量ACE用0.1 mol/L含0.3 mol/L NaCl硼酸缓冲液(pH8.3)配成浓度为100 mU/mL 的ACE 溶液;取适量HHL用0.1 mol/L硼酸缓冲液(含0.3 mol/L NaCl pH8.3)配成浓度为5 mmol/L的HHL溶液;反应过程:将30 μL HHL和10 μL 样品(或缓冲溶液)混匀后,于37 ℃环境下预热5 min(37 ℃水浴),再加入20 μL的ACE 启动反应,混匀后继续于37 ℃环境下反应1 h(37 ℃水浴),然后迅速加入70 μL HCl(1 mol/L)终止反应,用高效液相色谱分析结果。用硼酸缓冲液代替样品溶液做空白对照。
1.2.1.1 色谱条件 色谱柱:SunFire-C18柱(2.1 mm×100 mm,3.5 μm,美国 Waters 公司);流动相:乙腈-0.5%甲酸水溶液,流速:0.5 mL/min;双波长检测:220 nm、254 nm;柱温:30 ℃;进样量:10 μL。梯度洗脱条件:0~5 min,2%乙腈;5~25 min,2%~40%乙腈;25~30 min,40%乙腈。
ACE抑制率(%)=(1-样品组的马尿酸峰面积/空白组的马尿酸峰面积)×100
1.2.2 IC50的计算 IC50即半数抑制浓度,表示抑制率为一半时样品液的浓度,配置不同浓度的杂色蛤酶解物(μg/mL),测定ACE 抑制率,以 log(酶解物的浓度)为横坐标,ACE抑制率(%)的概率单位为纵坐标,进行回归分析得出回归方程,计算半数抑制浓度(IC50)。很明显,IC50的值越小,其抑制作用越强。
1.2.3 杂色蛤酶解物的制备 将杂色蛤软体洗净泥沙,加入3倍量水煎煮2次,每次1 h,过滤,弃上清液,保留肉渣并沥干称重。取适量肉渣加3倍量水匀浆,加入胰蛋白酶进行酶解,加酶量为肉渣量的0.60%,温度48 ℃、pH8.50,反应时间2 h。酶解结束后于沸水浴灭活15 min,然后于10000 r/min,4 ℃离心20 min,取上清液,备用。
1.2.4 杂色蛤活性酶解物的分离 将制备得的酶解液先经过0.45 μm微孔滤膜抽滤,然后顺序透过截流分子质量为3 ku和1 ku的平板膜,分别得到分子量>3 ku、1~3 ku和<1 ku的酶解产物。然后将酶解产物冻干,配成不同浓度的溶液,测定ACE抑制活性。然后将ACE抑制活性最好的一部分酶解产物过0.45 μm滤膜后经AKTA 900 蛋白质纯化仪纯化分段。对离子交换分离得到的各部位进行ACE抑制活性测定,筛选活性部位。
离子分段色谱条件:离子交换注:色谱填料,DEAE Sepharose Fast Flow;流动相:0.6 mol/L氯化钠——水:流速:3 mL/min;进样量:50 mL;检测波长:254 nm,梯度洗脱条件:1 mol/L氯化钠溶液0%(0~40 min),1 mol/L氯化钠溶液0%~100%(40~140 min)。
1.2.5 活性多肽的鉴定——质谱测序 将离子分段后所得活性最高的部分进行质谱扫描,并结合de novo sequencing从头测序软件测定其中所含多肽的氨基酸序列。
数据库比:串联质谱数据用Proteome Discoverer1.3 软件,SEQUEST 搜库,选择软体动物数据库(Mollusca 2015年3月下载于www.uniprot.org)检索参数设置为:前体离子误差 10 ppm;子离子误差 1 u;半胱氨酸残基固定修饰(氨甲酰甲基化 57.021 5 u);甲硫氨酸残基可变修饰(氧化+15.994 9 u);允许 2 个位点误切,假阳性率(FDR)≤1%;酶切方式选择胰蛋白酶酶切(trypsin);其他参数为默认参数,在上述检索条件下所得分值有显著性意义(p<0.05)被认定为有效的鉴定结果。
1.2.6 分子对接 受体蛋白的准备:从PDB数据库(www.rcsb.org)中下载ACE-lisinopril 复合物(1O86.pdb)X 衍射三维结构数据(PDB code:1O86),依据此复合物确定抑制肽与ACE相互作用的结合位点,并利用Discovery Studio3.0 软件处理该蛋白质:去除所有水分子,为蛋白加氢,去除Lisinopril配体,保留Zn2+和Cl-并优化蛋白质结构。
1.2.6.1 小分子配体的准备 用ChemBioDraw Ultra 13.0软件绘制多肽的分子结构式,用DS中Clean Geometry工具对其进行结构优化,然后再利用CHARMm工具对其进行能量优化,准备好对接配体。
1.2.6.2 分子对接 将ACE蛋白定义为受体,准备好的多肽分子设为配体,按照对接程序,使用CDDOCK程序将配体对接到受体中去。根据所得结果中-CDOCKER_ENERGY值判定最优构象。
2 结果与分析
2.1 ACE抑制活性部位的分离
首先通过超滤分离将杂色蛤酶解物分为三段。如图1所示,分离所得的三段酶解物均表现出一定的ACE抑制作用,其中以分子量小于1 ku部分的抑制效果最好,抑制率为37.44%,这与很多研究结果相一致[7-8],所以对分子量小于1 ku部分的酶解物进一步进行离子交换分离,共分离得到三段物质(图2)。如图3所示,三段离子交换部位除D3段外,另外两段均有明显的ACE活性抑制作用,抑制率分别为:D1:77.01%,D2:61.65%。与未进行离子分段的酶解物的抑制率相比较,分段后所获得的酶解物的抑制率显著提高,这说明通过离子分段,杂色蛤活性酶解物的ACE抑制活性大大增强了。
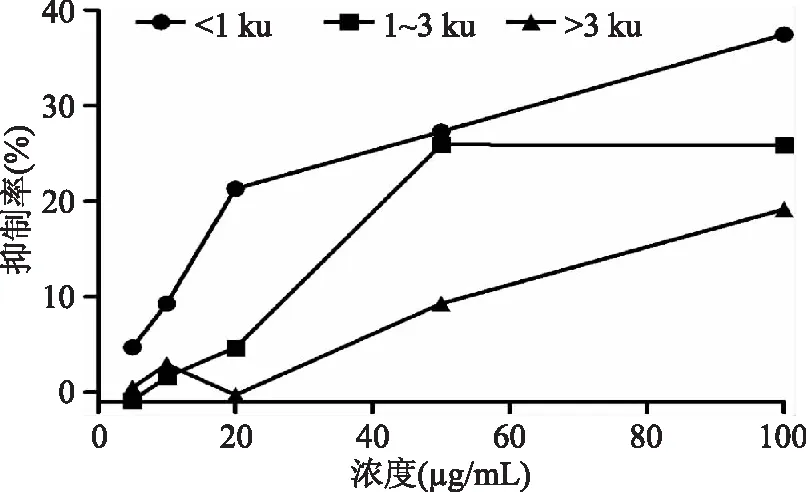
图1 杂色蛤酶解物超滤分离所得各段的ACE抑制曲线图Fig.1 ACE inhibitory of clams hydrolysate separated by ultrafiltration
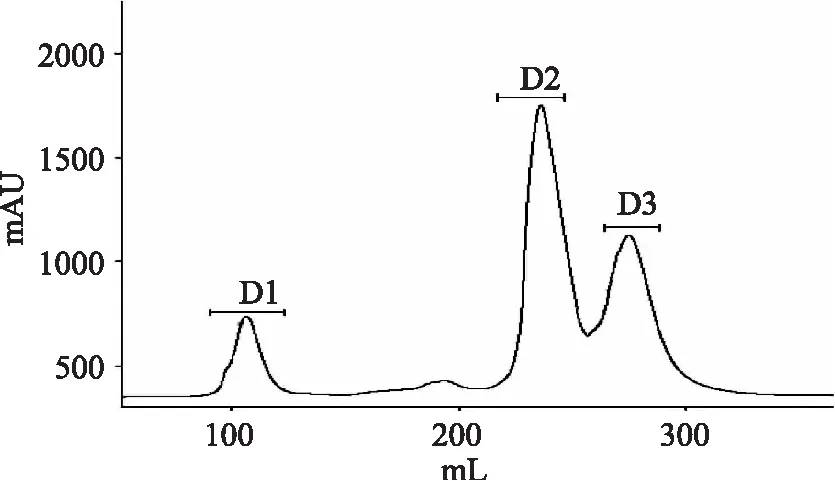
图2 杂色蛤酶解物离子交换分段部位Fig.2 Parts of Clams hydrolysate supernatant separated by ion-exchange
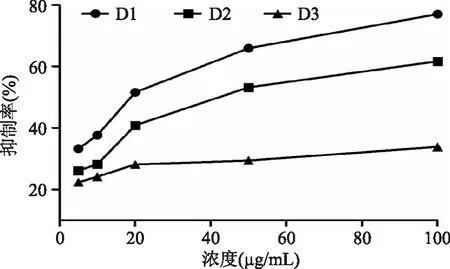
图3 杂色蛤酶解物离子交换所得各部分的ACE活性抑制曲线Fig.3 ACE inhibitory of clams hydrolysate separated by ion-exchange
经计算知,D1段的IC50值为17.60 μg/mL远小于D2段IC50值541.71 μg/mL,可知第一段的ACE抑制作用要比第二段的强很多(表1)。故选取离子分段后的第一段进行下一步的筛选研究。
表1 杂色蛤酶解物离子交换所得各部分的ACE活性抑制IC50值比较
Table 1 IC50of clams hydrolysate separated by ion-exchange

组别D1D2D3IC501760μg/mL54171μg/mL-
2.2 活性部位多肽的鉴定
通过质谱分析,并结合数据库比对与de novo sequencing从头测序软件分析,我们共得到1000多种多肽序列。我们选取-10lgP值≥40的多肽,de novo sequencing软件分析获得的多肽,选取ALC(%)值≥98的多肽,认为这些多肽的序列可信度更高,共得到67个多肽序列(见附件)。
2.3 活性多肽与ACE的分子对接
计算机分子对接技术现已广泛应用于模拟分析生物活性物质与药物作用靶点的分子作用机制[9-12]。本实验通过分子对接来进一步研究从杂色蛤活性酶解物中分离得到的具有高活性的ACE抑制肽对ACE酶抑制作用的分子机制。
ACE酶是一种含锌的二羧肽酶,而锌原子正处于一个包含多个氨基酸残基的活性位点中。据文献查阅可知[13],初步可确定的氨基酸残基共有16种,分别为Arg522,His353,Ala354,Ser355,Ala356,Val380,His383,Glu384,His387,Glu411,Lys511,Phe512,His513,Val518,Tyr520,Tyr523。我们将鉴定所得的67个多肽序列全部进行分子对接,最终根据-CDOCKER_ENERGY值大小,共得到四个较优的多肽序列,分别为QIIVQDLTKR,其-CDOCKER_ENERGY值为140.842;LDYRPGDKFKGT,其-CDOCKER_ENERGY值为150.135;NTQIIVQDLTKR,其-CDOCKER_ENERGY值为172.892;LLFDRAPVNFGNYR,其-CDOCKER_ENERGY值为183.785。在图4中ABCD 四张图分别显示了这四个多肽与ACE相互作用的整体视图,从图中可以明显看出,四个多肽均处于ACE蛋白的空腔中,周围被氨基酸残基紧紧包围着,形成一个较稳定的复合体。
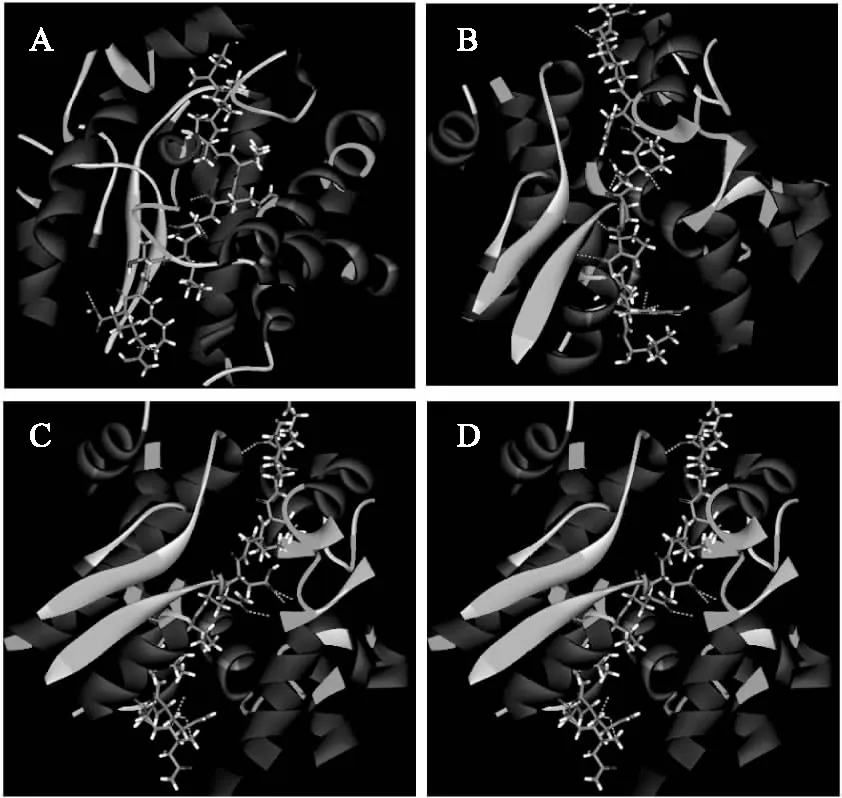
图4 多肽与ACE相互作用的整体视图Fig.4 The overall view of interaction schemes between polypeptides and ACE(说明:1. 图4、图5、图6中A代表多肽QIIVQDLTKR(分子量为1195.69 u),B代表多肽LDYRPGDKFKGT(分子量为1395.71 u),C代表多肽NTQIIVQDLTKR(分子量为1427.81 u),D代表多肽LLFDRAPVNFGNYR(分子量为1680.87 u);2. 图6中亲水氨基酸残基用绿色表示,疏水氨基酸残基用蓝色表示)。
图5中是四个多肽分别与ACE蛋白之间的氢键作用,多肽QIIVQDLTKR—共与ACE蛋白形成7个氢键,参与氢键形成的氨基酸残基有Asn66,His353,Ala356,Asn374,Tyr360,Glu384,Glu403;多肽LDYRPGDKFKGT共与ACE蛋白形成14个氢键,参与氢键形成的氨基酸残基分别是Glu403,Ala356,Glu384,Asn70,Ser517,Arg522,Ala354,His353,Glu162,Ala170,Asn285,Thr302,其中氨基酸残基Arg522和Glu162均形成两个氢键;多肽NTQIIVQDLTKR共与ACE蛋白形成13个氢键,参与氢键形成的氨基酸残基分别是Glu123,Glu403,Ser517,Thr166,Glu376,Tyr520,Ala356,Ala354,Arg522,Lys511,其中,Arg522形成3个氢键,Lys511形成2个氢键;多肽LLFDRAPVNFGNYR共形成7个氢键,参与氢键形成的氨基酸残基分别是Asn285,Asn374,Asp377,His353,Lys511,Glu403,其中氨基酸残基Glu403形成两个氢键。氢键作用是分子间较强的作用力,对两分子间的相互作用有着极其重要的影响[14-15]。从以上参与氢键作用产生的氨基酸残基分布来看,Glu403与四个多肽之间均产生了氢键作用,这说明Glu403对于形成的复合物的稳定存在给予了极大的贡献。而Glu403与多肽LLFDRAPVNFGNYR 之间产生了2个氢键作用,这也可能解释了为什么多肽LLFDRAPVNFGNYR 与ACE蛋白之间只形成了7个氢键但其-CDOCKER_ENERGY值最高。同时,我们还发现,Ala356与四个多肽中的3个产生了氢键作用,Arg522虽只与其中的2个多肽产生氢键作用,但是它分别与多肽11和多肽5产生了3个、2个氢键作用,并且管骁等人的研究[15]发现Arg522是ACE活性位点中起重要作用的氨基酸残基,郭慧青等人的研究[16]认为Ala356 与Arg522均对抑制肽与ACE之间相互作用产生重要影响,故我们推测Ala356 和Arg522也是导致多肽与ACE蛋白稳定结合的两个重要氨基酸残基。
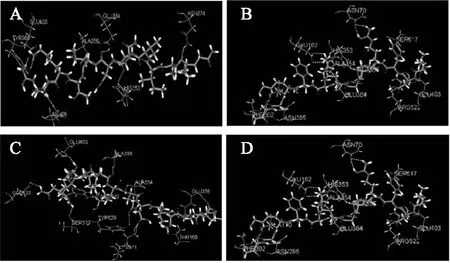
图5 多肽与ACE间的氢键作用Fig.5 Hydrogen bonding interaction between polypeptides and ACE
图6显示的是四个多肽周围的亲水氨基酸与疏水氨基酸的分布,其中多肽QIIVQDLTKR与18个氨基酸残基产生亲水作用,与8个氨基酸残基产生疏水作用,多肽LDYRPGDKFKGT与18个氨基酸产生亲水作用,与6个氨基酸残基产生亲水作用,多肽NTQIIVQDLTKR与19个氨基酸残基产生亲水作用,7个氨基酸残基产生疏水作用,多肽LLFDRAPVNFGNYR与18个氨基酸残基产生亲水作用,与4个氨基酸残基产生疏水作用(见附件)。同时多肽自身含有大量的亲水性基团(-COOH、-NH3、-CO-NH-、-CO-)也参与了分子间亲水作用的形成,这些亲水和疏水作用共同将多肽包裹在ACE蛋白空腔内,使得形成的复合物变得更加稳定。此外,据前期文献报道可知,活性肽的氨基酸序列对其活性有着重要影响[6,17]。当多肽N端含有较多的亮氨酸(Leu)、酪氨酸(Tyr)、缬氨酸(Val)等氨基酸,C端含有一些如精氨酸(Arg)、脯氨酸(Pro)等与ACE活性位点亲和力较强的氨基酸时,能够促进多肽与ACE的位点结合,是ACE抑制肽发挥活性的主要因素。而我们筛选得到的四个活性较高的多肽,其中有两个在N端含有亮氨酸,三个在C端含有精氨酸,并且其中-CDOCKER_ENERGY值最高的多肽(LLFDRAPVNFGNYR)在N端连续含有两个亮氨酸。这也再一次证明筛选得到的四个多肽可能有很强的ACE抑制活性。
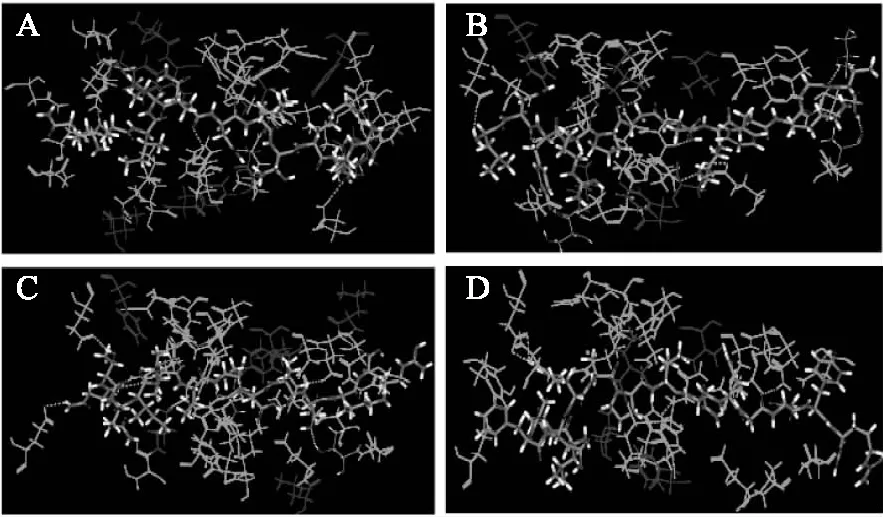
图6 多肽与ACE蛋白间的疏水作用和亲水作用Fig.6 Hydrophobic and hydrophilic interaction between polypeptides and ACE
3 结论
本文研究通过超滤技术与离子交换法对杂色蛤活性酶解物进行分离纯化,LC-MS/MS对纯化后的活性部位鉴定,通过分子对接技术进一步研究筛选活性多肽,及多肽与ACE可能的作用位点。本文方法快速、准确的实现混合多肽中活性多肽的寻找、评价与作用方式,建立了一种快速筛选活性多肽的方法。结果表明,分离鉴定得到的多肽能够与ACE中Glu403,Ala356,Arg522等主要活性位点的氨基酸残基结合,对于促进活性多肽与ACE蛋白形成的复合物稳定性有着重要影响。本文的方法为后续已知靶点的活性多肽的寻找与评价提供参考与借鉴。
[1]刘睿,吴皓,程建明,等.江苏沿海低值贝类资源综合利用现状与展望[J]. 南京中医药大学学报,2015,31(1):93-96.
[2]张玉艳.文蛤抗肿瘤多肽的分离纯化及其作用机理的研究[D]. 青岛:中国科学院研究生院,2010.
[3]嵇晶,刘睿,王令充,等.四角蛤蜊提取物抗氧化活性研究[J]. 中药新药与临床药理,2012,23(1):20-24.
[4]刘睿,朱蕴菡,贾梦蛟,等.四角蛤蜊废弃肉渣制备ACE抑制肽的工艺研究[J].食品工业科技,2013,34(22):145-148.
[5]Liu Rui,Zheng Wenwen,Lijun,et al. Rapid identification of bioactive peptides with antioxidant activity from the enzymatic hydrolysate of Mactra veneriformis by UHPLC-Q-TOF mass spectrometry[J]. Food Chemistry,2015,167:484-489.
[6]贾梦蛟,刘睿,陆杰霖,等.具有ACE 抑制活性的霞水母酶解肽制备条件优化[J]. 中国生物工程杂志,2014,34(3):103-108.
[7]Rafik Balti,Naima Nedjar-Arroume,Estelle Yaba Adje,et al. Analysis of Novel Angiotensin I-Converting Enzyme Inhibitory Peptides from Enzymatic Hydrolysates of Cuttlefish(Sepia officinalis)Muscle Proteins[J]. Agric. Food Chem,2010,58:3840-3846.
[8]Liu Rui,Zhu Yunhan,Wu Hao.Characterization of ACE Inhibitory Peptides from Mactra veneriformis Hydrolysate by Nano-Liquid Chromatography Electrospray Ionization Mass Spectrometry(Nano-LC-ESI-MS)and Molecular Docking[J]. Mar. Drugs,2014,12:3917-3928.
[9]Pan Daodong,Cao Jinxuan,Guo Huiqing,et al.Studies on purification and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J]. Food Chemistry,2012,130:121-126.
[10]V.K Jimsheena,Lalitha R Gowda.Arachin derived peptides as selective angiotensin I-converting enzyme(ACE)inhibitors:Structure-activity relationship[J]. Peptides,2010,31:1165-1176.
[11]Jenn-Shou Tsai,Chen Jia-Ling,Pan Bonnie Sun.ACE-inhibitory peptides identified from the muscle protein hydrolysate of hard clam(Meretrix lusoria)[J]. Process Biochemistry,2008,43:743-747.
[12]郭慧青,毛慧,赵波,等.两种血管紧张素转化酶抑制肽作用于靶标的分子机理[J]. 食品科学,2010,31:23.
[13]Pan Daodong,Guo Huiqing,,Zhao Bo,et al. The molecular mechanisms of interactions between bioactive peptides and angiotensin-converting enzyme[J]. Bioorganic and Medicinal Chemi stry Letters,2011,21(13):3898-3904.
[14]郁彩虹,张耀东,高裙裙,等.分子对接和荧光光谱法研究槲皮素与β-葡萄糖苷酶的相互作用[J].光谱学与光谱分析,2011,31(8):2151-2155.
[15]管骁,苏淅娜,刘静.ACE 抑制三肽与ACE 相互作用的分子机制[J]. 分析测试学报,2014,33(10):1116-1122.
[16]郭慧青,潘道东.乳源ACE 抑制肽作用于靶标模拟分子机理研究[J]. 食品科学,2011,32(23):21-27.
[17]贾俊强,马海乐,王振斌,等.降血压肽的构效关系研究[J]. 中国粮油报,2009,24(5):110-114.
Separation and identification of ACE inhibitory peptides fromRuditapesphilippinarumand molecular docking
WU Ti-zhi,SHENG Nai-juan,YANG Li,MAO Li-juan,WANG Chuan,WU Hao,LIU Rui*
(Jiangsu key laboratory of research and development on marine bio-resource pharmaceutics, Nanjing University of Chinese Medicine,Nanjing 210023,China)
Objective:ToselectthebioactivepeptidesquicklyandaccuratelyfromRuditapes philippinarumhydrolysate.Methods:PeptidesfromRuditapes philippinarumhydrolysatecouldbeseparatedbyultrafiltrationandionexchangechromatographybasedontheACEinhibitoryassay-directfractionation.ThenaminoacidssequencesofpeptideswereidentifiedaccordingtotheMS/MSspectraandproteindatabase.InteractionmechanismbetweenthepeptidesandACEwasinvestigatedbymoleculardocking.Results:67peptideswereidentified,amongwhichfourpeptides,QIIVQDLTKR,LDYRPGDKFKGT,NTQIIVQDLTKRandLLFDRAPVNFGNYR,canbindtoACEstably.OurdockingresultsalsosuggestedthattheACEinhibitorypeptidesbindtoACEviainteractionswithGlu403,Ala356andArg522residuesandtheresidueGlu403mightbeasignificantbindingsite.Conclusions:thisstudycanquicklyselect,identifyandevaluatethebioactivepeptideswhilefindingpotentialbindingsitesbetweenbioactivepeptidesandACE,whichprovidesthebasisandreferenceforfurtherresearch.
Ruditapes philippinarum;ACEinhibitorypeptide;moleculardocking
2016-02-01
吴体智(1993-),男,本科生,研究方向:药物制剂,E-mail:2465724882@qq.com。
*通讯作者:刘睿(1982-),男,博士,副研究员,研究方向:海洋药物研究与开发,E-mail:liurui@njucm.edu.cn。
2013,2014国家海洋公益性行业科研专项(201305007, 201405017) ;江苏高校优势学科建设工程(PAPD);江苏省高等学校大学生实践创新训练计划;江苏省青蓝工程;江苏省中药资源产业化过程协同创新中心,中药资源产业化与方剂创新药物国家地方联合工程研究中心资助。
TS254.9
A
1002-0306(2016)19-0153-05
10.13386/j.issn1002-0306.2016.19.021
