黑果枸杞花青素在水相体系中的稳定性研究
2016-12-19秦艳婷刘荟萃刘成成王树林
陈 虎,叶 英,秦艳婷,刘荟萃,刘成成,王树林
(青海大学农牧学院动科系,青海西宁 810016)
黑果枸杞花青素在水相体系中的稳定性研究
陈 虎,叶 英,秦艳婷,刘荟萃,刘成成,王树林*
(青海大学农牧学院动科系,青海西宁 810016)
以黑果枸杞水提液中花青素保存率为指标,研究黑果枸杞花青素氧化变化规律及几种抗氧化剂提高稳定性的方法。结果显示:黑果枸杞花青素的热降解符合一级反应动力学模型;维生素C、迷迭香、茶多酚及木糖醇对水溶液中花青素具有一定保护作用,可防止水相体系中花青素的氧化,单一使用时有效的质量百分比分别为:0.1%、0.4%、0.3%、6%,保存率分别达到89.0%、87.8%、91.0% 和56.0%;花青素在较低温度(20 ℃),酸性(pH3.0)条件下较稳定;采用微波杀菌时(850 W,5 min),花青素保存率为67.6%,高于其他杀菌方式,微波杀菌对黑枸杞水相体系中的花青素破坏程度最小。
黑果枸杞,花青素,水相体系,稳定性
黑果枸杞(LyciumruthenicumMurr)为茄科(SolanacEae)枸杞属(LyciumL.)植物,主要分布于我国西北地区[1-2]。黑枸杞含有大量的原花青素、花青素、多糖、维生素等营养成分,具有抗氧化、抗衰老、抗肿瘤及清除自由基等功能[3],同时它也是民族医药中的常用药材,藏医以其成熟的果实入药,可治疗心热病、心脏病、月经不调、停经等病症[4]。
黑果枸杞花青素(Anthocyanidin)含量丰富。花青素分子中存在高度分子共轭体系,具有较高活性,但也有很强的不稳定性,如光、热等外界因素都易导致其损失,不同加工处理方法及储存条件对花青素含量亦有明显影响[5]。
热加工不仅易导致花青素的降解,而且可能引起花青素单体聚合、氧化,导致褐变,致使天然蓝紫色消失,失去黑果枸杞天然颜色的特征,这种现象在产品(尤其果汁)中是最不期望发生的。因此,在加工和贮藏过程中花青素的稳定性成为影响该类产品品质的主要因素。本文系统研究了黑果枸杞花青素在水相体系中的氧化变化规律及稳定性,并对提高稳定性的方法进行了探讨,以期为黑果枸杞液态产品开发提供基础数据。
1 材料与方法
1.1 材料与仪器
黑果枸杞 青海省格尔木市;无水乙醇(AR,W%≥99.7%),盐酸(36.0%~38.0%)及氯化钾(AR,W≥99.5%) 天津市富宇精细化工有限公司;柠檬酸(AR,W≥99.8%) 天津市河东区红岩试剂厂;柠檬酸钠(AR,W≥99.0%)及氢氧化钠(AR,W≥96.0%) 天津恒兴化学试剂制造有限公司;迷迭香(W≥99.0%) 河南天辰生物科技有限公司,茶多酚(W≥98.0%,) 郑州市贝斯特食品工业有限公司;木糖醇 浙江华康药业股份有限公司;L-抗坏血酸(AR,W≥99.7%) 上海广诺化学科技有限公司。
STP FA1004电子天平 诸暨市超泽衡器设备有限公司;RE-2000B真空抽滤机 上海亚荣生化仪器厂;电热恒温水槽 上海比朗仪器有限公司;WDP-450电热恒温培养箱 上海安亭科学仪器有限公司;UV-2600紫外可见分光光度计 岛津企业管理有限公司;PHSJ-3FpH计 上海雷磁;LDZM-60KCS立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.2 实验方法
1.2.1 黑果枸杞花青素浓度的测定及保存率计算 采用分光光度法[6-7],用Greey公式计算出花青素的光密度值,计算含量[8-10]。在锥形瓶中加入1 g黑果枸杞粉,加入100 mL蒸馏水,摇匀,在不同处理条件下进行处理,并静置30 min,然后用真空过滤装置抽滤得到黑枸杞水提液,进行密封保存。取10 mL黑果枸杞水提取液样品于试管中,加10 mL 0.1 mol·L-1盐酸乙醇溶液,在60 ℃水浴中浸提30 min后,将试管内的上清液过滤转入到100 mL容量瓶中,剩下的滤渣中加入5 mL的盐酸乙醇溶液,继续在60 ℃水浴中浸提15 min,然后把试管内上清液转入100 mL容量瓶中,滤渣中加5 mL盐酸乙醇溶液,在60 ℃水浴中浸提15 min,最后将试管内的上清液倒入100 mL容量瓶,滤渣用盐酸乙醇溶液冲洗2~3遍,过滤,并将滤液倒入容量瓶内,最后用盐酸乙醇溶液定容到100 mL。
以0.1 mol·L-1的盐酸乙醇溶液做参比液,用分光光度计测定提取液在530、620、650 nm波长下的吸光值。
花青素含量及保存率计算
花青素光密度值:ODλ=(OD530-OD620)-0.1(OD650-OD620)
花青素含量(nmol/g)=ODλ/ε×V/m×1000000
式中:ODλ:花青素在530 nm波长下的光密度;ε:花青素摩尔消光系数4.62×104;V:提取液总体积(mL);m:取样质量(g);1000000:计算结果换算成nmol的倍数。
花青素保存率(%)=ρ/ρ0×100
式中:ρ为处理后花青素浓度(nmol/g),ρ0为处理前花青素浓度(nmol/g)。
1.2.2 黑果枸杞花青素的热降解动力学研究 食品中绝大多数成分降解反应的动力学模型基本上符合零级或一级动力学反应模型[11-12],根据相关数学模型计算反应级数、降解半衰期、反应的速率常数k及反应活化能Ea。
1.2.3 黑果枸杞花青素在水相体系中的稳定性实验
1.2.3.1 温度对花青素稳定性影响的实验 取 5个锥形瓶,在每个锥形瓶中加入1 g黑果枸杞粉,加入100 mL蒸馏水,摇匀,静置30 min 抽滤,滤液密封,分别置于 20、40、60、80、100 ℃恒温水浴锅中加热,每隔 2.0 h 吸取10.0 mL,测定吸光值,平行测定2次取平均值,计算花青素浓度及保存率,并进行热降解动力学模型及相应参数计算。
1.2.3.2 pH对花青素稳定性影响的实验 在1 g黑果枸杞粉中加入100 mL 用柠檬酸及柠檬酸钠缓冲液调整pH为3、4、5、6、7的蒸馏水摇匀,抽滤,滤液密封存放于30 ℃恒温箱。测初始吸光值及保存48 h时的吸光度值,平行测定2次取平均值,计算花青素质量浓度及保存率。储存时间对花青素稳定性影响的实验在1 g黑果枸杞粉中加入100 mL蒸馏水,摇匀,抽滤,滤液密封存,放置于常温下。每隔24 h取样,测定吸光度值,平行测定2次取平均值,计算花青素质量浓度及保存率。
1.2.3.3 杀菌方式对花青素稳定性影响的实验 取4份1 g黑果枸杞粉,分别加入100 mL蒸馏水,摇匀,抽滤。采用水浴锅进行巴氏杀菌(72 ℃,30 min)和煮沸杀菌(93 ℃,15 min),用微波炉进行微波杀菌(850 W,5 min),采用高压灭菌锅进行高压蒸汽灭菌(121 ℃,5 min)。测定处理前后的吸光度值,平行测定2次取平均值,计算花青素浓度及保存率。
1.2.4 木糖醇及抗氧化剂对花青素稳定性影响的实验
1.2.4.1 木糖醇对花青素稳定性影响的实验 取6份1 g黑果枸杞粉样品,分别加100 mL蒸馏水,再分别加入0、2%、4%、6%、8%和10%的木糖醇,摇匀,抽滤,滤液密封存放于30 ℃恒温箱。测定初始吸光度值以及保存48 h的吸光度值,平行测定2次取平均值,计算花青素质量浓度及保存率。
1.2.4.2 抗坏血酸对花青素稳定性影响的实验 取6份1 g黑果枸杞粉,分别加100 mL蒸馏水,再分别加入0、0.1%、0.3%、0.5%、0.7%、0.9%的抗坏血酸,摇匀,抽滤,滤液密封存放于30 ℃恒温箱。测定初始吸光度值以及保存48 h的吸光度值,平行测定2次取平均值,计算花青素质量浓度及保存率。
1.2.4.3 茶多酚对花青素稳定性影响的实验 茶多酚是一种抗氧化性较强的天然抗氧化剂,可以用于液态食品防止活性成分的降解。在7份1 g黑果枸杞粉中分别加入100 mL蒸馏水,再分别加入0、0.06%、0.12%、0.18%、0.24%、0.30%和0.36%的茶多酚,摇匀,抽滤,滤液密封存放于30 ℃恒温箱。测定初始吸光度值以及保存48 h的吸光度值,平行测定2次取平均值,计算花青素质量浓度及保存率。
1.2.4.4 迷迭香对花青素稳定性影响的实验 迷迭香是一种新型的植物提取物抗氧化剂,在水溶性和脂溶性产品中都可以应用。在7个锥形瓶中加入1 g黑果枸杞粉,分别加入0、0.08%、0.16%、0.24%、0.32%、0.40%和0.48%的迷迭香,加100 mL蒸馏水,摇匀,抽滤,滤液密封存放于30 ℃恒温箱。测定初始吸光度值和保存48 h的吸光度值,平行测定2次取平均值,计算花青素质量浓度及保存率。
2 结果与分析
2.1 黑果枸杞花青素热降解动力学模型研究结果
2.1.1 反应级数(n)确定 为了排除因传热引起的误差,分别以20、40、60、80 ℃ 条件下花青素水浴2.0 h的含量为起始值,以花青素含量保存率对数的负值-ln(ρt/ρ0)对加热时间t 作图,结果如图1所示。进行线性回归分析,得回归方程和决定系数,20、40、60、80 ℃条件下决定系数R2分别为0.9216、0.9458、0.988和0.9993,可知-ln(ρt/ρ0)和t成明显线性关系。由公式lnρ1=-kt+lnρ0可知其反应级数为1,即黑果枸杞花青素的热降解符合一级反应模型。
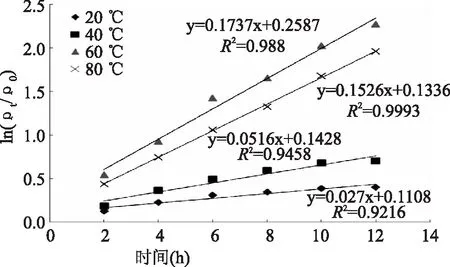
图1 热处理过程中加热时间与-ln(ρt/ρ0)的关系Fig.1 Relationships between heating time and-ln(ρt/ρ0)
2.1.2 黑果枸杞花青素热降解动力学参数的确定 由公式lnρ1=-kt+lnρ0及图1可知,花青素保存率对数的负值-ln(ρ1/ρ0)对加热时间t作图所得直线的斜率即为该温度时的热降解反应常数k。根据不同温度时的k值,以 lnk对1/T作线性回归,由公式k=k0exp(-Ea/RT)可得,直线的斜率为-Ea/R,截距为lnk0,由直线的斜率和截距即可求出活化能Ea和方程常数k0,具体参数如表1所示。
表1 黑果枸杞花青素降解动力学参数
Table 1 Kinetic parameters of thermal degradation of anthocyanidin
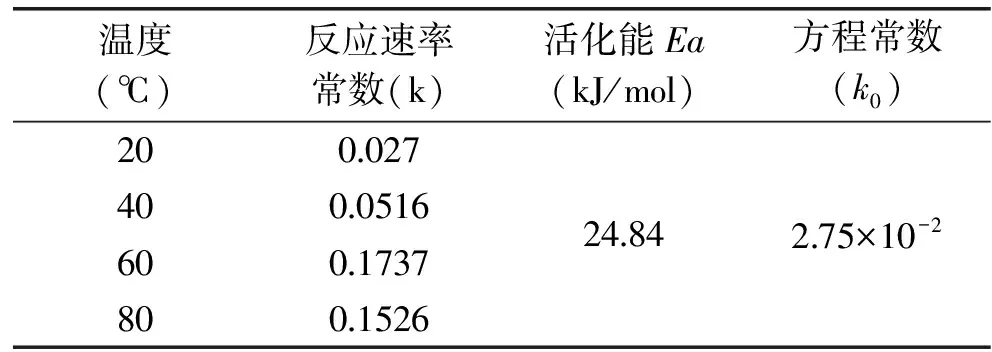
温度(℃)反应速率常数(k)活化能Ea(kJ/mol)方程常数(k0)2000274000516600173780015262484275×10-2
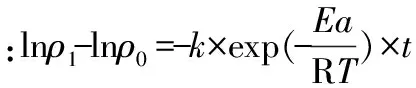
将活化能Ea=24.84kJ/mol、反应常数k0=2.75×10-2、R=8.314J/(mol·K)带入计算得到黑果枸杞花青素热降解的预测模型:t=(lnρ0-lnρ1)/(0.0275×exp(-2987.73/T))。
2.1.4 动力学模型的验证 应用动力学模型分别预测在25 ℃和35 ℃条件下黑果枸杞花青素的半衰期,分别为20.88h和15.44h。将质量浓度为1.06nmol/g的黑果枸杞花青素溶液在以上温度条件下保存,在第21h和第15h测定其花青素质量浓度,分别为0.53、0.55nmol/g,接近初始值的一半,表明动力学降解方程预测值和实际测定值符合,所得动力学模型有效。
2.2 影响水相体系中花青素稳定性单因素实验结果
2.2.1 温度对水相体系中花青素稳定性的影响 由图2可以看出,温度越低,样品中花青素的保存率越高,在温度为60、80、100 ℃时,提取液中黑果枸杞花青素保存率随时间延长下降明显,在20 ℃和40 ℃时,黑果枸杞色素变化量不太明显。
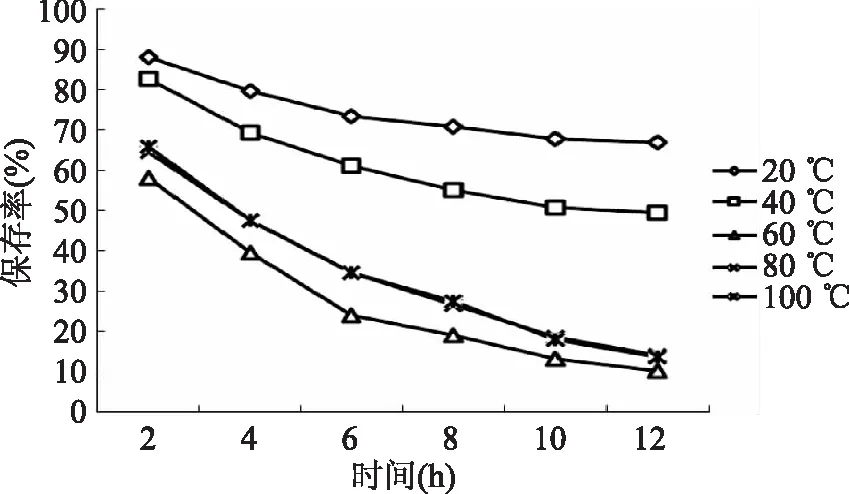
图2 温度对水相体系中花青素稳定性的影响Fig.2 Effect of temperature on the stability of anthocyanidin in aqueous system
本次测定结果显示温度60 ℃时,降解量最大,保存率最小;在80 ℃时,水提液中花青素的保存率高于60 ℃的保存率。这可能的原因是花青素是原花青素氧化产物,随着温度升高,水提液中原花青素的氧化加剧,有部分原花青素转化为花青素,使样品中花青素质量浓度增加。
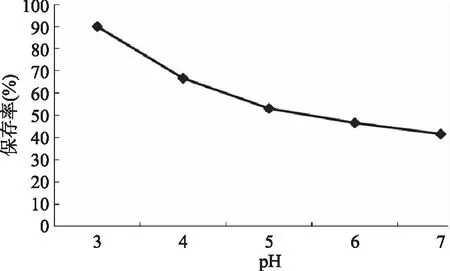
图3 pH对水相体系中花青素稳定性的影响Fig.3 Effect of pH on the stability ofanthocyanidin in aqueous system
2.2.2 pH对水相体系中花青素稳定性的影响 由图6可以看出,随着pH的增大,花青素的保存率降低。在实验范围内,提取液pH为3.0时,花青素的保存率最高。在饮料等液态产品生产中,酸碱环境会明显影响花青素的稳定性[11]。
2.2.3 保存时间对水相体系中花青素稳定性的影响 由图4可以看出,在放置的第1 d,水相体系中花青素保存率变化最大,随后几天内保存率变化不明显,在第4 d时,花青素变化逐渐趋于稳定,因此,在放置初期水相体系中的黑果枸杞花青素减少量最多,因此在产品加工过程中,需要做好初期黑果枸杞花青素抗氧化处理,可采取添加适宜的抗氧化剂、避光及隔氧等措施。
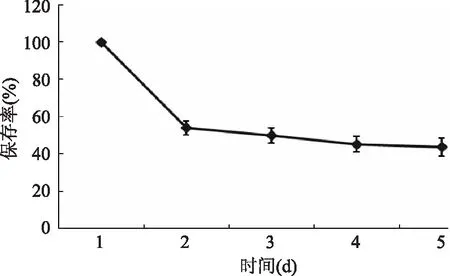
图4 保存时间对水相体系中花青素稳定性的影响Fig.4 Effect of storage time on the stability of anthocyanidin in aqueous system
2.2.4 灭菌方式对水相体系中花青素稳定性的影响 由图5可以看出,微波杀菌与其他灭菌方式相比较,水提液花青素保存率较高(p<0.05)。采用微波灭菌时,黑果枸杞花青素在水相体系中的保存率最高,可达到67.6%,而高压灭菌的保存率最低,说明在微波灭菌时,对花青素的破坏程度最低。实际生产中,在条件允许的情况下,也应该尽量采用微波灭菌。
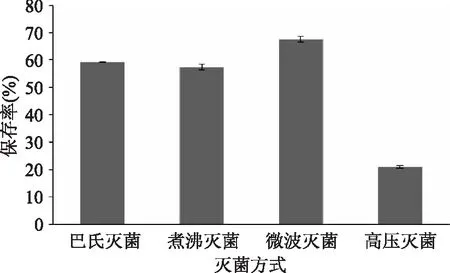
图5 灭菌方式对水相体系中花青素稳定性的影响Fig.5 Effects of sterilization methodson the stability of anthocyanidin in aqueous system
2.2.5 抗氧化剂及木糖醇对水相体系中花青素稳定性影响的实验结果
2.2.5.1 木糖醇对花青素稳定性的影响 由图6可以看出,木糖醇添加量对水提液花青素保存率具有显著影响(p<0.05)。在室温下放置48 h后,不含木糖醇的溶液花青素相对保存率为52.25%,当木糖醇质量百分比为10%时,提取液中花青素相对保存率为46.63%,低于不含木糖醇的花青素溶液,但是,当木糖醇质量百分比为2%、4%、6%、8%时,花青素保存率均高于对照组(p<0.05),最高可达到56.0%,说明一定含量的木糖醇对黑果枸杞具有一定的护色作用,但木糖醇质量百分比达到10%时,花青素的保存率反而降低。研究表明蔗糖能抑制花色苷的降解[11],本研究中一定浓度的木糖醇对水相体系中的花青素也有一定的保护作用,这种保护作用可能与木糖醇丰富的羟基结构有关。但木糖醇浓度与花青素降解之间的量效关系及机理需要进一步研究。
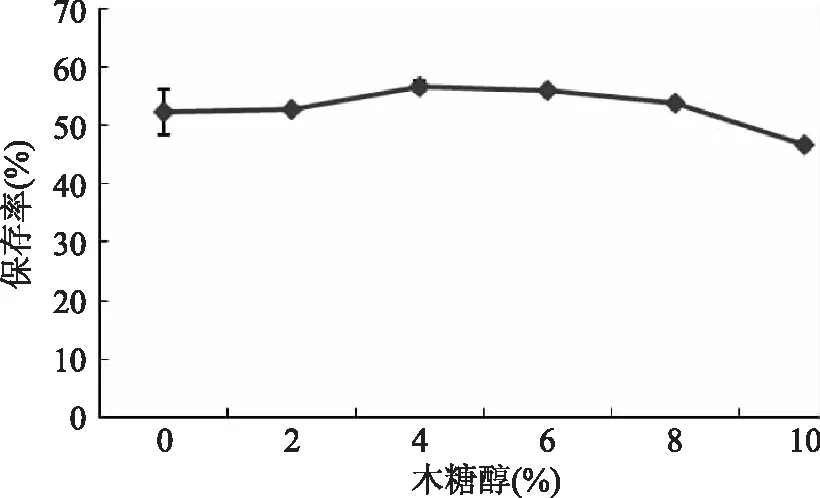
图6 木糖醇对水相体系中花青素稳定性的影响Fig.6 Effect of xylitol on anthocyanidin stability in aqueous system
2.2.5.2 抗坏血酸对水相体系中花青素稳定性的影响 由图7可以看出,抗坏血酸添加量对水提液花青素保存率具有明显影响(p<0.05)。在室温下放置48 h后,不含抗坏血酸的溶液花青素相对保存率为50.94%,当抗坏血酸的质量百分比为0.1%、0.3%、0.5%、0.7%、0.9%时,花青素相对保存率高于不含抗坏血酸的提取液,抗坏血酸质量百分比为0.1%时,色素保存率为89.0%。其他研究结果显示抗坏血酸对花青素具有保护作用[14],此次的研究结果与大多数研究者的结论一致。
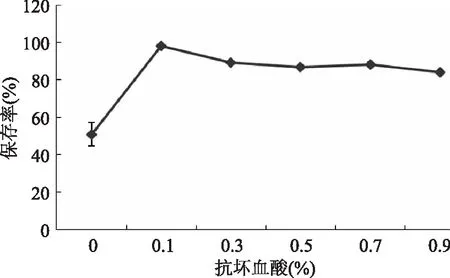
图7 抗坏血酸对水相体系中花青素稳定性的影响Fig.7 Effect of ascorbic acid on the stability of anthocyanidin in aqueous system
2.2.5.3 茶多酚对水相体系中花青素稳定性的影响 由图8可以看出,茶多酚添加量对水提液花青素保存率具有明显影响(p<0.05)。在室温条件下放置48 h后,不含茶多酚的溶液色素相对保存率为51.55%,当茶多酚的质量百分比为0.06%、0.12%、0.18%、0.24%、0.3%、0.36%时,提取液中花青素相对保存率高于不含茶多酚的提取液,但茶多酚质量百分比超过0.12%时,茶多酚在体系中质量百分比的增加并没有明显提高花青素的保存率,茶多酚的保存率甚至出现了波动。说明茶多酚在一定剂量范围内可增加花青素的稳定性。提取液中茶多酚质量百分比为0.12%时,黑果枸杞色素保存率可达到91.0%。
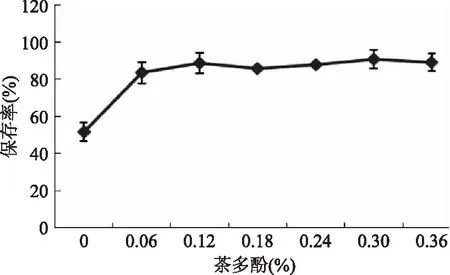
图8 茶多酚对水相体系中花青素稳定性的影响Fig.8 Effects of tea polyphenols on the stability of anthocyanidin in aqueous system
2.2.5.4 迷迭香对水相体系中花青素稳定性的影响 由图9可以看出,不同迷迭香添加量对水提液花青素保存率具有明显影响(p<0.05)。在室温条件下放置48 h后,不含迷迭香的溶液色素相对保存率为53.75%,当迷迭香的质量百分比达到0.08%、0.16%、0.24%、32%,0.4%、0.48%时,提取液花青素相对保存率高于不含迷迭香的提取液,说明迷迭香对花青素具有一定的护色作用。在迷迭香质量百分比为0.4%时,黑果枸杞色素保存率最高,可达到87.8%。
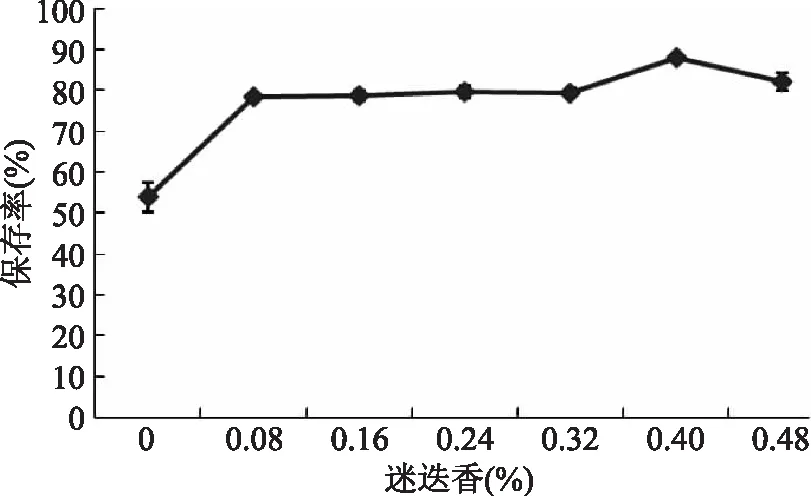
图9 迷迭香对水相体系中花青素稳定性的影响Fig.9 Effect of rosemary on the stability of anthocyanidin in aqueous system
3 结论
黑果枸杞花青素的热降解符合一级反应模型;采用微波灭菌对花青素的破坏程度最低;使用抗坏血酸,迷迭香,茶多酚和木糖醇可防止水相体系花青素氧化。单一使用时有效的质量百分比分别为0.1%、0.4%、0.12%、6%,保存率分别可达到89.0%、
87.8%、91.0%和56.0%;花青素在较低温度(20 ℃),酸性(pH3.0)条件下较稳定;采用微波灭菌时(850 W,5 min),花青素保存率为67.6%,高于其他杀菌方式,微波杀菌对黑枸杞水相体系中的花青素破坏程度最小。
[1]林丽,张裴斯,晋玲,等. 黑果枸杞的研究进展[J]. 中国药房,2013,24(47):4493-4496.
[2]李进,瞿伟菁,张素军,等. 黑果枸杞色素的抗氧化活性研究[J].中国中药杂志,2006,31(14):1179-1183.
[3]段雅彬,姚星辰,朱俊博,等. 藏药黑果枸杞中总花色苷与原花青素的含量测定[J]. 时珍国医国药 2015,26(7):1629-1630.
[4]帝玛尔·丹增彭措. 晶珠本草[M]. 成都:四川科学技术出版社,1986:438.
[5]杨琴,袁涛,孙湘滨. 不同保存方法对牡丹花瓣中花青素和黄酮含量的影响[J]. 食品工业科技,2015,36(17):90-95.
[6]Aandrew P,Michael G M. Changes in Anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose,nitrate,and abscisic acid[J]. Plant physiol,1976,58:468-469.
[7]林耀盛,刘学铭,杨荣玲,等. 桑椹片中多酚及花青素含量的测定[J]. 现代食品科技. 2013,29(4):890-893. 157-160.
[8]赖呈纯,范丽华,黄贤贵,等. 刺葡萄幼胚愈伤组织诱导及其高产原花青素细胞系筛选[J].植物生理学报. 2014,50(11):1683-1691
[9]胡甦. 三角紫叶酢浆草叶色变异株系的组织培养与RAPD和ISSR标记鉴定[D]. 雅安:四川农业大学,2010:14-15
[10]Fuleki T,Francis F J. Quantitative methods for anthocyanins.I. Extraction and determination of total anthocyanins in cranberries[J].Journals of Food Science,1968,33:72-77.
[11]樊金玲,朱文学,巩卫东,等. 蔗糖含量对牡丹花色苷热稳定性和降解动力学的影响[J]. 食品科学,2010,31(3):74-78.
[12]高愿军,郝莉花,张鑫,等. 猕猴桃汁维生素降解动力学的研究[J]. 农业工程学报,2006,22(5):157-160.
[13]李韬,张宏宇,吕玉璋. 花色苷类色素的研究进展[J]. 农业科技与装备,2010,5:23-26.
[14]李月,陈锦屏. 石榴果汁花青素的稳定性及其护色工艺研究[J]. 食品工业科技. 2004,25(12):2-3.
Research of stability of anthocyanidins fromlyciumruthenicummurr in the aqueous system
CHEN Hu,YE Ying,QIN Yan-ting,LIU Hui-cui,LIU Cheng-cheng,WANG Shu-lin*
(Agriculture and Animal Husbandry College of Qinghai University,Xining 810016,China)
WithpreservationrateofanthocyanidinsinwaterextractionliquidfromLycium ruthenicumMurrasindex,thelawofoxidationwerestudied,andthewayofimprovementonstabilityoftheanthocyanidinswerestudiedusingxylitolandantioxidantssuchasVC,rosmarinusofficinalandteapolyphenols.Thedynamicequationoftime-temperatureaboutanthocyanidinsfromlycium ruthenicummurrinaqueoussystemwascalculated,andtheresultsshoweditwasfirstorderreactionkineticsmodel.ThexylitolandantioxidantssuchasVC,rosmarinusofficinalandteapolyphenolscaneffectivelyprotecttheanthocyanidinsfromoxidationinaqueoussystemwhenitsmasspercentwas6%,0.1%,0.4%and0.3%,respectively.Preservationratewas56.0%,89.0%,87.8%and91.0%correspondingtoxylitolandthreeantioxidants.Theanthocyanidinshadhigherstabilizationunder20 ℃,pH3.0thanotherconditions.Therewashigherpreservationrateofanthocyanidinsundermicrowavesterilization(850W,5min)thanotherwayofsterilization,whichwas67.6%.Therewaslessdestructionofanthocyanidinsusingmicrowavesterilizationthanotherways.
lycium ruthenicummurr;anthocyanididins;aqueoussystem;stability
2016-03-18
陈虎(1991-),男,硕士,研究方向:特色食品资源开发,E-mail:819791934@qq.com。
*通讯作者:王树林(1970-), 男,博士,教授,研究方向:青藏高原特色食品资源开发,E-mail:wangsl1970@163.com。
青海省科技厅高新技术研究与发展计划(2015-GX-201A)。
TS201.2
A
1002-0306(2016)19-0127-05
10.13386/j.issn1002-0306.2016.19.016
