肉桂精油对成团泛菌和腐生葡萄球菌的抑菌活性及其机理
2016-12-19曹锦轩潘道东孙杨赢周昌瑜
王 芳,曹锦轩,潘道东,孙杨赢,周昌瑜,徐 娇
(宁波大学海洋学院,浙江宁波 315211)
肉桂精油对成团泛菌和腐生葡萄球菌的抑菌活性及其机理
王 芳,曹锦轩*,潘道东,孙杨赢,周昌瑜,徐 娇
(宁波大学海洋学院,浙江宁波 315211)
本文利用滤纸片法和二倍稀释法分别测定了肉桂精油对成团泛菌及腐生葡萄球菌的抑菌圈直径、最小抑菌浓度(MIC)以及最小杀菌浓度(MBC)来评估肉桂精油对其的抑菌活性,通过扫描电镜、透射电镜探究肉桂精油对成团泛菌和腐生葡萄球菌的形态影响,以及通过测定细胞膜的通透性、细胞膜的完整性和膜电位来共同阐释肉桂精油对两种菌活性抑制的机理。结果表明肉桂精油对成团泛菌和腐生葡萄球菌的生长均有较强的抑制作用,且对腐生葡萄球菌的抑菌作用明显强于成团泛菌的抑制作用;肉桂精油改变细胞的形态、增加膜的通透性、破坏了膜的完整性、并造成了细胞内容物的泄露、膜电位的降低,从而导致细菌的死亡。
肉桂精油,成团泛菌,腐生葡萄球菌,抑菌效果,抑菌机理
肉桂是樟科植物肉桂的树皮或者桂皮,树皮芳香,可作香料使用,主要分布在中国、印度、越南、老挝等地区[1]。肉桂精油是由桂皮、桂叶、桂枝等提取而得,一般为黄色或琥珀色液体。研究表明,肉桂油具有强烈的抑制或杀死微生物的特性,可以作为天然食品防腐保鲜剂。Oussalah等[2]研究发现肉桂精油对李斯特菌、沙门氏菌、大肠杆菌和金黄色葡萄球菌都有很强的抑制能力,MIC均小于0.05%。此外,李京晶等[3]将肉桂精油与常见的化学防腐剂作了对比探讨,采用体外抑菌实验,结果显示肉桂精油的MIC是0.2~1.6 mg/mL,而山梨酸钾及苯甲酸钠的MIC为6.4~25.6 mg/mL。李扬苹等[4]报道了肉桂精油对香荚兰根腐病尖镰孢菌的孢子萌发和菌丝生长有极强的抑制效果,且抑制率可达99.74%和100%。顾仁勇等[5]研究发现肉桂精油可以有效的抑制枯草芽孢杆菌、青霉、酵母、黑曲霉和大肠杆菌的活性,抑菌圈直径在20.6~49.6 mm之间。上述研究表明,关于肉桂精油的抑菌活性研究主要集中在李斯特菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌等,而其对成团泛菌和腐生葡萄球菌的抑菌活性研究相对较少,其抑制机理尚未被明确阐述。
生物胺具有潜在的毒性,若人体内生物胺的含量积累到一定程度,就会对机体产生毒害作用,如引起血管膨胀、偏头痛、高血压,导致呕吐、腹痛和腹泻等[6]。组胺是对人类健康危害最大的生物胺,其次是酪胺。组胺中毒可引起头晕、皮肤瘙痒、恶心和低血压[7]。酪胺被认为是一种主要的诱变剂,可诱发呼吸衰竭、心悸、湿疹、高血压等疾病的发生[8]。此外,多胺如腐胺、尸胺、精胺和亚精胺能与亚硝酸盐发生作用生成亚硝胺等杂环类致癌物质从而威胁人们的健康[9]。如何控制产生物胺细菌的生长繁殖,减少食品中生物胺的含量,从而提高食品的品质及安全性显得尤为重要。
因此,本研究以生鲜猪肉香肠中产生物胺的成团泛菌和腐生葡萄球菌为研究对象,通过测定抑菌圈直径、最小抑菌浓度(MIC)以及最小杀菌浓度(MBC)来评估肉桂精油对其的抑菌活性,然后通过扫描电镜、透射电镜来探究肉桂精油对成团泛菌和腐生葡萄球菌的形态影响,以及通过测定细胞膜的通透性、细胞膜的完整性和膜电位来共同阐释肉桂精油对两种菌活性抑制的机理。本研究为提高食品安全性以及开发天然的抗菌剂提供科学依据。
1 材料与方法
1.1 材料与仪器
成团泛菌(Pantoeaagglomeransstrain GS 1)及腐生葡萄球菌(Staphylococcussaprophyticusstrain CIFT MFB 5247(7)) 浙江省动物蛋白精深加工技术重点实验室分离,生工生物工程技术(上海)股份有限公司鉴定出来的产生物胺菌;100%纯度肉桂单方精油,萃取部位(蒸馏树皮) 上海卓典食品香料有限公司;罗丹明123 上海碧云天生物技术有限公司;吐温80 国药集团化学试剂有限公司;LB培养基 青岛海博生物技术有限公司;其他试剂均为分析纯 国药集团。
H-2050R台式高速冷冻离心机 湘仪离心机仪器有限公司;S-3400N扫描电镜 Hitachi公司;JEM-1230透射电镜 日本JEOL公司;YXQ-LS-50A高压灭菌锅 西安常仪仪器设备有限公司;Infinite 200酶标仪 瑞士TECAN公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;HSW型智能恒温恒湿箱 宁波江南仪器厂。
1.2 实验方法
1.2.1 菌悬液的制备方法 甘油保藏的成团泛菌和腐生葡萄球菌在LB液体培养基中活化2~3代后,吸取1 mL菌液接种到盛有100 mL已灭菌的LB液体培养基中,将含有成团泛菌的LB液体培养基置于30 ℃恒温培养箱中(120 r/min)培养24 h;将含有腐生葡萄球菌的LB液体培养基置于37 ℃恒温培养箱中(120 r/min)培养24 h,然后分别于4 ℃ 8000 r/min离心20 min后,收集菌体,用0.1 mol/L,pH为7.2的磷酸盐(PBS)缓冲液清洗三次,然后用0.85%无菌生理盐水洗涤三次后离心,将菌体重新悬浮于0.85%无菌生理盐水中,用平板菌落记数的方法制备成107cfu/mL的菌悬液,备用。
1.2.2 抑菌圈(DIZ)的测定 参考Tepe等[10],用滤纸片法来测定抑菌圈的大小。吸取100 μL的菌悬液然后均匀地涂布于有固体LB培养基的培养皿表面,无菌镊子夹取一个直径为7 mm的已灭菌的圆形滤纸片,置于每个培养基的中央,将10 μL肉桂精油滴加到滤纸片表面,将含有成团泛菌的LB液体培养基置于30 ℃恒温培养箱中培养24 h;将含有腐生葡萄球菌的LB液体培养基置于37 ℃恒温培养箱中培养24 h,然后用游标卡尺来测定抑菌圈的直径大小,每种细菌做三个重复。以常用的抗生素(1.35 mg/mL的注射用硫酸链霉素溶液)为细菌抑菌实验的阳性对照。抑菌圈实验判定标准参考黄晓冬等[11]。
1.2.3 最小抑菌浓度(MIC)、最小杀菌浓度(MBC)的测定 参考闫绍悦等[12]的方法略作修改,采用试管双倍稀释法,将肉桂精油用1%吐温80稀释成16、8、4、2、1、0.5 μL/mL的肉桂精油溶液,然后分别加入事先装有10 mL LB液体培养基的小试管中,使其最终浓度为8、4、2、1、0.5、0.25 μL/mL。再向各个试管中加50 μL的菌悬液,充分混匀,将含有成团泛菌的LB液体培养基置于30 ℃恒温培养箱中培养24 h;将含有腐生葡萄球菌的LB液体培养基置于37 ℃恒温培养箱中培养24 h。根据试管中液体的浑浊程度来判定精油的MIC值(液体澄清,无细菌生长),以1%的吐温80做对照实验。在MIC值的基础之上,取50 μL的混合菌悬液涂布于LB固体培养基上,将含有成团泛菌的LB液体培养基置于30 ℃恒温培养箱中培养24 h;将含有腐生葡萄球菌的LB液体培养基置于37 ℃恒温培养箱中培养24 h,无菌落生长的精油浓度即为MBC值。
1.2.4 扫描电镜观察肉桂精油对细菌细胞形态的影响 参考Kumar等[13]的方法略作修改。向已制备好的107cfu/mL的菌悬液中分别加入不同浓度的肉桂精油(0 MIC、1 MIC和1 MBC),充分混匀后,成团泛菌在30 ℃恒温培养箱中作用3 h;腐生葡萄球菌在37 ℃恒温培养箱中作用3 h,8000 r/min离心15 min,弃去上清液,用0.1 mol/L,pH为7.2的PBS缓冲液漂洗三次,每次10 min,依次用30%、50%、70%、80%、90%的乙醇溶液进行脱水,每次10 min,然后用无水乙醇洗两次,每次10 min。接着依次用3∶1,1∶1以及1∶3的无水乙醇和叔丁醇的混合溶液来逐级脱水10 min,最后用100%的纯叔丁醇来脱水两次,每次10 min,加少量纯叔丁醇来覆盖样品,放在4 ℃冰箱里,冷冻干燥,样品喷金,用扫描电镜(S-3400N,Hitachi)来观察。
1.2.5 透射电镜观察肉桂精油对细菌细胞形态的影响 参照Yi,S.M[14]的方法并稍作修改。
固定:向已制备好的107cfu/mL的菌悬液中分别加入不同浓度的肉桂精油(0 MIC、1 MIC和1 MBC),充分混匀后,成团泛菌在30 ℃恒温培养箱中作用3 h;腐生葡萄球菌在37 ℃恒温培养箱中作用3 h,8000 r/min离心15 min,弃掉上清液,然后将沉淀的菌体转移到1.5 mL的离心管中,再次离心15 min后,将沉淀菌体在3%的戊二醛中固定2 h,用0.1 mol/L,pH7.2的PBS缓冲液漂洗15 min,重复三次,离心弃去上清,再用1%的锇酸固定2 h,离心弃去上清,用0.1 mol/L,pH7.2的PBS缓冲液漂洗15 min,重复三次。
脱水:依次用30%、50%、70%、90%的乙醇溶液脱水15 min,离心丢弃上清后,用90%的丙酮溶液处理15 min。
浸透:用无水丙酮浸泡15 min,重复三次。然后用1∶1的包埋剂与丙酮的混合液,室温浸泡l h,再用2∶1的包埋剂与丙酮的混合液,室温浸透24 h,最后使用纯包埋剂处理1 h。
包埋:将样品放在包埋块儿的槽子前部,加过包埋剂后,在37 ℃恒温箱内放24 h。然后取出来包埋块,于45 ℃恒温箱里聚合14 h,再转移到60 ℃恒温箱里聚合24 h。
表1 肉桂精油对成团泛菌及腐生葡萄球菌的DIZ、MIC和MBC的影响
Table 1 Effects of diameter of inhibition zone(DIZ),minimum inhibitory concentration(MIC)and minimum bactericidal concentration(MBC)of cinnamon essential oil againstPantoeaagglomeransandStaphylococcussaprophyticus
切片:用超薄的切片机割成70 nm的超薄片,铜网捞片之后要自然晾干。
染色:用铅染液与醋酸铀枸缘酸来双染色。
电镜观察:用日本的JEM-1230透射电镜来观察并挑选典型的样品拍片。
1.2.6 细菌细胞膜通透率的测定 参考Kong 等[15]的方法略作修改,将已制备好的107cfu/mL的菌悬液在5000 r/min离心15 min,弃去上清液,然后用5%的葡萄糖(C6H12O6)溶液来清洗菌悬液,使得菌悬液的相对电导率几乎和5%的C6H12O6一样为止,此时的菌悬液为等渗菌液。接着向5%的C6H12O6里加肉桂精油(0 MIC、1 MIC和1 MBC),充分混匀后,立即测其相对电导率,记为L1;成团泛菌在30 ℃恒温培养箱中作用4 h;腐生葡萄球菌在37 ℃恒温培养箱中作用4 h,每2 h取出来测其相对电导率,记作L2。最后将在5%的C6H12O6中悬浮的菌液在沸水浴中加热5 min后冷却,测其相对电导率记作L0。相对电导率计算公式如下:
相对电导率(%)=100×(L2-L1)/L0
1.2.7 细菌细胞膜完整性的影响 参考Du等[16]的方法,将制备好的菌悬液在5000 r/min下离心10 min,弃上清液,菌体用0.1 mol/L,pH为7.2的PBS缓冲液冲洗3次后重新悬浮于此磷酸盐缓冲液中,加入不同浓度的肉桂精油(0 MIC、1 MIC和1 MBC),成团泛菌在30 ℃恒温培养箱中作用4 h;腐生葡萄球菌在37 ℃恒温培养箱中作用4 h后,8000 r/min离心5 min,取上清液于石英酶标板中,在波长260 nm处测定其吸光度[17]。蛋白质含量及还原糖含量的测定参考Xu 等[18]的方法进行。
1.2.8 细菌膜电位的测定 参考Novo等[19]的实验方法并稍作修改,在备好的107cfu/mL的菌悬液中分别加入不同浓度的肉桂精油(0 MIC、1 MIC和1 MBC),150 r/min振摇3 h后5000 r/min离心10 min弃上清液,菌体用0.1 mol/L,pH7.2的PBS缓冲液冲洗3次。用乙醇将罗丹明123粉末配成浓度为1 mg/mL的母液,分别加到菌悬液中,使其最终浓度为5 μg/mL,避光孵育45 min后,10000 r/min离心5 min,用0.1 mol/L,pH7.2的PBS缓冲液冲洗两次后重新悬浮,然后用流式细胞仪通过激光通道FL1进行检测。
1.3 数据分析
实验数据采用单因素方差分析进行差异性分析(p<0.05),并用Origin 8.0进行绘图。
2 结果与分析
2.1 抑菌圈直径、MIC和MBC
肉桂精油对成团泛菌和腐生葡萄球菌的抑菌圈直径大小、最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定结果见表1。由表可知,肉桂精油作用于成团泛菌和腐生葡萄球菌的抑菌圈直径大小分别为20.78 mm以及28.16 mm,MIC均为0.5 μL/mL,MBC分别为2 μL/mL和1 μL/mL。
抑菌圈大小、MIC和MBC是评价精油抑菌效果的常用指标[20]。Zhang等[20]报道了肉桂精油对常见的食品腐败菌大肠杆菌和金黄色葡萄球菌都有很好的抑菌效果,抑菌圈直径分别为19.2 mm和28.7 mm,MIC均为1.0 mg/mL,MBC分别为4.0 mg/mL和2.0 mg/mL。肉桂醛是肉桂精油的主要成分[21],Prabuseenivasan等[22]研究发现肉桂醛有抑菌、防腐及抗氧化的特性。本研究结果显示,肉桂精油对成团泛菌和腐生葡萄球菌都有很强的抑菌作用,很可能是肉桂精油中的肉桂醛抑制了这两种菌的活性;本研究还发现肉桂精油对腐生葡萄球菌(革兰氏阳性菌)的抑菌效果明显好于成团泛菌(革兰氏阴性菌),这与Bagamboula等[23]的结果类似,这可能是由于革兰氏阴性细菌存在的高脂多糖含量的双层膜结构,革兰氏阳性菌的单层膜结构使得肉桂精油更容易侵入。
2.2 扫描电镜观察肉桂精油对细菌壁膜的影响
肉桂精油对细菌壁膜影响的扫描电镜结果如图1所示,由图1A可知,未经肉桂精油处理的成团泛菌(A1)呈现典型的短杆状,菌体表面平整光滑,形态完好。添加1 MIC肉桂精油处理3 h后(A2),一部分细胞形态遭到破坏,菌体发生了扭曲变形,部分菌体的表面出现了明显的凹陷褶皱或孔洞。添加1 MBC肉桂精油作用3 h后(A3),菌体细胞壁膜的破坏程度更严重,出现明显凹陷褶皱或孔洞的菌体数量明显增多。由图1B可知,无肉桂精油添加的腐生葡萄球菌(B1)细胞表面光滑、平整,外观呈饱满的圆球状,菌体形态完好,折光性好。添加1 MIC肉桂精油处理3 h(B2)后,菌体表面不平整,形态也遭到了破损,添加1 MBC肉桂精油作用3 h后(B3),菌体的形态破损更加严重。由此可知,肉桂精油对革兰氏阴性菌和革兰氏阳性菌的细胞都有破坏作用。扫描电镜图可以从形态学方面来表明肉桂精油的抑菌机制。

图1 成团泛菌(A1、A2、A3)和腐生葡萄球菌(B1、B2、B3)的扫描电镜图Fig.1 Scanning electron microphotographs of Pantoea agglomerans(A1、A2、A3) and Staphylococcus saprophyticus(B1、B2、B3)注:A1、B1:对照组;A2、B2:1 MIC肉桂精油处理3 h;A3、B3:1 MBC肉桂精油处理3 h,图2同。
2.3 透射电镜观察肉桂精油对细菌壁膜的影响
肉桂精油对细菌壁膜影响的透射电镜结果如图2所示,由图可知,未经肉桂精油处理的成团泛菌(A1)细胞形态完好,细胞膜完整,细胞壁结构紧密,细胞质均匀。添加1 MIC肉桂精油处理3 h后(A2),细胞质分布开始出现不均匀,细胞壁和细胞膜破损,细胞内出现低密度空白区。继续加大肉桂精油浓度为1 MBC作用3 h后(A3),菌体细胞壁膜的破损非常严重,细胞内出现大面积的低密度空白区。无肉桂精油添加的对照组(B1)腐生葡萄球菌的细胞质均匀,细胞壁结构紧密,细胞膜完整,清晰可见。添加1 MIC肉桂精油处理3 h后(B2),菌体表面出现了皱缩,细胞内物质分布不均匀,出现了低电子密度区,当1 MBC精油浓度作用3 h后(B3),细胞壁与细胞膜开始出现模糊不清,细胞内有大面积的低电子密度空白区。结果表明,肉桂精油对细菌有很强的破坏作用,且作用效果与精油的浓度有关,这与扫描电镜的变化相呼应。
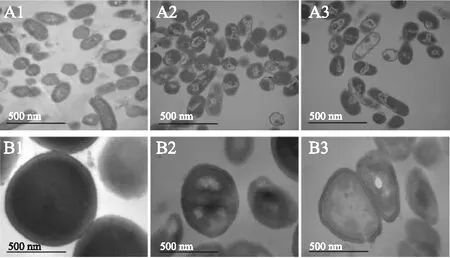
图2 成团泛菌(A1、A2、A3)和腐生葡萄球菌(B1、B2、B3)的透射电镜图Fig.2 Transmission electron microphotographs of Pantoea agglomerans(A1、A2、A3) and Staphylococcus saprophyticus(B1、B2、B3)
2.4 肉桂精油对细菌细胞膜通透性的影响
肉桂精油对细菌细胞膜通透性的影响结果如图3所示。随着肉桂精油浓度的增大,成团泛菌和腐生葡萄球菌菌悬液的相对电导率显著增加(p<0.05);随着肉桂精油作用时间的延长,成团泛菌和腐生葡萄球菌菌悬液的相对电导率显著增加(p<0.05)。由图3A可知,从0~4 h,未经肉桂精油处理(Control)的成团泛菌菌悬液的相对电导率由0.2%增加至4.77%,其增加幅度较小。而分别加入1 MIC、1 MBC浓度的精油后,成团泛菌和腐生葡萄球菌菌悬液的相对电导率分别增加至41.2%和56.63%。由图3B可知,当分别加入1 MIC、1 MBC浓度的精油后,成团泛菌和腐生葡萄球菌菌悬液的相对电导率分别增加至65.67%和75.66%。
Diao等[24]研究指出正常的细菌结构选择性透过H+、K+、Na+等小分子物质,此作用使得细菌生存于稳定的H+、K+、Na+等离子浓度环境。本研究发现,成团泛菌和腐生葡萄球菌菌悬液的相对电导率随着肉桂精油浓度的增大而增加,这与Zhang等[20]研究结果类似。这种现象很可能是肉桂精油作用于细胞膜,使得电解质大量泄漏影响细菌的正常代谢,最终导致细菌死亡。

图3 肉桂精油对成团泛菌(A)及腐生葡萄球菌(B)细胞膜通透性的影响Fig.3 Effects of cinnamon essential oil on the permeability of cell membrane of Pantoea agglomerans(A) and Staphylococcus saprophyticus(B)注:大写字母代表不同处理组之间的差异性,字母不同表示差异显著(p<0.05);小写字母代表不同时间点之间的差异性,字母不同表示差异显著(p<0.05),图4同。
2.5 肉桂精油对细菌膜完整性的影响

表2 肉桂精油对成团泛菌及腐生葡萄球菌的内容物释放的影响Table 2 Effects of cinnamon essential oil on cell constituents’ release of tested Pantoea agglomerans and Staphylococcus saprophyticus
注:同一列的字母不同代表差异显著(p<0.05)。不同浓度的肉桂精油对成团泛菌及腐生葡萄球菌的细胞膜完整性的影响结果见表2。由表可知,随着精油浓度的增大,成团泛菌及腐生葡萄球菌菌液的OD260 nm、蛋白质和还原糖的含量显著增加(p<0.05)。与对照组相比,当添加1 MIC肉桂精油时,成团泛菌菌液中的OD260 nm、蛋白质和还原糖分别增加至6.30、4.31和3.61倍;而当肉桂精油浓度为1 MBC时,成团泛菌菌液中的OD260 nm、蛋白质和还原糖分别增加至14.62、9.75和5.12倍。与成团泛菌类似,未经肉桂精油处理(Control)的腐生葡萄球菌,OD260 nm吸光度值较低,蛋白质以及还原糖的含量也不高,当添加1 MIC肉桂精油时,腐生葡萄球菌菌悬液中的OD260 nm、蛋白质和还原糖分别增加至7.68、4.23和4.04倍,然而当添加1 MBC肉桂精油后,腐生葡萄球菌菌悬液中的OD260 nm、蛋白质和还原糖分别增加至14.08、6.76和5.24倍。
细胞内蛋白质的含量和OD260 nm吸光度值可以反映细胞内容物的泄露情况,进而推测细菌细胞膜的完整性[25]。细菌细胞内的大分子物质包括蛋白质和核酸,它们是细胞的重要结构组分。本研究结果显示,肉桂精油破坏了成团泛菌和腐生葡萄球菌的细胞膜完整性,可能是由于肉桂精油造成了细胞膜的不可逆损伤,引起细胞内蛋白质、核酸及还原糖物质的释放,进而可致细胞死亡,这与Diao等[24]的研究一致。
2.6 肉桂精油对细菌膜电位的影响

图4 肉桂精油对成团泛菌及腐生葡萄球菌膜电位的影响Fig.4 Effects of cinnamon essential oil on the membrane potential of Pantoea agglomerans and Staphylococcus saprophyticus
从图4可知,随着肉桂精油浓度的增大,成团泛菌和腐生葡萄球菌的平均荧光强度显著降低(p<0.05);腐生葡萄球菌的平均荧光强度显著低于成团泛菌的平均荧光强度(p<0.05)。其中,未经肉桂精油处理(Control)的成团泛菌和腐生葡萄球菌的平均荧光强度分别为34.15 AU和19.44 AU。当添加1 MIC肉桂精油时,成团泛菌和腐生葡萄球菌的菌悬液的平均荧光强度分别下降了55.64%和56.12%,而当肉桂精油浓度为1 MBC时,成团泛菌和腐生葡萄球菌的平均荧光强度分别下降了91.41%和86.38%。
膜电位指的是生物膜内外的电势差,它作为一个质子动力元件,可参与ATP的形成[26]。膜电位在细菌的生理活动中发挥着重要的作用[27],例如细菌膜电位的改变可以引起细胞代谢活动的变化。本研究结果显示,添加肉桂精油可以显著降低成团泛菌和腐生葡萄球的平均荧光强度,这与张赟彬等[28]的发现相符,平均荧光强度的降低表明细胞膜产生去极化,干扰了细菌的正常代谢,从而使细菌死亡。
3 结论
本研究显示肉桂精油对成团泛菌和腐生葡萄球菌均有明显的抑菌作用,且抑菌效果:腐生葡萄球菌>成团泛菌;肉桂精油改变了成团泛菌和腐生葡萄球菌的细菌细胞形态,破坏了细胞壁和细胞膜的完整性,增加了细胞膜的通透性,使得细胞膜电位降低,导致细胞内小分子物质如蛋白质、核酸和还原糖发生了泄漏,影响了细菌的正常代谢活动,导致其死亡。本研究为开发天然、高效的成团泛菌和腐生葡萄球菌的抑制剂,提高食品安全性提供了理论依据。
[1]Wang R,Wang R,Yang B. Extraction of essential oils from five cinnamon leaves and identification of their volatile compound compositions[J]. Innovative Food Science & Emerging Technologies,2009,10(2):289-292.
[2]Oussalah M,Caillet S,Saucier L,et al. Inhibitory effects of selected plant essential oils on the growth of four pathogenic bacteria:E. coli O157∶H7,Salmonella typhimurium,Staphylococcus aureus and Listeria monocytogenes[J]. Food control,2007,18(5):414-420.
[3]李京晶,籍保平,周峰,等. 丁香和肉桂挥发油的提取,主要成分测定及其抗菌活性研究[J]. 食品科学,2006,27(8):64-68.
[4]李扬苹,何霞红,朱有勇,等. 7 种精油对香荚兰根腐病尖镰孢菌抑菌作用的初步研究[J]. 西北农林科技大学学报:自然科学版,2004,32(10):89-93.
[5]顾仁勇,傅伟昌,李佑稷,等. 肉桂精油抑菌及抗氧化作用的研究[J]. 食品研究与开发,2008,29(10):29-32.
[6]González-Fernández C,Santos E M,Jaime I,et al. Influence of starter cultures and sugar concentrations on biogenic amine contents in chorizo dry sausage[J]. Food Microbiology,2003,20(3):275-284.
[7]Bodmer S,Imark C,Kneubühl M. Biogenic amines in foods:histamine and food processing[J]. Inflammation research,1999,48(6):296-300.
[8]Joosten H. The biogenic amine contents of Dutch cheese and their toxicological significance[J]. Netherlands Milk and Dairy Journal(Netherlands),1988,42(1):,25-42.
[9]Scanlan R A. Formation and occurrence of nitrosamines in food[J]. Cancer research,1983,(43)2435-2440.
[10]Tepe B,Daferera D,Sokmen A,et al. Antimicrobial and antioxidant activities of the essential oil and various extracts of Salvia tomentosa Miller(Lamiaceae). Food chemistry,(2005),90(3),333-340.
[11]黄晓冬,黄晓昆,张娴,等.天竺桂叶精油的含量动态,化学成分及体外抗菌活性[J]. 中国农学通报,(2010),26(4),182-188.
[12]闫绍悦,林树乾,傅剑,等.五味子提取液抑菌活性研究[J]. 中国实验方剂学杂志,2014,20(10):142-146.
[13]Kumar P P N V,Shameem U,Kollu P,et al. Green Synthesis of Copper Oxide Nanoparticles Using Aloe vera Leaf Extract and Its Antibacterial Activity Against Fish Bacterial Pathogens[J]. BioNanoScience,2015,5(3):135-139.
[14]Yi S,Zhu J,Fu L,et al. Tea polyphenols inhibit Pseudomonas aeruginosa through damage to the cell membrane[J]. International Journal of Food Microbiology,2010,144(1):111-117.
[15]Kong M,Chen X G,Liu C S,et al. Antibacterial mechanism of chitosan microspheres in a solid dispersing system against E. coli[J]. Colloids and Surfaces B:Biointerfaces,2008,65(2):197-202.
[16]Du W,Sun C,Liang Z,et al. Antibacterial activity of hypocrellin A against Staphylococcus aureus[J]. World Journal of Microbiology and Biotechnology,2012,28(11):3151-3157.
[17]Aronsson K,Rönner U,Borch E. Inactivation of Escherichia coli,Listeria innocua and Saccharomyces cerevisiae in relation to membrane permeabilization and subsequent leakage of intracellular compounds due to pulsed electric field processing[J]. International Journal of Food Microbiology,2005,99(1):19-32.
[18]Xu J,Hu Q,Wang X,et al. Changes in the main nutrients,phytochemicals,and antioxidant activity in yellow corn grain during maturation[J]. Journal of Agricultural and Food Chemistry,2010,58(9):5751-5756.
[19]Novo D,Perlmutter N G,Hunt R H,et al. Accurate flow cytometric membrane potential measurement in bacteria using diethyloxacarbocyanine and a ratiometric technique[J]. Cytometry,1999,35(1):55-63.
[20]Zhang Y,Liu X,Wang Y,et al. Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J]. Food Control,2016,(59):282-289.
[21]Mallavarapu G R,Ramesh S,Chandrasekhara R S,et al. Investigation of the essential oil of cinnamon leaf grown at Bangalore and Hyderabad[J]. Flavour and Fragrance Journal,1995,10(4):239-242.
[22]Prabuseenivasan S,Jayakumar M,Ignacimuthu S.Invitroantibacterial activity of some plant essential oils[J]. BMC Complementary and Alternative Medicine,2006,6(1):1-8.
[23]Bagamboula C,Uyttendaele M,Debevere J. Inhibitory effect of thyme and basil essential oils,carvacrol,thymol,estragol,linalool and p-cymene towards Shigella sonnei and S. flexneri[J]. Food Microbiology,2004,21(1),33-42.
[24]Diao W R,Hu Q P,Zhang H,et al. Chemical composition,antibacterial activity and mechanism of action of essential oil from seeds of fennel(FoeniculumvulgareMill.)[J]. Food Control,2014,35(1):109-116.
[25]Bajpai V K,Sharma A,Baek K H. Antibacterial mode of action of Cudrania tricuspidata fruit essential oil,affecting membrane permeability and surface characteristics of food-borne pathogens[J]. Food Control,2013,32(2):582-590.
[26]Dimroth P,Kaim G,Matthey U. Crucial role of the membrane potential for ATP synthesis by F1F0 ATP synthases[J]. The Journal of Experimental Biology,2000(1),203,51-59.
[27]Borges,A.,Ferreira,C.,Saavedra,M. J.,& Simoes,M. Antibacterial activity and mode of action of ferulic and gallic acids against pathogenic bacteria[J]. Microbial Drug Resistance,2013,19(4),256-265.
[28]张赟彬,刘笑宇,姜萍萍,等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技,2015,31(5):31-35.
Bacteriostatic activity and mechanism of cinnamon essential oil againstPantoeaagglomeransandStaphylococcussaprophyticus
WANG Fang,CAO Jin-xuan*,PAN Dao-dong,SUN Yang-ying,ZHOU Chang-yu,XU Jiao
(Ocean University,Ningbo University,Ningbo 315211,China)
Bacteriostaticactivitywasevaluatedbymeansoftheinhibitionzonediameterswithfilterpaperandminimuminhibitoryconcentration(MIC)andminimumbactericidalconcentration(MBC)bythedoubledilutionmethod.Inaddition,theantibacterialmechanismaccordingtoscanningelectronmicroscopy,transmissionelectronmicroscopy,cellmembranepermeabilityandintegrityandmembranepotentialwerediscussed.Resultsindicatedthatcinnamonessentialoilexhibitedsignificantinhibitionoftwotestedstrains,andStaphylococcus saprophyticuswasmoreeffectivethanPantoea agglomerans.Furthermore,cinnamonessentialoilcouldcauseseveredamagetocellmicrostructure,cellwallandcellmembrane,enhancingthemembranepermeability,leadingtotheleakageofcellularmaterials,resultinginbacterialdeath.
cinnamonessentialoil;Pantoea agglomevans;Staphylococcus saprophyticus;bacteriostaticactivity;antibacterialmechanism
2016-03-01
王芳(1989-),女,硕士研究生,主要从事畜产品加工与质量控制研究,E-mail:15728046548@163.com。
*通讯作者:曹锦轩(1982-),男,博士,副研究员,主要从事畜产品加工与质量控制研究,E-mail:caojinxuan@nbu.edu.cn。
宁波市创新团队(2012B82017);国家农业科技成果转化资金项目(2013GB2C200191);国家自然科学基金资助项目(31471681)。
TS201.3
A
1002-0306(2016)19-0075-06
10.13386/j.issn1002-0306.2016.19.006
