磷酸肽的钙结合机制及抑制磷酸钙结晶的效果
2016-12-19李八方曾名湧
黄 海,李八方,曾名湧,*
(1.钦州学院食品工程学院,广西钦州 535011; 2.广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011; 3.中国海洋大学食品科学与工程学院,山东青岛 266003)
磷酸肽的钙结合机制及抑制磷酸钙结晶的效果
黄 海1,2,李八方3,曾名湧3,*
(1.钦州学院食品工程学院,广西钦州 535011; 2.广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011; 3.中国海洋大学食品科学与工程学院,山东青岛 266003)
探讨源于鲤鱼卵肽(carp egg peptide,CEP)的磷酸肽(isolated phosphopeptide,IPP)的钙结合机制及其抑制磷酸钙结晶的效果。通过质谱和红外光谱解析IPP结合钙的位点,通过红外光谱和圆二色谱分析IPP结合钙前后的空间结构变化,并通过电镜观察IPP抑制磷酸钙结晶的效果。结果表明,磷酸基团是钙离子的优先结合部位,1分子IPP能结合4个钙离子,羧酸基团未参与钙离子的结合。IPP在生理pH下无论是否结合钙离子均未形成有序的空间二级结构,完全以无序状态存在。在磷酸钙过饱和溶液中,IPP能够与磷酸根离子竞争与钙离子的结合,并吸附到晶核表面,抑制其聚集成结晶。IPP是通过磷酸基团与钙结合,并能有效抑制磷酸钙结晶。
鲤鱼卵肽,磷酸肽,钙结合,结晶抑制
钙的吸收主要是在小肠进行,在小肠吸收的钙约占总吸收钙的90%[1]。然而由于小肠的弱碱环境以及食物中存在的磷酸、植酸、草酸会使钙形成难溶性盐,导致钙的吸收利用率低下。目前,国内外科研工作者通过酶解、分离方法已从各种食物蛋白质中制备了一些具有结合钙离子和抑制生成磷酸钙沉淀活性的肽,如Jiang等从蛋黄中得到与钙离子结合能力较强的蛋白肽,其肽链中富含Ser、Thr和Asp残基[2]。Jung等从鳕鱼纯化出促进Ca2+吸收的活性肽,其肽链中的Ser、Thr、Met和Tyr残基有阻止小肠中的钙生成磷酸钙沉淀的功效[3-4]。Nishimoto等从鲤鱼中分离出osteocalcin蛋白肽,其氨基酸残基主要为Thr、Tyr、Gln和Asp[5]。上述研究表明,这些活性肽均富含具有极性尤其是带电基团侧链的氨基酸残基。然而针对上述活性肽与钙的结合机制和抑制磷酸钙结晶沉淀的机制还没有系统研究。
鱼卵富含脂质、卵黄蛋白、矿物元素、维生素、类胡萝卜素等营养物质,但在常规的加工过程中,鱼卵往往被作为下脚料而废弃。水产加工副产物已经有大量的利用研究[6-7],而关于鱼卵的利用研究则较少。作者前期研究表明通过酶解得到的鲤鱼卵肽(carp egg peptide,CEP)富含磷酸丝氨酸,鲤鱼卵肽-钙复合物具有促进体内钙吸收的活性[8-9],从CEP中分离纯化得到一条具有较强钙离子结合活性的磷酸肽(isolated phosphopeptide,IPP),其含有5个磷酸化的Ser残基[10]。本论文将对IPP的钙结合特性及其抑制磷酸钙结晶的效果进行系统研究,揭示其钙结合和抑制磷酸钙结晶的机制,为磷酸肽-钙复合物类补钙制剂的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
CEP:含有91.2%(w/w)的蛋白质和0.68%(w/w)的磷,实验室自制[11];IPP:一级结构为(pS)S(pS)AF(pS)(pS)ELAR,分子量1461 u,上海强耀生物有限公司合成,纯度98%以上。
D2O,DCl,NaOD:丰度99.9%,Sigma公司;实验所用其它试剂级别均为分析纯及以上。
ESI-QTOF质谱仪 英国Waters公司;JEM-1200EX透射电镜 日本JEOL公司;MOS450/AF-CD圆二色谱仪 法国Biologic公司;Nicolet iS10傅里叶变换红外光谱仪 美国Thermo公司;PHS-3C型精密pH计 上海雷磁仪器厂。
1.2 实验方法
1.2.1 质谱分析 用超纯水将IPP配成0.5 mmol/L样液,加入等体积3 mmol/L CaCl2溶液混合均匀,pH调至7.0,静置1 h。取200 μL加入20 μL乙腈混匀进样。收集200~2000荷质比范围内的离子碎片信息。
1.2.2 红外光谱分析 固体样品:取IPP分别在两个条件下与钙结合(条件1:肽钙摩尔比1∶6,pH7.0;条件2:肽钙摩尔比1∶10,pH10.0),冷冻干燥得到肽-钙复合物(IPP-Ca)。在玛瑙研钵中将样品与光谱纯KBr混合,研磨均匀,使其粒度在2.5 μm以下,用压片机压成透明片,置于光路中进行红外光谱分析。
液体样品:将样品用D2O溶解后,冷冻干燥,重复2次,尽可能去除样品中的H2O。处理好的样品用D2O溶解,配成3.5 mmol/L IPP溶液,用DCl和NaOD调节溶液pD。加入CaCl2重水溶液,使其与钙离子结合,形成IPP-Ca复合物(pD 7.0,15 mmol/L CaCl2和pD 10.0,50 mmol/L CaCl2)。样液置于两片氟化钙窗片之间进行红外光谱分析。
1.2.3 圆二色谱分析 用超纯水分别配制0.75 mmol/L IPP溶液,调节溶液pH,加入CaCl2,使其与钙离子结合,形成IPP-Ca复合物(pH7.0,3 mmol/L CaCl2和pH10.0,10 mmol/L CaCl2)。样液置于光程为1 mm的石英比色皿中,25 ℃条件下采用圆二色谱仪进行光谱扫描。实验参数设定为:扫描波长190~300 nm,分辨率0.1 nm,带宽1.0 nm,扫描速度40 nm/min,每个样品扫描3次,取平均值。
1.2.4 电镜分析 将待测样液吸附在铜网上,自然风干5~10 min后用磷钨酸负染,自然风干后置于80 kV透射电镜上观察。
1.2.5 磷酸钙过饱和溶液配制 所有溶液均用超纯水配制,防止离子干扰。磷酸盐缓冲液和CaCl2(含NaCl维持离子强度)溶液分开配制,临用时磷酸盐缓冲液、CaCl2和肽混合。体系条件为:25 ℃,初始pH7.4,磷酸盐60 μmol/L,钙离子15 μmol/L,离子强度0.15 mol/L。计算可得体系过饱和度(σHAP)为38.3。计算公式为[12]:
Ksp(HAP)是羟基磷灰石晶体的离子积常数,为10-116.8。
1.2.6 pH漂移曲线绘制 将肽加入σHAP为38.3的磷酸钙过饱和溶液中,使IPP终浓度分别为0.5、2.0、4.0 mol/L,CEP终浓度0.5 mg/mL。用超纯水做空白。用pH计实时监控体系pH。绘制体系pH随时间变化的曲线。
2 结果与分析
2.1 钙离子结合位点解析
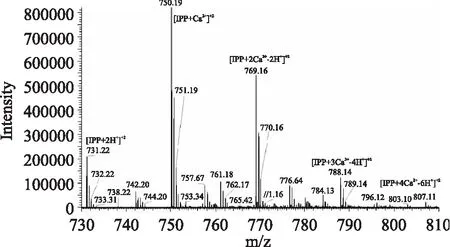
图1 IPP与钙离子结合的质谱图谱Fig.1 ESI-QTOF-MS spectra of IPP with calcium binding
2.1.2 红外光谱分析 为了进一步验证哪些基团参与钙的结合,对IPP和IPP-Ca进行红外光谱分析(图2),比对谱图变化情况。化合物中的不同基团由于其分子伸缩振动、变形振动需要的能量不同而在红外光谱中具有其特征吸收峰。图谱中主要的特征吸收峰及其表征[13]如表1所示。
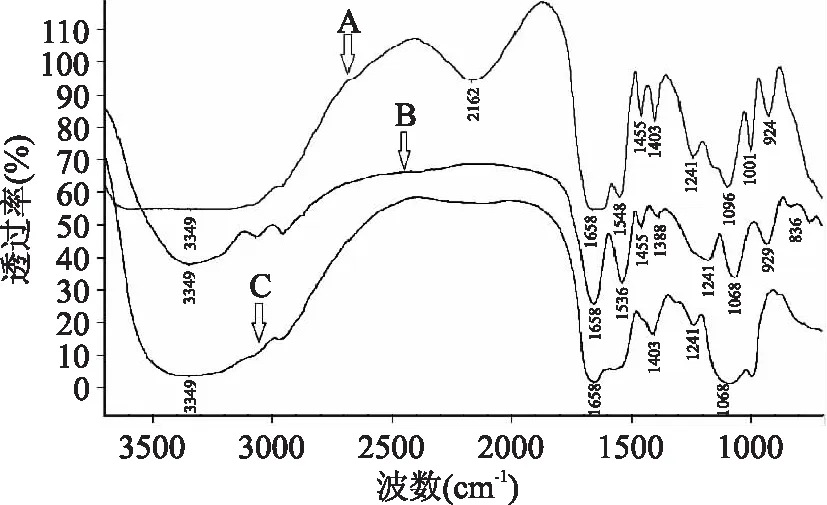
图2 IPP及IPP-Ca复合物的红外吸收谱带Fig.2 Infrared spectra of IPP and IPP-CaA:IPP;B:IPP-Ca(摩尔比1∶6,pH7.0);C:IPP-Ca(摩尔比1∶10,pH10.0)。
Table 1 Specifical IR absorbance peak of IPP and IPP-Ca
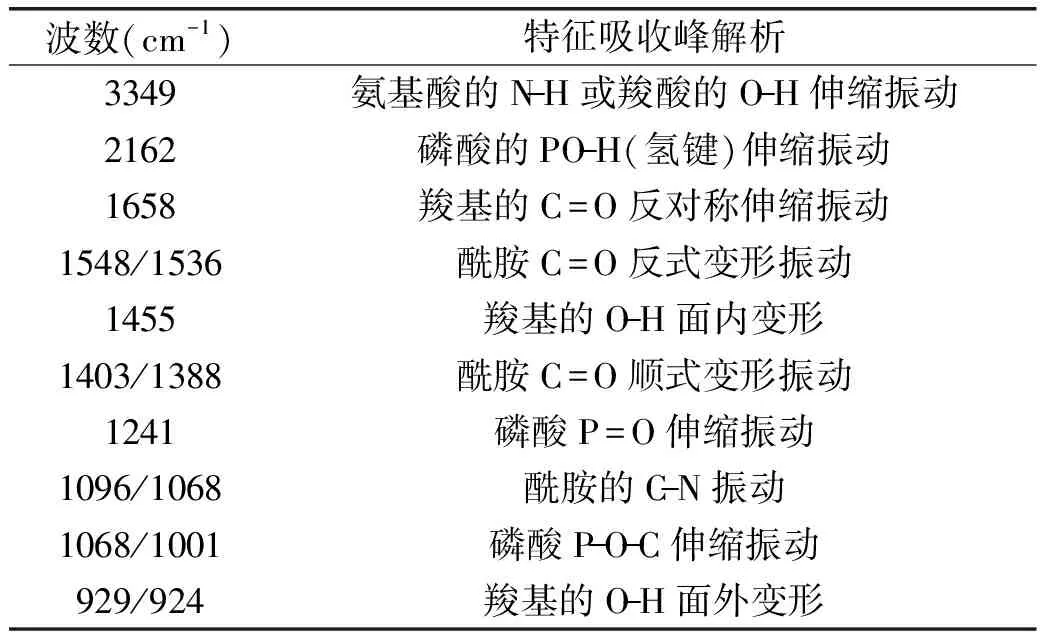
波数(cm-1)特征吸收峰解析3349氨基酸的N-H或羧酸的O-H伸缩振动2162磷酸的PO-H(氢键)伸缩振动1658羧基的C=O反对称伸缩振动1548/1536酰胺C=O反式变形振动1455羧基的O-H面内变形1403/1388酰胺C=O顺式变形振动1241磷酸P=O伸缩振动1096/1068酰胺的C-N振动1068/1001磷酸P-O-C伸缩振动929/924羧基的O-H面外变形
N-H和O-H以及它们之间缔结形成的氢键的伸缩振动会在3600~2800 cm-1区域形成宽吸收峰。由于IPP分子中含有羧基、羟基、氨基、胍基等基团,在此处有强吸收,形成宽吸收峰。图2中A 2162 cm-1处是O=P-O-H缔结氢键形成的特征吸收峰,但在图2中B和图2中C该峰消失,说明磷酸基团与钙结合后O=P-O-H中的H被取代[14]。三个图谱中均观察到羧基C=O反对称伸缩振动形成的吸收峰(1658 cm-1),然而,羧基的O-H面内变形和面外变形形成的两个特征峰(1455 cm-1和924 cm-1)却出现了改变。图2中B仍保留了这两个峰,924 cm-1处的峰红移到929 cm-1,说明分子中的羧基氢在结合后未被取代,羧基并未参与钙的结合,由此可知,在生理pH下即使磷酸基团饱和后钙也依然不与羧酸根离子结合,这与质谱分析结果一致。然而,图2中C的这两个峰均消失,表明羧基参与了钙的结合。由此可知,羧酸是否参与钙的结合与pH和肽钙摩尔比这两个因素有关。通过质谱及红外光谱分析证实IPP的磷酸基团参与钙的结合,而当溶液pH和肽钙摩尔比等因素发生改变时羧基也可能参与钙的结合。学者在研究酪蛋白磷酸肽(casein phosphopeptide,CPP)及其特征序列肽(S(p)S(p)S(p)EE)在磷酸盐缓冲体系下的肽钙结合性能时,发现它们与钙结合并不符合P/Ca化学计量关系,由此推测CPP可能与钙离子及无机磷酸形成纳米颗粒[15-16],但并未对结合位点进行系统研究。因此羧基可能在促进肽分子通过“钙桥”交联从而形成纳米颗粒的过程中起到一定作用。
酰胺C=O的反式、顺式变形振动分别发生在1548 cm-1和1403 cm-1处,与钙结合后位置发生了偏移。图2中B这两处峰分别红移到1536 cm-1和1388 cm-1处,而在图2中C 1548 cm-1处的峰却发生蓝移并与羧酸C=O反对称伸缩吸收峰(1658 cm-1)发生部分重叠。1096 cm-1和1001 cm-1分别是酰胺的C-N伸缩振动和磷酸P-O-C伸缩振动产生的特征峰,在与钙结合后两处的峰发生重叠,并成1068 cm-1的宽峰[14]。
2.2 IPP与Ca结合前后空间结构的变化
2.2.1 酰胺Ⅰ带红外光谱分析 通过红外光谱法分析蛋白质在红外光谱1700~1600 cm-1处的特征吸收带(酰胺Ⅰ带)的变化情况,可得到蛋白质二级结构变化的信息[15]。1683 cm-1处涉及到分子间反平行β折叠结构形成,而1617 cm-1处的β折叠结构形成与分子聚集过程有关[16-17]。由图3可知,在生理pH下,无论IPP是否与钙结合,其谱图只在1659 cm-1和1607 cm-1(氨基酸侧链振动)处有弱吸收(图3中A、B),均未观察到任何有序的二级结构,如β折叠和α螺旋,这是由于IPP带大量负电荷,由于排斥作用难以形成有序的二级结构,分子可能是以无规卷曲形式存在,而且IPP与钙离子结合后结构没有发生改变。在不添加钙离子的条件下,将IPP的pH调至10.0,其二级结构依然没有变化,也呈现无序状态(图3C)。但当同时调节pH和添加钙离子时,其谱图(图3D)中具有多个吸收峰,分别为1683cm-1(β折叠)、1657 cm-1(β转角)、1637 cm-1(β折叠)和1617 cm-1(β折叠),也未发现α螺旋结构吸收峰(1651 cm-1或1646 cm-1)[16-19],说明此时IPP的空间结构发生了从无序到有序的转变。结合2.1.2的实验结果可知,这种转变可能与羧基结合钙离子有关。
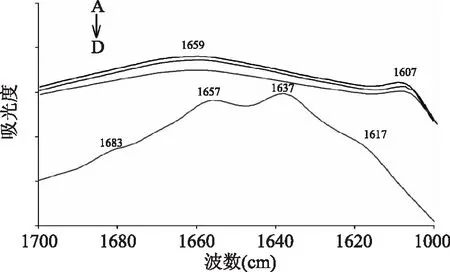
图3 IPP及IPP-Ca的酰胺Ⅰ带红外吸收光谱Fig.3 Infrared spectra of amideⅠband ofIPP and IPP-CaA:3.5 mmol/L IPP(pD 7.0);B:3.5 mmol/L IPP-Ca (pD 7.0,15 mmol/L CaCl2);C:3.5 mmol/L IPP(pD 10.0); D:3.5 mmol/L IPP-Ca(pD 10.0,50 mmol/L CaCl2)。
2.2.2 圆二色谱分析 圆二色谱能够灵敏检测蛋白质二级或三级结构的变化[20]。198 nm附近的正峰和218 nm附近的负峰是典型的β折叠结构形成的吸收峰,208 nm附近的负峰是α螺旋结构形成的吸收峰[21-22],198 nm附近的负峰表明无规卷曲[21]。如图4所示,生理pH下的IPP和IPP-Ca以及pH10.0下的IPP的圆二色谱图(图4中A~C)均观察到表征无规则卷曲的200 nm处负峰,没有观察到任何有序的二级结构,这与酰胺Ⅰ带红外光谱分析的结论相一致,进一步确定了IPP在生理条件下是以完全无序的状态存在。Wang[23]等用CD色谱发现合成的骨桥蛋白(osteopontin,OPN)的高度保守序列(OPN93-106)的肽(DDVDDTDDSHQSDE)不存在任何的二级结构,呈完全无序的结构(198 nm负峰),在pH7.0与钙结合后二级结构没有显著差异,这与本研究结果一致。这可能是由于IPP和OPN93-106均是高度荷电,分子内及分子间的排斥作用使得分子难以形成α螺旋和β折叠结构。同样,当同时调节pH和添加钙离子时,其圆二色谱图(图4中D)出现了典型的β折叠结构特征峰(198 nm正峰和218 nm负峰),这也与酰胺Ⅰ带红外光谱分析结果相吻合。
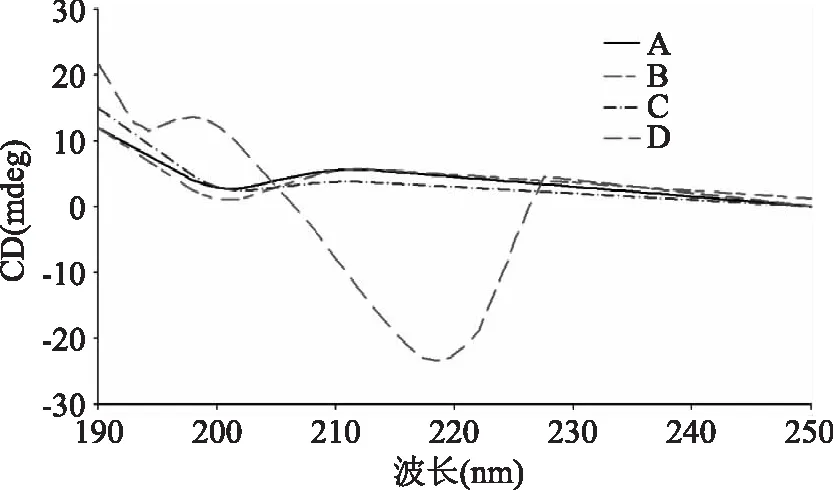
图4 IPP及IPP-Ca的圆二色谱图Fig.4 CD spectra of IPP and IPP-Ca A:0.75 mmol/L IPP(pH7.0);B:0.75 mmol/L IPP-Ca(pH7.0,3 mmol/L CaCl2);C:0.75 mmol/L IPP(pH10.0); D:0.75 mmol/L IPP-Ca(pH10.0,10 mmol/L CaCl2)。
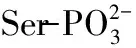
2.3 抑制磷酸钙结晶的效果
2.3.1 pH漂移曲线 25 ℃时,当初始体系pH低于6.1,磷酸钙过饱和溶液中磷酸(氢)根与钙离子结合形成二水合磷酸氢钙结晶,而当初始体系pH高于6.7则形成Ca8H(PO4)3·5H2O结晶,并逐步转化成羟基磷灰石晶体Ca10(PO4)6(OH)2(HAP)[24]。按照经典成核理论,磷酸钙过饱和溶液中磷酸(氢)根与钙离子首先自发成核形成晶核或晶胚,进而聚集形成无定形颗粒(ACP),然后聚集形成结晶。则当无定形态磷酸钙开始结晶,伴随着pH的快速下降。
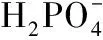
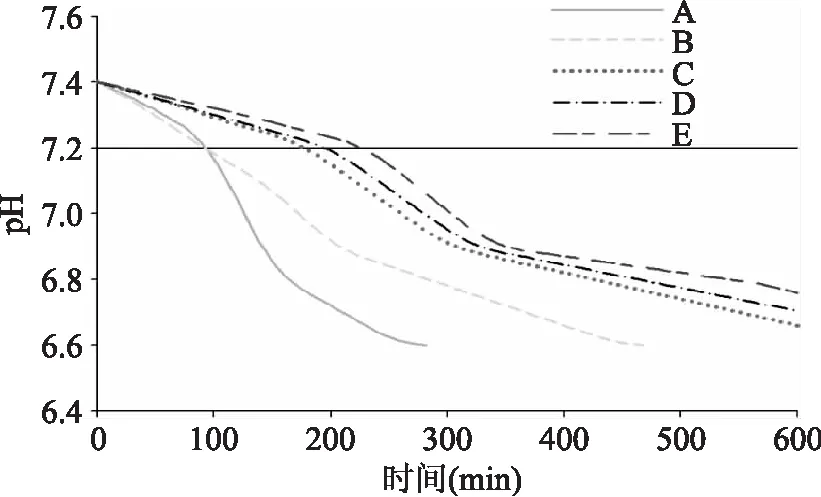
图5 磷酸钙过饱和溶液pH漂移曲线Fig.5 pH drift curve of calcium phosphate supersaturated solutionA:空白;B:添加0.5 mg/ml CEP; C~E:分别添加0.5,2.0,4.0 μmol/L IPP。
由图5可以看出,所有浓度的IPP对磷酸钙的成核阶段和结晶形成、增长阶段均有显著抑制作用,且随着浓度升高抑制作用增强。许多研究表明,磷酸基团是蛋白/肽抑制体内草酸钙和磷酸钙沉淀所必需的,因为磷酸基团能吸附到Ca-P簌和ACP的表面,显著增大成核阶段的表面活化能,从而抑制其聚集、结晶,也能吸附到结晶表面抑制其增大[25-26]。如OPN是人体尿液中存在的天然蛋白,主要作用是抑制尿液中草酸钙结晶,防止肾结石。OPN富含天冬氨酸,中间连有磷酸化丝氨酸,实验证明其不仅能抑制草酸钙结晶,还能抑制磷酸钙结晶,而磷酸基团是必不可少的。由此可知,IPP对磷酸钙结晶的抑制作用也是由于磷酸基团对ACP及晶体表面的吸附、包裹作用。CEP对成核不但无抑制作用,反而有促进作用,表现在诱导时间的缩短,然而在结晶形成和增长阶段却表现出明显的抑制作用。这可能是由于CEP是混合蛋白且浓度较大,非活性蛋白肽分子在体系中充当晶核从而促进了成核。然而活性组分(磷酸肽)对晶核、ACP及结晶的吸附作用又抑制了结晶形成和增大。
2.3.2 电镜分析 电镜图片(图6)也清楚显示过饱和溶液在没有添加IPP或CEP时,ACP迅速聚集、定向,6 h后明显形成结构致密的单晶,此时也正好对应pH漂移曲线中pH降至6.6,12 h可观察到微量沉淀生成。当在体系中添加0.5 μmol/L的IPP时,能使Ca-P簌和ACP大小稳定在纳米阶段,形成纳晶,大大减缓了结晶的形成和增大,直至48 h后形成明显的结晶。由于CEP是含有活性肽组分的混合肽,也表现出抑制磷酸钙结晶的作用。当体系中添加0.5 mg/mL CEP时,直至12 h后形成明显结晶。
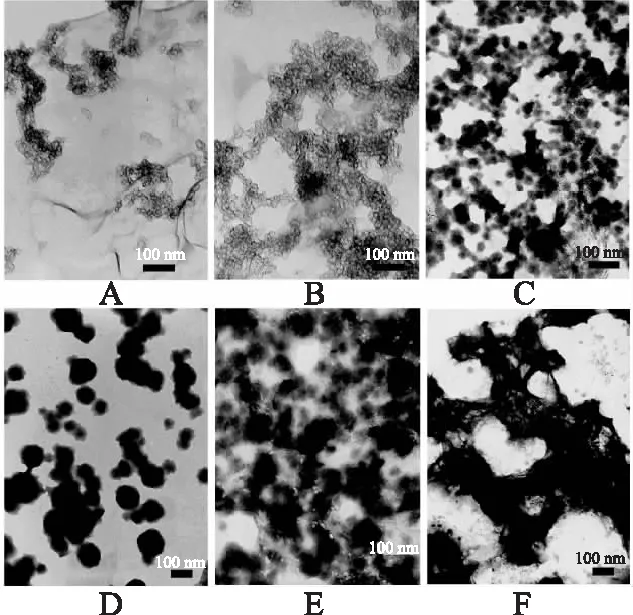
图6 磷酸钙过饱和溶液电镜图Fig.6 TEM image of calcium phosphate supersaturated solutionA:添加0.5 μmol/L IPP,24 h;B:添加0.5 mg/mL CEP,6 h; C:空白,6 h;D:添加0.5 μmol/L IPP,48 h; E:添加0.5 mg/mL CEP,12 h;F:空白,12 h。
为进一步确定结晶的形成,对上述在电镜观察中认为形成结晶的样品(图6中的D、E、F样品)进行晶体衍射观察,结果如图7所示。没有添加IPP和CEP的空白磷酸钙过饱和体系,观察到典型的单晶衍射现象,说明晶体形成。在添加IPP的体系中,则观察到的是典型的多晶衍射现象,这说明IPP在晶体形成中吸附到ACP及晶体表面,阻碍结构更为致密的单晶形成。由于CEP的活性组分含量不高,与钙结合及吸附在ACP及晶体表面能力不如IPP,所以在添加CEP的体系中观察到单晶和多晶衍射共存现象。
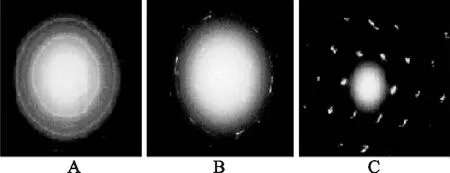
图7 磷酸钙晶体衍射图Fig.7 Crystal diffraction image of calcium phosphate 注:A:IPP;B:CEP;C:空白。
3 结论
磷酸肽中的磷酸基团是钙离子的优先结合部位,1分子IPP能结合4个钙离子,生理pH下羧酸基团未参与钙离子的结合。IPP在生理pH下无论是否结合钙离子均未形成有序的空间二级结构,完全以无序状态存在。IPP通过与磷酸根竞争与钙结合,有效抑制磷酸钙过饱和溶液的成核,并能吸附到晶核、ACP及晶体表面,有效抑制其聚集成结晶及结晶的增长。本论文揭示了磷酸肽与钙离子的结合机制,并证明其具有抑制磷酸钙结晶的效果。
[1]Bronner F. Recent developments in intestinal calcium absorption[J]. Nutrition Reviews,2008,67(2):109-113.
[2]Jiang B,Mine M. Preparation of novel functional oligophosphopeptides from hen egg yolk phosvitin[J]. Journal of Agriculture and Food Chemistry,2000,48:990-994.
[3]Jung W K,Karawita R,Heo S J,et al. Recovery of a novel Ca-binding peptide from Alaska Pollack(Theragrachalcogramma)backbone by pepsinolytic hydrolysis[J]. Process Biochemistry,2006,41:2097-2100.
[4]Jung W K,Park P J,Byun H G,et al. Preparation of hoki(Johnius belengerii)bone oligophosphopeptide with a high affinity to calcium by carnivorous intestine crude proteinase[J]. Food Chemistry,2005,91:333-340.
[5]Nishmoto S K,Waite J H,Nishimoto M,et al. Structure activity,and distribution of fish osteocalcin[J]. Journal of Biological Chemistry,2003,278:11843-11848.
[6]Duan R,Zhang J,Du X. Properties of collagen from skin,scale and bone of carp(Cyprinuscarpio)[J]. Food Chemistry,2009,112:702-706.
[7]Kongsri S,Janpradit K,Buapa K. Nanocrystalline hydroxyapatite from fish scale waste:Preparetion,characterization and application for selenium adsorption in aqueous solution[J]. Chemical Engineering Journal,2013,215-216:522-532.
[8]Huang H,Li B,Liu Z,et al. Effectiveness of carp egg phosphopeptide on inhibiting the formation of insoluble Ca saltsinvitroand enhancing Ca bioavailabilityinvivo[J]. Food Science and Technology Research,2014,20(2):385-392.
[9]黄海,李八方,刘尊英,等. 鱼卵肽钙复合物对大鼠体内促钙吸收作用的研究[J]. 食品工业科技,2014,35(3):331-335.
[10]Huang H,Li B,Liu Z,et al. Purification of an oligophosphopeptide with high calcium binding activity from carp eggs hydrolysate[J]. Food Science and Technology Research,2014,20(4):799-807.
[11]Li Y,Huang H. Enzymatic preparation of carp roes’hydrolysate with Ca-binding capacity[J]. Advanced Material Research,2012,554-556:1309-1317.
[12]Li SY. Phosphorylated osteopontin peptides inhibit crystallation by resisting the aggregation of calcium phosphate nanoparticles[J]. Crystal Engineering Communication,2012,14:8037-8043.
[13]刘振海,李春鸿,张建国. 译. 仪器分析导论(第二版)[M]. 北京:化学工业出版社,2005.
[14]庄玉明,王颖,赵根锁,等. 磷酸酯的红外光谱研究[J]. 光谱学与光谱分析,2010,30(11):157-158.
[15]Lefèvre T,Subirade M. Structural and interaction properties of blactoglobulin as studied by FTIR spectroscopy[J]. International Journal of Food Science and Technology,1999,34:419-428.
[16]Bandekar J. Amide modes and protein conformation[J]. Biochimica et Biophysica Acta Protein Structure and Molecular Enzymology,1992,1120(2):123-143.
[17]Liu G,Li J,Shi K,et al. Composition,secondary structure and self-assembly of oat protein isolate[J]. Journal of Agricultural and Food Chemistry,2009,57:4552-4558.
[18]Boye JI,Ma CY,Ismail A,et al. Effects of physicochemical factors on the secondary structure ofβ-lactoglobulin[J]. Journal of Dairy Research,1996,63:97-109.
[19]Byler DM,Susi H. Examination of the secondary structure of proteins by deconvoluted FTIR spectra[J]. Biopolymers,1986,25:469-487.
[20]Wallace B A,Janes R W. Circular dichroism and synchrotron radiation circular dichroism spectroscopy:Tools for drug discovery[J]. Biochemical Society Transactions,2003,31:631-633.
[21]Wu HH,Liu ZY,Dong SY,et al. Formation of ferric oxyhydroxide nanoparticles mediated by peptides in anchovy(Engraulis japonicus)muscle protein hydrolysate[J]. Journal of Agricultural and Food Chemistry,2013,140:390-399.
[22]Correal DHA,Ramos CHI. The use of circular dichroism spectroscopy to study protein folding,form and function[J]. African Journal of Biochemistry Research,2009,3:164-173.
[23]Wang L J,Guan X Y,Tang R K,et al. Phosphorylation of osteopontin is required for inhibition of calcium oxalate crystallation[J]. The Journal of Physical Chemistry B,2008,112:9151-9157.
[24]Schmidt DG,Both P,Visser S,et al. Studies on the precipitation of calcium phosphate II. Experiments in the pH range 7.3 to 5.6 at 25 and 50 ℃ in the presence of additives[J]. Netherlands Milk and Dairy Journal,1987,41:121-136.
[25]Ellegard KH,Gammelgard-Larsen C,Sorensen ES,et al. Process scale chromatographic isolation,characterization and identification of tryptic bioactive casein phosphopeptides[J]. International Dairy Journal,1999,9:639-652.
[26]Yang XD,Qin YL. How amelogenin orchestrates the organization of hierarchical enlongated microstructures of apatite[J]. The Journal of Physical Chemistry B,2010,114:2293-2300.
[27]Wang LJ,Nancollas G. Pathways to biomineralization and biodemineralization of calcium phosphates:the thermodynamic and kinetic controls[J]. Dalton Transactions,2009,38:2665-2672.
Mechanism of binding Ca2+and the effect of inhibiting calcium phosphate crystal formation of phosphopeptide
HANG Hai1,2,LI Ba-fang3,ZENG Ming-yong3,*
(1.College of Food Engineering,Qinzhou University,Qinzhou 535011,China; 2.Guangxi Colleges and Universities Key Laboratory of Development and High-value Utilization of Beibu Gulf Seafood Resource,Qinzhou 535011,China; 3.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
ToinvestigatethemechanismofbindingCa2+andtheeffectofinhibitingcalciumphosphatecrystalsformationofisolatedphosphopeptide(IPP)derivedfromcarpeggpeptide(CEP).TheCa2+bindingsitesofIPPweredeterminedbymassspectrometry(MS)andFouriertransforminfraredspectroscopy(FTIR).ThechangeofitsspacestructureafterbindingCa2+wasstudiedthroughFTIRandcirculardichroismspectroscopy(CD).TheeffectofIPPinhibitingcalciumphosphatecrystalformationwasobservedbyelectronmicroscope.TheresultsshowedthatphosphatehadtheprioritytobindingCa2+.OnemoleofIPPcouldbindfourmolesofCa2+andcarboxylgroupcouldnotbindcalcium.RegardlessofthepresenceofCa2+,IPPwaspresentinthestateofunordedstructureinsolutionunderphysiologicalconditions,withoutanyorderedsecondarystructures.Inthesupersaturatedsolutionofhydroxylapatite(HAP),IPPcouldcompetewithphosphatetobindCa2+andadsorbtothesurfacesofcrystalnucleus,whichinhibitedthenuleationofcalciumphosphateanditsaggregationtocrystal.
carpeggpeptide;phosphopeptide;bindingCa2+;crystalinhibition
2016-04-08
黄海(1977- ),男,博士,副教授,研究方向:水产品加工及资源利用,E-mail:jxfifagoal@163.com。
*通讯作者:曾名湧(1965- ),男,博士,教授,研究方向:水产品高值化利用,E-mail:mingyz@ouc.edu.cn。
国家自然科学基金(31101379);国家星火计划项目(2012GA740048)。
TS254.1
A
1002-0306(2016)19-0062-06
10.13386/j.issn1002-0306.2016.19.004
