含氮杂环化合物的烷基化反应及其医学应用
2016-12-19周元敬龙昭航周世阳胥建霞
周 红,张 颖,周元敬,胡 容,龙昭航,周世阳,胥建霞
(贵州省分析测试研究院,贵州 贵阳 550002)
含氮杂环化合物的烷基化反应及其医学应用
周 红,张 颖▲,周元敬,胡 容,龙昭航,周世阳,胥建霞
(贵州省分析测试研究院,贵州 贵阳 550002)
综述了几种常见含氮杂环化合物的烷基化反应方法及其在医药领域的应用,系统阐述了含氮杂环化合物的结构特性、碱的种类、烷基化试剂、溶剂和温度等因素对烷基化位置的影响,总结了含氮杂环化合物的烷基化反应特征,展望了含氮杂环化合物烷基化产物在生物医药中潜在的应用价值。
含氮杂环化合物,烷基化,医学应用
0 引言
杂环化合物在生命体系中起着重要的作用,而含氮杂环化合物是杂环化合物的一个重要分支,从青霉素到现在的第四代头孢菌素,抗高血压药利血平(reserpine),抗肿瘤活性的嘧啶拮抗物,类镇痛药物、巴比妥类镇静催眠药物等,含氮杂环化合物及其衍生物一直是药物研发领域中重点关注的对象,其合成也一直受到有机化学家的高度重视。近年来,一些含氮杂环化合物及其衍生物的研发不仅在医药开发中担当重要角色,而且在农药、染料和精细化工中的应用也被广泛关注[1-4]。
含氮杂环化合物在进行烷基化反应时,发生反应的位点受其本身的结构特性、碱的种类、烷基化试剂、溶剂和温度等因素的影响[5-6]。本文将阐述几种常见含氮杂环化合物(吡咯、吲哚、咪唑、1,2,3-苯并三唑、咔唑)的烷基化反应研究情况及其在医药领域的应用,并总结几种氮杂环化合物的烷基化反应特征,进一步展望氮杂环的烷基化产物在生物医药中潜在的应用价值。
1 吡咯的烷基化反应研究及其在医药方面的应用
1.1 吡咯的烷基化反应研究
吡咯是含一个氮原子的五元杂环化合物,环中氮上的氢具有微弱的酸性,在碱的作用下失去质子,生成吡咯负离子。吡咯负离子是两可亲核试剂,较硬的亲核中心是氮原子,较软的亲核中心是碳原子,烷基化反应可生成N-1,C-2和C-3取代产物。有关吡咯的烷基化反应,研究报道得很多[5,7-11]。
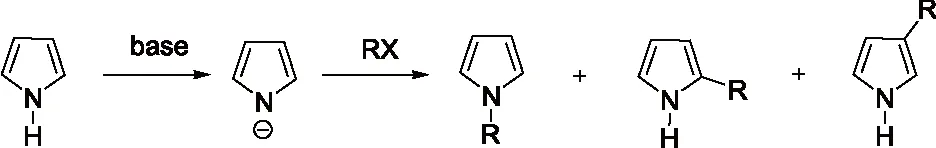
图1 吡咯烷基化反应机理
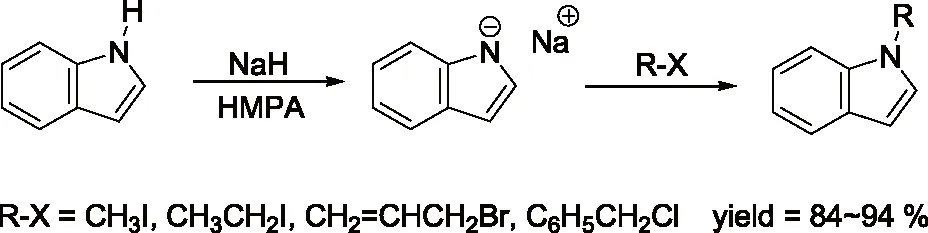
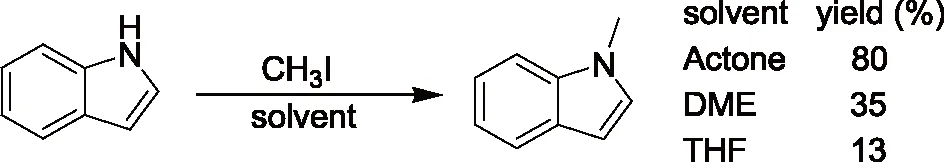
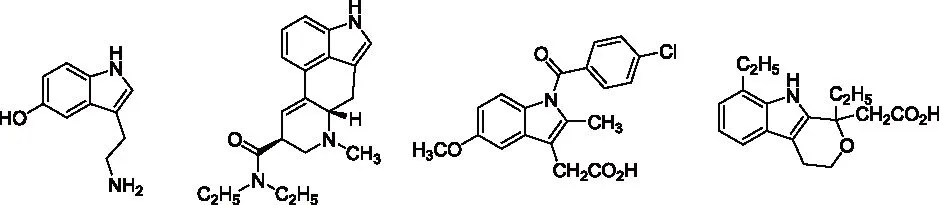
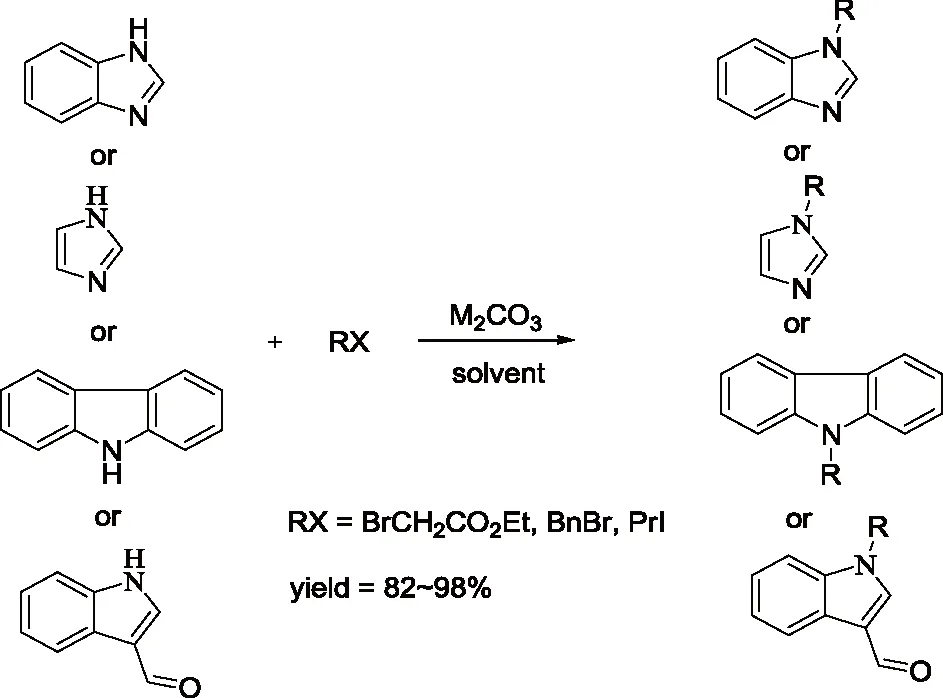
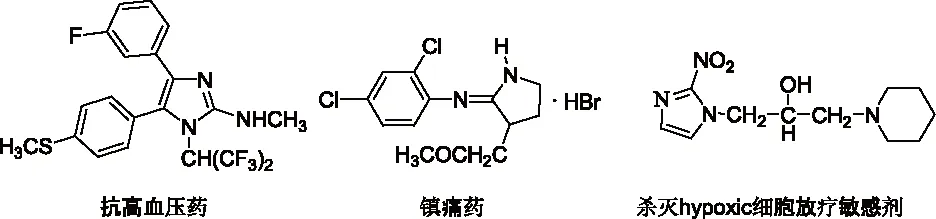
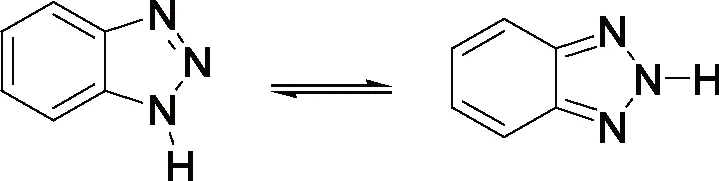
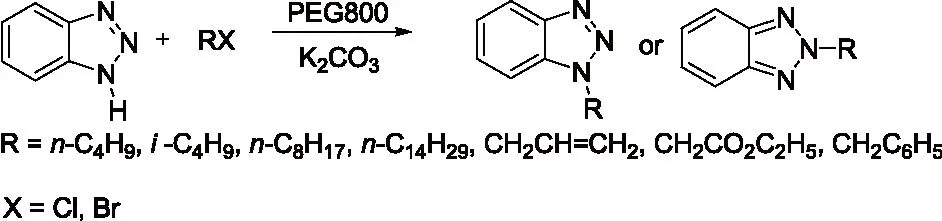
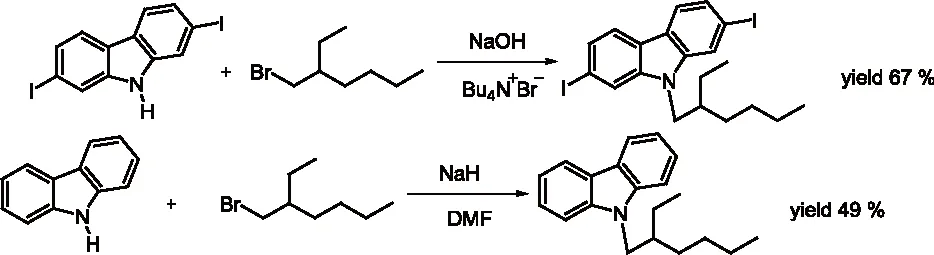
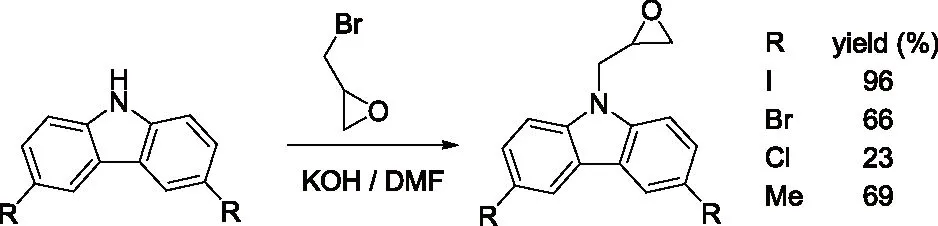
研究发现吡咯的碱金属盐,与烯丙基、巴豆基和苄基卤化物的反应生成N-1,C-2和C-3取代产物的比例受反应的介质和金属离子的性质影响较大。如Hobbs等人[5]的研究发现金属离子和季铵正离子分别与吡咯负离子结合时,烷基化产物比例N/C按下列次序增加:Li+ Santaniello等人[7]报道了用KOH作为碱,18-crown-6催化吡咯的烷基化反应,可取得较高的产率,该反应体系也可应用于吲哚的烷基化反应,且在相同的反应条件下,吲哚的烷基化收率比吡咯的高。 图2 吡咯和吲哚的烷基化反应比较 近年来,报道用NaH作为碱对含氮杂环进行烷基化反应的文献越来越多[8-10,12-14]。如Paleo等人[9]报道了用NaH作为碱,在DMF中烷基化2-甲醛吡咯的反应。 图3 2-甲醛吡咯的烷基化反应 Kato等人[1]分别用AlCl3和K2CO3将不同的烷基基团引到吡咯骨架上,最终合成得到具有类固醇5α-还原酶抑制剂潜在功能的化合物1(图4)。 图4 具有医药应用前景的吡咯衍生物 1.2 吡咯的烷基化合物在医药方面的应用 吡咯及其衍生物在医药行业的应用极其广泛[1,15,16],Kato等人[1]合成了一系列的吡咯衍生物并对人和老鼠进行了体内和体外的抑制活性实验,发现化合物1具有类固醇5α-还原酶抑制剂的潜在功能。由Jiang等人[15]报道的化合物2、3在较低的微摩尔范围内可抑制HIV- 1的复制,通过干扰gp41六螺旋束的形成和破坏α-螺旋构象来抑制HIV- 1的融合和入侵,阻碍一个D- 缩氨酸结合gp41的三聚体内部卷曲螺旋结构域表面的疏水区。通过疏水和离子相互作用绑定到gp41的疏水区,抑制具有融合活性的gp41核的形成,从而具有抑制HIV- 1介导的膜融合和病毒侵入的功能。因此,化合物2、3可作为设计和开发更有效的靶向gp41的HIV- 1融合抑制剂的小分子先导化合物。 2.1 吲哚的烷基化反应研究 吲哚是含一个氮的双环化合物,五元环中氮上氢也具有微弱的酸性,与吡咯类似烷基化反应可生成N-1和C-3取代产物。 图5 吲哚烷基化反应机理 文献报道,吲哚的烷基化反应受金属正离子和溶剂等因素的影响[17-21]。Reinecke等人[17]研究在甲苯中,金属离子与吲哚负离子结合时,甲基化产物比例N/C按K+、Na+、Li+的顺序增加,这可以用“硬软酸碱原理”予以解释,锂离子是硬酸易与吲哚负离子的硬氮原子结合。Rubottom等人[18]报道了在HMPA(hexamethylphosphortriamide)中吲哚的钠盐与烷基卤反应,能以较高的产率(>84 %)得到烷基化的吲哚产物。 图6 吲哚与烷基卤反应 Hegedus等人[19]报道了Pd(II)催化的吲哚烷基化反应,他们研究发现,用吲哚的锂盐最有效,而吲哚的钠、钾、溴化镁、四烷基铵盐的反应效果很差,并且在他们的实验体系下,只产生N-1取代的产物,而没有C-3取代产物的生成。 图7 吲哚与烯烃反应 Kikugawa等人[20]研究发现,用KOH作为碱,烷基化吲哚时,溶剂对烷基化产物比例的影响较大,当用DME(dimethoxyethane)和THF作溶剂时,吲哚烷基化的产率很低,而用丙酮做溶剂时,室温下反应几分钟就可以得到较高产率的烷基化吲哚产物。 图8 溶剂对吲哚的烷基化反应影响 Fink等人[21]报道了Cs2CO3作为弱碱可在DMPU(1,3-dimethyl-3,4,5,6-tetrahydro-2(1H)- pyrimidone)中,对吲哚进行烷基化反应,产率在75 %以上。Reinecke等人[11]的研究也发现在四氢呋喃和甲苯中,溴化吡咯基镁与碘化甲烷反应,给出几乎全部C -烷基化产物,但在HMPA中,只给出N -甲基化产物。 对于吲哚的烷基化反应,文献也报道了一些特殊的合成方法。Jorapur等人[11]报道了用K2CO3作为碱,在离子液体[BMIM][BF4](1-n-butyl-3-methylimidazolium tetrafluoroborate)中,以乙腈作为助溶剂,可得到产率为82 %的烷基化吲哚产物。反应用Cs2CO3作为碱,可得到80 %的烷基化吲哚产物,回收再用的离子液体,不会影响反应的效果。此反应体系也可用于吡咯的烷基化反应中。 图9 在离子液体中吲哚的烷基化反应 Fig.9 The alkylation reaction of indole in ionic liquids 2.2 吲哚的烷基化合物在医药方面的应用 吲哚衍生物是药物化学中最重要的杂环类化合物之一,广泛分布于天然和人工合成的具有生物活性的化合物体系中[2,22]。如化合物4是一种中枢神经系统的关键神经递质,具有调节心血管和胃肠道系统的平滑肌功能和调节血小板的功能。含有吲哚环的化合物5,是一种强效的非选择性5-羟色胺受体激动剂。还有非甾体抗炎药吲哚美辛(6,indomethacin)和依托度酸(7,etodolac)等。研究还表明,分子中含有吲哚环会具有部分激动剂和神经降压素拮抗剂,生长抑素受体激动剂和凝血酶受体拮抗剂的作用。 图10 具有生物活性的吲哚衍生物 3.1 咪唑及其衍生物的烷基化反应研究 有关烷基化咪唑的合成,文献报道主要采用相转移催化和固液条件下反应得到。Greiner等人[23]报道了在相转移催化剂三乙基苄基氯化铵TEBAC(triethylbenzylammonium chloride)的作用下,微波促进的固液相烷基化苯并咪唑,结果发现,在反应体系下苯并咪唑反应活性很高,和苄基卤在K2CO3存在下不需要TEBAC,就可以得到N-苄基化的苯并咪唑产物,琥珀酰亚胺也具有这样的性质。然而,在反应体系下N-苄基化硫代二苯胺时,用TEBAC催化反应的N-苄基化产物的比例显著高于C-苄基化产物。 图11 苯并咪唑、琥珀酰亚胺、硫代二苯胺的烷基化反应 Milen等人[24]系统地研究了固液相烷基化含氮杂环,如苯并咪唑、咪唑、咔唑和吲哚-3-甲醛,得出用碳酸盐(K2CO3、CsCO3或RsCO3)作为碱,在DMF中反应都可以得到相应的烷基化产物,当在乙腈中反应时,加10 %的相转移催化剂TBAB(tetrabutylammoni-um bromide)也可以得到相应的烷基化产物,而且在相同的条件下,用微波促进的烷基化反应不需要加有机溶剂,对于一些较活泼的底物,如苯并咪唑和吲哚-3-甲醛,不需要加相转移催化剂就可以得到相应的烷基化产物。 图12 苯并咪唑、咪唑、咔唑、吲哚-3-甲醛的烷基化反应 3.2 咪唑及其衍生物的烷基化合物在医药方面的应用 咪唑是一种含有两个氮原子的五元杂环化合物,是生物体内组氨酸、核酸、肌肽的组分,可构成一系列具有生理活性的咪唑衍生化合物。烷基化的咪唑是一类重要的咪唑的衍生物,在医药、农业、工业中有着广泛的应用[25]。如可作为高效的抗高血压药、镇痛药、杀灭hypoxic细胞放疗敏感剂等。 图13 具有生理活性的咪唑衍生化合物 4.1 1 ,2,3-苯并三唑的烷基化反应研究 1,2,3-苯并三唑有两个互变异构体,即1-氢苯并三唑和2-氢苯并三唑,如图14所示,在碱作用下,可转变为苯并三唑负离子。苯并三唑负离子是两可亲核试剂,进行烷基化反应时,可生成N-1和N-2取代的产物。 图14 1,2,3-苯并三唑的互变异构体 有关1,2,3-苯并三唑的烷基化反应早期主要是先使苯并三唑与醇钠等强碱作用生成钠盐,然后用烷基化剂处理得到相应的烷基化产物。Bensen等人[26]在这方面做了详细的报道,并研究发现当用硫酸酯作烷基化剂时,苯并三唑烷基化反应的主要产物是N-1取代的产物。 图15 1,2,3-苯并三唑的甲基化反应 20世纪80年代后期,1,2,3-苯并三唑的烷基化反应方法主要是采用相转移催化剂催化的烷基化反应。Dabak等人[27]报道了以PEG为相转移催化剂,K2CO3为碱的固-液相转移催化1,2,3-苯并三唑的烷基化反应,用各种不同的伯、仲卤代烃都得到了N-取代产物,但用氯代叔丁烷时,未能得到相应的N-取代产物,对于链状卤代烷,其体积越大,N-2取代的产物的比例越高,氯化苄、烯丙基氯等活泼的烷基化剂导致N-1的比例升高;比较固-液和液-液两种相转移催化方法对生成N-1和N-2取代产物的影响得出,液-液方法的产率稍低,但是N-1烷基化的比例却较高。 图16 1,2,3-苯并三唑的烷基化反应 4.2 1,2,3-苯并三唑的烷基化合物在医药方面的应用 近些年,三唑化合物的生物活性成为研究的热点。含1,2,3 -三唑基的化合物[4]、 三氮唑糖苷衍生物,都已被发现具有良好的抗肿瘤和抗病毒活性[28]。研究表明苯并三唑化合物也具有一定的抗癌性。Handratta 等人[29]报道类固醇类C-17 苯并三唑8能够明显抑制前列腺癌细胞生长。孙婕等人[38]研究报道苯并三唑化合物(Bz)具有诱导小鼠乳腺癌 4T -1细胞凋亡的作用。 图17 具有抑制前列腺癌细胞生长的苯并三唑衍生物 5.1 咔唑的烷基化反应研究 咔唑的烷基化反应受底物结构、反应体系(烷基化试剂、溶剂和碱等)的影响较大。Vp-rachtick等人[30]用NaOH作为碱,以甲苯 -DMSO (80∶35 mL)为溶剂,在相转移催化剂Bu4NBr存在下烷基化二碘代的咔唑类化合物,得到相应的烷基化产物,产率为67 %。Shi等人[31]则报道无取代的咔唑用NaH作为碱,在DMF中室温反应4 h得到相应的烷基化咔唑产物产率仅为49 %,反应如图18所示。 图18 咔唑的烷基化反应 MacMillan等人[4]用KOH粉末作为碱,带有不同取代基的咔唑和3-溴-1,2-环氧丙烷在DMF中室温反应,可得到相应的烷基化咔唑类化合物。他们用NaH作为碱,将缩水甘油酸甲酯引到咔唑分子中,继而得到具有从细胞凋亡中保护新生神经元作用的化合物9(图20)。 图19 带有不同取代基的咔唑和3-溴-1,2-环氧丙烷的反应 5.2 咔唑的烷基化合物在医药方面的应用 MacMillan等人[4]报道的烷基化咔唑类化合物9具有从细胞凋亡中保护新生神经元的作用。研究表明,一些天然的或合成的含有咔唑核的化合物,具有明显的药物性质,在临床应用中有巨大的潜力[32]。 图20 具有生理活性的咔唑类化合物 总之,含氮杂环化合物在进行烷基化反应时,一般是先在碱的作用下,生成含氮杂环化合物盐的正离子,然后再与烷基化试剂反应,其合成大致可分为两种,一种是用相转移催化剂催化的反应,一种是不用相转移催化剂直接发生的反应,还有一些其它的特别合成方法。 综上所述,含氮杂环化合物中吡咯、吲哚中氮上的氢具有弱的酸性,在碱性环境中生成两可亲核试剂,形成以氮原子为核心的硬亲核中心和以碳原子为核心的软亲核中心,可生成烷基化和C-烷基化两种产物:N-烷基化的百分比随着溶剂极性的增大而增加,随着吡咯的碱金属盐在溶剂中溶解能力的增大而增加,根据“硬软酸碱原理”,与较硬的酸(烷基化试剂)反应一般得到烷基化产物,但与较软的酸(如烯丙基溴等)反应得到较高比例的碳烷基化产物,烷基化试剂越活泼、离去基团越易离去,温度越低越有利于N-烷基化。咪唑、苯并三唑和咔唑类化合物,在碱性环境中会生成N-烷基化产物,产物收率受底物结构和反应体系影响较大。不同类型的氮杂环化合物的烷基化产物由于具有电荷、空间效应等因素的作用,预测将在生物医药领域发挥不同的作用。 总之,含氮杂环化合物及其衍生物活泼的化学性质和广阔的应用前景都极大地吸引着众多有机化学家的研究兴趣。然而,目前氮杂环化合物的烷基化反应收率还不高,在医药、农药等领域中的应用还很有限,因此还有待进一步研究。 【REFERENCES】 [1] Kato M,Komoda K,Namera A,et al.Pyrrole butyric acid derivatives as inhibitors of steroid 5α-reductase[J].Chem.Phar-m.Bull.,1997,45(11):1767-1776. [2] Horton D A,Bourne G T,Smythe M L.The combinatorial synthesis of bicyclic privileged structures or privileged substruct-ures[J].Chem.Rev.,2003,103(3):893-930. [3] Lara S K,Qing L,Chen W,et al.4-Aryl-1,2,3-triazole:A novel template for a reversible methionine aminopeptidase 2 inhi-bitor,optimized to inhibit angiogenesis in vivo[J].J.Med.Chem.,2005,48(18):5644-5647. [4] MacMillan K S,Naidoo J,Liang J,et al.Development of proneurogenic,neuroprotective small molecules[J].J.Am.Chem.Soc.,2011,133(5):1428-1437. [5] Hobbs C F,McMillin C K,Papadopoulos E P,et al.Fact-ors affecting the position of alkylation of alkali metal salts of pyrrole with allylic[J].J.Am.Chem.Soc.,1962,84(1):43-51. [6] Humphrey G R,Kuethe J T.Practical methodologies for the synthesis of indoles[J].Chem.Rev.,2006,106(7):2875-2911. [7] Santaniello E,Farachi C,Ponti F.N-alkylation of pyrrole and indole catalyzed by crown ethers[J].Synthesis,1979,8:617-618. [8] Taylor J E,Jones M D,Williams J M J,et al.Friedel-crafts acylation of pyrroles and indoles using 1,5- diaza- bicyclo[4.3.0]non-5-ene(DBN)as a nucleophilic catalyst[J].Org.Lett.,2010,12(24):5740-5743. [9] Ma C,Cao R,Shi B,et al.Synthesis and cytotoxic evaluation of 1-carboxamide and 1-amino side chain substituted β-carbolines[J].Eur.J.Med.Chem.,2010,45(11):5513-5519. [10] Paleo E,Osornio Y M,Miranda L D.Synthesis of(±)-desethylrhazinal using a tandem radical addition-cyclization process[J].Org.Biomol.Chem.,2011,9(2):361-362. [11] Jorapur Y R,Jeong J M,Chi D Y.Potassium carbonate as a base for the N-alkylationof indole and pyrrole in ionic liquids[J].TetrahedronLett.,2006,47(14):2435-2438. [12] Hamel P,Girard M.Base-promoted in situ generation of methyl acrylate from dimethyl 3,3′- dithiodipropionate.Applic-ation to N-alkylation of heterocycles[J].J.Org.Chem.,2000,65(10):3123-3125. [13] Karchava A V,Shuleva1 I S,Ovcharenko1 A A,et al.2- and 3- Phenylsulfonylindoles synthetic equivalents of unsubstitu-ted indole in N-alkylation reactions[J].Chem.Heterocycl.Com-p.,2010,46(3):291-301. [14] Lemasson F A,Strunk T,Gerstel P,et al.Selective dispersion of single-walled carbon nanotubes with specific chiral indices by poly(N-decyl-2,7-carbazole)[J].J.Am.Chem.Soc.,2011,133(4):652-655. [15] Jiang S,Lu H,Liu S,et al.N-substituted pyrrole derivatives as novel human immunode ciency virus type 1 entry inhibitors that interfere with the gp41 six- helix bundle formation and block virus fusion[J].Antimicrob.AgentsChemother.,2004,48(11):4349-4359. [16] Gholap S S.Pyrrole:An emerging scaffold for construct-ion of valuable therapeutic agents[J].EuropeanJournalofMedicinalChemistry,2016,47(14):13-31. [17] Reinecke M G,Sebastian J F,Jonson H W,et al.The effect of solvent and cation on the reaction of organometallic derivatives of indole with methyl iodide[J].J.Org.Chem.,1972,37(20):3066-3068. [18] Rubottom G M,Chabala J C.The alkylation of indole sodium salt[J].Synthesis,1972(10):566. [19] Hegedus L S,Winton P M,Sudarsanan V.Palladium-assisted N-alkylation of indoles:Attempted application to polycyclization[J].J.Org.Chem.,1981,46(11):2215-2221. [20] Kikugawa Y,Miyake Y.A simple synthesis of N-alkylindoles[J].Synthesis,1981,9(6):461-462. [21] Fink D M.Cesium carbonate promoted N-alkylation of indoles[J].Synlett,2005,36(18):2394-2396. [22] Sravanthi T V,Manju S L.Indoles-A promising scaffold for drug development[J].EuropeanJournalofPharmaceuticalSciences,2016(91):1-10. [23] Greiner I,Sypaseuth F D,Grün A,et al.The role of phase transfer catalyst in the microwave-assisted N-benzylation of amides,imides,and N-heterocycles[J].Lett.Org.Chem.,2009,6(7):529-534. [24] Milen M,Grün A,Bálint E,et al.Solid-liquid phase alkylation of N-heterocycles:Microwave-assisted synthesis as an environmentally friendly alternative[J].Synth.Commun.,2010,40(15):2291-2301. [25] Sharma A,Kumar V,Kharb R,et al.Imidazole Derivati-ves as Potential Therapeutic Agents[J].CurrPharmDes,2016,22(21):3265-3301. [26] Bensen F R,Savell W L,The chemistry of the vicinal triazoles[J].Chem.Rev.,1950,46(1):1-68. [27] Dabak K,Sez er O,Akar A,et al.Synthesis and investigation of tuberculosis inhibition aactivities of some 1,2,3-triazole derivatives[J].Eur.J.Med.Chem.,2003,38(2):215-218. [28] Chen X M,Li Z J,Ren Z X,et al.Synthesis of glucosylated 1,2,3-triazole derivatives[J].CarbohydrRes.,1999,315(34):262-267. [29] Handratta V D,Vasaitis T S,Njar V C O,et al.Novel C-17-heteroaryl steroidal CYP17 inhibitors/antiandrogens:Synthesis,in vitro biological activity,pharmacokinetics,and antitumor activity in the LAPC4 human prostate cancer xenograft model[J].J.Med.Chem.,2005,48(8):2972 -2984. [30] Vyprachticky D,Kmínek I,Pavla ková P,et al.A novel three-step synthesis of N-(2-ethylhexyl)-2,7-diiodocarbazole[J].Synthesis,2011(9):1472-1476. [31] Shi J,Huang M,Xin Y,et al.Synthesis and characterization of a series of carbazole-based monolithic photorefractive molecules[J].Mater.Lett.,2005,59(17):2199-2203. [32] Caruso A, Iacopetta D, Puoci F,et al.Carbazole derivatives:a promising scenario for breast cancer treatment[J].MiniReviewsinMedicinalChemistry,2016,16(8):630-643. Alkylation reaction of nitrogenous heterocyclic compounds and its medical application ZHOU Hong,ZHANG Ying▲,ZHOU Yuanjing,HU Rong,LONG Zhaohang,ZHOU Shiyang,XU Jianxia (GuizhouAcademyofTestingandAnalysis,Guiyang550002,China) In this paper,we summarized the alkylation reaction method of several common nitrogenous heterocyc-lic compounds and its medical application,expounded the effects of the structure characteristics of the nitrogenous heterocyclic compounds,alkali kinds,alkyl agents,solvents and temperature on the alkyl position,and predicted the potential medical application of alkylation products of nitrogenous heterocyclic compounds. nitrogenous heterocyclic compounds,alkylation,medical application O626;R A 2016-06-25; 2016-08-03 周 红(1968-),女,统计师,研究方向:食品安全、职业卫生、环境检测。 ▲通讯作者:张 颖(1979-),男,高级工程师,主要从事食品、药品、冶金、化工材料分析检测工作。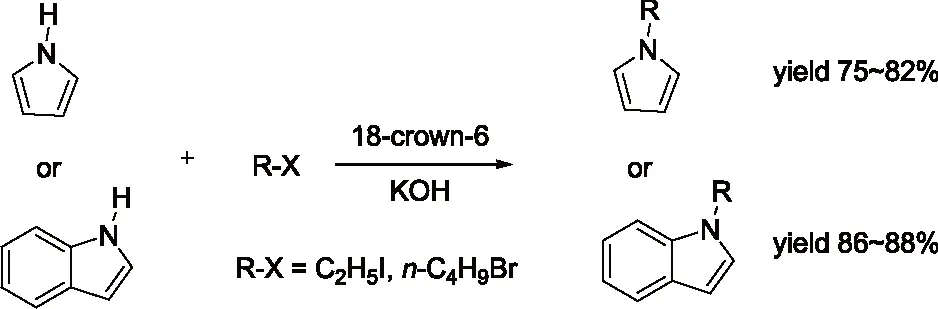


2 吲哚的烷基化反应研究及其在医药方面的应用



3 咪唑及其衍生物的烷基化反应研究在医药方面的应用

4 1,2,3-苯并三唑的烷基化反应研究及其在医药方面的应用


5 咔唑的烷基化反应研究及其在医药方面的应用

6 结论与展望
