电石渣循环煅烧/碳酸化捕集CO2的动力学分析∗
2016-12-19龚德鸿张忠孝
龚德鸿,张忠孝,钱 进,朱 兵
(1.上海理工大学能源与动力工程学院,上海200093;2.贵州大学电气工程学院,贵州贵阳550025)
电石渣循环煅烧/碳酸化捕集CO2的动力学分析∗
龚德鸿1,2,张忠孝1∗,钱 进2,朱 兵2
(1.上海理工大学能源与动力工程学院,上海200093;2.贵州大学电气工程学院,贵州贵阳550025)
用STA409同步热分析仪进行80目、150目和250目电石渣循环煅烧/碳酸化捕集CO2试验,重点研究循环时间、循环次数、反应温度等因素对电石渣循环碳酸化转化率的影响。通过对比分析钙基吸收剂双参数模型和单参数简化公式与电石渣循环碳酸化转化率衰减规律的差异性,获得适合电石渣的双参数模型拟合参数。对电石渣碳酸化反应两个阶段分别用缩核模型、随机成核和随后生长的Avrami-Erofeev方程进行动力学参数计算,结果表明:快速化学反应控制阶段活化能远低于慢速扩散控制阶段,前202 s碳酸化反应程度比重较大;在快速化学反应控制阶段,电石渣碳酸化反应存在动力学补偿效应;在慢速扩散控制阶段,粒径对碳酸化反应影响不明显。
煅烧/碳酸化;动力学模型;CO2捕捉;电石渣
以钙基吸收剂为原料采用循环煅烧/碳酸化法(CCCR)从富氧燃烧锅炉烟气中吸收/分离CO2捕捉的技术被认为是短期内能获得规模化商业应用的CO2技术之一[1-2]。钙基吸收剂在600~700℃的温度范围内进行碳酸化反应,从烟气中吸收CO2生成CaCO3,CaCO3在850~950℃的温度范围内进行煅烧反应,分离出高浓度CO2后生成CaO再次循环反应。前人研究发现[3-5],钙基吸收剂的碳酸化反应主要发生在颗粒内部微孔、颗粒表面和颗粒内部大孔壁面,根据反应机理分为快速化学反应控制和慢速扩散控制两个阶段;在快速化学反应控制阶段,碳酸化反应主要受到吸收剂微孔数量影响,当反应生成的CaCO3充满全部微孔后反应就停止了;在慢速扩散控制阶段,反应则主要取决于CO2在具有一定厚度的CaCO3产物层上的扩散系数。在多次循环的煅烧过程中,微孔特性受高温烧结影响[6],孔隙结构和颗粒表面积的变化导致快速化学反应控制阶段的碳酸化转化率逐渐下降,而钙基吸收剂活性的降低正是发生在这一阶段。临界产物层厚度[7]概念的提出明确了划分快速化学反应控制阶段和慢速扩散控制阶段分界点的方法,该参数的计算对CCCR技术工艺设计至关重要。煅烧过程对钙基吸收剂颗粒内部结构变化影响重大,水蒸汽的存在将恶化吸收剂的孔隙结构和减小比表面积,使其活性降低[8]。
提高钙基吸收剂碳酸化转化率、降低碳酸化转化率随循环次数的衰减率和低成本运行是CCCR法的研究重点。通过碳酸化反应的动力学参数分析和动力学模型建立,可以获得碳酸化转化速率随时间的变化规律,揭示碳酸化两步反应遵循的机理及影响因素,预测吸收剂在每次循环中的碳酸化转化率。研究表明,当反应温度低于515℃时,碳酸化反应遵循CO32-与O2-的离子扩散机理[9];在小型固定床反应器内,利用孔隙分析实验,推导产物层厚度与颗粒孔隙体积之间的关系式,可以计算出最大产物层临界点厚度约49 nm[4];利用晶粒模型模拟石灰石及白云石颗粒的碳酸化反应过程,发现在一定温度条件下,反应气氛中的CO2分压力与平衡分压力的差值小于10 kPa时,碳酸化反应为一级反应,否则反应均为零级[10];Ca(OH)2碳酸化热重实验表明,动力学模型适用于双参数二级拟稳态动力学模型,可以计算出两个动力学区域的时间常数[11]。
电石渣是一种工业废弃物,由于其主要成分是氢氧化钙,在烟气脱硫工艺研究中取得了较大进展[12-13]。作为新型CO2钙基吸收剂,与石灰石相比较,电石渣应用于CCCR技术研究取得了一些成果:(1)价格低廉,有成本优势;(2)电石渣具有较高CO2吸收能力,且活化能低于石灰石[14];(3)电石渣粒径对碳酸化转化率变化规律影响不明显[15]。但表征吸收剂反应活性的循环煅烧/碳酸化动力学分析研究仍较少发现文献发表,本文在电石渣循环吸收CO2的热重试验基础上,重点探讨碳酸化反应动力学特性和动力学模型适用性,为电石渣在富氧燃烧烟气捕捉CO2技术的工业应用提供有益参考。
1 试验部分
试验在德国NETZSCH同步热分析仪STA409 PC上进行,该设备能同时测量TG和DSC信号,并自动记录为曲线;升温速率为0.1~50 K/min;测量温度为常温25℃;反应气氛为氧化、还原、惰性及一些腐蚀气体(无毒、不易燃);样品最大重量为18 g;带恒温水浴。
为控制样品称量精度,每次试验用精度为十万分之一的BT25S型电子分析电平称取约21 mg的电石渣样品送入STA409 PC,电石渣成分分析见表1。

表1 电石渣化学组成 wt%
图1为电石渣热分解及一次循环碳酸化/煅烧过程:(1)段1在N2气氛由30℃以15 K/min的升温速率加热到900℃,为电石渣热分解为CaO过程,TG曲线上有两个明显失重台阶,分别为Ca(OH)2和CaCO3组分热分解成CaO的过程,DSC曲线均表现为吸热状态;(2)段2不改变气氛,以20 K/min的降温速度降温到600℃,处于碳酸化反应温度范围;(3)段3改变气氛为纯 CO2,以15 K/min的升温速率加热到750℃;(4)段4为20 min恒温段,气氛仍为纯CO2,段3、段4为碳酸化过程,TG曲线上有明显增重台阶,DSC曲线表明碳酸化反应为放热过程;(5)段5改变气氛为N2,以10 K/min的升温速率加热到900℃;(6)段6为15 min恒温段,气氛为仍为N2,段5、段6为煅烧过程,TG曲线上有明显失重台阶,DSC曲线表明煅烧为吸热过程。重复(2)-(6)可进行下一循环。

图1 电石渣热分解及一次循环碳酸化/煅烧过程
根据段3、段4吸收的CO2量,可以计算出电石渣碳酸化转化率和碳酸化速率。

式中:XN为碳酸化转化率;rN为碳酸化速率,s-1;m0为吸收剂首次热分解后质量,mg;A为初次吸收时CaO质量分数,本试验样品为0.7859;mN0为第N次循环吸收剂碳酸化反应前初值,mg;mN1为第N次循环吸收剂碳酸化反应后终值,mg;MCaO为CaO摩尔质量,g/mol;MCO2为CO2摩尔质量,g/mol;t为时间,s。
2 结果及讨论
2.1 电石渣碳酸化转化率随反应时间的变化分析
电石渣中CaO与CO2的碳酸化反应通常分为快速化学反应控制和慢速扩散控制两个阶段。图2为80目、150目和250目电石渣第1次循环的碳酸化转化率和碳酸化转化速率随碳酸化时间变化的关系曲线,从碳酸化转化率变化曲线可以看出,随着碳酸化反应时间的增加,三种粒径电石渣碳酸化转化率变化趋势基本一致,均为反应前期快速增大,反应后期增幅逐渐平缓,直至达到恒值。

图2 不同粒径电石渣碳酸化转化率和碳酸化转化速率与时间的关系
从碳酸化转化速率变化曲线可知,X1为最大碳酸化转化速率点,X2为碳酸化转化速率点对时间的拐点,通过对试验TG曲线分别进行一次微分和二次微分可以计算出X1约42 s,X2约为208 s。0时刻到X2时刻为快速化学反应控制阶段,如图2中的第1阶段,碳酸化反应主要发生在吸收剂的表面,反应迅速,在X1时刻达到最大碳酸化转化速率,随着表面生成的CaCO3产物厚度不断增加,碳酸化转化速率开始下降,在X2时刻处进入慢速扩散控制阶段,即为图2中第2阶段,X2时刻为反应的分界点,此阶段CO2需要通过CaCO3产物层与孔隙内的CaO进行反应,碳酸化转化速率主要取决于CO2的扩散阻力。
2.2 电石渣循环碳酸化转化率模型分析
CaO在快速化学反应控制阶段,晶粒表面会生成厚度约0.2μm的CaCO3产物层[16],这也成为慢速扩散控制阶段中的CO2需要克服较大扩散阻力的主要原因。存在于CaO内部孔隙可根据尺寸分为小于或等于0.2μm的微孔隙和大于0.2μm的大孔隙两种,微孔隙可使碳酸化反应始终处于快速化学反应控制阶段;大孔隙则使CaCO3产物层厚度增加,碳酸化反应进入慢速扩散控制阶段。多次循环中,通过煅烧过程使吸收剂重新获得碳酸化反应活性,但由于长时间的高温烧结作用使CaO表面晶粒互相融合,CaO中的微孔隙数量随着循环次数增加而逐渐减少,而大孔隙数量则逐渐增加,使吸收剂活性下降,碳酸化转化率逐渐降低。图3中80目、150目和250目三种粒径电石渣碳酸化转化率随循环次数增加的变化规律正如上述分析。

图3 碳酸化转化率与循环次数的关系
为了描述钙基吸收剂循环碳酸化转化率与循环次数的关系,前人做了许多卓有成效的研究,提出适用于50次循环次数以内的双参数模型[4]和计算更为简单的单参数的简化公式[17],分别为公式(3)和(4)。


式中:XN为第N次循环时碳酸化转化率;fm是与小孔相关的拟合参数,取值为0.77;fw是与大孔相关的拟合参数,取值为0.17;N为吸收次数;k为比例系数,取值为0.06。
图3给出双参数模型和单参数简化公式11次循环与碳酸化转化率的关系,与电石渣变化规律相比较,在第1次循环时,双参数模型的碳酸化转化率与电石渣相当,单参数简化公式的碳酸化转化率高于电石渣;随着循环次数增加,双参数模型的碳酸化转化率与电石渣差值越来越大,在11次循环时,仅为电石渣碳酸化转化率的一半,而单参数简化公式的碳酸化转化率与电石渣越来越接近,在11次循环时,几乎接近,但由于其曲线斜率较大,可以预测,随着循环次数进一步增加,单参数简化公式的碳酸化转化率将低于电石渣,其差值会进一步增大。
为了预测电石渣在更多循环次数下的碳酸化转化率变化规律,本试验选择通用性好的双参数模型算法,根据试验数据进行fm和fw参数拟合,采用数学优化分析综合工具软件包1stOpt软件用麦夸特算法可以计算出fm=0.626,fw=0.553,图3给出了电石渣双参数模型的碳酸化转化率随循环次数的变化规律。
2.3 电石渣非等温碳酸化反应动力学分析
电石渣与CO2反应是典型气固反应,其反应方程为式(5)。本试验吸收剂碳酸化反应主要发生在600~750℃的升温过程中,升温速率为15 K/min,热分析方法研究[18]非等温条件下的非均相反应时采用的动力学方程为式(6):

式中:X为碳酸化转化率;t为反应时间,s;k为反应速率常数,min-1;f(X)为机理函数。

式中:β为升温速率,K/min;T为热力学温度,K;k0为前因子,min-1;E为活化能,J/mol;R为普适气体常数,值为8.314 J/(mol·K)。
对式(7)积分可得:
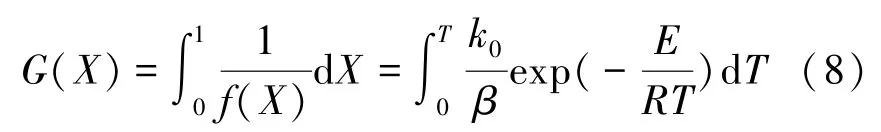

p(z)可用Coats-Redfern近似函数[19]代替,即,则式(9)积分式为:

钙基吸收剂碳酸化反应两阶段的反应机理不同,适用的反应动力学模型不同。快速化学反应控制阶段反应动力学模型采用缩核模型[20],其积分形式为式(11);慢速扩散控制阶段采用随机成核和随后生长的Avrami-Erofeev方程[18]描述其反应机理,取n=4[21],Avrami-Erofeev方程积分式为式(12)。
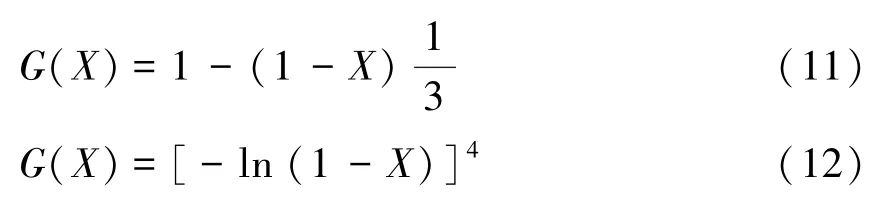

对式(13)作图可得一条直线,a为直线的斜率,b为直线的截距。由斜率和截距可求出电石渣碳酸化反应不同阶段的活化能E及前因子k0。
图4为碳酸化转化率、碳酸化转化速率与温度的关系曲线,图3中X2点为电石渣碳酸化反应分界点,即前202 s为快速化学反应控制阶段,对应温度约在600~650℃区间;慢速扩散控制阶段温度范围在650~750℃区间,分别计算两个区间的动力学参数见表2。

图4 不同粒径电石渣碳酸化转化率和碳酸化转化速率与温度的关系

表2 电石渣非等温碳酸化反应动力学参数
由表2可知,在快速化学反应控制阶段,随着粒径由80目减小到250目,活化能由254.97 kJ/mol降低至161.37 kJ/mol,但同时前因子明显下降,两者共同作用使碳酸化反应活性变化不明显;活化能变化顺序与前因子变化顺序一致,即活化能越大,则前因子也越大,反之,表明在此阶段进行的碳酸化反应存在动力学补偿效应,活化能与前因子的对数值遵循线性关系,如图5,其数学表达式为

式中:a和b为补偿参数,a的单位为mol/kJ。

图5 快速化学反应控制阶段的电石渣碳酸化动力学补偿效应
由于动力学补偿效应可被视为前因子对数值ln A,活化能E和反应温度T三者之间内部联系在ln A-E平面上的投影,且补偿参数a,b与试验因素如升温速率等无关,因此动力学补偿效应方程被认为在描述反应过程特征方面较动力学参数或燃烧参数更具优越性。
在慢速扩散控制阶段,三种粒径电石渣活化能相差不大,但均高出快速化学反应控制阶段同一样品活化能一倍以上,这与碳酸化转化速率的变化规律相符。两阶段活化能的数值关系也验证了碳酸化反应机理分析和不同阶段反应动力学模型选择的合理性。
3 结论
(1)电石渣碳酸化反应分为快速化学反应控制和慢速扩散控制两个阶段,两阶段分界点约在反应后202 s附近,快速化学反应控制阶段完成了整个碳酸化反应的65%以上。
(2)电石渣碳酸化转化率随循环次数的衰减规律与其他钙基吸收剂相同,均呈减少趋势,但其循环碳酸化转化率预测并不适用于常见双参数模型和单参数简化公式,根据试验修正了双参数模型,拟合出fm=0.626,fw=0.553。
(3)电石渣快速化学反应控制阶段反应动力学模型适用缩核模型,慢速扩散控制阶段适用随机成核和随后生长的Avrami-Erofeev方程。化学反应控制阶段不同粒径电石渣活化能变化顺序与前因子变化顺序一致,此阶段存在动力学补偿效应。在慢速扩散控制阶段活化能高出快速化学反应控制阶段一倍以上,粒径对此阶段反应影响不大。
[1]唐诗,诸林,范峻铭,等.钙基CO2吸收剂改性研究进展[J].现代化工,2015,35(2):44-48.
[2]Abanades JC,Grasa G,Alonso M,et al.Cost structure of a post combustion CO2capture system using CaO[J].Environmental Science&Technology,2007,411(5):5523-5527.
[3]Barker R.The reversibility of the reaction CaCO3↔ CaO+CO2[J].Journal of Applied Chemistry and Biotechnology,1973,23: 733-742.
[4]Abanades JC,Alvarez D.Conversion limits in the reaction of CO2with lime[J].Energy&Fuels,2003,17:308-315.
[5]Fennel P S,Pacciani R,Dennis JS,et al.The effects of repeated cycles of calcination and carbonation on a variety of different limestones,asmeasured in a hot fluidized bed of sand[J].Energy&Fuels,2007,21:2072-2081.
[6]王春波,周兴,张斌,等.烧结对钙基吸收剂循环煅烧/碳酸化捕集CO2影响[J].中国电机工程学报,2014,34(35):6271-6278.
[7]李振山.基于化学链燃烧的吸收增强式甲烷重整制氢研究[D].北京:清华大学,2006.
[8]王春波,周兴,张斌,等.水蒸汽对钙基吸收剂循环煅烧/碳酸化捕集CO2过程中的孔结构的影响[J].中国电力工程学报,2015,35(2):390-394.
[9]SK Bhatia,D D Perlmutter.Effectof the product layer on the kinetics of the CO2-lime reaction[J].American Institute of Chemical Engineers Journal,1983,29(1):79-86.
[10]Sun P,Grace JR,Lim C J,et al.Determination of intrinsic rate constantsof the CaO-CO2reaction[J].Chemical Engineering Science,2007,63:7601-7610.
[11]Montes-Hernandes G,Chiriac R,Toche F,et al.Gas-Solid Carbonation of Ca(OH)2and CaO Particles under Non-isothermal and isothermal Conditions by using a Thermogtavimetric Analyzer:Implications for CO2Capture[J].International Journal of Greenhouse Gas Control,2012,11:172-180.
[12]吕宏俊.电石渣-石膏法湿法脱硫技术的应用分析[J].电站系统工程,2011,27(1):41-42.
[13]龚德鸿,韦佳钰,张健,等.用热重法分析电石渣的固硫性能[J].贵州大学学报(自然科学版),2011,28(1):129-131.
[14]LiY J,Liu H L,Sun RY,etal.Thermal analysis of cyclic carbonation behavior of CaO derived from carbide slag at high temperature[J].Journal of Thermal Analysis and Calorimetry,2012,110 (2):685-694.
[15]ZHANG D F,ZHAO P F,LISG,et al.Cyclic CO2capture performance of carbide slag:parametric study[C]//7thInternational Symposium on Coal Combustion,Harbin,China:Institute of Thermal Engineening in Tsinghua University,2011.
[16]Mess D,Sarofim A F,Longwell JP.Product layer diffusion during the reaction of calcium oxide with carbon dioxide[J].Energy&Fuels,1999,13(5):999-1005.
[17]WANG Jinsheng,Edward JAnthony.On the decay behavior of the CO2absorption capacity of CaO-based sorbets[J].Ind Eng Chem Res,2005,44(3):627-629.
[18]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001.
[19]付鹏,胡松,向军,等.非等温热重分析研究生物质催化气化特性[J].电站系统工程,2007,23(4):14-17.
[20]陈甘棠.化学反应工程[M].2版.杭州:化学工业出版社,1990:171-173.
[21]孟永杰.钙基CO2吸收剂循环煅烧/碳酸化性能改进研究[D].杭州:浙江大学,2014.
(责任编辑:周晓南)
K inetic Analysis of the Cyclic Calcination and Carbonation of Carbide Slag for CO2Capture
GONG Dehong1,2,ZHANG Zhongxiao1∗,QIAN Jin2,ZHU Bin2
(1.School of Energy and Power Engineering,University of Shanghai for Science and Technology,Shanghai200093,China;2.College of Electrical Engineering,Guizhou University,Guiyang 550025,China)
Experiments of calination/carbonation cycles,using carbon slag as sorbent,were performed at various particle sizes using the STA409 thermogravimetric analyzer,the relation between the cyclic carbonation conversion rate and different factor such as cyclic time,numbers and reaction temperaturewas studied specially.Double parametermodel of carbon slagwas calculated by analyzing generalmodels about the decay behavior of the cyclic carbonation conversion rate.The coremodel and the randomly nucleating and nucleus growthmodel controlled by Avrami-Erofeev equation were used to calculate kinetic parameters of carbon slag in rapid reaction section and slow reaction section.Results show the activation energy in rapid reaction section ismore than in slow reaction section,extent of carbonation conversion is very high in the first 202 seconds;Kinetic compensation effect existed in rapid reaction section of carbonation reaction of carbon slag;Relation on the carbonation conversion rate and particle size is not obvious in slow reaction section.
calcination/carbonation;kinetic model;CO2capture;carbide slag
TQ424
A
1000-5269(2016)04-0044-05
10.15958/j.cnki.gdxbzrb.2016.04.09
2016-03-01
贵州省自然科学基金项目资助(黔科合J字[2011]2006号);贵州省社会攻关项目资助(黔科合SY字[2015]3010)
龚德鸿(1977-),男,在读博士,副教授,研究方向:CO2捕捉,gdh191@163.com.
∗通讯作者:张忠孝,Email:zhzhx222@163.com.
