蒺藜苜蓿DGAT1基因的克隆和功能鉴定
2016-12-17徐荣华王建才苗永美钱立生胡庆森
徐荣华,崔 涛,王建才,苗永美,钱立生, 胡庆森
(1 安徽科技学院 生命科学学院,安徽凤阳 233100;2 山东省农业科学院畜牧兽医研究所,济南 250100)
蒺藜苜蓿DGAT1基因的克隆和功能鉴定
徐荣华1,崔 涛1,王建才2,苗永美1,钱立生1, 胡庆森1
(1 安徽科技学院 生命科学学院,安徽凤阳 233100;2 山东省农业科学院畜牧兽医研究所,济南 250100)
该研究采用RT-PCR与电子克隆的方法,从蒺藜苜蓿cDNA中克隆得到2个编码二脂酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)的基因MtDGAT1-1和MtDGAT1-2。MtDGAT1-1长1 620 bp,编码539个氨基酸;MtDGAT1-2长1 524 bp,编码507个氨基酸。多序列比对显示,MtDGAT1-1和MtDGAT1-2编码蛋白具有典型的植物DGAT1结构域。表达分析显示,MtDGAT1-1和MtDGAT1-2在根、茎、叶、花、种子中都有表达,在种子发育中高表达,且MtDGAT1-1于种子发育的中前期高表达,而MtDGAT1-2于种子发育的中后期高表达。酵母互补实验证实,MtDGAT1-2编码蛋白具有DGAT酶活性,能够恢复H1246的TAG合成和油体形成;而MtDGAT1-1编码蛋白不能恢复H1246的TAG合成和油体形成。
二脂酰甘油酰基转移酶;三脂酰甘油;蒺藜苜蓿;油体
三脂酰甘油(triacylglycerol,TAG)是真核生物中储存能量和结构分子——脂肪酸(fatty acid, FA)的主要方式,也是油料作物种子油脂的主要成份,对于植物的生长、发育、繁衍具有重要的作用[1],同时也是人类日常生活中的食物资源和化工原料[2]。TAG的生物合成分为两步:FA的从头合成及TAG组装。FA的初始碳链合成和延长是在质体内进行的,以光合作用中间产物转化的乙酰辅酶A(acetyl-CoA)为底物,在一系列脂肪酸合成酶复合体(fatty acid synthase complex,FAS)的共同作用下催化完成的。TAG组装的胞内场所为内质网,以质体输出的FA(脂酰ACP或脂酰辅酶A的形式)为底物,以三磷酸甘油(glycerol-3-phosphate,G3P)为骨架,在甘油-3-磷酸酰基转移酶(sn-glycerol-3-phosphate acyltransferase,GPAT)、溶血磷脂酸酰基转移酶(lysophosphatidic acid acyltransferase,LPAAT)、磷脂酸磷酸酶(phosphatidate phosphatase,PAP)和二脂酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)的次序催化下合成的。TAG组装是Kennedy在1961年发现的,因此也被称为Kennedy途径[3]。
DGAT催化的反应是TAG合成的最后一步,因此被认为是TAG合成过程中的关键酶[4]。目前已发现的DGAT分为4类:DGAT1、DGAT2、可溶性的DGAT3和双功能的DGAT4[5]。其中研究较多主要为DGAT1和DGAT2,这两类DGAT在基因结构、编码蛋白、进化和酶学活性及特异性等方面都存在巨大差异[5],然而关于DGAT1和DGAT2对于种子油含量和油成分的作用如何,目前尚未完全明确。目前研究表明在不含特殊FA的植物中DGAT1对于种子油含量贡献较大,而在含有特殊FA的植物中,DGAT2对于种子中特殊FA的积累具有较大的贡献[6]。
蒺藜苜蓿(Medicagotruncatula)因倍性小(2n=16),基因组小(5×108bp),自花受粉及种子较多,再生时间较短,具有较高的遗传转化效率,有大量的突变体和多种生态型,具有较高的生物多样性等特点,被认为是豆科模式植物[7-8],从蒺藜苜蓿获得的信息有助于其它豆科植物的研究。目前已从拟南芥、油菜、烟草、蓖麻、小桐子等多种植物中克隆和鉴定了DGAT1,然而对于蒺藜苜蓿DGAT1基因的功能却未见报道。本课题以豆科模式植物蒺藜苜蓿A17为研究对象,通过克隆鉴定蒺藜苜蓿中编码DGAT1的基因,不仅有助于揭示DGAT1基因在蒺藜苜蓿中对TAG合成的影响,同时可以进一步丰富植物DGAT1基因的理论研究,对于豆科植物基因发掘和种质创新具有重要意义。
1 材料和方法
1.1 实验材料
大肠杆菌TOP10和蒺藜苜蓿A17由本实验室保存。酿酒酵母(Saccharomycescerevisiae)突变株H1246,由瑞典斯堪的纳维亚生物技术研究中心的Sten Stymne教授赠送。
1.2 方 法
1.2.1 RNA提取和反转录 将-80 ℃冻存的材料(A17的叶片)在液氮中研磨成粉,采用Trizol法[6]进行总RNA提取,RNA沉淀使用适量的DEPC水溶解,用1%甲醛变性琼脂糖胶电泳法[6]对RNA进行质量检测,用分光光度法[8]对RNA浓度进行估算。使用PrimeScriptTMRT-PCR试剂盒(大连宝生物)进行反转录获得cDNA第一链。
1.2.2MtDGAT1-1和MtDGAT1-2基因克隆及序列分析 以AtDGAT1(NP_179535)为探针搜索蒺藜苜蓿基因组网站(http://www.jcvi.org/medicago/)的蛋白质数据库,获得Medtr2g039940和Medtr4g125980的参考序列,分别命名为MtDGAT1-1和MtDGAT1-2。基于参考序列设计ORF引物(表1)。以A17的cDNA为模板进行PCR扩增,PCR反应体系按照Ex Taq(大连宝生物)说明配制。PCR反应条件为:94 ℃预变性 2 min;94 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸 1 min,32个循环;72 ℃补充延伸 7 min。扩增产物电泳检测后纯化,克隆到pGM-T载体(北京天根生化有限公司)并转化大肠杆菌TOP10,通过蓝白斑筛选及菌液PCR鉴定阳性克隆后测序。引物合成由通用生物系统(安徽)有限公司完成,测序由生工生物工程(上海)股份有限公司完成。
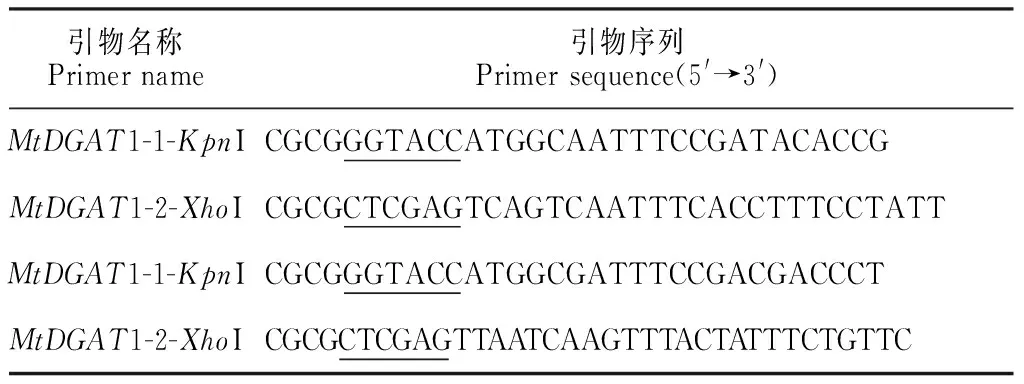
表1 引物信息*
注: *划线碱基为KpnI或XhoI位点
Note: * The underlined bases encode restriction enzyme site ofKpnI orXhoI
使用ORF finder对获得的cDNA序列进行开放阅读框分析;ProtParam在线分析蛋白的理化性质;TMHMM在线分析跨膜结构; MEGA 6.0进行进化树构建[6]; Vector NTI 11软件包的AlignX模块构建多序列比对[6]。
1.2.3 表达模式分析和酵母表达载体构建及转化 苜蓿基因MtDGAT1-1和MtDGAT1-2表达模式的数据来自蒺藜苜蓿基因组Nobel网站的表达芯片数据[8],使用Excel进行数据分析,使用Origin进行作图。
将所得MtDGAT1-1和MtDGAT1-2基因通过KpnI和XhoI(Fermentas)双酶切克隆到酵母表达载体pWXY3.1上,分别构建酵母表达载体pWXY3.1- MtDGAT1-1和pWXY3.1-MtDGAT1-2。按照醋酸锂-PEG法[6]转化酵母菌株H1246,使用缺少尿嘧啶的合成培养基(synthetic minimal defined medium lacking uracil,SCU-)筛选阳性克隆,同时以空质粒pWXY3.1和含有酿酒酵母ScDGA1基因质粒pWXY3.1-ScDGA1做对照。在SCU-平板培养基上28 ℃生长2~4 d,挑取酵母菌斑进行PCR验证。
1.2.4 转基因酵母油脂分析和油体观察 将转基因酵母接种10 mL SCU-液体培养基(2%葡萄糖),250 r/min、30 ℃培养过夜,测OD600,离心收集菌体,用SCU-液体培养基重悬菌体至OD600为 0.4,250 r/min、30 ℃重新开始培养。24 h后,进行尼罗红染色观测酵母油体。84 h后离心收集酵母细胞,使用酸热法破碎细胞,使用正己烷∶异丙醇(3∶2)法提取酵母油脂进行TLC分析和油脂百分含量测定。转基因酵母的油体观察、油脂抽提、TLC层析按照参考文献[3,6]记载的方法进行。
2 结果与分析
2.1 MtDGAT1-1和MtDGAT1-2的克隆和序列分析
以蒺藜苜蓿野生型A17的叶片为材料进行RNA抽提,反转录获得cDNA,进行MtDGAT1-1和MtDGAT1-2基因克隆的PCR扩增,分别得到约1.5 kb目的条带(图1),测序结果与预期序列完全一致。MtDGAT1-1开放阅读框为1 620 bp,编码蛋白长度为539个氨基酸,预测分子量为61.6 kD,理论等电点为8.27。MtDGAT1-2开放阅读框为1 524 bp,编码蛋白长度507个氨基酸,预测分子量为58.4 kD,理论等电点为9.00。MtDGAT1-1和MtDGAT1-2在cDNA水平的序列相似性为70.5%,在蛋白质水平的序列相似性为73.5%。

M. Marker 2501; 1~2. MtDGAT1-1; 3~4. MtDGAT1-2图1 MtDGAT1-1和MtDGAT1-2的克隆Fig.1 Amplification of MtDGAT1-1and MtDGAT1-2
BlastP结果显示MtDGAT1-1和MtDGAT1-2均与其他植物DGAT1高度同源,与GmDGAT1(AAS78662)相似性分别为78.3%(MtDGAT1-1)和79.2%(MtDGAT1-2),与LjDGAT1(AAW51456)的相似性分别为70.9%(MtDGAT1-1)和78.4%(MtDGAT1-2),与RcDGAT1(AAR11479)的相似性分别为65.4%(MtDGAT1-1)和75.4%(MtDGAT1-2)。跨膜结构预测结果显示MtDGAT1-1和MtDGAT1-2均含有9个跨膜结构域,推测MtDGAT1-1和MtDGAT1-2属于膜蛋白。将MtDGAT1-1和MtDGAT1-2与AtDGAT1进行多序列比对分析,发现MtDGAT1-1和MtDGAT1-2具有典型的植物DGAT结构域,MtDGAT1-1、MtDGAT1-2和AtDGAT1的序列差异主要表现在N端,而C端区域和中间区域的氨基酸序列则相对保守(图2)。比较MtDGAT1-1和MtDGAT1-2的序列,可以发现MtDGAT1-1相对MtDGAT1-2在两处出现较大的插入,一是MtDGAT1-2的Q74和N75之间插入KTDHAEGIVDDDDDNAVKK,二是S81和S82之间插入NDRENVA片段,推测这两处插入可能与MtDGAT1-1和MtDGAT1-2在蒺藜苜蓿中的功能分化相关。同时发现MtDGAT1-1和MtDGAT1-2均存在植物DGAT1中已知的结构域[6]:(1)脂酰辅酶A结合域(acyl-CoA binding motif);(2)蔗糖非发酵相关蛋白激酶结构域(sucrose non-fermenting related protein kinase motif);(3)硫酰酶中间体结合域(thiolase acyl-enzyme intermediate-binding motif);(4)DGAT结构域;(5)脂肪酸结合域(fatty acid binding protein signature);(6)二酰甘油或佛波酯结合域(DAG/phorbol ester binding motif);(7)内质网定位信号(ER retrieval motif)。在MtDGAT1-1和MtDGAT1-2的C端均发现的内质网定位信号遵循-Φ-X-X-K/R/D/E-Φ-COOH的规则[6]。系统进化分析(图3)显示,双子叶植物的DGAT1聚为一支,单子叶植物DGAT1聚为一支,MtDGAT1-1和MtDGAT1-2与同属豆科植物中大豆的GmDGAT1以及百脉根LjDGAT1聚在一起。

同源氨基酸残基以黑色背景显示,相似的氨基酸残基以灰色显示。脂酰辅酶A结合域、SnRK1蛋白激酶结构域、硫酰酶中间体结合域、DGAT功能域、脂肪酸结合蛋白签名、DAG或佛波酯结合域和内质网定位信号分别使用蓝色方框标出。关键的丝氨酸、脯氨酸、酪氨酸、苯丙氨酸和组氨酸分别以●、★、■、▲和◆标出。AtDGAT1. 拟南芥DGAT1图2 MtDGAT1-1编码蛋白、MtDGAT1-2编码蛋白和AtDGAT1的多序列比对Identical residues are shaded black, and similar residues are shaded grey. Conserved motifs or putative signatures are blue boxed, such as the acyl-CoA binding motif, sucrose non-fermenting related protein kinase motif, thiolase acyl-enzyme intermediate-binding motif, DGAT motif, fatty acid binding protein signature, DAG/phorbol ester binding motif, and ER retrieval motif. Critical serine, proline, tyrosine, phenylalanine and histidine were marked by ●,★,■,▲and ◆, respectively. AtDGAT1. Arabidopsis thaliana DGAT1Fig.2 Multiple sequence alignment of deduced amino acid sequences of MtDGAT1-1, MtDGAT1-2 with AtDGAT1

括号内为氨基酸登录号;分支上的数字为Bootstrap验证中基于1 000 次重复该节点的可信度的百分比图3 MtDGAT1-1和 MtDGAT1-2与其他植物DGAT1的进化树分析The accession No. was given in bracket; The numbers on the branches represent the reliability percent of bootstrap values based on 1 000 replicationsFig.3 Phylogenetic relationships of MtDGAT1-1, MtDGAT1-2 with other plant DGAT1s

图4 MtDGAT1-1和MtDGAT1-2基因的表达模式Fig.4 Expression pattern of MtDGAT1-1 and MtDGAT1-2
2.2 MtDGAT1-1和MtDGAT1-2基因的表达分析
以Nobel网站的基因芯片数据为基础,构建了MtDGAT1-1和MtDGAT1-2基因的表达模式(图4),图4显示MtDGAT1-1和MtDGAT1-2在蒺藜苜蓿的根、茎、叶、花和种子等组织中均有表达,MtDGAT1-1和MtDGAT1-2在花、芽和茎中的表达差异不大。在根和叶中,MtDGAT1-2表达量高于MtDGAT1-1的表达量,MtDGAT1-2的表达量分别是MtDGAT1-1的2.3和1.8倍。在果中,MtDGAT1-2表达量低于MtDGAT1-1的表达量,MtDGAT1-2是MtDGAT1-1表达量的0.59倍。在种子中MtDGAT1-1和MtDGAT1-2的表达存在明显差异。MtDGAT1-1在苜蓿种子发育中呈现单峰表达模式,即在种子发育初期(10~12 d)表达量较低,随着种子的发育表达量逐渐增高,在16 d时达到最高,随后逐渐降低,36 d时降到最低,约为其第10天表达量的0.5倍。MtDGAT1-2在苜蓿种子发育中也呈现单峰的表达模式,也随着种子的发育表达量逐渐增高,在24 d时达到最高,在36 d时仍维持着很高的表达量,约为其第10天表达量的7.5 倍。
2.3 酿酒酵母表达载体构建和互补实验
为证实MtDGAT1-1和MtDGAT1-2编码蛋白具有DGAT酶功能,使用酵母突变体H1246进行互补实验,该突变体中负责中性油脂TAG和固醇酯合成的基因都被敲除,因此H1246既不能合成TAG,也不能形成油体[3]。通过KpnI和XhoI双酶切和连接的方法将MtDGAT1-1和MtDGAT1-2插入酵母表达载体pWXY3.1,置于TEF1启动子的下游和CYC1终止子的上游,菌落PCR的结果(图5)证实酵母表达载体pWXY3.1-MtDGAT1-1和pWXY3.1-MtDGAT1-2已经构建成功。抽提质粒后使用醋酸锂-PEG的方法将重组质粒导入H1246,同时以空质粒转化为阴性对照,以转化酿酒酵母ScDGA1为阳性对照挑取SCU-平板上阳性克隆进行扩大培养,提取油脂进行TLC层析和碘显色,结果显示转化空质粒的阴性对照中TAG条带处无斑点出现,转化阳性对照ScDGA1的处理中可以检测到TAG斑点,转化MtDGAT1-1的处理中不能检测到TAG斑点,转化MtDGAT1-2的处理中可以检测到TAG斑点(图6,A),这说明MtDGAT1-2的表达恢复H1246合成TAG的能力,而MtDGAT1-1不能恢复。随后对转基因酵母进行尼罗红染色,结果表明MtDGAT1-1编码蛋白不能互补H1246的油体缺陷表型,而MtDGAT1-2的表达则可以互补H1246的油体缺陷表型(图6,B)。

图5 pWXY3.1-MtDGAT1-1和pWXY3.1-MtDGAT1-2的菌落PCR结果Fig.5 Colonies PCR analysis of pWXY3.1-MtDGAT1-1 and pWXY3.1-MtDGAT1-2

ScDGA1编码酿酒酵母内源的DGAT2图6 转基因酵母油脂的TLC层析(A)和油体观察(B)ScDGA1 encoding endogenous DGAT2 of Saccharomyces cerevisiaeFig.6 TLC analysis (A) and oil body (B) of transgenic yeasts
3 讨 论
研究表明在牲畜快速生长时添加高油饲料(如高油玉米)能显著改善牲畜的生产性能以及畜产品的品质[9]。紫花苜蓿被誉为牧草之王,在世界各国广泛种植,然而其叶片几乎不含油脂,严重限制了紫花苜蓿作为高油饲料的应用。植物通常不在叶片中积累TAG,但是近年来的研究表明在烟草叶片中异位表达拟南芥AtDGAT1、AtWRI1和AtOLE1可以使得叶片积累干重30%的油脂[10]。研究也表明模式植物拟南芥的研究结果在紫花苜蓿中并不适用,如在苜蓿中异位表达调控花青素代谢途径的转录因子AtPAP1不能导致苜蓿叶片中花青素的积累,而异位表达苜蓿中AtPAP1的同系物MtLAP1则可以导致苜蓿叶片中大量积累花青素[8],暗示拟南芥和苜蓿中的代谢调控机制的细节并不相同。理解苜蓿TAG合成和积累的分子机制是使用基因工程技术发展高油牧草的前提。然而紫花苜蓿是四倍体,基因组复杂,难以操作[7-8]。而蒺藜苜蓿是二倍体,且与紫花苜蓿的亲缘关系较近,基于蒺藜苜蓿的研究可以直接推广到紫花苜蓿上面。
本研究从蒺藜苜蓿中克隆得到2个编码DGAT1的基因MtDGAT1-1和MtDGAT1-2,并对其功能进行了初步的分析和鉴定。前人研究表明硫解酰基酶结合域中存在一个重要的脯氨酸残基,在玉米中此脯氨酸残基的缺失可使得DGAT酶活下降50%,异位表达带有此脯氨酸残基的玉米DGAT1可使得玉米种子中油含量增加41%,油酸含量增加107%[11],MtDGAT1-1在此位置氨基酸残基为丝氨酸,而MtDGAT1-2在此位置则为脯氨酸,暗示MtDGAT1-2具有DGAT酶活性,而MtDGAT1-1可能没有DGAT酶活性。使用酵母突变株H1246对MtDGAT1-1和MtDGAT1-2进行功能互补验证,TLC分析和尼罗红染色的结果都显示异源表达MtDGAT1-2可以恢复H1246的TAG合成和油体形成,暗示MtDGAT1-2具有DGAT酶活,而MtDGAT1-1不能恢复H1246的TAG合成和油体形成,暗示MtDGAT1-1可能不具有DGAT酶活。AtDGAT2曾一度被认为是编码无功能的DGAT酶,因为AtDGAT2不能互补H1246,而且拟南芥中AtDGAT2的突变没有产生影响种子油含量和成分改变的表型,然而后续的研究表明对AtDGAT2进行酵母密码子优化表达则可以使得AtDGAT2互补H1246[12],在烟草叶片中瞬时表达的结果也证实AtDGAT2能够催化合成TAG,但具有脂酰基辅酶A底物的依赖性[13],因此推断AtDGAT2不易互补H1246的原因在于植物和酵母密码子偏爱的差异以及酵母中没有合适的底物。据此同样可以推断MtDGAT1-1不能互补H1246也可能是因为密码偏爱性和酵母中不存在MtDGAT1-1偏爱的脂酰基辅酶A底物,因此是否MtDGAT1-1为无功能的DGAT,仍需进一步的实验证实。
先前的研究发现在多数二倍体物种DGAT1通常为单一拷贝,如拟南芥、蓖麻、小桐子等植物[6],目前仅在斑鸠菊中发现2个DGAT1,分别为VgDGAT1a和VgDGAT1b,二者在核苷酸水平的相似性为92%,蛋白质水平的相似性为94%[14],远高于本研究克隆的MtDGAT1-1和M12在核苷酸和蛋白质水平的相似性,暗示VgDGAT1a和VgDGAT1b是属于斑鸠菊内部的基因进化事件的结果。进化树研究中,MtDGAT1-2与GmDGAT1和LjDGAT1聚在一起,而MtDGAT1-1单独一枝,说明MtDGAT1-1与MtDGAT1-2形成的分歧要早于豆科物种内部分化开始之前,这也表明MtDGAT1-1与MtDGAT1-2不是简单的基因复制关系。为何在蒺藜苜蓿中出现2个序列差异如此之大的DGAT1基因,需要进一步研究。
对旱金莲和小桐子中的DGAT1基因时空表达研究发现DGAT1在根、茎、叶、花、种子中都可以检测到表达,在种子中的表达量显著高于其他组织,而且表达丰度的变化与种子中油脂积累的曲线变化正相关[6,11]。本研究中MtDGAT1-1和MtDGAT1-2表达与旱金莲和小桐子中DGAT1的研究相一致,说明MtDGAT1-1和MtDGAT1-2与苜蓿中油脂的积累相关。在发育的初期,MtDGAT1-1的表达明显高于MtDGAT1-2的表达,MtDGAT1-1的表达高峰(16 d)也比MtDGAT1-2(24 d)出现早,在种子接近成熟的36 d,MtDGAT1-1的表达已经降到与叶片中水平类似的时候,MtDGAT1-2的表达水平仍然很高,推测MtDGAT1-1和MtDGAT1-2在苜蓿种子发育中都起作用,MtDGAT1-1发挥作用的时段主要为中前期,可能与种子的胚发育和成熟有关,而MtDGAT1-2发挥作用则主要为中后期,可能与子叶中油脂的积累相关。
综上所述,本研究首次从蒺藜苜蓿cDNA中克隆得到2个编码DGAT1的基因MtDGAT1-1和MtDGAT1-1,发现MtDGAT1-1和MtDGAT1-2在根、茎、叶、花、种子中都有表达,在种子发育中期表达量最高,同时也发现MtDGAT1-1高表达种子发育的中前期,而MtDGAT1-2则高表达于种子发育的中后期。酵母互补实验证实MtDGAT1-2编码蛋白具有DGAT酶活性,能够恢复H1246的TAG合成和油体形成;而MtDGAT1-1编码蛋白不能够恢复H1246的TAG合成和油体形成。考虑到酵母互补系统没有能够成功检测到MtDGAT1-1编码蛋白的活性,本实验室下一步拟采用烟草瞬时表达系统来测试MtDGAT1-1和MtDGAT1-2的功能,从而探讨MtDGAT1-1和MtDGAT1-2对于TAG合成和FA成份的限制作用。
[1] YEN C L, STONE S J, KOLIWAD S,etal. Thematic Review Series: Glycerolipids. DGAT enzymes and triacylglycerol biosynthesis[J].JournalofLipidResearch, 2008, 49(11): 2 283-2 301.
[2] 王安可, 孙英超, 何秋伶, 等. 植物Ⅰ型二酰甘油酰基转移酶研究进展[J]. 中国油料作物学报, 2014, 36(2): 281-288.
WANG A K, SUN Y C, HE Q L,etal. Recent advances in research of type Ⅰ diacylglycerol acyltransferase in plants[J].ChineseJournalofOilCropSciences, 2014, 36(2): 281-288.
[3] 阳天泉, 徐荣华, 刘爱忠. 烟草二脂酰甘油酰基转移酶基因(NtDGAT2)的克隆与功能分析[J]. 植物生理学报, 2013, 49(1): 81-88.
YANG T Q, XU R H, LIU A Z. Cloning and characterization of diacylglycerol acyltransferase gene (NtDGAT2) from tobacco (NicotianatabacumL.)[J].PlantPhysiologyJournal, 2013, 49(1): 81-88.
[4] LUNG S C, WESELAKE R J. Diacylglycerol acyltransferase: A key mediator of plant triacylglycerol synthesis[J].Lipids, 2006, 41(12): 1 073-1 088.
[5] 唐桂英, 柳展基, 单 雷. 二酰基甘油酰基转移酶(DGAT)研究进展[J]. 中国油料作物学报, 2010, 32(2): 320-328.
TANG G Y, LIU Z J, SHAN L. Progress of diacylglycerol acyltransferase (DGAT) study[J].ChineseJournalofOilCropSciences, 2010, 32(2): 320-328.
[6] XU R H, YANG T Q, WANG R L,etal. Characterisation ofDGAT1 andDGAT2 fromJatrophacurcasand their functions in storage lipid biosynthesis[J].FunctionalPlantBiology, 2014, 41(3): 321-329.
[7] 魏臻武, 盖钧镒. 豆科模式植物——蒺藜苜蓿[J]. 草业学报, 2008, 17(1): 114-120.
WEI Z W, GAI J Y. Model legume:Medicagotruncatula[J].ActaPrataculturaeSinica, 2008, 17(1): 114-120.
[8] PEEL G J, PANG Y, MODOLO L V,etal. The LAP1 MYB transcription factor orchestrates anthocyanidin biosynthesis and glycosylation inMedicago[J].ThePlantJournal, 2009, 59(1): 136-149.
[9] 马延华, 李德全, 李绥艳, 等. 高油玉米的饲用价值及在畜牧业中的应用前景[J]. 黑龙江农业科学, 2005,(1): 1-3.
MA Y H, LI D Q, LI S Y,etal. The high oil corn’s feeding value and the practical prospect in livestock agriculture[J].HeilongjiangAgriculturalSciences, 2005,(1): 1-3.
[10] VANHERCKE T, TAHCHY A E, LIU Q,etal. Metabolic engineering of biomass for high energy density: Oilseed-like triacylglycerol yields from plant leaves[J].PlantBiotechnologyJournal, 2014, 12(2): 231-239.
[11] ZHENG P, ALLEN WB, ROESLER K,etal. A phenylalanine in DGAT is a key determinant of oil content and composition in maize[J].NatureGenetics2008, 40(3):367-372.
[12] AYME L, BAUD S, DUBREUCQ B,etal. Function and localization of theArabidopsisthalianadiacylglycerol acyltransferase DGAT2 expressed in yeast[J].PLoSOne, 2014, 9(3): e92237.
[13] ZHOU X R, SHRESTHA P, YIN F,etal. AtDGAT2 is a functional acyl-CoA:diacylglycerol acyltransferase and displays different acyl-CoA substrate preferences than AtDGAT1[J].FEBSLetters, 2013, 587(15): 2 371-2 376.
[14] YU K, LI R, HATANAKA T,etal. Cloning and functional analysis of two type 1 diacylglycerol acyltransferases fromVernoniagalamensis[J].Phytochemistry, 2008, 69(5): 1 119-1 127.
(编辑:宋亚珍)
Cloning and Functional Characterization of Diacylglycerol Acyltransferase Gene (MtDGAT1) from Medicago truncatula
XU Ronghua1, CUI Tao1, WANG Jiancai2, MIAO Yongmei1, QIAN Lisheng1, HU Qingsen1
(1 College of Life Sciences, Anhui Science and Technology University, Fengyang, Anhui 233100, China; 2 Institute of Animal Husbandry and Veterinary Medicine, Shandong Academy of Agricultural Sciences, Jinan 250100, China)
In this study, we acquired twoMtDGAT1 genes (MtDGAT1-1 andMtDGAT1-2) from cDNA ofMedicagotruncatulaby using insilico cloning combined with RT-PCR. The length ofMtDGAT1-1 is 1 620 bp, encoding 539 amino acids, while the length ofMtDGAT1-2 is 1 524 bp, encoding 507 amino acids. Multiple alignments revealed that both MtDGAT1-1 and MtDGAT1-2 shared the typical functional motifs with DGAT1s from other plant species. Expression analysis showed that bothMtDGAT1-1 andMtDGAT1-2 were expressed in root, stem, leaf, flower and seed, and highly expressed in developing seeds;MtDGAT1-1 was highly expressed in early-middle periods of seed development, whileMtDGAT1-2 was highly expressed in the middle and later periods of seed development. Functional complementation in yeast H1246 confirmed thatMtDGAT1-1 encodes disfunctional DGAT andMtDGAT1-2 encodes functional DGAT.
diacylglycerol acyltransferase; triacylglycerol;Medicagotruncatula; oil body
1000-4025(2016)10-1941-07
10.7606/j.issn.1000-4025.2016.10.1941
2016-06-14;修改稿收到日期:2016-08-26
国家自然科学基金青年基金(31300569);安徽省教育厅2016振兴计划(gxfxzD2016181)
徐荣华(1979-),男, 博士,讲师,主要从事生物技术和生物工程研究。E-mail:xrh96@163.com
Q785;Q786; Q789
A
