茶黄素与EGCG抑制体内外β-淀粉样蛋白1-42水平及其诱导的神经细胞氧化损伤
2016-12-15张静黄建安蔡淑娴易晓芹刘建军王英姿田丽丽刘仲华
张静,黄建安,2,3,蔡淑娴,易晓芹,刘建军,王英姿,田丽丽,刘仲华,2,3*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 植物功能成分利用协同创新中心,湖南 长沙 410128
茶黄素与EGCG抑制体内外β-淀粉样蛋白1-42水平及其诱导的神经细胞氧化损伤
张静1,黄建安1,2,3,蔡淑娴1,易晓芹1,刘建军1,王英姿1,田丽丽1,刘仲华1,2,3*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 植物功能成分利用协同创新中心,湖南 长沙 410128
通过模拟生理条件体外实验,将β-淀粉样蛋白1-42(Aβ42)与EGCG和4种茶黄素单体分别按照1∶1和1∶5比例进行孵育,采用硫黄素T荧光检测β-折叠结构的生成量,结果表明,EGCG与茶黄素均能明显降低β-折叠结构生成,从而抑制Aβ42聚集;此外,通过建立20μmol·L-1Aβ42诱导人神经母细胞瘤SH-SY5Y细胞损伤模型,将不同浓度的EGCG或茶黄素(10、50、100μmol·L-1)处理后,MTT法检测细胞存活率,同时,检测细胞内活性氧(ROS)、谷胱甘肽过氧化物酶(GSH-Px)及丙二醛(MDA)等抗氧化指标,结果表明,EGCG与茶黄素可抑制因Aβ42诱导SH-SY5Y细胞活力下降及氧化损伤。体内实验中,通过10mg·kg-1·d-1的EGCG或茶黄素处理快速老化模型小鼠(SAMP8),10周后检测小鼠血清Aβ42及晚期糖基化终末产物(AGEs)含量,结果表明,EGCG和茶黄素可显著降低SAMP8小鼠血清中Aβ42及AGEs含量。本研究表明了茶黄素和EGCG可抑制Aβ42聚集纤维化及Aβ42导致的神经氧化损伤,从而对阿尔茨海默病具有一定保护作用。
EGCG;茶黄素;β-淀粉样蛋白1-42;晚期糖基化终末端产物;SH-SY5Y细胞;SAMP8小鼠
阿尔茨海默病(Alzheimer’s desease,AD)作为最常见的老年痴呆病,早在一个世纪前已被归为神经退行性疾病,AD的发病率仅次于心血管疾病及癌症,成为第三大流行病[1]。AD致病因子的作用机制较为复杂,因此有不同假说解释其发病机制,如基因假说、淀粉样蛋白假说、氧化应激假说、炎症机制学说、胆碱能学说等;虽然有关AD的细胞分子机制未完全明确,但大量基因、生物化学及分子生物学研究支持淀粉样蛋白假说,淀粉样蛋白假说认为,β-淀粉样蛋白(Amyloid-β,Aβ)才是造成AD的罪魁祸首,脑内Aβ生成与清除之间失去平衡将使Aβ大量积累,这将是AD最主要的发病机理[2]。Aβ聚集将导致一系列问题,如炎症、突触损伤、tau蛋白聚集、氧化应激及细胞凋亡等[3]。Aβ聚集过程中将产生具有毒性的寡聚体和淀粉样纤维,其富含稳定的β折叠(β-sheet)结构。同时,有研究表明糖基化终末产物(Advancedglycation end products,AGEs)可促进Aβ聚集并增强其稳定性[4],从而加剧AD的主要病理特征。
表没食子儿茶素没食子酸酯(Epigallocatechingallate,EGCG)和茶黄素(Theaflavins,TFs)分别是绿茶和红茶中的主要功能成分。儿茶素占茶叶干重12%~24%,EGCG是儿茶素的主要成分之一,占儿茶素总量的50%~80%[5-6];红茶中茶黄素一般以茶黄素(Theaflavin,TF)、茶黄素-3-没食子酸酯(Theaflavin-3-gallate,TF-3-G),茶黄素-3'-没食子酸酯(Theaflavin-3'-gallate,TF-3′-G)和茶黄素双没食子酸酯(Theaflavin-3, 3'-digallate,TF-DG)4种为主体成分,红茶中茶黄素含量通常不超过2%,甚至低至0.3%[7]。较多研究表明[8-11],以EGCG为主的绿茶多酚类化合物以及红茶提取物能直接与松散无折叠的淀粉样蛋白相结合,从而促进其形成无毒性单体结构,而不是形成具有毒性的β-sheet结构;同时,茶多酚等功能活性成分对AD的神经细胞具有保护作用[12],表明了EGCG和茶黄素具有防治AD的潜能[13]。茶黄素和EGCG含有较多酚羟基结构,众多研究已证实茶黄素及EGCG具有清除超氧阴离子、抑制脂质过氧化损伤等抗氧化功能[14-16];同时,有研究表明茶黄素与绿茶中EGCG抗氧化能力相当[17]。
本研究通过体外实验构建Aβ42聚集化模型以及Aβ42诱导SH-SY5Y神经细胞氧化损伤模型,探讨EGCG及茶黄素单体抑制蛋白聚集过程中毒性β-sheet结构生成,以及拮抗Aβ42神经毒性的作用。以茶黄素和EGCG干预快速老化模型小鼠(Senescence accelerated mouse-prone 8,SAMP8),进一步探究这些茶叶功能成分对AD模型小鼠体内Aβ42及AGEs抑制作用,以期为将茶叶开发成有效防治AD相关神经退行性疾病的药物奠定基础。
1 材料与方法
1.1仪器与材料
SH-SY5Y神经细胞购自上海生命科学研究院,SAMR1和SAMP8小鼠购自北京大学医学部,茶黄素单体(TF、TF-3-G、TF-3′-G、TF-DG,含量>98%,北京工商大学提供,EGCG(纯度≥98%)购自长沙飞拓植物制品公司,茶黄素混合物(>68%)由湖南农业大学茶学重点实验室提供,Aβ42蛋白(纯度≥95%)购自上海吉尔生化,胎牛血清、DMEM高糖培养基购自Hyclone,MTT、DMSO、硫磺素-T(Thioflavin T,ThT)、六氟异丙醇(Hexafluoroisopropanol,HFIP)购自Sigma,DCFH-DA活性氧(ROS)探针、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)检测试剂盒、BCA法蛋白质检测试剂盒购自南京建成科技有限公司,小鼠Aβ42检测试剂盒购自北京乐博生物科技有限公司。
SKY-200B摇床、水浴锅、Christ ALPHA 1-2 LD冷冻干燥机、Thermo Scientific Varioskan Flash光谱扫描多功能酶标仪,LDZX-50KB立式压力蒸汽灭菌器、Nuaire CO2培养箱、SW-CJ-2FD型双人单面净化工作台、MIKRO-22R型冷冻离心机。
1.2实验方法
1.2.1ThT荧光检测EGCG和茶黄素抑制Aβ42聚集
ThT与含β-sheet结构的分子相结合后可发出荧光,发射光谱呈现红移特点,通过ThT检测的荧光强度可得知被测分子中β-sheet结构的相对含量,ThT荧光探针法是检测蛋白质聚集纤维化过程中产生的β-sheet结构较为理想的方法[18]。
每0.5 mg Aβ42加入250μL HFIP溶解过夜后预冻2~3 h,冷冻干燥,Aβ42干粉用少量DMSO溶解。本试验各组Aβ42终浓度为30μmol·L-1,药物干预组分别加入浓度为30μmol·L-1(1×)和150μmol·L-1(5×)的EGCG、TF、TF-3-G、TF-3′-G、TF-DG,各组由PBS(pH7.2)配成1.5mL总体系,置于180 r·min-1,37℃摇床进行孵育;于0、2、4、8、12、24、48、72 h不同时间点取样检测,96孔板中每孔40μL样品+160μL 40μmol·L-1ThT(用50mmol·L-1甘氨酸溶解配制,pH8.5),激发波长440nm(band pass 5nm),发射波长485nm于全自动酶标仪检测荧光值[19]。
1.2.2细胞培养
SH-SY5Y细胞用含10%胎牛血清的DMEM高糖(4.5mmol·L-1)培养基培养于CO2培养箱中,CO2浓度5%,温度37℃;两天换液1次,当融合度达到80%~90%,用0.25%胰酶消化后吹散成1×106mL-1细胞悬液,接种于细胞培养板。
1.2.3药物浓度选择及细胞模型的建立
Aβ42蛋白溶解于DMSO中,配制成浓度为1mmol·L-1母液,加入前用培养基稀释成20μmol·L-1的Aβ42工作液。
将SHSY-5Y细胞以密度为104个/孔种于96孔板,待细胞融合率为50%~60%,加药组先加入不同浓度EGCG、TF、TF-3-G、TF-3′-G、TF-DG(10、50、100μmol·L-1),6 h后去培养基加入20μmol·L-1Aβ42培养48 h;Aβ42模型组加入20μmol·L-1Aβ42以及Control对照组加入培养基同时培养48 h;各组均设4~5个复孔。
MTT检测细胞活力,每孔加入5 mg·mL-1的MTT 20μL,37℃孵育4 h,吸弃MTT后加入100μL DMSO,置37℃摇床中数分钟,待紫色结晶溶解后,于全自动酶标仪检测OD值,检测波长为570nm。
1.2.4细胞内活性氧ROS检测
参考步骤1.2.3将SH-SY5Y细胞经Aβ42或药物处理后,经PBS洗涤3次,加入原培养基稀释的10μmol·L-1DCFH-DA,37℃孵育40min,细胞经原培养基洗3次后用0.25%胰酶消化并收集;PBS洗涤细胞2次(1 000 r·min-1,10min),细胞重悬于PBS中,于全自动酶标仪上检测荧光强度(激发波长为488nm,发射波长为525nm)。
1.2.5细胞内MDA、GSH-PX活性检测
将SH-SY5Y细胞用PBS洗涤2~3次,胰酶消化收集后置于冰上超声裂解(重复3次,每次5 s),将细胞悬液按照试剂盒操作说明,分别检测细胞中MDA、GSH-PX含量。
1.2.6快速老化模型小鼠分组给药
快速老化模型小鼠SAMP8,对照小鼠SAMR1,雄性,12周龄。小鼠自由饮食普通饲料,在安静、通风、清洁环境下,饲养环境温度22~25℃,相对湿度40%~60%。采用每只小鼠单笼饲养的方式,饲养1周后,将小鼠随机分为4组(每组6只):正常对照组(SAMR1,R1)、模型组(SAMP8,P8),EGCG组(P8+EGCG)及茶黄素组(P8+TFs),加药组剂量为10mg·kg-1·d-1,SAMR1组和SAMP8组灌胃等量的蒸馏水,连续灌胃10周。
1.2.7实验取材及相关指标检测
实验中,定期记录各组小鼠的体质量、饮水量和进食量。实验结束时,各组小鼠禁食12 h,摘眼球取血,全血离心(3 500 r·min-1,4℃,10min)并收集血清。试剂盒检测血清中Aβ42含量;于全自动酶标仪(激发波长为370nm,发射波长为440nm)检测血清中AGEs含量[20-21]。
1.3数据分析
实验重复次数至少3次,所有数值以平均值±标准误表示;实验数据用SPSS 18.0统计软件进行统计分析,采用ANOVA进行单因素方差分析。
2 结果与分析
2.1EGCG和茶黄素对Aβ42聚集过程中β-sheet生成的影响
通过构建不同浓度茶黄素、EGCG与Aβ42共同孵育的反应体系,孵育过程中于不同时间点取样进行ThT荧光检测。因ThT检测的荧光强度反映了Aβ42聚集水平,因此,从结果(图1-A)可知,在72 h内,Aβ42模型组ThT荧光值一直处于上升趋势,表明Aβ42中β-sheet结构在不断生成,聚集化水平不断增加;然而,在0~24 h之间,各加药组聚集化水平呈加速上升趋势,直至24 h,聚集化水平开始进入平稳期。取48 h时间点作为代表,将各组ThT荧光值作柱形图(图1-B),综合图1-A分析可知,与Aβ42模型组相比,各加药组均显著降低了β-sheet结构的生成,从而抑制Aβ42聚集纤维化;同时,5×加药组抑制效果比1×加药组更加明显,其ThT荧光值约为1×加药组的一半(图1-B)。各个单体成分之间比较分析,可大致得出不同成分之间存在的差异,整体而言,EGCG与同浓度的TFs相比,对Aβ42聚集过程中β-sheet结构生成的抑制效果更为显著,甚至1×EGCG与5×TF效果相当。4种主要茶黄素单体成分之间相比,抑制Aβ42聚集化及β-sheet结构生成的作用大小排序大致为TF-DG>TF-3′-G>TF-3-G>TF。
2.2EGCG和茶黄素对Aβ42诱导SH-SY5Y细胞活力的影响
由图2中MTT检测结果可知,20μmol·L-1Aβ42处理48 h能显著降低SH-SY5Y细胞的存活率,将细胞活力下降至58.87%。用不同浓度的EGCG或TFs处理6 h后,其神经细胞活力均存在不同程度提高。当EGCG和TFs浓度为10μmol·L-1或50μmol·L-1时,对Aβ42诱导细胞损伤具有一定缓解作用,提高SH-SY5Y细胞活力的效果较为显著,且差异具有统计学意义(P<0.05或P<0.01);而当药物浓度高达100μmol·L-1时,其对细胞活力提升作用并不显著,差异无统计学意义,由此推测100μmol·L-1或较高浓度的EGCG或茶黄素可能超出药物有效浓度范围。综合以上结果表明,在10~50μmol·L-1这一有效浓度范围内,EGCG和TFs对Aβ42产生的神经毒性具有一定程度的拮抗作用,从而保护神经细胞。
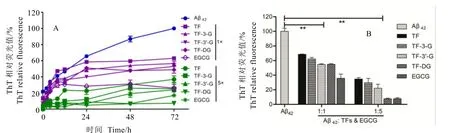
图1 EGCG和TFs对Aβ42聚集化β-sheet生成的抑制作用Fig. 1 EGCG and TFs inhibit thegeneration of β-sheet in the aggregation of Aβ42

图2 EGCG和TFs对Aβ42诱导损伤的SH-SY5Y细胞活力的影响Fig. 2 The effects of EGCG and TFs on the viability of SH-SY5Y cells injured by Aβ42
2.3EGCG和茶黄素保护Aβ42致SH-SY5Y细胞氧化损伤
当机体或细胞内遭受氧化应激损伤时,ROS和抗氧化系统将失去平衡。从图3-A可知,Aβ42诱导的SH-SY5Y神经细胞内ROS荧光值显著增加(与Control组相比,P<0.01);经EGCG和TFs处理后,ROS荧光值不同程度降低(与Aβ42诱导组相比,P<0.01),整体而言,EGCG抑制ROS产生或清除ROS能力强于TFs,EGCG组ROS荧光值甚至低于Control组。综上结果表明,Aβ42处理SH-SY5Y细胞将增加细胞内ROS含量,10μmol·L-1EGCG或TFs能显著抑制神经细胞内ROS的生成或清除细胞内过量的ROS。
GSH-Px为广泛存在于机体内分解H2O2的主要氧化还原相关酶,其活性在一定程度上反映了机体内抗氧化水平。本实验检测了各组细胞内GSH-Px活性,图3-B表明,Aβ42损伤组细胞内GSH-Px活性显著下降(与Control组相比,P<0.01);而经10μmol·L-1EGCG或TFs处理后均能有效抑制GSH-Px活性下降(与Aβ42模型组相比,P<0.01);其中,TF和TF-3-G提高GSH-Px活性效果优于其他加药组。MDA为脂质过氧化中产物之一,由图3-C表明,各加药组不同程度降低了因Aβ42诱导细胞产生的过量的MDA。
总之,EGCG和TFs可不同程度抑制Aβ42诱导SH-SY5Y细胞氧化应激。由结果可推测EGCG和TFs可能通过降低细胞内ROS和MDA含量,提高GSH-Px活性,从而对Aβ42诱导神经细胞氧化损伤产生保护作用,为细胞维持平衡的抗氧化系统并提供较为良好的氧化还原环境。
2.4EGCG和茶黄素对小鼠血清Aβ42及AGEs的影响
SAMP8小鼠是目前国内外用来研究AD机理方面应用较广泛、较理想的模型小鼠,此模型小鼠具有明显的AD病理特征。由图4-A可知,SAMP8小鼠血清中Aβ42含量明显高于SAMR1对照组(P<0.01),而灌胃茶黄素或EGCG后,小鼠血清中Aβ42呈明显下降趋势,且差异具有统计学意义(P<0.01)。
现大量研究已证实,体内AGEs不断积累在AD发生与发展过程中起到至关重要的作用[22-23]。图4-B表明EGCG和茶黄素均能显著降低SAMP8小鼠血清中AGEs含量,两者效果相当。
3 讨论
本文通过体内外实验,综合验证了茶叶中典型的功能成分EGCG和茶黄素4种主要单体控制Aβ42大量聚集纤维化和沉积,以及抑制Aβ42诱导神经细胞造成氧化损伤,为进一步证实茶叶功能成分具有缓解AD发病的效果提供理论依据。

图3 EGCG和TFs对Aβ42处理的SH-SY5Y细胞内ROS、GSH-Px和MDA含量的影响Fig. 3 The effects of EGCG and TFs on the contents of ROS, GSH-Px and MDA in SH-SY5Y cells injured by Aβ42

图4 EGCG和TFs对SAMP8小鼠血清中Aβ42和AGEs含量的影响Fig. 4 The effects of EGCG and TFs on the contents of Aβ42and AGEs in SAMP8 serum
体外实验通过30μmol·L-1Aβ42与不同浓度EGCG和茶黄素4种单体(TF、TF-3-G、TF-3′-G和TF-DG)分别以1∶1和1∶5的比例于模拟生理条件下共同孵育3 d,结果表明,几种不同茶叶功能成分能不同程度阻抑蛋白聚集纤维化过程中β-sheet结构的生成,富含β-sheet结构的毒性寡聚体明显减少,Aβ42聚集化水平也相应降低;EGCG和茶黄素对Aβ42聚集纤维化的抑制效果存在剂量依赖关系,其抑制效果从强到弱大致排序为EGCG>TF-DG>TF-3′-G>TF-3-G>TF。此外,本实验构建体外细胞模型,将20μmol·L-1Aβ42诱导SH-SY5Y神经细胞48 h后,细胞活力下降至58.87%,从而成功建立Aβ42诱导SH-SY5Y神经细胞损伤模型;10μmol·L-1或50μmol·L-1EGCG和茶黄素对神经细胞预处理6 h后,不同程度提高了细胞活力,从而有效拮抗Aβ42导致神经毒性。同时,Aβ42可导致神经细胞氧化损伤,显著提高ROS及MDA含量,并降低GSH-Px酶活力,EGCG和茶黄素能提高抗氧化酶GSH-Px活力并降低破坏氧化还原系统的ROS和脂质过氧化终末产物MDA,从而暗示着EGCG和茶黄素拮抗Aβ42导致的神经细胞损伤与其维护细胞内氧化还原系统平衡存在一定关系。整体而言,EGCG缓解Aβ42致神经细胞活力下降及氧化损伤的水平高于茶黄素4种主要单体,这与体外ThT荧光检测EGCG及茶黄素抑制Aβ42聚集化的相关结果相符合。
有报道称AD患者体内AGEs水平与同龄正常人相比升高了3倍[4],且AGEs积累可加速Aβ聚集从而加剧AD病症。本实验运用快速老化模型小鼠SAMP8作为AD动物模型,SAMR1作为对照组,SAMP8小鼠连续灌胃剂量为10mg·kg-1·d-1的EGCG和茶黄素混合物10周后,发现药物干预组小鼠血清中Aβ42及AGEs水平均有所降低。因Aβ聚集为AD发病机制中较为典型的病理特征,且Aβ与AGEs在AD患者机体内具有协同作用,因此,由此推断EGCG和茶黄素可能通过调控Aβ42和AGEs处于正常水平,从而缓解AD的发生与发展。
近年来,AD等神经退行性疾病严重影响着人们的健康生活,日益受到科研及医学界的关注。Aβ作为AD的主要致病因子之一,成为国内外研究AD的焦点。茶叶作为最受欢迎的饮料之一,因其含有多酚类化合物而具有较多药理功效;且茶多酚类化合物不仅具备抑制蛋白质聚集或寡聚体解聚等功能;还具有与AD发病机制相关联的如抗氧化、清除自由基、神经保护等功能[24-25];因此,茶叶被开发为防治AD的药物具有一定的潜力,并可能成为医学研究的热点。
[1] Schmaier A H. Alzheimer disease is in part a thrombohemorrhagic disorder [J]. Journal of Thrombosis and Haemostasis, 2016, 14(5): 991-994.
[2] Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer'sdisease: progress and problems on the road to therapeutics [J]. Science, 2002, 297(5580): 353-356.
[3] Fernandez-Echevarria C, Diaz M, Ferrer I, et al. Aβ promotes VDAC1 channel dephosphorylation in neuronal lipid rafts. Relevance to the mechanisms of neurotoxicity in Alzheimer’s disease [J]. Neuroscience, 2014, 278: 354-366.
[4] Vitek M P, Bhattacharya K, Glendening J M, et al. Advancedglycation end products contribute to amyloidosis in Alzheimer disease [J]. Proceedings of the National Academy of Sciences, 1994, 91(11): 4766-4770.
[5] da Silva Pinto M. Tea: A new perspective on health benefits [J]. Food Research International, 2013, 53(2): 558-567.
[6] Frei B, Higdon J V. Antioxidant activity of tea polyphenols in vivo: evidence from animal studies [J]. Journal of Nutrition, 2003, 133(10): 3275S-3284S.
[7] Balentine D A, Wiseman S A, Bouwens L C, et al. The chemistry of tea flavonoids [J]. Critical Reviews in Food Science & Nutrition, 1997, 37(8): 693-704.
[8] Bastianetto S, Yao Z X, Papadopoulos V, et al. Neuroprotective effects ofgreen and black teas and their catechingallate esters against β-amyloid-induced toxicity [J]. European Journal of Neuroscience, 2006, 23(1): 55-64.
[9] Grelle G, Otto A, Lorenz M, et al. Black tea theaflavins inhibit formation of toxic amyloid-β and α-synuclein fibrils [J]. Biochemistry, 2011, 50(49): 10624-10636.
[10] Bieschke J, Russ J, Friedirich R P, et al. EGCG remodels mature α-synuclein and amyloid-β fibrils and reduces cellular toxicity [J]. Proceedings of the National Academy of Sciences, 2010, 107(17): 7710-7715.
[11] Ehrnhoefer D E, Bieschke J, Boeddrich A, et al. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers [J]. Nature structural & molecular biology, 2008, 15(6): 558-566.
[12] 高雄, 陈忠正, 张媛媛, 等. 茶叶活性成分对阿尔茨海默症的神经保护作用研究进展[J]. 现代食品科技, 2015, 31(12): 416-425.
[13] 魏然, 徐平, 应乐, 等. 茶多酚对阿尔茨海默病的防治功能与机理研究进展[J]. 茶叶科学, 2016, 36(1): 1-10.
[14] Yang Z, Jie G, Dong F, et al. Radical-scavenging abilities and antioxidant properties of theaflavins and theirgallate esters in H2O2-mediated oxidative damage system in the HPF-1 cells [J]. Toxicology in Vitro, 2008, 22(5): 1250-1256.
[15] Halder J and Bhaduri A N. Protective role of black tea against oxidative damage of human red blood cells [J]. Biochemical and Biophysical Research Communications, 1998, 244(3): 903-907.
[16] 刘晓慧, 揭国良, 林康, 等. EGCG和茶氨酸对细胞氧化损伤的协同保护和修复作用研究[J]. 茶叶科学, 2014, 34(3): 239-247.
[17] Leung L K, Su Y, Chen R, et al. Theaflavins in black tea and catechins ingreen tea are equally effective antioxidants [J]. The Journal of Nutrition, 2001, 131(9): 2248-2251.
[18] 李松, 刘夫锋, 余林玲, 等. 硫黄素T对淀粉样β-蛋白质40聚集成核动力学的双重影响[J]. 物理化学学报, 2016, 32(6): 1391-1395.
[19] 张静, 蔡淑娴, 黄建安, 等. 茶黄素对BSA/MDA羰-氨交联反应体系中的蛋白质羰基化及其聚集化抑制作用研究[J]. 茶叶科学, 2016, 36(4): 363-371.
[20] Lee S J, Lee K W. Protective effect of (-)-epigallocatechingallate against advancedglycation endproducts-induced injury in neuronal cells [J]. Biological & Pharmaceutical Bulletin, 2007, 30(8): 1369-1373.
[21] Mustata G T, Rosca M, Biemel K M, et al. Paradoxical effects ofgreen tea (Camellia sinensis) and antioxidant vitamins in diabetic rats: improved retinopathy and renal mitochondrial defects but deterioration of collagen matrixglycoxidation and cross-linking [J]. Diabetes, 2005, 54(2): 517-526.
[22] Shuvaev V V, Laffont I, Serot JM, et al. Increased proteinglycation in cerebrospinal fluid of Alzheimer’s disease [J]. Neurobiology of aging, 2001, 22(3): 397-402.
[23] Loske C, Gerdemann A, Schepl W, et al. Transition metal-mediatedglycoxidation accelerates cross-linking of β-amyloid peptide [J]. European Journal of Biochemistry, 2000, 267(13): 4171-4178.
[24] 李大祥, 鲜殊, 杨卫, 等. 茶叶的神经保护作用研究进展[J]. 茶叶科学, 2011, 31(2): 79-86.
[25] 刘春芳. 表没食子儿茶素没食子酸酯抗氧化及神经元保护作用的研究进展[J]. 蚌埠医学院学报, 2011, 36(10): 1163-1164.
Theaflavins and EGCG Protect SH-SY5Y Cells from Oxidative Damage Induced by Amyloid-β 1-42 and Inhibit the Level of Aβ42in vivo and in vitro
ZHANG Jing1, HUANG Jian'an1,2,3, CAI Shuxian1, YI Xiaoqin1, LIU Jianjun1, WANG Yingzi1, TIAN Lili1, LIU Zhonghua1,2,3*
1. Key Laboratory of Ministry of Education for Tea Science, Hunan Agricultural University, Changsha 410128, China; 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 3. Collaborative Innovation Center of Utilization of Functional Ingredients from Botanicals, Changsha 410128, China
In this study, amyloid β-protein Aβ42was incubated with EGCG, TF, TF-3-G, TF-3'-G, TF-DG at the ratio of 1∶1 and 1∶5 under simulated physiological condition. The contents of β-sheets after incubation were tested by thioflavin T fluorometric assay. It was found that EGCG and theaflavins could suppress the formation of β-sheet structure, therebyinhibiting aggregations of Aβ42. In addition, an SH-SY5Y cell damage model was established and MTT assay was used to examine cell viabilities when 20μmol·L-1Aβ42was incubated with different concentrations of EGCG and theaflavins (10, 50, 100μmol·L-1). Intracellular reactive oxygen species (ROS) levels, antioxidant enzyme activities (GSH-Px) and MDA levels were also measured. The results showed EGCG and theaflavins treatments could alleviate the Aβ42induced oxidative damage to neural cells by reducing ROS and increasing the activity of GSH-Px. To study the in vivo protective effects of EGCG and theaflavins, SAMP8 mice were treated with 10mg·kg-1·d-1EGCG or theaflavins respectively bygavage for 10 weeks, and the contents of Aβ42and AGEs in mouse serum were determined. The results showed that EGCG and theaflavins significantly decreased the contents of Aβ42and AGEs in SAMP8 serum. In summary, EGCG and theaflavins could inhibit the aggregations of Aβ42and reduce oxidative injury induced by Aβ42in neural cells, thereby exerting protective effects on AD.
EGCG, theaflavins, amyloid-β 1-42, advancedglycation end products, SH-SY5Y cells, SAMP8 mice
TS272;Q946.8
A
1000-369X(2016)06-655-08
2016-08-08
2016-10-13
国家茶叶产业技术体系项目(CARS-23-11B)、湖南省植物功能成分利用协同创新项目(HNCR-2014003)、国家自然科学基金项目(31471590)、湖南省研究生科研创新项目(CX2015B245)。
张静,女,博士,主要从事茶叶功能成分药理研究。*通讯作者:larkin-liu@163.com
