雷公藤甲素对实验性大鼠结肠炎组织中细胞因子IFN-γ、IL-12表达的影响
2016-12-14肖明明
杨 立,肖明明,李 艳,邢 煜,王 岩,姚 远
雷公藤甲素对实验性大鼠结肠炎组织中细胞因子IFN-γ、IL-12表达的影响
杨 立*,肖明明,李 艳,邢 煜,王 岩,姚 远
目的 探讨雷公藤甲素对TNBS诱导大鼠结肠炎的疗效及对炎性细胞因子IL-12和IFN-γ表达的影响。方法 将18只成年 SD大鼠随机分为对照组、模型组及雷公藤甲素组,观察大鼠的一般情况,比较结肠组织炎症程度。HE染色观察大鼠结肠组织形态学变化。用反转录聚合酶链反应(RT-PCR)和Western blot(WB)法检测大鼠结肠组织中IL-12、IFN-γ的表达水平。结果 对照组大鼠结肠组织中 IL-12和IFN-γ的表达水平最低,与对照组相比,模型组大鼠结肠组织中IL-12、IFN-γ表达显著增高(P<0.01),与模型组相比,雷公藤甲素组IL-12、IFN-γ表达明显降低(P<0.05)。雷公藤甲素治疗对大鼠结肠组织及大体变化都有一定程度的改善。结肠组织IFN-γ和IL-12的阳性细胞表达与结肠炎病情轻重呈正相关。结论 雷公藤甲素能有效治疗 TNBS诱导的大鼠结肠炎,其作用机制可能与雷公藤甲素下调大鼠结肠黏膜炎性细胞因子IL-12和 IFN-γ的表达,抑制炎症的发生发展有关。
雷公藤甲素;实验性结肠炎;IFN-γ;IL-12
0 引言
免疫调节异常在炎症性肠病(IBD)发病机制中的作用日益引起人们重视[1]。以往的研究指出,炎症性肠病结肠黏膜聚集的炎性细胞通过多种免疫途径损伤结肠黏膜的上皮组织,最终导致疾病发生。雷公藤甲素(TP)又称雷公藤内酯醇,具有抗炎、免疫抑制、抗肿瘤等活性,临床上广泛用于治疗多种炎症性疾病,但用于IBD治疗的报道少有。本文以三硝基苯磺酸(TNBS)诱导构建实验性大鼠结肠炎模型,检测模型大鼠结肠组织干扰素-γ(IFN-γ)、白细胞介素-12(IL-12)表达水平的变化,探讨雷公藤甲素对实验性大鼠结肠上皮细胞中IL-12、IFN-γ表达的调节及其在炎症性肠病治疗中的作用。
1 材料与方法
1.1 试剂和装置 浓度5%(w/v)的2,4,6-三硝基苯磺酸(TNBS)购自Sigma公司(批号:107k5008)。雷公藤甲素(TP)购自中国药品生物制品检定所。雷公藤甲素100 μg/(kg·d)与生理盐水制成混悬液,腹腔注射。IFN-γ和IL-12抗体,美国Santa Cruz 生物技术有限公司产品。生物素化驴抗山羊IgG、辣根酶标记链酶亲合素、RIPA裂解液PMSF、BCA蛋白浓度测定试剂盒均为上海碧云天生物技术有限公司产品。其他试剂和实验设备同文献[2]。
1.2 模型建立、结肠炎表现及病理学观察 参考文献[3]建立TNBS大鼠结肠炎模型。选取18只8周左右SPF级SD雄性大鼠(辽宁长生生物技术有限公司),体重180~200 g,随机分为3组,每组6只。分别为对照组(C)、TNBS模型组(D1)、雷公藤甲素治疗组(D5)。所有大鼠实验前适应环境 1周。具体造模过程及标本处理、制备见文献[2]。计算疾病活动指数(DAI),进行大鼠结肠组织炎性病变程度评分[4]和病理学(组织学损伤)评分[5]。
1.3 IFN-γ、IL-12检测 按公司试剂盒说明书提取大鼠结肠黏膜组织总RNA,逆转录后得到对应的cDNA在PCR仪上进行扩增。序列引物信息见表1。PCR产物片段经1.5%琼脂糖凝胶电泳。电泳过后利用凝胶成像系统对得到的凝胶进行拍照,测定目的条带灰度值。提取结肠黏膜总蛋白,SDS-PAGE蛋白质电泳,进行Western 杂交。一抗:IFN-γ、IL-12,1∶1 00;二抗,驴抗山羊IgG-HRP 1∶5 000稀释。内参抗体 Mouse antiβ-actin-HRP 1∶10 000稀释。WD-9413B型凝胶成像系统成像,测定目的条带灰度值。
1.4 统计学分析 使用 SPSS 18.0统计软件处理实验数据,P<0.05为差异有统计学意义。

表1 引物序列及扩增片段长度
2 结果
2.1 形态及组织学观察 对照组结肠大体正常,可见大量胞质富含黏液的杯状细胞,黏膜固有层、黏膜下层未见炎性细胞浸润。模型组肠组织肠壁坏死、变薄,肠黏膜可见溃疡,肠黏膜和黏膜下组织可见大量中性粒细胞、淋巴细胞、浆细胞及嗜酸性粒细胞浸润,肠黏膜隐窝变形,脓肿形成,黏膜下组织充血、水肿,伴急性小血管炎症。雷公藤甲素组见炎性细胞浸润减少、隐窝变形恢复和杯状细胞胞质黏液增多,溃疡缩小修复。
与对照组比较,模型组和雷公藤甲素组DAI评分、病理学评分明显升高(P<0.05);与模型组比较,雷公藤甲素治疗组DAI评分、病理学评分均下降,差异有统计学意义(P<0.05,见表2)。
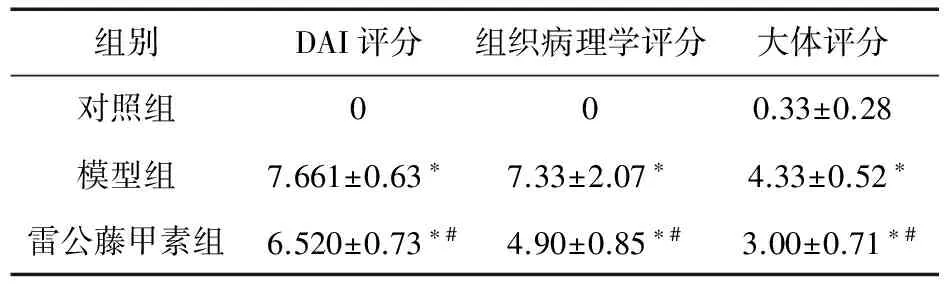
表2 各组大鼠结肠组织大体评分、DAI评分、病理学评分比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.2 炎性因子IFN-γ和IL-12的RT-PCR法表达 与对照组相比,模型组大鼠结肠组织 IL-12、IFN-γ相对表达水平明显上调,相对表达量由高到低依次为模型组、雷公藤甲素组、对照组(图1、图 2)。模型组和雷公藤甲素组 IL-12的表达与对照组比较差异有统计学意义(P<0.01,P<0.05),雷公藤甲素组与模型组相比,差异亦有统计学意义(P<0.05);模型组 IFN-γ的表达与对照组比较差异有统计学意义(P<0.01),雷公藤甲素组与对照组和模型组比较,差异均有统计学意义(P<0.05)。
2.3 IL-12 和IFN-γ的Western blot法表达 以β-actin为内参,WB法检测各组大鼠结肠组织的IL-12的表达。对照组大鼠结肠组织 IL-12低水平表达(IL-12/β-actin:0.16±0.07);模型组较对照组明显偏高(IL-12/β-actin:0.88±0.27,P<0.01);雷公藤甲素组中 IL-12表达(IL-12/β-actin:0.44±0.31)高于对照组、低于模型组,与对照组和模型组比较,差异有统计学意义(P<0.05)。和IL-12表达类似,大鼠结肠组织 IFN-γ在对照组中也处于较低水平表达(IFN-γ/β-actin∶0.27±0.09);模型组IFN-γ表达较对照组明显增高(IFN-γ/β-actin∶0.59±0.20,P<0.05);雷公藤甲素组IFN-γ表达较对照组明显增加(IFN-γ/β-actin∶0.43±0.12,P<0.05);雷公藤甲素组IFN-γ表达低于模型组,与模型组比较,差异有统计学意义(P<0.05),见图3、图4。
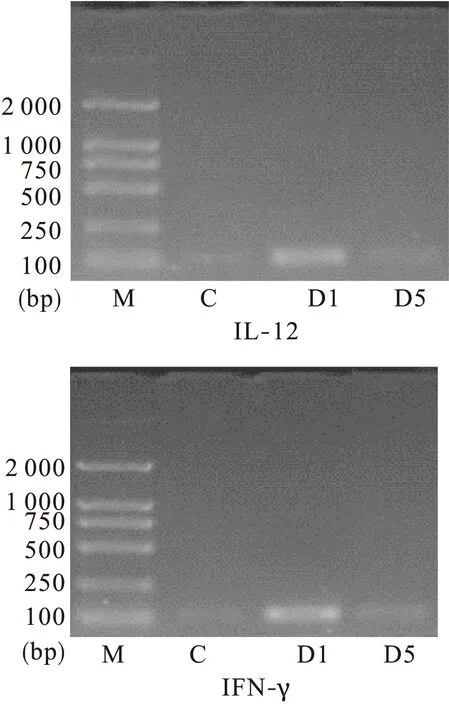
图1 大鼠结肠组织中IL-12和 IFN-γ的表达(RT-PCR法)
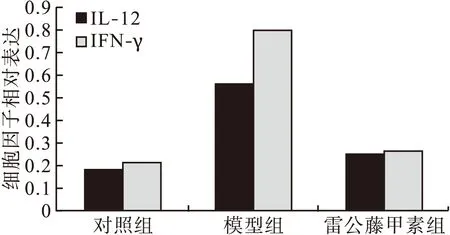
图2 大鼠结肠组织中IFN-γ和IL-12的光密度值比较(RT-PCR法)
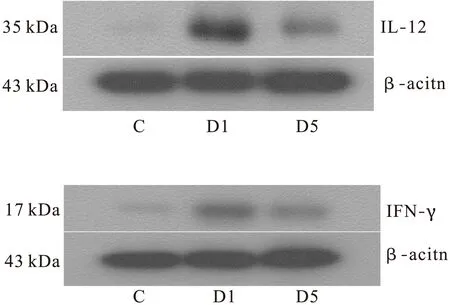
图3 大鼠结肠组织中IL-12和 IFN-γ的表达(WB法)
2.4 结肠炎大鼠肠组织IL-12、IFN-γ表达与DAI、病理损伤指数,以及 IL-12与IFN-γ表达的相关分析 结肠炎大鼠肠组织IL-12、IFN-γ的 IOD值与肠组织病理损伤评分、DAI评分均呈正相关,R值分别为 0.673 1、0.633 6、0.434 2、0.436 3 (α=0.05)。结肠炎大鼠肠组织IL-12与IFN-γIOD值呈线性正相关,回归方程:RT-PCR法:IOD(IFN-γ)=-0.053 7+1.430 7* IOD(IL-12),R=0.968 1;WB法:IOD(IFN-γ)=0.228 3+0.413 9* IOD(IL-12),R=0.951 2。见图5。
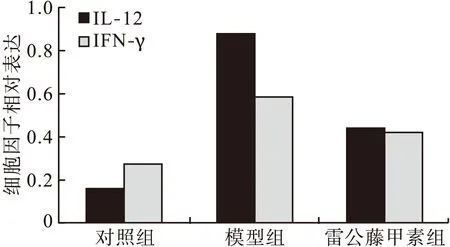
图4 大鼠结肠组织中IL-12和IFN-γ的光密度值比较(WB法)
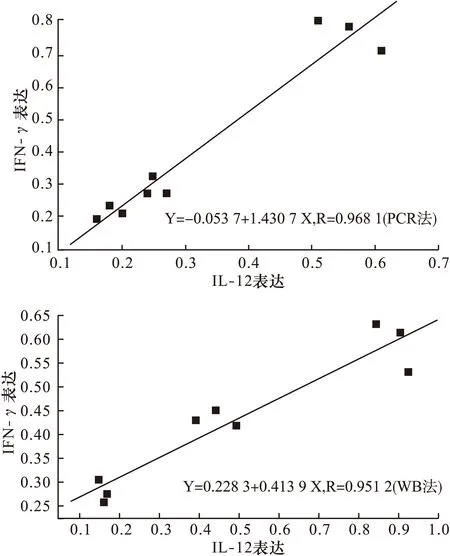
图5 促炎因子IL-12和 IFN-γ在2种检测法中的线性关系
3 讨论
在炎症性肠病多种致病因素中,患者自身免疫紊乱、抗炎细胞因子与促炎细胞因子失衡是目前公认的致病机制之一[6-7]。病理研究证实,作为重要的促炎因子,IFN-γ和 IL-12表达异常参与了溃疡性结肠炎的病理损伤过程[8-9]。IL-12作为异源二聚体形式的前炎症细胞因子,能诱导早期辅助性T细胞分化为Th1细胞,并促进Th1细胞的发育和增殖。在IBD动物模型中,炎症小鼠结肠部位的巨噬细胞异常活化,导致IL-10、IL-12等细胞因子表达异常[10]。 IFN-γ由活化T细胞和NK细胞产生,主要功能是免疫调节作用,是强有力的吞噬细胞和中性粒细胞激活物,促进T、B细胞分化。已有实验表明,溃疡性结肠炎大鼠血清中IL-4、IL-10含量明显降低,而IFN-γ、IL-12 含量明显升高[11-12]。IL-12 或IFN-γ对单核/巨噬细胞、中性粒细胞等炎性细胞的趋化作用会产生过量的基质降解酶,破坏黏膜的完整性[13]。亦有文献报道,UC患者Th1细胞存在异常激活,UC小鼠IFN-γ表达明显升高[14-15]。
雷公藤甲素是从中药雷公藤的提取物中分离出来的一种单体成分。药理研究指出,作为一种新型的免疫抑制剂,雷公藤甲素对肠道炎症具有一定的抗炎和免疫抑制作用。雷公藤甲素能抑制树突状细胞和T细胞的活化,促进体外培养的T细胞caspase的表达,诱导小鼠结肠固有层T细胞凋亡[16-18]。李毅[19]研究表明,经雷公藤甲素治疗的小鼠的结肠炎性浸润和淋巴细胞的数量显著减少,小鼠结肠组织、固有层的T细胞均出现显著的凋亡现象。表明雷公藤甲素在减轻炎症程度方面,既能够减少细胞自身的细胞因子的释放,也能够减少炎性细胞的数量。机制为雷公藤甲素通过抑制肠黏膜过激IL-6/STAT3信号通路逆转CD状态下固有层T细胞的凋亡抵抗,从而达到抑制肠道炎症的目的。
张文志等[20]报道,UC大鼠肠道局部黏膜发生免疫功能紊乱,促炎因子IFN-γ和IL-12表达水平升高,诱导和促进肠道黏膜炎症的发生和发展。而经芦荟多糖治疗后,结肠炎大鼠的结肠黏膜促炎细胞因子IL-12和IFN-γ水平较模型组显著降低。与张文志等研究类似,我们在实验中观察到,在实验性大鼠结肠炎组织中,模型组大鼠结肠组织中 IL-12、IFN-γ的表达水平显著增加(与对照组比较);雷公藤甲素组IL-12、IFN-γ蛋白表达水平呈不同程度下降(与模型组比较)。雷公藤甲素给药后,大鼠结肠炎症明显好转,说明雷公藤甲素可以有效下调促炎细胞因子 IFN-γ和IL-12的分泌,降低IL-12、IFN-γ的表达活性,从而有利于消除炎症、修复损伤。
本研究表明,在大鼠结肠炎肠组织中,IL-12和IFN-γ的表达上调水平与结肠炎症程度呈正相关,说明雷公藤甲素的疗效机制可能与降低IL-12和 IFN-γ的表达有密切关系。IFN-γ阳性表达与IL-12阳性表达呈线性相关关系,无论是RT-PCR 检测法还是WB检测法都是如此。这可能是因为作为促炎因子,除能促进分化的 CD4+T辅助细胞(Th1细胞)的增殖,增强 NK和 CTL细胞的细胞毒活性外,IL-12还能促进 NK细胞和 T细胞的发育与增殖,并刺激这些细胞产生 IFN-γ。反之,IFN-γ也会增加IL-12的分泌[21],IFN-γ在抗原致敏过程中可以和细胞因子IL-12共同调节Thl 细胞分化,IFNγ-可以通过阻抑Th2细胞分化,使Thl 细胞分化占优势[22],两者共同参与了实验性结肠炎的炎性损害过程。
总之,本研究结果表明,IL-12和IFN-γ作为促炎因子,在实验性大鼠结肠炎中表达明显上调,雷公藤甲素治疗后,一定程度上降低了这两种促炎因子的表达,减轻和改善了大鼠结肠炎症状。说明促炎因子IL-12和IFN-γ与大鼠结肠炎发病关系密切,但其在大鼠实验性结肠炎中表达调控的具体过程有待进一步开展研究。
[1]Bengmark S.Gut microbiota,immune development and function [J].Pharmacol Res,2013,69(1):87-113.
[2]杨立,李艳,尹秋华,等.实验性大鼠结肠黏膜中炎性因子对Th1/Th2平衡的影响及VSL#3的调节作用[J].胃肠病学和肝病学杂志,2014,23(5):529-534.
[3]Morris GP,Beck PL,Herridge MS,et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology,1989,96(3):795-803.
[4]Hamamoto N,Maemura K,Hiram I,et al. Inhibition of dextran sulphate sodium(DSS) induced colitis in mice by intracolonically administered antibodies against adhesion molecules (endothelial leucocyte adhesion molecule-I (ELAM-1) or intercellular adhesion molecule-1 (ICAM-1) )[J].Clin Exp lmmun,1999,117(3):462-468.
[5]Dieleman LA,Palmen MJ,Akol H,et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines [J].Clin Exp Immunol,1998,114(3):385-391.
[6]方健松,马媛萍,刘畅,等.自噬介导肠黏膜屏障维持肠道稳态在炎症性肠病中的作用[J].实用医学杂志,2016,32(8):1367-1369.
[7]安琦,牛小娟,阎凯,等.T细胞免疫球蛋白结构域相关分子1在炎症性肠病小鼠不同部位淋巴细胞中表达的变化[J].中国医院,2015,10(8):1227-1231.
[8]Wendelsdorf K,Bassaganya-Riera J,Hontecillas R,et al.Model of colonic inflammation:immune modulatory mechanisms in inflammatory bowel disease[J].J Theor Boil,2010,264(4):1225-1239.
[9]Brown KA,Back SJ,Ruchelli ED,et al.Lamina propria and circulating interleukin-6 in newly diagnosed pediatric inflammatory bowel disease patients[J].Am J Gastroenterol,2002,97(10):2603-2608.
[10]Kamada N.Abnormally differentiated subsets of intestinal macrophage play a key role in Th1-dominant chronic colitis through excess production of IL-12 and IL-23 response to bacteria[J].J Immunol,2005,175:6900-6908.
[11]王雪茜,王新月.2 种给药途径对大鼠溃疡性结肠炎血清IFN-γ和 IL-4 的影响[J].北京中医药大学学报,2010,33(7):468-471.
[12]徐霞,戴幸平,蒋荣鑫,等.三皮汤对小鼠实验性溃疡性结肠炎相关因子的影响[J].中国现代医学杂志,2014,24(6):9-13.
[13]MacDonald TT,Monteleone G,Pender SL. Recent developments in the immunology of inflammatory bowel disease [J]. Scand J Immunol,2000,51(1):2-9.
[14]Kumawat AK,Strid H,Tysk C,et al. Microscopic colitis patients demonstrate a mixed Th17/Tc17 and Th1/Tc1 mucosal cytokine profile[J].Mol Immunol,2013,55(3/4):355-364.
[15]Chu CC,Hou YC,Pai MH,et al.Pretreatment with alanyl-glutamine suppresses T-helper-cell- associated cytokine expression and reduces inflammatory responses in mice with acute DSS-induced colitis[J].J Nutr Biochem,2012,23(9):1092-1099.
[16]Wei X,Gong J,Zhu J,et al.Therapeutic effects of triptolide on interleukin-10 gene deficient mice with colitis[J].Int J Immunopharmacol,2008,8:1808-1812.
[17]Wei X,Gong J,Zhu J,et al.The suppressive effect of triptolide on chronic colitis and TNF-alpha/TNFR2 signal pathway in interleukin-10 deficient mice[J].Clini Immunol,2008,129:211-218.
[18]Zhu KJ,Shen QY.Triptolide affects the differentiation,maturation and function of human dendritic cell[J].Int Immunopharmacol,2005,5:1415-1426.
[19]李毅.雷公藤甲素对炎性肠病(克罗恩病)肠黏膜免疫系统IL-6/STAT3信号通路的干预机制[D].南京:南京大学,2011.
[20]张文志,欧水平,吴会超,等.芦荟多糖对实验性结肠炎大鼠肠黏膜的保护作用及其机制研究[J].实用医学杂志,2016,32(3):352-355.
[21]Xue X,Feng T,Yao S,et al. Microbiota down-regulates dendriti ccell expression of miR-10a,which targets IL-12/IL-23p40[J].J Immunol,2011,187(11):5879-5886.
[22]郭新红,赵芳,石伟,等. 特发性血小板减少性紫癜患者Th1/Th2的细胞因子水平及临床意义[J].细胞与分子免疫学杂志,2012,24(11):1185-1187.
Effects of tripotlide on the expression of IFN-γ and IL-12 of intestinal mucosa in rats with colitis
YANG Li*,XIAO Ming-ming,LI Yan,XING Yu,WANG Yan,YAO Yuan
(Department of Gastroenterology,People′s Hospital of Liaoning Province,Shenyang 110016,China)
Objective To evaluate the curative effect and regulation of tripotlide on the expression of intestinal mucosa IL-12 and IFN-γ in rats with colitis induced by trinitrobenzene sulfonic acid (TNBS).Methods Eighteen adult Sprague-Dawley rats were averagely randomized into three groups:control group,model group,tripotlide treatment group.After treatments,the general status of all rats was observed;the histopathologic changes in the colon were examined;reverse transcription-polymerase chain reaction and Western blot techniques were used to detect the expression of cytokines IL-12 and IFN-γ.Results Compared with control group,the immunoreactive positive cells of IL-12 and IFN-γ increased significantly in model group.Compared with model group,the expression of Il-12 and IFN-γ in tripotlide treatment group decreased significantly (P< 0.05).It indicated that tripotlide could decrease the expression of IL-12 and IFN-γ in the colonic mucous membrane.Conclusion Tripotlide can effectively treat TNBS-induced colitis in rats by down-regulating the expression of IL-12 and IFN-γ and relieving the inflammation.
Triptolide;Experiment colitis;IFN-γ;IL-12
2016-08-05
辽宁省人民医院消化内一科,沈阳 110016
辽宁省自然科学基金课题(201102106)
10.14053/j.cnki.ppcr.201611003
*通信作者
